Acqua
e
macromolecole
La polarità della molecola dell’acqua ha
un’enorme conseguenza,
è responsabile
•della coesività
•della capacità di stabilizzare la temperatura
•delle proprietà di solvente dell’acqua
Coesività
E’ la tendenza a formare legami a “H+” tra le
molecole adiacenti che rende l’acqua così
coesiva
Questa coesività spiega
• l’elevata tensione superficiale* dell’acqua
• elevato punto di ebollizione
• elevato calore specifico: quantità di calore che
un grammo di sostanza deve assorbire per
aumentare la sua temperatura di 1°C.
• elevato calore di evaporazione (ammontare di
E necessaria per elevare un grammo di un
liquido in vapore.
* La tensione superficiale di un
liquido è il lavoro che deve
essere svolto per portare un
numero sufficiente di molecole
dall'interno del liquido alla
superficie, per poter formare una
nuova area unitaria di detta
superficie.
IMPORTANTE
Il calore richiesto
per evaporare
l’acqua
è fornito
dall’organismo
che viene
raffreddato nel
processo.
PRINCIPALI ANIONI:
•Cloruro
•Bicarbonato
•Solfato
•fosfato
Peso molecolare
Somma dei pesi atomici degli atomi componenti una molecola
esempio: H2O
2H (p.a. ≈ 1) + 1 O (p.a. ≈ 16) = 18
Peso Molecolare (P.M.) = 18
Peso atomico = protoni + neutroni
Mole
Quantità in grammi equivalente al peso molecolare
Esempio: 1 mole H2O = 18 g
Una mole di un qualsiasi composto contiene sempre lo stesso numero di molecole
Soluzione 1 M (molare) = soluzione che contiene una mole di soluto in un litro di
soluzione
Esempio: 1 mole di NaCl ≈ 58 g
(p.a. Na ≈ 23 + p.a. Cl ≈ 35)
58 g di NaCl in 1 l di soluzione = soluzione 1 M di NaCl
Esercizio: calcolare la molarità dell’acqua (H2O)
P.M. H2O = 18
Peso di 1 litro H2O = 1 Kg
1000 g = 55,5…. numero di moli di H2O in 1 litro di H2O
18 g
H2O è 55,5.. M
COMPOSIZIONE CHIMICA
DELLA MATERIA VIVENTE
ACQUA
•70-80% DELLA MATERIA VIVENTE
•STABILE A PRESS.E TEMP AMB.
•SOLVENTE DELLA MATERIA VIV.
PLASTICITA’
FLUIDITA’
DIPOLO ELETTRICO
δ+
MATERIA
VIVENTE
H
δ-
O
δ+
H
MOLECOLA POLARE
Il centro delle parziali cariche NEG non coincide con
quello delle parziali cariche POS.
MOLECOLA APOLARE
Sulla sua superficie non si verifica uno sbilanciamento
nella distribuzione degli e- (molte mol.biol)
LEGAMI SECONDARI
(deboli)
Attrazioni Elettrostatiche
Molecole Polari
Molecola Polare
+
Molecola Apolare
Forze di van der Waals
Due molecole
Apolari
Legami Idrogeno
COMPOSTI
IONICI
SALI
Carboidrati./ Aa / Nucleotidi
POLARI
Grassi / Lipidi neutri / O2
APOLARI
Fosfolipidi
AMFIPATICI
LE MOLECOLE DELLA MEMBRANA POSSONO
MUOVERSI SOLO NEL PIANO DELLA MEMBRANA
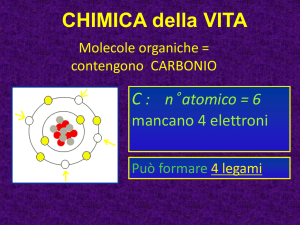
COMPOSTI DEL CARBONIO
CARBOIDRATI
Gliceraldeide
3C
Eritrosio
4C
Monosaccaridi
Ribosio
Mannosio
Sedoeptuloso
5C
6C
7C
D-glucosio
Ac. glucuronico
glucosammina
N-acetil-glucosammina
D-ribosio
2-D-deossiribosio
Derivati dei monosaccaridi
•Desossi zuccheri
•acidi uronici
•aminozuccheri
•acido sialico
Grazie alle cariche (-)
dell’acido sialico gli eritrociti si
respingono l’un l’altro.
Nell’eritrocita
OLIGOSACCARIDI
DA 2 A 10 UNITA’
MONOSACCARIDICHE
•SACCAROSIO
•GLICOPROT.
(glucosio + fruttosio)
•LATTOSIO
(galattosio + glucosio)
•GLICOLIPIDI
POLISACCARIDI
DECINE O CENTINAIA DI UNITA’
MONOSACCARIDICHE LINEARI O RAMIFICATE
• OMOPOLISACCARIDI (CELLULOSA)
• ETEROPOLISACCARIDI (ACIDO IALURONICO)
FUNZIONI
•Di sostegno (esoscheletri di insetti)
•Per riserve energetiche
3 diversi
Polimeri del glucosio:
LIPIDI
Acidi grassi
FUNZIONI:
Lipidi semplici
(o neutri)
• di deposito
• strutturali(membr.)
• ormoni
Lipidi complessi
(o polari)
Steroidi
Acidi grassi
Saturi
Insaturi
Diverse molecole si affiancano parallele
Formano angoli
Lipidi semplici (o neutri)
Acidi grassi combinati sotto forma di esteri con alcool
Lipidi complessi
(o polari)
Fosfogliceridi
Lipidi complessi
(o polari)
Sfingolipidi
Steroidi
ACIDI NUCLEICI
Informazione genetica
Polimeri di quattro diversi nucleotidi
PROTEINE
Polimeri di venti diversi
aminoacidi
MACROMOLECOLE BIOLOGICHE
ED INFORMAZIONE BIOLOGICA
POLIMERI
PROTEINE
•Enzimi
•fattori trascrizione
•proteine strutturali
•proteine contrattili
•trasporto; pompe; canali ionici
•ormoni - fattori di crescita
•recettori
•deposito
•anticorpi
•tossine
PROTEINE
Struttura chimica
•Proteine semplici
•Proteine coniugate (con gruppi prostetici)
Modificazione
post-traduzionale
apoproteine
PROTEINE
Concatenamento di una
ventina di Aa
R
H2N
C
H
COOH
Aa sostanze anfotere
pH del mezzo
Grado di dissociazione
Punto isoelettrico
Cariche pos = cariche neg.
Comportamento ac.-base al variare del pH
Struttura secondaria:
Legame H tra -NH e =CO
Interazioni che
stabilizzano la struttura
terziaria delle proteine
Struttura secondaria
Nei liquidi biologici
Proteine globulari
Interno:Aa
apolari
Ext:Aa
polari
Proteine intrins. di membrana
Interno:Aa
polari
Ext:Aa
apolari
Proteine: struttura terziaria
Zone raggom. collegate a
zone con flessibilità
Struttura quaternaria
sottodominii
Dominii funzionali
catalitico regolatorio
Si conserva nell’evoluzione
Più catene polip. con loro strutt. terz. si associano
Stessi legami strutt. terziaria
Denaturazione delle proteine
Fisici: calore, radiazioni
Agenti denaturanti
pH molto acido o basico, alta
conc. Urea, guanidina ecc.
•Lasciano intatta solo la struttura primaria
•modificano proprietà chimico-fisiche
•perdita attività biologica
•se si allontanano, in molte proteine
rinaturazione
Regolazione attività biologiche delle proteine
1) Regolazione allosterica
La maggiore concentr. effettore
aumenta probabilità incontro con
la proteina
Proteina allosteriche sono
p. complesse con modific.
conform. struttura terz. e
quatern.
Conform. attiva
Conform. inattiva
Regolazione attività biologiche delle proteine
2) Regolazione per modificazione covalente
Conformaz. attiva e inattiva tramite legame covalente con un raggrupp. chimico
Enzimi regolano altri enzimi
Amplificazione
di un segnale
Es. attivazione di una proteincinasi consente di attivare o inibire molte
molecole enzima-substrato
ACIDI NUCLEICI
•DNA : deposito informazioni
•RNA: a) espressione informazione (es. sintesi proteica)
b) alcuni virus: deposito inform. genetica
FORMAZIONE DEL LEGAME
FOSFODIESTERICO
Legami H
DNA
Watson e Crick (1953)
5’
3’
•Basi azotate rivolte verso interno
•avvolgimento dimin. la distanza
•1 giro = 10 coppie nucleotidi
•passo spirale = 3.4 nm
•diametro = 2 nm
•si appaiano 1 purina e 1 pirim.
3’
5’
Eliche con andamento antiparallelo
Per separarle: srotolamento
2 eliche: sequenze diverse ma complementari
elica “senso” ed elica “non senso”
•Semplice modello per la replicazione
•facile riparazione
•A + G = T + C
•doppia elica stabilizzata da:
a) legami H tra coppie di basi
complementari
b) interazioni Van der Waals
tra basi sovrapposte
DNA
Dimensioni e forma
DNA
Dimensioni e forma
Zone non codificanti (DNA spaziatore)
Sequenze ripetute (no informazione)
Batteri: 1 cromosoma
circolare immerso nel
citoplasma
Eucarioti: più cromosomi nel nucleo; il
numero e le dimensioni sono
caratteristici di ogni specie; piccole
quantità DNA nei mitocondri e
cloroplasti;
superavvolgimenti
Denaturazione e rinaturazione DNA
Agenti fisici e chimici
•In soluzione strutt. disordinata
Denaturazione
•modif. proprietà fisico-chimiche (aumento assorb.
UV effetto ipercromico)
•no inform genetica
Temperatura di fusione
Circa 70°-80° C; varia a seconda delle basi
Ibridazione ac. nucleici:
(ingegneria genetica )
sequenze compl. si rinaturano
anche se 1 di DNA e 1 di RNA
RNA