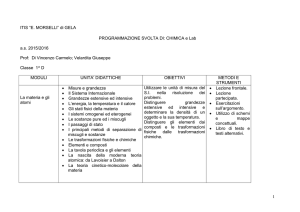
Chimica classe 1°
contenuti
MISURE E
GRANDEZZE
obiettivi
conoscenze
obiettivi
abilità
Sistema internazionale
delle unità di misura.
Grandezze estensive ed
intensive
Energia, calore e lavoro
Temperatura e calore
Misure precise e misure
accurate
La materia e le sue
LE
TRASFORMAZIONI caratteristiche
Sistemi omogenei ed
FISICHE DELLA
eterogenei
MATERIA
Sostanze pure e miscugli
Passaggi di stato
Le operazioni di
separazione dei miscugli
- Definire le unità di
misura del Sistema
Internazionale.
- Eseguire semplici
misure dirette e
indirette.
- Progettare semplici
investigazioni.
- Distinguere le
grandezze estensive
dalle grandezze
intensive.
- Distinguere il calore
dalla temperatura.
- Usare la notazione
esponenziale nelle
misure e nei calcoli
- Classificare i materiali
in base al loro stato
fisico.
- Descrivere i passaggi
di stato delle sostanze
pure e disegnare le curve
di riscaldamento e di
raffreddamento.
Utilizzare le principali
tecniche di separazione
dei materiali (filtrazione,
distillazione,
cromatografia ecc.)
obiettivi
competenze
Applicare le unità di
misura del Sistema
Internazionale, i relativi
prefissi del SI e la
notazione esponenziale
nella risoluzione dei
problemi
Classificare i materiali
come sostanze pure e
miscugli e spiegare le
curve di riscaldamento e
raffreddamento dei
passaggi di stato.
contenuti
obiettivi
conoscenze
Trasformazioni fisiche e
LE
TRASFORMAZIONI chimiche
CHIMICHE DELLA Elementi e composti
Metalli e non metalli
MATERIA
obiettivi
abilità
Spiegare le differenze
tra una trasformazione
fisica e una
trasformazione chimica.
- Distinguere un
elemento da un
composto.
obiettivi
competenze
Distinguere gli elementi
dai composti e le
trasformazioni fisiche
dalle trasformazioni
chimiche
- Descrivere le proprietà
di metalli e non metalli
contenuti
obiettivi
conoscenze
LE TEORIE DELLA L’atomo e la sua storia
Le prove sperimentali
MATERIA
della teoria atomica:
Lavoisier, Proust, Dal
ton
Teoria atomica e proprietà
della materia
Le particelle e l’energia
Teoria cinetica e passaggi
di stato
Sosta termica e calore
latente
obiettivi
abilità
obiettivi
competenze
Usare l’ipotesi atomicomolecolare della materia
Definire le tre leggi
ponderali della chimica. per spiegare la natura
- Descrivere il modello particellare di miscugli,
elementi e composti
atomico di Dalton.
- Spiegare le
caratteristiche
macroscopiche
microscopiche delle
principali trasformazioni
fisiche.
- Utilizzare il modello
cinetico-molecolare per
interpretare le
trasformazioni fisiche e
chimiche.
La massa di atomi e
LA QUANTITA’
CHIMICA: LA MOLE molecole: un po’ di
- Misurare la massa di
storia
un certo numero di
Le reazioni tra gas e
atomi o di molecole
principio di Avogadro
usando il concetto di
Quanto pesano un atomo mole e la costante di
ed una molecola?
Avogadro.
La massa atomica ela
- Calcolare il numero di
massa molecolare
moli dalla massa di una
Contare per moli
sostanza.
Formule chimiche e
composizione
- Ricavare la formula di
percentuale
un composto
conoscendo la
percentuale di ogni suo
elemento.
Conoscere la quantità
delle sostanze,
calcolando e misurando
il numero di moli di una
determinata sostanza
contenuti
LE LEGGI DEI GAS
obiettivi
conoscenze
I gas ideali e la teoria
cinetico molecolare
La pressione dei gas
Legge di Boyle
Legge di Gay-Lussac
Legge di Charles
Volume molare dei gas
Equazione di stato dei
gas ideali
Le miscele gassose
I gas reali
obiettivi
abilità
- Interpretare le
proprietà fisiche dei gas
mediante il modello
cinetico-molecolare.
- Descrivere l’effetto
della temperatura e del
numero di particelle
sulla pressione e sul
volume.
- Spiegare l’idea di
molecola, sulla base
dell’ipotesi di
Avogadro.
- Correlare la densità dei
gas al volume molare e
alla massa molare.
- Usare l’equazione
generale per il calcolo
del volume molare e
delle altre variabili dei
gas
obiettivi
competenze
Descrivere i gas
mediante la teoria
cinetica-molecolare e
applicare nella
risoluzione di problemi
le leggi di Boyle, di
Charles, di Gay-Lussac,
di Avogadro e
l’equazione generale dei
gas..