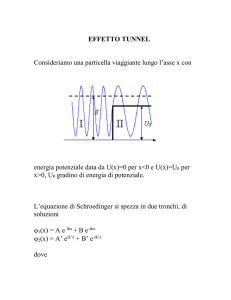
Il Postulato di de Broglie
Nella sua tesi di dottorato, nel 1924, Louis de Broglie propose l’esistenza di onde associate alle
particelle. il suo postulato si puó enunciare come segue:
Postulato Ad ogni particella di impulso p ed energia E é associata una lunghezza d’onda
λ =
h
p
(1)
ed una frequenza
E
(2)
h
(λ é detta la lunghezza d’onda di de Broglie della particella)
Si osservi che l’eqs.(1)-(2) hanno la stessa forma delle relazioni tra frequenza ed energia per un
fotone.
Possiamo valutare subito che la lunghezza d’onda di de Broglie per particelle macroscopiche, per
quanto piccole, é una quantitá non misurabile. Se consideriamo una pallina di massa m = 10−3 gr e
velocitá v = 1 cm/sec si trova, sostituendo i valori nell’eq.(1)
ν =
λ =
6, 6 · 10−34
h
=
= 6, 6 · 10−26 m = 6, 6 · 10−16 Å
−6
−2
p
10 · 10
(3)
Se valutiamo la lunghezza d’onda di de Broglie per particelle microscopiche invece troviamo valori
che sono dell’ordine della grandezze atomiche. Per esempio, per un elettrone di energia cinetica
K = 102 ev, valutando l’impulso con le formule della fisica non relativistica essendo K << mc2 ≈
500KeV , si ha
λ =
h
6, 6 · 10−34
h
= √
= p
= 1, 2 · 10−10 m = 1, 2 · Å
−31
2
−19
p
2mK
2 · 9, 1 · 10
· 10 · 1, 6 · 10
(4)
Tuttavia l”eqs.(1)-(2) portano ad un’apparente contraddizione con il postulato della relativitá speciale
di Einstein. Infatti, se valutiamo la velocitá dell’onda di materia dalla relazione abituale tra lunghezza
d’onda e frequenza, otteniamo
s
p
2
2
2
2
(cp)
+
(mc
)
E
mc
=
=c 1 +
>c
(5)
V = νλ =
p
p
p
L’apparente paradosso scompare se valutiamo non la velocitá di fase (V = νλ = ω/k), ma la velocitá
di gruppo (Vg = dω/dk), che é la velocitá con cui si propaga l’energia in un pacchetto d’onda
s
2 −1
dω
dE
p
mc
Vg =
=
=cp
=c 1 +
<c
(6)
dk
dp
p
p2 + (mc)2
dove abbiamo usato, per fare la derivata di E/p rispetto a k, le relazioni
E
dE
2πE
=
=⇒ dω =
h
~
~
2π
2πp
p
dp
k =
=
=
=⇒ dω =
λ
h
~
~
ω = 2πν =
1
(7)
(8)
Si noti che l’eq.(6) si puó scrivere, nel limite non relativistico, come
Vg =
c2 mṼ
c2 p
≈
= Ṽ
E
mc2
(9)
dove Ṽ é la velocitá della particella (abbiamo usato lo stesso valore per la massa a riposo e per la
massa relativistica, cioé abbiamo trascurato l’energia cinetica della particella rispetto alla sua energia
di riposo).
La conferma sperimentale della natura ondulatoria della materia venne ottenuta nel 1927 da
Davisson e Germer. In tale esperienza un fascio di elettroni, emessi da un filamento riscaldato e
accelerati da un campo elettrico di V = 54 V olt, venne inviato su un cristallo di nickel, i cui piani
atomici sono distanziati di d = 0.91 Å, e gli elettroni diffusi vennero rilevati a vari angoli rispetto al
fascio incidente. Il risultato dell’esperienza fu di rilevare un picco di interferenza costruttiva spiegabile
con una lunghezza d’onda di λ = 1, 67 Å, del tutto in accordo con la lunghezza d’onda di de Broglie
corrispondente ad elettroni di E = 54 eV , vedi eq.(1).
Se inseriamo il postulato di de Broglie (1) nel postulato di quantizzazione della quantitá di moto
di Bohr otteniamo
h
e p r = n ~ =⇒ 2πr = n λ
(10)
p=
λ
Quindi le circonferenze delle orbite permesse sono un multiplo intero della lunghezza d’onda associata
alla particella, cioé le onde di materia corrispondono alle possibili onde stazionarie del cerchio.
2