Proposta di Percorso Diagnostico presentato durante il
XXXVII Congresso Nazionale AMCLI - Stresa, 5-8 ottobre 2008
1
INFEZIONE CONGENITA DA VIRUS DELLA ROSOLIA
2
3
Coordinatore:
4
Con la collaborazione di:
5
AMCLI, Francesca Greco, UOC Microbiologia e Virologia Clinica e Molecolare, Azienda
6
Ospedaliera di Cosenza, Milena Furione, Maria Grazie Revello, Virologia e Microbiologia,
7
Fondazione IRCCS Policlinico San Matteo Pavia, Paolo Lanzarini, Clinica Malattie Infettive,
8
Fondazione IRCCS Policlinico San Matteo Pavia
AMCLI, Cristina Giraldi, U.O.C. di Microbiologia e Virologia, Azienda Ospedaliera di Cosenza
9
10
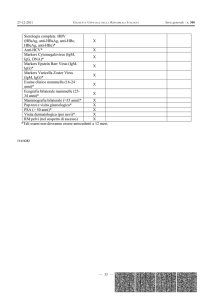
1. EZIOPATOGENESI, ASPETTI CLINI ED EPIDEMIOLOGIA
11
Il virus della rosolia è membro della famiglia Togaviridae, unico componente del genere Rubivirus.
12
Il virus contiene un RNA monocatenario circondato da un capside e da un envelope lipoproteico. Il
13
capside è costituito dalla proteina C, mentre l’envelope contiene due glicoproteine: E1 e E2.
14
L’uomo rappresenta l’unico ospite e la trasmissione avviene per contatto interumano diretto,
15
prevalentemente per via aerogena. Il virus penetra nel tratto respiratorio dove avviene la prima fase
16
di replicazione cui fa seguito una seconda nei linfonodi cervicali. Il periodo di incubazione varia da
17
due a tre settimane, con una media di quattordici giorni. La fase viremica dura per i sette giorni che
18
precedono la comparsa dell’ esantema mentre l’escrezione virale dal rinofaringe inizia circa 7 giorni
19
prima dell’esantema e persiste fino a 7-12 giorni dopo il rash. Gli anticorpi di tipo IgM compaiono
20
dopo brevissimo tempo dall’infezione, raggiungono un picco a 7-10 giorni dal contagio e persistono
21
in genere fino a 60 giorni dalla comparsa dell’esantema. In alcuni casi, vi è una persistenza delle
22
IgM tale da rendere difficoltosa la diagnosi di infezione. Le IgG compaiono generalmente dopo 2-5
23
giorni dalla comparsa delle IgM e persistono indefinitamente conferendo l’immunità (5). Il test di
24
avidità delle IgG non è sempre utile nella datazione di infezione acuta poiché la rapida maturazione
25
(circa 6 settimane ) costituisce un limite all’utilizzo di tale metodica.
26
Il virus causa una malattia esantematica a decorso benigno, caratterizzata da febbre, esantema,
27
linfoadenopatia retroauricolare e suboccipitale e, in alcuni casi, può dar esito ad artromialgie. Rare
28
gravi complicanze della rosolia sono l’encefalopatia post-infettiva (1 caso su 6000) e la
29
trombocitopenia severa (1 caso su 3000). L’infezione decorre in forma asintomatica nel 25-50%
30
dei casi. Se contratta entro le prime 16-18 settimane di gestazione determina nel embrione/feto:
31
aborto o gravi alterazioni transitorie e/o permanenti definite come “sindrome della rosolia
32
congenita” (SRC) o nascita di un neonato infetto asintomatico o di un neonato non infetto. La SRC
33
è caratterizzata da una o più delle seguenti manifestazioni: cataratta o glaucoma, difetti cardiaci,
34
sordità, retinopatia pigmentaria, porpora, splenomegalia, ittero, meningoencefalite, microcefalia,
05­1_Rosolia_CG1_111109 Pagina 1
Proposta di Percorso Diagnostico presentato durante il
XXXVII Congresso Nazionale AMCLI - Stresa, 5-8 ottobre 2008
35
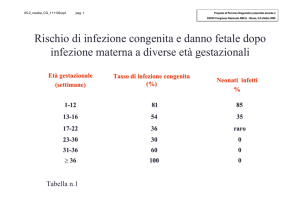
ritardo mentale, radiolucentezza ossea (2). La probabilità di danno fetale è maggiore nelle prime
36
settimane di gravidanza e tende ad annullarsi dopo la 16a-17a settimana di gestazione (SG). Il
37
rischio di danno fetale è pari al 85% dei casi di infezione durante le prime 12 settimane, con
38
maggiori probabilità di lesioni multiple se l’infezione decorre entro la 8a settimana. Dopo la 12a SG
39
il rischio di danno fetale diminuisce rapidamente, con rari casi di sordità in infezioni occorse alla
40
17a -18a SG (tabella n.1) (6). La malattia è presente allo stato endemico in tutto il mondo. Nei paesi
41
occidentali, il 5-20% circa delle donne in età riproduttiva è suscettibile al virus. In caso di
42
esposizione il tasso di infezione è del 100% per familiari conviventi o in comunità chiuse. La
43
rosolia si manifesta più frequentemente in primavera e, in assenza di campagne vaccinali efficaci, si
44
verifica ad intervalli di tre/quattro anni, in ondate epidemiche.
45
Misure di prevenzione della diffusione
46
Misure di prevenzione di primo livello
47
Sono rappresentate dai programmi di vaccinazione di tutti i bambini, maschi e femmine, con
48
vaccino combinato contro rosolia, morbillo e parotite (MRP) in doppia somministrazione entro il
49
secondo anno di vita ed a 4-12 anni. In alternativa, o in aggiunta, è possibile vaccinare solo le
50
donne in epoche filtro (età scolare, post partum e categorie a rischio). In Italia, il Ministero della
51
Sanità ha autorizzato il Servizio Sanitario Nazionale ad attuare campagne di prevenzione vaccinale
52
relative a “morbillo-rosolia-parotite" al fine di conferire una copertura immunitaria del 90% e con
53
l’obiettivo, per rosolia di ottenere:
54
1.
incidenza di rosolia congenita inferiore a 1 per 100.000 nati vivi (8)
55
2.
bassi livelli di suscettibilità alla rosolia nelle donne in età fertile (< 5%)
56
3.
incidenza della rosolia congenita inferiore a 1 per 100.000 abitanti della popolazione (3).
57
Misure di prevenzione di secondo livello (tabella n.2)
58
Consiste nella pratica clinica corretta e scrupolosa che preveda di:
59
a. richiedere sempre una valutazione sierologica in epoca pre-concezionale per tutte le donne e
60
prescrivere loro il vaccino in caso di suscettibilità o dubbia immunità. Il tempo di attesa
61
raccomandato tra la vaccinazione e il concepimento è di almeno un mese. Si suggerisce un
62
controllo sierologico dopo un mese dalla vaccinazione. In caso di immunità per rosolia non
63
è necessario ricontrollare la sierologia durante le successive gravidanze, se non nel caso la
64
paziente presenti un esantema o un contatto a rischio con un soggetto affetto da rosolia al
65
fine di documentare un’eventuale reinfezione;
66
b. in gravidanza effettuare gli esami per la valutazione sierologica di rosolia, entro le prime 5-
67
8 settimane. Nelle donne suscettibili ripetere mensilmente la ricerca di IgG e IgM anti
68
rosolia fino alla 20a settimana di gestazione e in prossimità del parto (1);
05­1_Rosolia_CG1_111109 Pagina 2
Proposta di Percorso Diagnostico presentato durante il
XXXVII Congresso Nazionale AMCLI - Stresa, 5-8 ottobre 2008
69
70
c. vaccinare post-partum le gravide suscettibili o con titolo anticorpale dubbio e raccomandare
un controllo sierologico a distanza di un mese (9).
71
72
2. DIAGNOSI NELLA MADRE
73
a.CRITERI CLINICI
74
Febbre, esantema, lifoadenopatia retroauricolare e suboccipitale, artropatia post rubeolica alle
75
grosse articolazioni. In caso di sieroconversione materna accertata nelle prime 8 settimane di
76
gestazione, deve essere offerta l’opzione dell’interruzione di gravidanza e della diagnosi prenatale
77
per l’elevatissima possibilità di danni fetali severi. Non ci sono evidenze di una diagnosi
78
strumentale come screening o conferma dell’infezione.
79
b.CRITERI DI LABORATORIO:
80
DIAGNOSI DIRETTA ED INDIRETTA ED INTERPRETAZIONE DEI RISULTATI
81
test di I livello: screening IgG, IgM
82
screening basato sulla determinazione delle IgG ed IgM specifiche mediante indagini
83
immunoenzimatiche o di chemioluminescenza.
84
I test devono essere eseguiti entro le prime 8 settimane di gestazione (flow chart n.1- tabella n.8).
85
Donne sieropositive per rosolia (tabella n.3):
86
la presenza di IgG specifiche in assenza di IgM indica uno stato immunitario di protezione
87
dall’infezione (6).
88
Donne sieronegative per rosolia (tabella n.3):
89
l’assenza di IgG e IgM specifiche indica un soggetto suscettibile di infezione che necessita di
90
controlli sierologici mensili fino alla 20a SG ed al momento del parto. Raccomandazione di
91
vaccinazione antirosolia post partum.
92
test di II livello: conferma IgM dubbie/positive con due metodiche e valutazione indice
93
avidità IgG
94
tutti i campioni con un forte sospetto di infezione rubeolica devono essere conservati dal laboratorio
95
al fine di poter essere testati successivamente in corso di approfondimento diagnostico.
96
Donne sieropositive per IgM e sieronegative per IgG anti-rosolia (tabella n.4)
97
Le IgM devono essere confermate con altra metodica avente la stessa sensibilità del test di
98
screening. La ricerca delle IgG deve essere ripetuta a distanza di 7-10 giorni per valutare una
99
eventuale sieroconversione che insieme alla conferma delle IgM è sufficiente alla diagnosi di
100
infezione recente. Al contrario, la persistenza delle IgM con IgG negative equivale ad una falsa
101
positività o una reazione crociata ad altre infezioni (citomegalovirus, toxoplasma, parvovirus, virus
05­1_Rosolia_CG1_111109 Pagina 3
Proposta di Percorso Diagnostico presentato durante il
XXXVII Congresso Nazionale AMCLI - Stresa, 5-8 ottobre 2008
102
Epstein-Barr). In questi casi si suggerisce di continuare i controlli sierologici a cadenza mensile
103
poiché la paziente risulta suscettibile all’infezione.
104
Donne sieropositive per IgM e IgG anti-rosolia (tabella n.4)
105
La valutazione delle IgM è identica alla precedente insieme alla determinazione del’indice di
106
avidità IgG (AI). I test sierologici per l’avidità oggi disponibili evidenziano una rapida
107
“maturazione” delle IgG rosolia specifiche, ovvero un rapido passaggio da valori di avidità bassa a
108
valori intermedi o alti (circa 6 settimane). Pertanto, l’interpretazione di questo test richiede molta
109
cautela. In particolare: se una bassa avidità è suggestiva di un’infezione da rosolia recente,
110
un’avidità intermedia o alta non sempre consentono di escluderlo (4). Si suggerisce, infine, di non
111
basarsi unicamente sull’indice di avidità per porre una diagnosi di rosolia recente, ma di valutare
112
contemporaneamente:
113
a) la cinetica delle IgG e IgM specifiche nelle successive 1-2 settimane;
114
b) la sintomatologia clinica (data di esordio)
115
c) il dato anamnestico (contatti a rischio e precedente stato immunitario per rosolia ).
116
Donne con IgM persistenti o dovute a reazione crociata ad altra infezione (tabella n.5)
117
La diagnosi di persistenza di IgM rosolia-specifiche si pone in caso di assenza di variazioni nei
118
livelli di IgM in prelievi sequenziali ottenuti a distanza di 2-4-8 settimane analizzati in parallelo
119
dutante la stessa seduta analitica.
120
La presenza di IgM può essere dovuta a reazione crociata verso altre infezioni virali quali
121
citomegalovirus, toxoplasma, parvovirus, virus Epstein-Barr, o patologie autoimmuni.
122
123
Test siero immunologici eseguiti dopo 8a settimana di gestazione (flow chart n.2- tabella n.9)
124
I test siero immunologici eseguiti in quest’epoca gestazionale hanno scarso valore diagnostico,
125
considerata la rapida scomparsa delle IgM specifiche e la precoce maturazione dell’indice di avidità
126
delle IgG.
127
128
3. DIAGNOSI NEL FETO
129
Lo studio del compartimento fetale si avvale della diagnostica prenatale invasiva (test di III livello)
130
che consente la diagnosi di infezione fetale e dell’esame ecografico. Quest’ultimo, evidenzia nel
131
follow up, eventuali anomalie strutturali e/o dell’accrescimento del feto.
132
test di III livello: diagnosi prenatale (tabella n.6)
133
La diagnosi prenatale per rosolia viene raccomandata nell’infezione rubeolica acuta in gravidanza
134
contratta entro la 16a-18 a SG o nei casi di dubbia interpretazione diagnostica evidenziati dopo la 18a
135
SG, e si avvale delle seguenti procedure:
05­1_Rosolia_CG1_111109 Pagina 4
Proposta di Percorso Diagnostico presentato durante il
XXXVII Congresso Nazionale AMCLI - Stresa, 5-8 ottobre 2008
136
1)
ricerca del virus mediante tecniche di biologia molecolare (RT PCR) o coltura su liquido
137
amniotico dopo 7-8 settimane dall’infezione materna (21a SG );
138
2)
139
3) ricerca del virus mediante tecniche di biologia molecolare (RT PCR) o coltura su villi coriali.
140
L’esperienza relativa a queste indagini è limitata e i risultati ottenuti possono essere di difficile
141
interpretazione. Infatti tale determinazione non rispecchia lo stato dell’infezione fetale in quanto il
142
virus può essere presente anche in assenza di infezione fetale (infezione limitata alla placenta).
143
Poiché la quantità di virus può essere molto bassa, tutti i campioni biologici dovrebbero essere
144
testati almeno in triplicato, per quanto riguarda i test molecolari, e con almeno due metodiche per la
145
determinazione di IgM su sangue fetale (10).
146
La positività di uno o più dei suddetti risultati test eseguiti su liquido amniotico e sangue fetale
147
indica una infezione congenita. Viceversa, non è mai possibile escludere un risultato falso negativo.
148
Nell’infezione rubeolica acuta avvenuta dopo la 16a-18a SG viene raccomandato esclusivamente il
149
controllo clinico e siero-virologico nel neonato alla nascita, a causa della bassissima incidenza di
150
danno fetale e della possibile falsa negatività della diagnosi prenatale.
151
Nella persistenza di IgM non è raccomandata la diagnosi prenatale invasiva, ma solo un controllo
152
delle IgM sul neonato alla nascita.
ricerca del virus e delle IgM su sangue cordonale alla 21a SG;
153
154
REFERTAZIONE E COUNSELLING
155
I tempi di refertazione e counselling devono essere urgenti e contenuti entro 1-2 giorni dal prelievo
156
per la diagnosi sieroimmunologica e 3-7 giorni per la diagnosi prenatale.
157
158
STRATEGIE DI TRATTAMENTO
159
nessuna
160
161
4. DIAGNOSI NEL NEONATO
162
Manifestazioni cliniche ed esiti
163
Alla nascita, le anomalie più frequentemente descritte nell’ambito della SRC sono rappresentate da
164
lesioni oculari (cataratta, microftalmia, glaucoma, corioretinite), cardiache (dotto arterioso pervio,
165
stenosi polmonare, difetto inter-atriale ed inter-ventricolare) e cerebrali (sordità neurosensoriale,
166
microcefalia, ritardo mentale). Sono inoltre spesso presenti ritardo di accrescimento, epato-
167
splenomegalia e trombocitopenia. I casi lievi di SRC (quelli da infezione dopo le 18 settimane di
168
gestazione e/o da reinfezione materna) possono avere un decorso sub-clinico e sfuggire alla
05­1_Rosolia_CG1_111109 Pagina 5
Proposta di Percorso Diagnostico presentato durante il
XXXVII Congresso Nazionale AMCLI - Stresa, 5-8 ottobre 2008
169
diagnosi. E’ quindi opportuno controllare alla nascita tutti i nati da madre con documentata o
170
sospetta infezione da rosolia in gravidanza.
171
172
Strumenti per la diagnosi
173
a. CRITERI DI LABORATORIO (tabella n.7)
174
screening
basato
sulla
determinazione
delle
IgM
specifiche
mediante
indagini
175
immunoenzimatiche o di chemioluminescenza sul siero del neonato con sospetta infezione
176
(non da sangue cordonale) alla nascita. Durante il follow up: dosaggio delle sole IgG a 6 e
177
12 mesi al fine di valutare le variazione del titolo nel bambino con sospetta infezione
178
congenita non diagnosticata alla nascita. Il dosaggio delle IgM nel liquido cefalorachidiano
179
(CSF) alla nascita e successivamente è da riservare ai casi con sintomi neurologici
180
ricerca del virus mediante tecniche di biologia molecolare (RT PCR) o coltura nelle urine,
181
secrezioni naso faringee e sangue. La ricerca del virus su CSF è da riservarsi ai casi con
182
sintomi neurologici (7).
183
b. CRITERI CLINICI
184
Caso confermato
185
Presenza di difetti congeniti riferibili a SRC e uno o più dei seguenti dati di laboratorio :
186
•
presenza di virus accertata madiante RT PCR o isolamento
187
•
presenza di IgM specifiche
188
•
persistenza sieropositività anticorpale IgG a 6-12 mesi (dopo la scomparsa degli anticorpi
189
materni).
190
191
Caso probabile
192
Dati di laboratorio insufficienti per confermare la diagnosi ma con due manifestazioni
193
cliniche appartenenti al gruppo (a) o una del gruppo (a) e una del gruppo (b):
194
(a) cataratta o glaucoma congenito, difetti cardiaci congeniti, sordità, retinopatia
195
196
197
pigmentaria
(b) porpora, splenomegalia, ittero, meningoencefalite, microcefalia, ritardo mentale,
radiolucentezza ossea
198
Caso possibile
199
Presenza di segni clinici compatibili con una SRC ma con criteri insufficienti per l’inclusione nella
200
categoria probabile o confermata
201
202
5. RACCOMANDAZIONI
05­1_Rosolia_CG1_111109 Pagina 6
Proposta di Percorso Diagnostico presentato durante il
XXXVII Congresso Nazionale AMCLI - Stresa, 5-8 ottobre 2008
203
o
vaccinazione universale
204
o
screening donne in età fertile
205
o
screening prenatale
206
o
screening neonatale
207
o
screening audiologico
208
209
6. RIFERIMENTI BIBLIOGRAFICI
210
1- Andrade JQ, Bunduki V, Curti SP, Figueiredo CA, de Oliveira MI, Zugaib M: “Rubella in
211
pregnancy: intrauterine transmission and perinatal outcome during a Brazilian epidemic”.J Clin
212
Virol. 2006 Mar;35(3):285-91.
213
2- Best J.M. “Rubella” Seminars in fetal et Neonatal medicine. 2007 12,182-192
214
3- Bonanni P, Bechini A, Boccalini S, Peruzzi M, Piscione E, Boncompagni G, Mannelli F,
215
Salmaso S, Filia A, Ciofi degli Atti “Progress in Italy in control and elimination of measles and
216
congenital ribella” Vaccine 2007 25 3105-3110
217
4- Bottiger B, Jensen IP “Maturation of rubella IgG avidity over time after acute rubella infection”
218
Clin Diagn Virol. 1997 Aug;8(2):105-11.
219
5- Cohen J, PowderlyWG. “Infection disease” Eds second edition Mosby 2004
220
6- Cooper L Z, Altford CA, Rubella347-388 in Remington &Klein editors “Infectious diseases of
221
the fetus and newborn infant “ 6th edition 2006 Elsevier Saunders Philadelfia
222
7- Miller E, JE Cradock-Watson JE, Pollock TM “Risk of serologically confirmed congenital
223
rubella infection and associated defects in children exposed to symptomatic maternal rubella
224
infection, by weeks of gestation “Lancet 82
225
8- Ministero della Salute: Decreto 14 ottobre 2004 “Notifica obbligatoria della sindrome/infezione
226
da rosolia congenita”
227
9- Pandolfi E, Chiaradia G, Moncada M, Ravo L, Tozzi AE “Prevention of congenital rubella and
228
congenital varicella in Europe” Eurosurveillance 2009 14 (9) www. Eurosurveillancre.org
229
10- Revello MG, Baldanti F, Sarasini A, Zavattoni M., Torsellini M., Gerna G “ Prenatal diagnosis
230
of rubella virus infection by direct detection and semiquantitation of viral RNA in clinical samples
231
by reverse transcription-PCR”. J Clin Microbiol. 1997 Mar;35(3):708-13
232
05­1_Rosolia_CG1_111109 Pagina 7