Appunti di Biochimica Per le Lauree Triennali
MV Catani, I Savini, P Guerrieri L Avigliano
Piccin Editrice
Questo testo è consigliato per chi deve comprarlo, per gli altri
va bene qualunque testo.
scaricato da www.sunhope.it
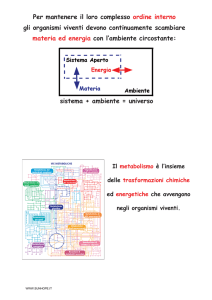
Tutto ciò che ci circonda dalla impalpabile aria che ci avvolge al
suolo su cui posiamo, è fatto di materia.
In fisica classica, con il termine materia si indica genericamente qualsiasi cosa che
abbia massa e occupi spazio; oppure, alternativamente, la sostanza di cui gli
oggetti fisici sono composti, escludendo l'energia dovuta al contributo dei campi
delle forze. La parola materia deriva dal latino mater (madre), che suggerisce come
essa venga considerata il fondamento costituente di tutti i corpi e di tutte le cose
scaricato da www.sunhope.it
Il passaggio da uno stato all’altro richiede
una modifica dell’energia perché
cambiano le relazioni tra le molecole, ma
è sempre reversibile. Es. acqua,
ghiaccio, vapore acqueo.
scaricato da www.sunhope.it
Es. H2O, diversa da H2 e O2
Es. NaCl
Na+ Cl-
L’atomo può esistere sotto forma di isotopi diversi
come ad es l’H1, il deuterio H2 e il Trizio H3.
scaricato da www.sunhope.it
LEGAME CHIMICO
• Si ha un legame chimico quando una forza di natura elettrostatica
tiene uniti più atomi in una molecola o in un cristallo (legami forti, o
intramolecolari) o più molecole in una sostanza allo stato
condensato (legami deboli, o intermolecolari).
• I legami chimici "più forti" hanno un contenuto energetico maggiore
e sono più difficili da rompere, mentre i legami "più deboli" hanno un
contenuto energetico minore e sono più facili da rompere. Da ciò
deriva che le molecole che hanno al loro interno legami chimici più
deboli sono più instabili.
• Inoltre tanto più un legame è forte, tanto minore è la lunghezza del
legame, essendo la forza che tiene uniti gli atomi maggiore.
• I legami chimici forti sono le forze che tengono uniti gli atomi che
formano le molecole. Un legame forte è attuato dalla condivisione o
dal trasferimento di elettroni tra atomi e dall'attrazione elettrostatica
tra protoni ed elettroni.
scaricato da www.sunhope.it
LEGAME COVALENTE
• Il legame covalente è il legame che si instaura tra due
atomi appartenenti alla categoria dei non metalli, uguali
o aventi differenza di elettronegatività - che mettono in
compartecipazione una coppia di elettroni (detti coppia di
legame) in un orbitale esterno che abbraccia entrambi gli
atomi. Il legame covalente viene rappresentato da un
trattino che congiunge i due atomi legati.
• Un legame covalente puro (o omopolare) è un legame
covalente che s'instaura fra due atomi appartenenti allo
stesso elemento. In pratica si stabilisce una interazione
(cioè il legame) tra atomi dello stesso tipo: è il caso tipico
dell'idrogeno, dell'ossigeno, dell'azoto atmosferico, ecc
scaricato da www.sunhope.it
SECONDO LA TEORIA DEL LEGAME DI VALENZA
la formazione di un legame covalente
viene interpretato in termini di sovrapposizione tra
gli orbitali dei due atomi impegnati nel legame:
• Si ha, quindi, la formazione di una regione ad
alta densità elettronica come risultato della
compenetrazione delle nuvole elettroniche.
• Il legame ottenuto è tanto più forte quanto più
efficace è la sovrapposizione degli orbitali.
scaricato da www.sunhope.it
LEGAME POLARE
• Il legame covalente polare si instaura tra due atomi con
differenza di elettronegatività media. In questo caso, gli
elettroni coinvolti nel legame risulteranno maggiormente
attratti dall'atomo più elettronegativo, il legame risulterà
quindi polarizzato elettricamente, cioè ognuno degli
atomi coinvolti nel legame presenterà una carica elettrica
parziale.
scaricato da www.sunhope.it
LEGAME di COORDINAZIONE
• È un tipo particolare di legame covalente detto, in
passato, dativo in quanto i due elettroni coinvolti nel
legame provengono da uno solo dei due atomi detto
donatore (in sostanza tale atomo "dona" il suo coppia
cioè entrambi gli elettroni appaiati presenti in un suo
orbitale), mentre l'altro, che deve essere in grado di
mettere a disposizione un orbitale esterno vuoto (cioè
con due posti vuoti che possono essere occupati da due
elettroni) oppure di riorganizzare la sua configurazione
elettronica per accogliere la coppia di elettroni (cioè ad
esempio spostare due elettroni presenti su di un orbitale
dispari su di un altro orbitale dispari, liberando di fatto un
orbitale) viene detto accettore. Il legame dativo può
essere rappresentato con una freccia, dal donatore
all'accettore, o più impropriamente può essere indicato
con un doppio trattino.
scaricato da www.sunhope.it
Legame metallico
• La forma più estrema di delocalizzazione del
legame covalente si ha nel legame metallico.
Secondo questo modello un metallo può essere
rappresentato come un reticolo cristallino di ioni
positivi tenuti uniti da una nube di elettroni
condivisi estesa a tutto il reticolo; essendo tali
elettroni non legati a nessun atomo particolare,
risultano essere estremamente mobili; tale
mobilità è responsabile della elevata
conducibilità elettrica dei metalli
scaricato da www.sunhope.it
LEGAME IONICO
• Il legame ionico è un legame tra ioni con carica di segno opposto.
Tali ioni si formano da atomi aventi differenza di elettronegatività
superiore al limite convenzionale, in queste condizioni, l'atomo più
elettronegativo (quindi caratterizzato da una bassa energia di
ionizzazione) priva l'altro atomo meno elettronegativo, di un
elettrone; il primo atomo diventa uno ione con carica negativa, il
secondo uno ione con carica positiva.
• Questo legame è di natura prettamente elettrostatica;
l'arrangiamento degli atomi nello spazio non ha la direzionalità del
legame covalente: il campo elettrico generato da ciascuno ione si
diffonde simmetricamente nello spazio attorno ad esso.
• E' il tipo più semplice di legame chimico, sia dal punto di vista
concettuale sia da quello della sua descrizione analitica, essendo
interpretabile in base alle leggi classiche dell'elettrostatica.
scaricato da www.sunhope.it
LEGAME A IDROGENO
• Un caso particolare di legame intermolecolare, che può anche
essere intramolecolare quando la geometria della molecola lo
consente, è il legame idrogeno.
Un atomo di idrogeno legato ad un atomo di ossigeno (o di fluoro), a
causa della sua polarizzazione positiva e delle sue ridotte
dimensioni, attrae con un'intensità relativamente elevata gli atomi di
ossigeno (e di fluoro e, in misura minore, di azoto) vicini.
Tale legame, benché debole, è responsabile della conformazione
spaziale delle proteine e degli acidi nucleici, conformazione da cui
dipende l'attività biologica dei composti stessi.
• Come ordine di grandezza, l'entità delle varie forze di legame può
essere indicato dalla seguente tabella:
δ+ δ-
δ+ δ-
H----X.......H----Cl
scaricato da www.sunhope.it
il carbonio forma sempre 4
legami.
• Gli idrocarburi sono i più semplici composti del carbonio
con l'idrogeno. Sono le molecole di base della chimica
organica poiché, oltre ad essere molto numerosi, tutti gli
altri composti si possono considerare come derivati da
essi per sostituzione di un atomo di idrogeno con un
cosiddetto gruppo funzionale, quel gruppo chimico,
cioè, che conferisce al composto proprietà
caratteristiche, diverse da quelle dell'idrocarburo di
origine e peculiari di una classe di composti.
• I composti organici possono essere suddivisi in tre
grandi gruppi:
• Alifatici e Aliciclici
• Aromatici
• Eterociclici
scaricato da www.sunhope.it
• Il primo gruppo comprende i composti
alifatici (dal greco "aleifar" = olio, grasso),
sinonimo di composti a catena aperta
(detti anche aciclici) e gli aliciclici, o ciclici,
composti chiusi ad anello, con proprietà
relativamente simili agli alifatici.
• Gli idrocarburi alifatici si suddividono a loro
volta in alcani, alcheni e alchini (figura
1.1).
scaricato da www.sunhope.it
Alcani
scaricato da www.sunhope.it
scaricato da www.sunhope.it
•
Gli alchini sono gli idrocarburi caratterizzati dal triplo legame carbonio-carbonio. A
differenza del doppio legame che si incontra in numerose molecole di interesse
biologico, il triplo legame è assai raro nel regno vivente. Per questo motivo, ci
limiteremo solo a poche nozioni su questi composti.
•
Il primo termine della serie è l'acetilene o etino, H-C= C-H. Per quel che riguarda la
nomenclatura, si fa riferimento al corrispondente alchene di pari numero di atomi di
carbonio, cui si sostituisce la desinenza –ene con –ino.
•
A differenza di alcani e alcheni, che sono tra le sostanze meno acide che si conoscano,
gli alchini sono caratterizzati da una debole acidità: l'atomo di carbonio impegnato nel
triplo legame si comporta infatti come se fosse più elettronegativo di un carbonio
impegnato in un legame semplice o doppio. Per questo motivo gli alchini possono
reagire con i metalli dei gruppi IA e IIA (ad esempio, Na e Ca) per dare composti di
natura ionica: acetiluri e carburi:
=
scaricato da www.sunhope.it
•
•
•
I cicloalcani appartengono alla categoria degli idrocarburi aliciclici, quei composti cioè
caratterizzati da una struttura ad anello costituito esclusivamente da atomi di
carbonio. Vengono anche detti omocicli, in contrapposizione agli eterocicli, il cui
anello contiene anche atomi diversi dal carbonio. Hanno caratteristiche che ricordano
in larga parte quelle degli idrocarburi alifatici.
Dato il loro limitato interesse biologico, ci occuperemo quasi esclusivamente della
loro struttura, in particolar modo di quella del cicloesano, la cui conoscenza ci sarà
utile in seguito per comprendere meglio la struttura dei monosaccaridi.
Per quanto riguarda la nomenclatura, basta anteporre il prefisso ciclo- al nome del
corrispondente idrocarburo alifatico. La loro struttura si può rappresentare
semplicemente con una figura geometrica, omettendo gli atomi di carbonio dell’anello
e gli idrogeni ad essi legati:
Si dovranno tuttavia mettere in
evidenza eventuali sostituenti:
scaricato da www.sunhope.it
• Il termine «aromatico» fu usato inizialmente per
designare i composti organici dotati di odore gradevole.
Oggi il termine ha piuttosto un significato “strutturale”,
poiché con esso si indicando molecole caratterizzate da
un particolare assetto elettronico, che conferisce loro
un determinato comportamento chimico.
• Il primo a ipotizzare che il benzene avesse una struttura
ciclica fu Kekulé (1865). Successivamente, egli suggerì
che la molecola si trovasse in uno stato di equilibrio tra
due forme; un equilibrio talmente rapido che nessuna
delle due poteva essere isolata:
scaricato da www.sunhope.it
• I dati sperimentali sono perfettamente in linea con questa
rappresentazione: ogni legame C-C è equivalente e la lunghezza di
legame (1.39Å) è intermedia a quella prevista per un legame
semplice (1.54Å) e uno doppio (1.33Å), la forma è quella di un
esagono regolare. Ogni carbonio ha ibridazione sp2 e i rimanenti
orbitali p non ibridati. I sei elettroni rimanenti possono delocalizzarsi
in un unico orbitale π esteso a tutto l'anello.
• È allo scopo di mettere in evidenza questo aspetto che si usa
rappresentare il benzene come un esagono con un cerchio al
centro.
• In questa osservazione è implicito che la molecola del benzene è
molto più stabile di quello che ci si aspetterebbe per strutture come
quelle rappresentate dalle formule canoniche di risonanza. L'aspetto
veramente notevole, legato al fenomeno dell'aromaticità, è proprio
l'elevato valore dell'energia di risonanza della molecola del
benzene. Si preferisce in questo caso parlare di stabilizzazione per
delocalizzazione, piuttosto che di stabilizzazione per risonanza.
È allo scopo di mettere in
evidenza questo aspetto che si
usa rappresentare il benzene
come un esagono con un cerchio
al centro.
scaricato da www.sunhope.it
COMPOSTI CARBONILICI
Composti organici caratterizzati dal gruppo funzionale carbonilico.
Il gruppo carbonilico è planare, con angoli di legame di 120°.
Il doppio legame C=O consiste in un legame σ (sovrapposizione di due orbitali
ibridi sp2) e in un legame π (sovrapposizione di due orbitali p).
scaricato da www.sunhope.it
COMPOSTI CARBONILICI
FORMULA
FAMIGLIA
FORMULA
O
R
R
O
Aldeidi
C
O
O
Chetoni
O
C
OH
scaricato da www.sunhope.it
Esteri
C
O
R’
R
R
H
C
FAMIGLIA
R
C
Ammidi
NH2
Acidi
Carbossilici
R’
ALDEIDI E CHETONI
ALDEIDI
CHETONI
Nelle aldeidi, il gruppo carbonilico è
legato ad un atomo di idrogeno e ad
un atomo di carbonio.
Nei chetoni, il gruppo carbossilico è
legato a due atomi di carbonio.
l’aldeide più
Nella formaldeide,
formaldeide
semplice, il gruppo carbonilico è
legato a due atomi di idrogeno.
In figura: Propanone o Acetone
In figura: Etanale o Acetaldeide
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Le reazioni della chimica
organica
• Le reazioni della chimica organica implicano
normalmente la rottura di legami e la formazione di
nuovi. Poiché il legame è sempre formato da una coppia
di elettroni condivisa da due atomi (A:B), esso può
scindersi essenzialmente in due modi:
• 1) OMOLITICO o RADICALICO. In questo caso, ciascun
atomo si “prende” un elettrone (A:B → A• + B•) e si
formano dei radicali. La formazione di radicali è un
processo che richiede una certa energia: è favorita dal
calore e dai raggi U.V.)
• 2) ETEROLITICO o IONICO. In questo caso il doppietto
è preso interamente da uno dei due atomi e si formano
quindi un anione e un catione (A:B → A:– + B+).
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Gli aminoacidi (o amminoacidi) sono l'unità strutturale primaria delle proteine. Possiamo
quindi immaginare gli aminoacidi come mattoncini che, uniti da un collante chiamato,
legame peptidico formano una lunga sequenza che dà origine ad una proteina.
All'interno dello stomaco e del duodeno questi legami vengono rotti ed i singoli
aminoacidi giungono sino all’intestino tenue dove vengono assorbiti come tali ed utilizzati
dall'organismo.
Dal punto di vista chimico l'aminoacido è un composto organico contenente un gruppo
carbossilico (COOH) ed un gruppo aminico (NH2). Oltre a questi due gruppi ogni
aminoacido si contraddistingue dagli altri per la presenza di un residuo (R) conosciuto
anche con il nome di catena laterale dell'aminoacido.
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Tutti gli amino acidi hanno la stessa
struttura generale ma ciascuno differisce
per il gruppo R
scaricato da www.sunhope.it
Amino acidi idrofobici e amino acidi
“speciali”
scaricato da www.sunhope.it
Amino Acidi Idrofilici
scaricato da www.sunhope.it
I legami peptidici uniscono gli amino
acidi in catene lineari
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Struttura primaria
E’ data dalla sequenza degli aminoacidi che costituiscono una
catena peptidica. Ogni proteina è caratterizzata dall’avere una
specifica composizione in aminoacidi, e da un ben preciso ordine
con cui questi si susseguono lungo la catena.
La struttura primaria è determinata geneticamente: le sequenze
aminoacidiche delle proteine di un individuo si trovano depositate,
in codice, in altrettanti tratti del suo DNA, geni.
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Una proteina ha una catena principale ripetitiva (nero) e
catene laterali variabili (verde)
scaricato da www.sunhope.it
Le proteine hanno una direzione
scaricato da www.sunhope.it
I legami peptidici sono planari
scaricato da www.sunhope.it
Distanze fra atomi che caratterizzano il
legame peptidico
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Struttura secondaria
Lunghe catene di amminoacidi si piegano (fold) o si arricciano
(curl) in una struttura regolare che si ripete.
La struttura è il risultato della formazione di legami idrogeno
tra gli amminoacidi della proteina.
Tra le strutture secondarie comuni troviamo
Le eliche alfa
I foglietti beta pieghettati
Queste strutture secondarie sono responsabili della rigidità
delle proteine,
scaricato da www.sunhope.it
Una comune struttura
secondaria
Proprietà dell’alfa-elica:
Resistenza e solubilità in
acqua
Proposta nel 1951 da Pauling
e Corey
scaricato da www.sunhope.it
Asse immaginario intorno al quale si avvolge l’a-elica
Ogni idrogeno ammidico
è coinvolto in
un legame idrogeno con
il carbonile di
un altro amminoacido
posto 3,6 aa più in basso
la distanza tra due anse
è il passo dell’elica
scaricato da www.sunhope.it
Nei foglietti pieghettati ci sono ancora dei
legami ad idrogeno,
ma stavolta sono tra fogli adiacenti (sheet)
scaricato da www.sunhope.it
Come si orientano i legami negli amminoacidi?
alfa elica
Guardate i carbonili! Nell’alfa elica puntano
nella stessa direzione, mentre nei foglietti
pieghettati sono alternati
scaricato da www.sunhope.it
Ad esempio …la seta.
Le proteine della seta sono
un esempio
di foglietto pieghettato…
Sono composte
principalmente
da glicina e alanina
scaricato da www.sunhope.it
Struttura terziaria
• Riguarda tutte le possibili interazioni tra i gruppi
R.
• Nessun legame covalente.
• Un’eccezione è il ponte disolfuro tra due
cisteine.
La struttura terziaria è responsabile della forma
della proteina nello spazio:
- Globulare (enzimi, mio- e emoglobina)
- Fibrosa (Fibroina, elastina, cheratina, collageno)
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
I residui di cisteina possono formare ponti disolfuro intra o
extra catena
scaricato da www.sunhope.it
Aminoacidi non proteici
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Classificazione degli aminoacidi
• Nella sintesi proteica intervengono solo
venti dei diversi aminoacidi esistenti in
natura (attualmente oltre cinquecento). Dal
punto di vista nutrizionale questi
aminoacidi possono essere a loro volta
divisi in due grandi gruppi: quello degli
aminoacidi essenziali e quello degli
aminoacidi non essenziali.
Aa essenziali per l’uomo:
fenilalanina, isoleucina, lisina, leucina, metionina, treonina,
triptofano e valina
scaricato da www.sunhope.it
Sono definiti essenziali quegli aminoacidi che
l’organismo umano non riesce a sintetizzare in
quantità sufficiente a far fronte ai propri bisogni.
Amminoacidi essenziali:
• fenilalanina, isoleucina,
lisina, leucina, metionina,
treonina, triptofano e
valina
Amminoacidi
semiessenziali:
•
Aminoacidi
condizionatamente
essenziali:
•
scaricato da www.sunhope.it
cisteina e la tirosina, in quanto
l’organismo li può sintetizzare a partire
da metionina e fenilalanina.
arginina, glicina, glutamina, prolina e
taurina, quegli aminoacidi che
ricoprono un ruolo fondamentale nel
mantenimento dell’omeostasi e delle
funzioni dell’organismo in determinate
situazioni fisiologiche. In alcune
condizioni patologiche questi
aminoacidi possono non essere
sintetizzati a velocità sufficiente per far
fronte ai reali bisogni dell'organismo.
L’arginina sta assumendo notevole
importanza, come precursore dell’ossido
nitrico, per le tante funzioni che
quest’ultimo esplica nell’attività cellulare,
nella trasduzione dei segnali biologici
e nella difesa immunitaria.
scaricato da www.sunhope.it
CONTENUTO IN AMINOACIDI ESSENZIALI: si possono definire complete o nobili quelle
proteine che contengono tutti gli AA essenziali in quantità e in rapporti equilibrati. In
generale le proteine animali sono complete e quelle vegetali sono incomplete.
• I legumi sono la”carne dei
poveri: questa affermazione
serve a sottolineare che i
legumi posseggono la maggior
parte degli aa. necessari per la
sintesi proteica con l’eccezione
dell’ac. glutammico il quale
può essere integrato
utilizzando la combinazione
legumi- carboidrati, cioè pasta
e fagioli. Questo è un esempio
di mutua integrazione, in realtà
oltre che per completare il pool
di aa. questo tipo di
integrazione favorisce anche
l’introduzione nella dieta di una
corretta quantità di vegetali.
scaricato da www.sunhope.it
• Proteine nobili: è stato
introdotto impropriamente il
termine "nobili“per sottolineare
la presenza di tutti gli aa. nella
composizione delle proteine di
origine animale.
AMINOACIDO LIMITANTE: di una proteina o di una miscela proteica è
l’aminoacido essenziale carente o del tutto assente che limita l’utilizzo
di tutti gli altri aminoacidi anche se presenti in eccesso rispetto ai
bisogni. Come abbiamo visto nelle proteine di origine vegetale questo
aminoacido non è in genere sufficiente a garantire il fabbisogno e
deve essere introdotto tramite l'abbinamento con altri cibi.
scaricato da www.sunhope.it
•
AMINOACIDI RAMIFICATI: sono tre aminoacidi (Valina, isoleucina e Leucina) che in
particolari condizioni, come l'impegno fisico intenso, vengono utilizzati come
substrato energetico ausiliario di grassi e carboidrati.
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Idrossilazione della lisina
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
scaricato da www.sunhope.it
Più di 1000 mutazioni nei 22 geni che cod. per il collageno e la sua sintesi, sono
causa di molte patologie. La sindrome di Ehlers-Danlos (EDS) si origina da: Carenza
di lisil/prolil idrossilasi o carenza di procoll. peptidasi, o da mutazioni puntiformi della
sequenza aminoacidica. Mutazioni del collageno di tipo III, importante componente
delle arterie, è causa di disturbi vascolari potenzialmente letali. Si associa anche a
lassità della cute, oltre cha articolare.
scaricato da www.sunhope.it
Osteogenesi imperfetta (OI) o sindrome delle ossa di vetro, comprende un gruppo
eterogeneo di patologie ereditarie. Tipo I, OI tardiva, si manifesta nella prima
infanzia con fratture secondarie a traumi di minore entità, si può ipotizzare se
l’ecografia prenatale mostra incurvature o fratture nelle ossa lunghe.
OI di tipo II o
congenita, I
pazienti
muoiono prima
della nascita o
subito dopo il
parto per
insufficienza
respiratoria
scaricato da www.sunhope.it
scaricato da www.sunhope.it
L’Elastina è un polimero insolubile formato da tropoelastina, una proteina lineare di
700aa., prevalentemente piccoli e apolari (gly, ala, val) Inoltre presenta pro, e lys, ma
solo tracce di HyPro e manca di HYLYs.
La tropoelastina viene secreta
dalle cellule nello spazio
extracellulare dove interagisce
con una glicoproteina, la
fibrillina, che ha funzione di
impalcatura. Le lys di tre catene
di tropoelastina vengono
deaminate (D. Ossidativa) e le
allisine di 3 catene di
tropoelastina contigue con una
lys, non modificata formano un
legame crociato di desmosina
scaricato da www.sunhope.it
Sindrome di Marfan dovuta ad una elastina sbagliata:
Le cause: La MFS è una malattia genetica, dovuta all’alterazione di un gene. All’inizio
degli anni ‘90, è stato identificato sul cromosoma 15 il difetto genetico che causa la
MFS. Si tratta di alterazioni (mutazioni) del gene della fibrillina-1 (FBN1). La fibrillina-1
è una grossa glicoproteina, che costituisce una componente importante delle fibre
elastiche presenti nel tessuto connettivo. Le mutazioni che causano la MFS, e quindi
una fibrillina-1 “difettosa”, sono numerose: a tutt’oggi sono note circa 500 diverse
mutazioni del gene FBN1 e questo rende particolarmente difficile effettuare una
diagnosi genetica per identificare la presenza di una mutazione. Mutazioni nel gene
della fibrillina-1 sono responsabili anche di altre malattie come la lussazione isolata
familiare del cristallino e, in parte, dell’aneurisma aortico-toracico familiare.
Disturbi cardiovascolari.
I disturbi più severi riguardano il sistema cardiovascolare. Il problema maggiore è
costituito dalla dilatazione dell’aorta
Disturbi dell’apparato scheletrico.
Le persone affette da MFS hanno un aspetto “dinoccolato” e longilineo, con arti e mani
lunghe e sottili. Le articolazioni sono “lasse”, con lussazioni spesso ricorrenti. Spesso
è presente piede piatto. Si possono avere anche deformità della gabbia toracica come
il petto carenato (sterno all’infuori) e il petto escavato (sterno verso l’interno), e
problemi alla spina dorsale come scoliosi e lordosi di gravità variabile. Un altro difetto
frequente è la miopia.
scaricato da www.sunhope.it
L’antitripsina α (α1−
ΑΤ), prodotta da
fegato, ma anche
monociti e macrofagi
alveolari impedisce la
degradazione
dell’elastina nelle pareti
alveolari . Una α1-AT
difettosa può causare
enfisema.
scaricato da www.sunhope.it