17/11/2009
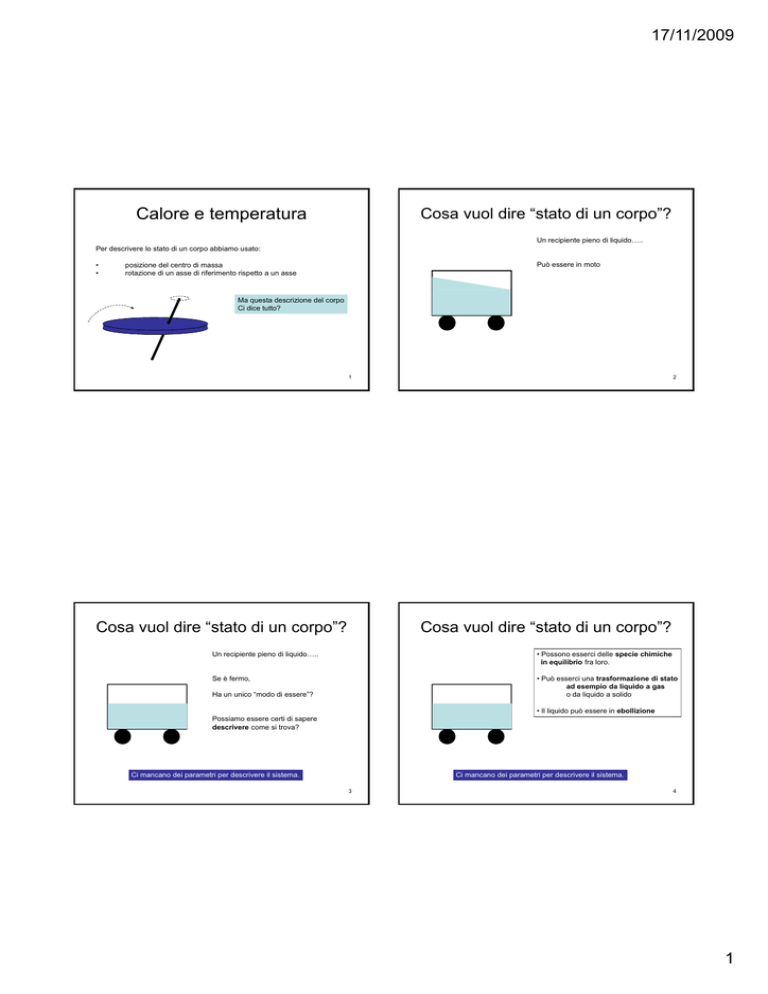
Calore e temperatura
Cosa vuol dire “stato di un corpo”?
Un recipiente pieno di liquido…..
Per descrivere lo stato di un corpo abbiamo usato:
•
•
Può essere in moto
posizione del centro di massa
rotazione di un asse di riferimento rispetto a un asse
Ma questa descrizione del corpo
Ci dice tutto?
1
Cosa vuol dire “stato di un corpo”?
2
Cosa vuol dire “stato di un corpo”?
Un recipiente pieno di liquido…..
• Possono esserci delle specie chimiche
in equilibrio fra loro.
Se è fermo,
• Può esserci una trasformazione di stato
ad esempio da liquido a gas
o da liquido a solido
Ha un unico “modo di essere”?
• Il liquido può essere in ebollizione
Possiamo essere certi di sapere
descrivere come si trova?
Ci mancano dei parametri per descrivere il sistema.
Ci mancano dei parametri per descrivere il sistema.
3
4
1
17/11/2009
Cosa vuol dire “stato di un corpo”?
Ad esempio: cambiamento di stato,
ghiaccio Æ acqua
Esistono sostanze “conduttori”
o “isolanti” di “calore”:
Se due corpi sono messi a contatto tramite
una parete conduttiva, CAMBIANO IL LORO
STATO.
Se due corpi sono messi a contatto tramite
una parete isolante, NON CAMBIANO IL LORO
STATO.
Parete isolante
Acqua calda
Ovviamente esistono sostanze parzialmente conduttive o
parzialmente isolanti….
5
Molte sostanze che
modificano il loro stato
se messi a contatto con
altri corpi:
6
All'inizio del diciassettesimo secolo, non c'era alcun metodo per quantificare il calore
di un corpo. Molti studiosi dell'epoca sapevano che l'aria si espande quando viene
riscaldata. Il termoscopio fu ideato da Galileo all'inizio del 1600 ed era costituito da una
piccola fiaschetta con il collo lungo e sottile, piena d'aria, posto a testa in giu' entro una
vasca piena d'acqua. Quando la fiaschetta veniva riscaldata, l'aria al suo interno si
espandeva, e il livello dell'acqua nel collo scendeva, mentre quando l'aria si raffreddava,
il suo volume decresceva e l'acqua saliva dalla vaschetta lungo il collo del fiasco.
Negli anni successivi, il dispositivo venne perfezionato da Galileo e dai suoi amici
Santorio Santorio e Gianfrancesco Sagredo, per includervi una scala numerica:
si ebbe cosi' il primo termometro ad aria. Contemporaneamente ed indipendentemente,
altri studiosi europei misero a punto analoghi dispositivi.
Si passo' poi, intorno al 1630, ai termometri riempiti di liquido, ma fu solo nel
diciannovesimo secolo che venne stabilita una scala universale di temperature,
sulla base di alcune temperature base (quella di fusione del ghiaccio e quella di
ebollizione dell'acqua) da parte di D.G. Fahrenheit e A. Celsius.
Dilatazione
della colonnina
di mercurio
7
8
2
17/11/2009
Messa a contatto
con un oggetto “freddo”…
fornisce calore..
Il termoscopio di Galileo:
Espansione dell’aria che comprime
l’acqua.
L’aria
Si contrae..
e l’acqua
l acqua scende
nel collo
Versione moderna
e commerciale:
differente densità del
Liquido: differente
capacità di galleggiamento
Assunzione:
L’acqua non cambia molto
Volume con la temperatura
L’aria
L
aria si contrae e
L’acqua sale nella
colonnina
9
10
Celsius
700 oC
Scale di temperatura
filamento
della lampadina
Kelvin
Esistono varie scale:
Celsius
Fareneiht
Reamur
Kelvin
…………….
Necessitano di
due punti di riferimento
e di una proprietà fisica
che si ipotizza cambi
100 oC
“linearmente con …..”.
Acqua in ebollizione
0 oC
11
Acqua-ghiaccio
-200 oC
Azoto liquido
-269 oC
-273.15 oC
Elio liquido
Zero assoluto
373.15 K
273.15 K
73 K
4K
0K
12
3
17/11/2009
Proprietà termiche della materia
Si trova che la dilatazione/contrazione relativa dipende da:
- La differenza della temperatura ∆T
- il materiale
Un corpo cambia volume se la temperatura cambia.
∆Lx
= α ∆T
Lx
E’ difficile isolare un cambiamento di taglia in una sola dimensione….
∆Lx
Lx
In generale si tratta sempre di
dilatazioni/contrazioni in 3Dimensioni.
Se il corpo è allungato in una direzione x, la
variazione assoluta di dimensioni prevalente
è lungo x
13
14
Dilatazione di volume
esempio
In prima approssimazione la dilatazione di volume è proporzionale a:
Volume iniziale: V
Il mercurio ha un coefficiente α = 10-1 oK-1
Coefficiente di dilatazione di volume: β
Variazione di temperatura: ∆T
e quindi
i di un coefficiente
ffi i t di dil
dilatazione
t i
volumetrica
l
ti
β = 3*10-1 oK-1
10mm
∆V = Vβ∆T
β = 3 α,
A=area
H
15
16
4
17/11/2009
Per i solidi:
Poiché la colonnina è costretta in un diametro di 2mm,
Considero la variazione di volume.
∆T=1oK
Coefficienti di espansione lineare:
L =1m
∆V = Vβ ∆T = AHβ ∆T
Temperatura (oC)
Materiale
Alluminio
Hβ∆T
∆H = H
∆V = A∆H
A=area
∆T=1[oK]
H
−1
Diamante
Vetro comune
∆H = 10[mm]3 *10 *1[ K ] = 3mm
α(oK-1)
2.21*10-5
2.30*10-5
2.41*10-5
3.35*10-5
1.00*10-6
8.3*10-6
-23
20
77
527
20
50
∆L
22 µm
23 µm
24 µm
33 µm
1 µm
8 µm
o
17
18
Esempio importante: acqua
Temperatura?
Il coefficiente di dilatazione cubica non è sempre positivo
o
-1
Coefficiente di Es
spansione Cubica ( K )
•Un parametro che indica lo stato “interno” di un corpo.
per T = 4 oC Æ β = 0
β
0.0002
Per T < 4 oC Æ β < 0 Æ contrazione
•Posso assegnarlo a un corpo:
0.0001
Per T > 4 oC Æ β > 0 Æ dilatazione
un corpo
p HA una certa TEMPERATURA
0.0000
0
4oC
0
5
10
15
20
o
Temperatura ( C)
Energia? Æ Energia potenziale + “interna”?
La densità dell’acqua è massima
Per T = 4 oC.
h
19
20
5
17/11/2009
Scambi di calore
Parete
conduttrice
Verso il primo principio della termodinamica.
1.Scambi di calore
2.Calori specifici
3.Cambiamenti di stato e non continuità dei
calori specifici
1.Lavoro, calore e energia interna (I principio)
2.Applicazioni e esempi del primo principio
T1
T1 > T2
T2
Massa
M1
Due sistemi identici sono a contatto con una
parete conduttrice
(ovvero che permette l’equilibrio termico)….
Massa
M2
…. La temperatura finale è la stessa per
entrambi i corpi: Tf
T1 > Tf > T2
Si trova che:
c1M 1 (T f − T1 ) = c2 M 2 (T2 − T f )
c2 e c1 sono
costanti che dipendono
dal MATERIALE:
21
22
Scambi di calore
Parete
conduttrice
T1 > Tf > T2
Parete
conduttrice
T1 > T2
T1
Massa
M1
T1
T2
Massa
M2
Massa
M1
Possiamo pensare che ci sia una forma di
energia che fluisce dal corpo caldo a quello freddo
P
Possiamo
i
iinterpretare
t
t
l’ equilibrio
ilib i ttermico
i come un ttrasferimento
f i
t di calore:
l
Calore negativo
ceduto dal corpo
caldo ( a T=T1).
Possiamo interpretare il risultato di equilibrio termico come:
Qceduto + Qassorbito = 0
= -Qceduto > 0
Massa
M2
Qceduto = Q1 = c1M 1 (T f − T1 )
Che chiamiamo calore, Q
c1M 1 (T f − T1 ) + c2 M 2 (T f − T2 ) = 0
Attenzione: Qassorbito
T2
Qassoribto = Q2 = c2 M 2 (T f − T2 )
Calore positivo
assorbito dal corpo
freddo ( a T=T2).
Qceduto + Qassorbito = 0
23
c1M 1 (T f − T1 ) + c2 M 2 (T f − T2 ) = 0
24
6
17/11/2009
Calore ?
Equivalenza fra calore e energia meccanica?
Robert Joule, 1870 circa.
Una forma di Energia: Energia termica
Non posso assegnarlo a un oggetto:
un corpo NON HA una certa quantità di calore
può SCAMBIARE una certa quantità di calore.
Unità di misura:
[Q] = [J]
25
Calore specifico per unità di massa
L’acqua
contenuta
nel cilindro
si scalda quando
le pale si muovono
trascinate dalla caduta
dei due pesi.
1 Cal = 4.186 J
26
Calore specifico dell’acqua
Energia termica scambiata
per unità di Temperatura e di Massa
cH2O = 1 cal/K/gr = 4186 J/K/Kg
Q = cM∆T
Il coefficiente c viene detto CALORE SPECIFICO a volume costante
di un materiale.
Per ottenere l’innalzamento di un grado Kelvin (o un grado Celsius) di un Kg
((o un litro)) di acqua:
q
Non dipende dalla massa dell’oggetto ma dal MATERIALE.
devo fornire 4186 Joule-
Q = cM∆T
Unità di misura:
[c] = [J
Kg-1
K-1]
= [J/Kg/K]
[Q] = Joule !!!!
27
28
7
17/11/2009
esempio
MH2O = 10 kg
Mal = 1 kg
cal = 898 J
Un cubo di alluminio della massa di 1 Kg
kg-1 oK-1
cacqua = 4169 J kg-1 oK-1
cal M al (50 − T f ) = cH 2O M H 2O (T f − 25)
Viene scaldato a T1=50oC
Quindi immerso in 10 L di acqua a T2=25oC.
Qual è la temperatura di equilibrio, Tf?
cacqua = 4169 J kg-1 oK-1
Qal = cal M al (T f − Tal )
QH 2O = cH 2O M H 2O (T f − TH 2O )
Qal < 0
QH 2O > 0
cal = 898 J kg-1 oK-1
29
30
Conti in dettaglio….
Tf =
MH2O = 10 kg
Mal = 1 kg
cal = 898 J kg-1 oK-1
cacqua = 4169 J
kg-1 oK-1
Tf
cal M al (50 − T f ) = cH 2O M H 2O (T f − 25)
Qal = cal M al (T f − Tal )
(c M 50 + cH 2O M H 2O 25)
= al al
(cal M al + cH 2O M H 2O )
Qal ≅ −21970 J
T f = 0.021* 50 + 0.979 * 25 = 25.52o C
Qal ≅ −21970 J
QH 2O ≅ +21970 J
50 +
cH 2 O M H 2 O
(cal M al + cH 2O M H 2O )
25
T f = 0.021* 50 + 0.979 * 25 = 25.52o C
(cal M al 50 + cH 2O M H 2O 25) = T f (cH 2O M H 2O + cal M al )
Tf
cal M al
(cal M al + cH 2O M H 2O )
(c M 50 + cH 2O M H 2O 25)
= al al
(cal M al + cH 2O M H 2O )
QH 2O = cH 2O M H 2O (T f − TH 2O )
QH 2O ≅ +21970 J
Una stufa elettrica da 4 kW =4000 J/s Æ circa 5 secondi?
31
32
8
17/11/2009
Il primo principio della
termodinamica
esempio
In una vasca ci sono VH2O=130 L di acqua a T=30oC.
Variazione
di energia
“interna” Æ temperatura
- Quanti litri di acqua a T=60 oC dovrei aggiungere per avere una Tf = 40 oC ?
Non è associabile
alla differenza
di una funzione
cH 2O M x (60 − T f ) = cH 2O M H 2O (T f − 30)
L + ∆U = Q
M x (60 − 40 ) = M H 2O (40 − 30)
MH2O = 130 Kg
M x = 130
10
= 65Kg
20
Lavoro fatto dall’esterno
Sul sistema/corpo
Calore = -Lattrito
L>0 se fatto dal sistema
Mx = 65 Kg
Q>0 se fornito al sistema
33
Legame fra Q e U
Q = calore scambiato
(energia “termica”)
34
Legame fra Q e U
ASSENZA DI LAVORO MECCANICO
Q = ∆U
A volume costante
Q = cM∆T
ASSENZA DI LAVORO MECCANICO
Q = ∆U
∆U = U fin − U in = cM∆T
Il calore scambiato in una trasformazione dipende solo dalle temperature
fra cui e’ passato. Esso è una funzione della temperatura e della composizione
del sistema (numero di moli o massa).
Calore specifico (per unità di massa)
Q
1 ∆U
c=
=
M∆T M ∆T
U(T,n) è una funzione dello stato del sistema: energia interna.
35
Calore specifico (per unità di moli)
cn =
Q
1 ∆U
=
n∆T n ∆T
n = numero di moli
36
9
17/11/2009
Legame fra Q e U
Legame fra Q e U
Si trova che:
U = energia interna
c=
Q
1 ∆U
=
M∆T M ∆T
∆U
= Mc
∆T
Teoricamente è più semplice
esprimere il calore specifico
per unità di moli.
cn =
R = “costante dei gas” = 8.31 [J/0K/Kg]
6× 10 23 atomi o molecole della
n è la concentrazione molare: moli
di sostanza per unità di volume
sostanza
T2
Massa
M2
Q
1 ∆U
=
M∆T M ∆T
cn = cM w
Mw è il peso molecolare!
37
38
Lavoro “adiabatico”
L + ∆U = Q
L=0
Massa
M1
a=5/2
5/2 per un gas
biatomico
Trasferimento di calore fra corpi a due T
in assenza di Lavoro compiuto
Parete
conduttrice
c=
Q
1 ∆U
=
n∆T n ∆T
In una mole sono contenuti
U = U 0 + McT
T1
cn = nRa
Q
1 ∆U
=
n∆T n ∆T
∆U = Mc∆T
T1 > T2
cn =
a=3/2 per un gas
monoatomico
Compressione: lavoro negativo
perché fatto sul sistema
∆U = Q
gas
Se non posso scambiare calore con
L’esterno ho SOLO variazione di energia interna
Q1 = ∆U1 < 0
∆U = − L > 0
Q2 = ∆U 2 > 0
Aumenta la temperatura.
Fluisce calore verso l’esterno Æ il corpo possiede meno energia interna
L + ∆U1 + ∆U 2 = Q1 + Q2 = 0
L + ∆U = Q
Trasformazione ADIABATICA: non posso scambiare calore
39
40
10
17/11/2009
L + ∆U = Q
L’equazione di STATO di un sistema: esempio con il gas.
Compressione: lavoro negativo
perché fatto sul sistema
Posso definire la pressione P di un gas come la forza per unità di superficie.
gas
Se posso scambiare calore con
l’esterno e aspetto l’equilibrio,
non ho una variazione di temperatura
e quindi di energia interna
Allora esiste un legame, per gas sufficientemente rarefatti, fra P, V e T:
N
Numero
di molili
L = Q − ∆U = Q < 0
PV = nRT
Il lavoro fatto sul sistema va in calore
ceduto all’ambiente!
Costante dei gas: R
R= 8.31(J/oK/Kg)
Trasformazione ISOTERMA: POSSO scambiare calore
41
Se diminuisco il volume a parità di temperatura (trasf. isoterma),
allora deve aumentare la pressione.
42
Un ciclo
P=1atm = 105 N/m2
Nel ciclo, la temperatura
Non cambia (cosi’ come le
Altre varibaili) e l’energia
Interna non cambia.
P
T
Il primo principio ci dice allora che il lavoro compiuto
è tutto uguale a calore scambiato.
L3→4 + L1→2 = Qceduto + Qassorbito
V
43
44
11
17/11/2009
Trasformazioni dell’acqua
Calore Æ energia
Temperatura Æ stato energetico “interno” al sistema.
solido
Percezioni soggettive della temperatura: sono dovute alla
conducibilità termica.
L = − ∆U + Q
meccanica
Q>0
fusione
Q>0
liquido
q
I principio
della termodinamica
sublimazione
Q>0
evaporazione
Attriti?
L + ∆U potenziale = ∆K + ∆K int erna + Q
gas
Principio di conservazione dell’energia meccanica Æ termodinamica
45
46
P
FASE
SOVRASATURA
né gas né liquido
Punto critico
Acqua liquida
E
D
C
Gas-vapore
ghiaccio
Punto triplo
B
Gas-vapore
A
T
E’ proprio così semplice????
47
48
12
17/11/2009
P
né gas né liquido
E
Punto critico
D
ghiaccio
B
Gas-vapore
Punto triplo
Calore latente
Durante i cambiamenti di
Stato:
FASE
SOVRASATURA
Acqua liquida
C
LA TEMPERATURA
RIMANE COSTANTE
A
Ghiaccio Æ liquido
Esempio: fusione
Gas-vapore
T
Forniamo energia sotto forma di calore ma la temperatura non cambia
Transizione
Liquido
solido
T oC
fino a che tutto il ghiaccio si è trasformato in acqua liquida
liquida.
C
Transizione
Solido
liquido
Qf = Lf M
D
Qe = Le M
E
tempo
49
Calori latenti
Elio
Azoto
Etanolo
Mercurio
Acqua
q
Argento
Piombo
Oro
Tf [oC]
-209.9
-114
-39
0
96
327
1063
Lf [kcal kg-1]
6.09
24.9
2.82
79.7
21.1
5.86
15.4
Te[oC]
-268.9
-195.8
78
357
100
2193
1620
2660
50
Esempio: evaporazione
Le = 539 [kcal kg-1]
Le[kcal kg-1]
5
48
204
65
539
558
218
377
Quanto calore serve per fare evaporare 1 L di acqua?
Attenzione: evaporazione non implica ebollizione!
Q = MLe = 1 [Kg] * 539 [kcal kg-1] = 539 kcal = 2.26 *106 J
Equivalgono a 1 ora su un fornello da 35 kW.
Calore specifico del ghiaccio: c=0.5 [kcal kg-1 oK-1]
51
52
13
17/11/2009
Conduzione del calore
conduzione
Un corpo in un ambiente a temperatura diversa dalla propria
La conduzione
avviene in modo
continuo:
parliamo di calore
scambiato per unità di tempo
Area=A
CONDUCE CALORE in diversi modi
Barra conduttrice
Se è a contatto con un corpo conduce calore
L
Se non è a contatto con un corpo (anche nel vuoto) irraggia calore
Se non è a contatto con un corpo ma si trova in aria perde calore per
convezione
dQ
Bassa Tb
Alta Ta
∆T = Ta-Tb
Conducibilità termica,
χ
esempio
Q χA
=
∆T
∆t
L
esempio
χ = 0.42[J oK −1m −1s −1 ]
Q
= 0.03[J / s ]
∆t
Cosa vuol dire ?
In un 1 minuto
passa 1.8 J
[χ ] = [J oK −1m −1s −1 ]
Quanto tempo ci mettiamo
A sciogliere 5 gr di ghiaccio?
3 cm
Per un diametro di 5mm Æ A = 0.0000785 m2 = 0.785 cm2
5 mm
T
A una distanza L = 3cm = 0.03m
Q
= 0.03[J / s ]
∆t
E Per ∆T = 30oK
3 cm
La velocità di trasmissione
del Calore
nell’unità di tempo, ∆t54
53
Conducibilità dell’argento:
Q
∆T
= χA
L
∆t
In un 1 minuto
passa 1.8 J
T+30
Lf = 80 [kcal kg-1]
Qf = Lf M
−3
Q f = L f 5 × 10 [ kg ] = 0.4[kcal ] = 0.4 ⋅ 4186[ J ] = 1674.4[ J ]
5 mm
T
T+30
55
Ci mettiamo 1674/1.8 = 930 minuti = 15 ore!!!!!
56
14
17/11/2009
Esempio: una buona camminata…..
Conducibilità termiche
Sostanza
conducibilità termica
kcal/s/m/oK
Una persona che cammina a una andatura moderata Æ dQ = 0.07 kcal/s
Calore diffuso
Per secondo
dt
La superficie del corpo è circa A= 1.5
argento
0.1
rame
0.095
alluminio
0.057
acciaio
ghiaccio
m2
0.019
Attraverso un’area A=1
χ = 5 *10 −5 kcal / s / m / oK
La conduttività termica:
m2
e per un gradiente di 1oK/m
Se il calore viene fornito da L=3 cm sotto la cute…
4.00E-04
vetro
2.00E-04
acqua
1.40E-04
muscolo
5.00E-05
grasso
5.00E-05
legno
2.00E-05
feltro
1.00E-05
aria
5.70E-06
Quale variazione di temperatura si instaura
Fra dentro e fuori il corpo?
L=1m
dQ
Bassa Tb
Ta = Tb + 1oK
∆T =
A temperatura ambiente!
L dQ
χA dt
≅ 28o C
termografia
57
58
esempio
irraggiamento
Una finestra con doppi vetri
Differenza di temperatura di 10 oC
A differenza della conduzione e convezione NON richiede materia
Coefficiente di adduzione q=10-3 kcal/s/m2
Area = 1.2 m2
E’ una trasmissione di calore per mezzo di onde elettromagnetiche
Un corpo alla temperatura T PERDE ENERGIA PER EMISSIONE DI
RADIAZIONE ELETTROMAGNETICA
Perdite di calore p
per secondo?
CAMPO ELETTRICO E MAGNETICO ALTERNATI
L’irraggiamento del calore può essere schermato quasi totalmente
o limitato con materiali opportuni
L'adduzione è
un processo di
trasferimento di
calore che si ha
quando coesistono
convezione
e irraggiamento.
dQ
= qA∆T ≅ 0.012[kcal / s ]
dt conv
59
e per conduzione??
60
15
17/11/2009
Esempio: perdita per convezione dalla pelle
Per conduzione
χ vetro = 2 *10 −4 kcal / s / m / oK
Tstanza = 29 oC
χ aria = 6 *10 kcal / s / m / K
Tpersona = 33 oC
−6
L
o
Prevale la conducibilità dell’aria
A = area del corpo = 1.5 m2
L=3cm = 0.03 m
q ≅ 1.7 *10 −3 kcal / s / oK / m 2
Area = 1
1.2
2
T
[
χ
=
1
χA
+
dQ
= qA∆T ≅ 0.01[kcal / s ]
dt conv
dQ
∆T
= χA
≅ 0.024[kcal / s ]
dt conduz
L
1
χB
]
m2
x
1
Quale perdita di calore per unità di tempo
dalla pelle per convezione?
È solo il doppio della convezione
Metabolismo: 200 kcal/h = 0.06 kcal/s
61
62
Effetto vento: il calore viene asportato più rapidamente
pericolo di congelamento
v vento
(km/h)
T aria (oC)
calma
-9
-12
-15
-18
-21
-23
-26
-29
-32
-34
-40
-43
T effettiva
ff
(oC)
10
-12
-18
-21
-23
-23
-26
-29
-32
-34
-37
-43
-46
20
-18
-26
-29
-32
-32
-37
-40
-43
-46
-51
-54
-57
30
-23
-32
-34
-40
-34
-43
-46
-51
-54
-57
-62
-59
50
-26
-34
-37
-43
-43
-46
-51
-54
-59
-62
-65
-71
70
-29
-37
-43
-46
-46
-51
-54
-59
-62
-68
-71
-76
90
-32
-40
-46
-48
-48
-54
-57
-62
-65
-71
-73
-79
Pericolo limitato di congelamento
Pericolo di congelamento
63
16