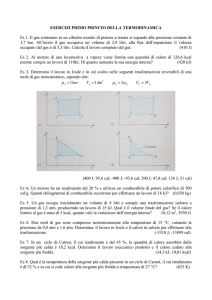
TEMPERATURA
Il corpo umano percepisce le variazioni di
temperatura con le sensazioni di caldo e freddo
Molte grandezze fisiche variano al variare della temperatura
volume dei corpi
pressione di un gas
viscosità di un liquido
resistenza elettrica
È possibile usare una di queste grandezze fisiche
per definire e misurare la temperatura
1
MISURA DELLA TEMPERATURA
C
41
40
Per la misura della temperatura si usa
il termometro: un bulbo riempito di
mercurio che può espandersi in un
capillare di vetro
39
38
37
36
Al variare della temperatura del bulbo
il mercurio di espande nel capillare e le
sue variazioni di lunghezza sono
tradotte in misura della temperatura
La temperatura del corpo umano si
misura con i termometri "a massima"
2
SCALE TERMOMETRICHE
CELSIUS
FARENHEIT
ghiaccio fondente
0oC
32oF
acqua bollente
100oC
212oF
F
C
212
100
96
37
32
0
cambiamenti di scala
Celsius
Farenheit
PUNTI FISSI
C
100 C
F 32 F
180 F
3
DILATAZIONE TERMICA
Quasi tutti i corpi si dilatano
quando la temperatura aumenta
V V0 (1 )
è il coefficiente di dilatazione termica
L’acqua ha un comportamento anomalo:
1.000
1.000
cm3
0.999
g/cm3
cm3
0.999
0.998
V0
V0.998
0
0.997
V0
V0
Il suo volume decresce con
l’aumentare della temperatura
fino a 4 C e poi aumenta
all’aumentare della temperatura
0.997
0
4
T (°C)
4
LEGGI DEI GAS PERFETTI
Isoterma = cost
pV = cost
Isobara p = cost
V = Vo(1+)
Isocora V = cost
p = po(1+)
Per tutti i gas reali risulta
approssimativamente
1
273 C
Si chiama gas perfetto o gas ideale, quel gas che
obbedisce incondizionatamente alle precedenti leggi.
5
EQUAZIONE DI STATO
n : numero di moli
pV= nRT
R: costante universale
T: temperatura assoluta
mole: quantità in grammi pari alla massa molecolare
NA (numero di Avogadro): numero di molecole
contenute in 1 mole (6.021023)
litri atm
cal
joule
R 0.082
1.98
8.31
mol K
mol K
mol K
T= c+273.2oC e si misura in gradi kelvin (K)
6
CALORE
All’interno di un solido, liquido, gas, le molecole sono
in un continuo moto di agitazione completamente
disordinato.
Si chiama energia interna la somma delle energie,
cinetica (moto di agitazione molecolare) e potenziale
(forze di legame intermolecolare), possedute dagli
atomi e dalle molecole che costituiscono un corpo.
La temperatura è la misura dell’energia cinetica
media delle molecole.
7
CALORE
È stato osservato che ad ogni diminuzione di energia
meccanica, si verifica un riscaldamento, cioè la
produzione di calore.
Si chiama calore l’energia assorbita o ceduta da un
corpo a livello molecolare, cioè l’energia direttamente
assorbita o ceduta dalle molecole del corpo.
Il calore scambiato da un corpo può produrre:
1) una variazione di temperatura (variazione dell’energia
molecolare);
2) una variazione dello stato di aggregazione del corpo
(modificazione dei legami molecolari, cioè dell’energia
chimica).
8
CALORE
kilocaloria (kcal) o grande caloria (Cal): quantità di
calore necessaria per portare da 14.5 C a 15.5 C la
temperatura della massa di 1 kg di acqua distillata.
caloria o piccola caloria (cal): quantità di calore
necessaria per portare da 14.5 C a 15.5 C la
temperatura della massa di 1 g di acqua distillata.
1 kcal = 1 Cal = 1000 cal
Il calore è una forma di energia
e nel S.I. si misura in joule (J).
Molti esperimenti hanno
determinato l’equivalente
meccanico della caloria
1 kcal = 4180 joule
1 cal = 4.18 joule
9
CALORE
Se lo scambio di calore non modifica lo stato di
aggregazione di un corpo, il calore scambiato è
Q = C (f - i)
C = capacità termica
Q > 0 calore assorbito
Q < 0 calore ceduto
Se il corpo è omogeneo C=mcs
cs è il calore specifico e la sua unità di misura è
kcal
cal
joule
1 1 4180
kg C
kg C
g C
10
CALORE
Quando due corpi a diversa temperatura sono posti
in contatto termico, si ha passaggio di calore dal
corpo più caldo a quello più freddo fino a quando essi
assumono la stessa temperatura (equilibrio termico).
m1 c1 ( - 1) + m2 c2 ( - 2) = 0
Temperatura
di equilibrio
m1c11 m2c2 2
m1c1 m2c2
11
CAMBIAMENTI DI STATO
Il cambiamento di stato avviene ad una definita
temperatura che dipende dalla sostanza e dalla
pressione esterna
Il cambiamento di stato avviene isotermicamente ed
è accompagnato da uno scambio di calore, legato
alle variazioni dell’energia chimica di legame
fusione
SOLIDO
ebollizione
LIQUIDO
solidificazione
VAPORE
condensazione
12
CAMBIAMENTI DI STATO
Si definisce calore latente L la quantità di calore
necessaria per far compiere isotermicamente
all’unità di massa della sostanza un passaggio di
stato
Calore necessario per il
passaggio di stato di una
massa m di quella sostanza
Per il passaggio di stato
ghiaccio-acqua alla
pressione atmosferica
Q mL
kcal
cal
L 80
80
kg
g
13
CAMBIAMENTI DI STATO
Cambiamenti di stato che avvengono a tutte le
temperature ed i rispettivi calori latenti dipendono
dalla temperatura
SOLIDO
LIQUIDO
sublimazione
VAPORE
evaporazione
L’evaporazione avviene sino a quando l’ambiente non
raggiunge la saturazione, cioè non può contenere altre
molecole di quel liquido (vapore saturo)
La pressione o tensione di vapore saturo è caratteristica
della sostanza ed è funzione crescente della temperatura
14
CAMBIAMENTI DI STATO
Temperatura (C)
Temperatura di un campione di acqua in funzione del
tempo quando viene somministrato un flusso
costante di calore a pressione costante (1 atm).
125
100
75
50
p=1 atm
25
0
-25
Tempo
15
PROPAGAZIONE DEL CALORE
Il calore si propaga per
conduzione (nei solidi senza movimento di materia)
convezione (nei fluidi con movimento di materia)
irraggiamento (per onde elettromagnetiche)
La temperatura della pelle varia da punto a punto e
sensibili variazioni di temperatura hanno luogo
quando esiste qualche anomalia circolatoria o
cellulare.
Su questo principio si basa la termografia, in grado di
rivelare variazioni di 0.1 C.
16
TERMOREGOLAZIONE
La sorgente del calore corporeo è il metabolismo
degli alimenti.
Un uomo di 70 kg in condizioni di riposo produce circa 70
kcal/h; durante un esercizio fisico la produzione di calore
può essere anche 20 volte maggiore
La temperatura del corpo è rilevata da alcuni neuroni
dell’ipotalamo, che sono sensibili alla temperatura del
sangue circostante ed attivano alcuni meccanismi per
mantenere affinché la temperatura rimanga
costantemente uguale a 37 °C.
17
TERMOREGOLAZIONE
I meccanismi di termoregolazione possono favorire la
cessione del calore (vasodilatazione, sudorazione, ...),
ridurla (vasocostrizione) o produrre calore (brivido, ...).
L’equilibrio si raggiunge quando: Hm= Hc+Hi+Ht+He
Hm: calore prodotto dal metabolismo
Hc: calore dissipato per convezione
Hi: calore dissipato per irraggiamento
Ht: calore dissipato per traspirazione del sudore
He: calore dissipato per evaporazione polmonare
18
LAVORO DI UN GAS
Espansione di un gas a pressione costante
p
B1
A
B
A1
VA
VB
V
L F h pS h p V
Il lavoro è una forma di trasferimento d’energia fra
sistema ed ambiente esterno diversa dal calore.
19
PRIMO PRINCIPIO TERMODINAMICA
Poiché il calore ed il lavoro sono due “modi di
trasferimento dell’energia”, quando in un sistema
termodinamico entra energia sotto forma di calore Q ed
esce energia sotto forma di lavoro L, la loro differenza
viene immagazzinata dal sistema sotto forma di energia
interna U.
Q
Ui
Uf
L
U = Uf - Ui = Q - L
20
SECONDO PRINCIPIO TERMODINAMICA
I fenomeni naturali presentano un verso privilegiato di
evoluzione, quando avvengono spontaneamente:
1) Il lavoro si trasforma in calore;
2) Il calore passa spontaneamente da un corpo più
freddo ad un corpo più caldo.
È possibile rovesciare il verso naturale di questi fenomeni
È possibile trasformare una parte del calore prelevato ad
una sorgente in lavoro, ma occorre cedere il rimanente
ad un’altra sorgente ad una temperatura più bassa.
È possibile trasferire del calore da un corpo “freddo” ad
un corpo “caldo”, impiegando un certo lavoro.
21
SECONDO PRINCIPIO TERMODINAMICA
Calore e lavoro, pur essendo due diverse forme di
energia, non sono del tutto equivalenti:
Il lavoro è una forma di energia ordinata (più pregiata),
mentre il calore è una forma di energia disordinata (meno
pregiata).
Formulazione di Kelvin: “È impossibile realizzare una
macchina che, lavorando in ciclo, trasformi interamente in
lavoro il calore prelevato ad una sorgente.”
Formulazione di Clausius: “È impossibile che il calore
passi da un corpo più freddo ad uno più caldo senza una
adeguata spesa di lavoro.”
Si dimostra che le due formulazioni sono equivalenti.
22
METABOLISMO DEL CORPO UMANO
L’energia utilizzata dall’organismo umano, per il suo
funzionamento e per compiere una certa attività, è fornita
dagli alimenti.
Ad esempio:
C6H12O6 + 6O2 = 6CO2 + 6H2O + 666 kcal
alla pressione di 1 atm occorrono 134.4 litri di ossigeno per
liberare 666 kcal.
Contenuto energetico
del glucosio:
Valore calorico
dell’ossigeno:
666 kcal
kcal
3.7
180 g
g
666 kcal
kcal
5
134.4 litri
litro
23
METABOLISMO DEL CORPO UMANO
Misurando il consumo d’ossigeno è possibile calcolare la
variazione di energia interna all’interno dell’organismo.
Metabolismo basale: consumo di energia per kg di peso
corporeo e per secondo in condizioni di riposo.
In media i valori sono:
W
1 .2
kg
per gli uomini
W
1 .1
kg
per le donne
24
METABOLISMO DEL CORPO UMANO
Valori approssimati delle potenze metaboliche per
unità di massa relative ad un uomo di 20 anni
durante lo svolgimento di varie attività in W/kg
Dormire
1.1
Pedalare
7.6
Giacere sveglio
1.2
Spalare
9.2
Sedere eretto
1.5
Nuotare
11.0
Stare in piedi
2.6
Spostare mobili
11.0
Camminare
4.3
Sciare
15.0
Rabbrividire
7.6
Correre
18.0
25
METABOLISMO DEL CORPO UMANO
Il calore prodotto viene solo in parte trasformato in
lavoro. Il resto viene eliminato tramite i meccanismi di
termoregolazione
Efficienza con cui l’organismo utilizza l’energia
chimica degli alimenti per compiere lavoro
efficienza
L
t
U U b
t
t
Spalare
3%
Sollevare pesi
9%
Salire una scala
23%
Pedalare
25%
Camminare in salita
30%
26