SCHEDA DI PROGRAMMAZIONE DISCIPLINARE PER LA CERTIFICAZIONE
DELLE COMPETENZE NEL BIENNIO DELL’OBBLIGO SCOLASTICO
A.S. 2016-2017
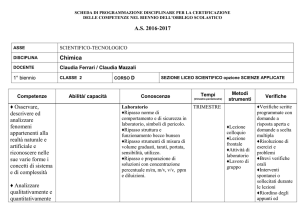
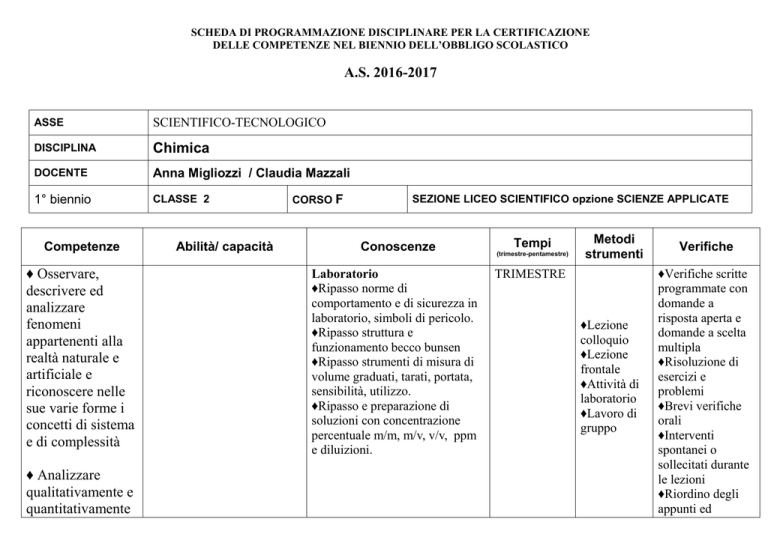
ASSE
SCIENTIFICO-TECNOLOGICO
DISCIPLINA
Chimica
DOCENTE
Anna Migliozzi / Claudia Mazzali
1° biennio
CLASSE 2
Competenze
♦ Osservare,
descrivere ed
analizzare
fenomeni
appartenenti alla
realtà naturale e
artificiale e
riconoscere nelle
sue varie forme i
concetti di sistema
e di complessità
♦ Analizzare
qualitativamente e
quantitativamente
Abilità/ capacità
CORSO F
SEZIONE LICEO SCIENTIFICO opzione SCIENZE APPLICATE
Conoscenze
Laboratorio
♦Ripasso norme di
comportamento e di sicurezza in
laboratorio, simboli di pericolo.
♦Ripasso struttura e
funzionamento becco bunsen
♦Ripasso strumenti di misura di
volume graduati, tarati, portata,
sensibilità, utilizzo.
♦Ripasso e preparazione di
soluzioni con concentrazione
percentuale m/m, m/v, v/v, ppm
e diluizioni.
Tempi
(trimestre-pentamestre)
Metodi
strumenti
TRIMESTRE
♦Lezione
colloquio
♦Lezione
frontale
♦Attività di
laboratorio
♦Lavoro di
gruppo
Verifiche
♦Verifiche scritte
programmate con
domande a
risposta aperta e
domande a scelta
multipla
♦Risoluzione di
esercizi e
problemi
♦Brevi verifiche
orali
♦Interventi
spontanei o
sollecitati durante
le lezioni
♦Riordino degli
appunti ed
fenomeni legati
alle trasformazioni
di energia a partire
dall’esperienza
♦saper rappresentare la
struttura elettronica esterna di
un atomo con il simbolismo
di Lewis
♦saper individuare gli ioni
stabili di alcuni elementi
metallici e non metallici
utilizzando la regola
dell’ottetto
♦Conoscere le definizioni di
distanza e di energia di
legame
♦Conoscere le definizioni di
legame ionico, covalente puro
e polare, dativo e metallico
♦Saper individuare il tipo di
legame in base alla differenza
di elettronegatività
♦Saper correlare le proprietà
delle sostanze al legame in
esse presente
♦Saper scrivere le formule
elettroniche e di struttura di
composti inorganici
♦Saper individuare e
rappresentare la geometria
molecolare con la teoria
VSEPR
♦Saper stabilire la polarità di
una molecola attraverso
l’esame dei legami chimici e
della geometria molecolare
I legami chimici
♦I simboli di Lewis
♦Variazione dell’energia
potenziale in funzione della
distanza tra 2 atomi. Energia e
distanza di legame
♦l legame ionico, il legame
covalente puro e polarizzato, il
legame dativo e il legame
metallico
♦Le strutture di Lewis delle
molecole e delle specie
poliatomiche
♦ La risonanza
♦La carica formale
♦ Gli strati di valenza espansi
♦Proprietà dei composti ionici,
delle sostanze molecolari e
metalliche: interpretazione delle
proprietà alla luce dei legami
chimici
♦ Formule di struttura
♦Geometria molecolare:teoria
VSEPR
♦Polarità delle molecole
Laboratorio
♦ Esperienza sui legami primari:
conducibilità di zolfo, glucosio,
stagno e sodio tiosolfato allo
stato solido e allo stato liquido.
♦Prove di polarità su liquidi e
solidi
esecuzione degli
esercizi assegnati
♦Comportamento
dell’allievo in
laboratorio
♦Conoscere le definizioni e i
modelli dei legami
intermolecolari
♦Saper prevedere il tipo di
legame intermolecolare a
partire a partire dalla formula
di struttura della molecola
♦Comprendere la relazione
esistente tra legami
intermolecolari e punto di
ebollizione (o di fusione)
♦Saper motivare i diversi
punti di ebollizione o di
fusione di sostanze diverse
♦Descrivere i meccanismi di
solubilizzazione
♦Conoscere le definizioni di
elettroliti e non elettroliti
♦Comprendere la relazione
tra miscibilità o solubilità e
legami intermolecolari
♦Saper confrontare la forza di
elettroliti diversi in base alla
conducibilità elettrica delle
loro soluzioni
I legami intermolecolari
♦Forze di Van der Waals,
interazione dipolo-dipolo, legame
a idrogeno, legame ione-dipolo
♦Proprietà fisiche delle sostanze
e forze intermolecolari
♦Miscibilità e solubilità:
solvatazione/idratazione,
dissociazione ionica,
ionizzazione, solubilizzazione
♦Elettroliti e non elettroliti
Laboratorio
♦Prove di miscibilità e solubilità
♦Misure di conducibilità elettrica
di soluzioni acquose e di un sale
fuso
♦ osservazione del profilo della
goccia, della volatilità e prova di
sostentamento spillo su acqua ed
esano.
♦Saper ricavare il numero di
ossidazione dalla formula
grezza e viceversa
♦Saper classificare un
composto in base alla sua
formula
♦Saper assegnare il nome
IUPAC e tradizionale a un
composto
♦Saper ricavare la formula di
un composto in base al nome
IUPAC o tradizionale
♦Conoscere un percorso di
sintesi per i composti
inorganici
♦Saper riconoscere e scrivere
una reazione di precipitazione
Nomenclatura dei composti
inorganici
♦Numero di ossidazione delle
sostanze e regole per
determinarlo
♦Classificazione dei composti
inorganici: composti binari e
ternari
♦Idruri, perossidi, ossidi basici,
ossidi acidi o anidridi, idracidi,
sali binari: nomenclatura IUPAC
e tradizionale
♦Idrossidi, ossiacidi, sali ternari:
nomenclatura IUPAC e
tradizionale
♦Reazioni di sintesi dei composti
inorganici
♦Reazioni di precipitazione.
♦Reazioni redox
Laboratorio
♦Formazione di un’anidride e del
relativo acido partendo da un non
metallo
♦Formazione di un ossido e di un
idrossido partendo da un metallo
PENTAMESTRE
Mole e stechiometria
♦Massa atomica e massa
molecolare
♦Unità di massa atomica
♦Mole e numero di Avogadro,
volume molare
♦Analisi elementare: formule
♦Saper calcolare la massa
minime , molecolari e
molare delle sostanze
composizione percentuale
♦Saper calcolare il numero di
♦Equazioni chimiche bilanciate:
moli e il numero di particelle
significato quantitativo.
di una sostanza a partire dalla
♦Resa percentuale
massa o dal volume se è un
♦Molarità
gas
♦Saper determinare la
Laboratorio
formula minima e molecolare
♦ Problem solving:
dalla composizione
determinazione della massa di
percentuale e viceversa
una mole di semi.
♦Saper determinare la massa
♦Preparazione di soluzioni a
dei prodotti di una reazione
concentrazione molare da soluto
conoscendo la massa di un
solido e da soluzioni in
reagente e viceversa
concentrazione percentuale m/m.
♦Saper calcolare la massa di
♦Diluizioni di soluzioni a
prodotti di una reazione in
concentrazione molare.
presenza di un reagente
♦Determinazione del reagente
limitante
limitante in una reazione:
confronto tra moli dei reagenti e
moli dei prodotti, calcolo della
resa teorica e sperimentale.