Parametri NMR
Accoppiamento Scalare
Mario Piccioli
Magnetic Resonance Center
CERM
Department of Chemistry
University of Florence, Italy
Ringraziamenti
Stefano Mammi
Stefano Chimichi
Alessandro Bagno
Daniel Cicero
Paola Turano
M.Levitt Spin Dynamics
J. Keeler Understanding NMR Spectroscopy
H.Gunther NMR Spectroscopy
Termini dell’Hamiltoniano di spin
Meccanismi di accoppiamento
La partecipazione degli elettroni cambia il modo in cui l’interazione
tra spin é dipendente dalla loro riorientazione
Pertanto, quando in un liquido isotropico le interazioni sono mediate
per effetto del moto, rimane un termine isotropico.
Esso fornisce una diretta evidenza spettrale dei legami chimici e
pertanto é un prezioso strumento per la determinazione strutturale
Gli effetti di accoppiameno dipolare indiretto sono SOLO
INTRAMOLECOLARI
L’effetto é misurabile sono per un limitato numero di legami chimici
Significato fisico della J
Significato fisico della J
Accoppiamento scalare
13C
1H
13C
1H
Accoppiamento scalare
13C
1H
13C
1H
Accoppiamento scalare
β
β
α
1H
S
α
13C
I
Accoppiamento scalare
Accoppiamento scalare
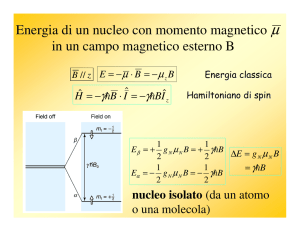
Due spin isolati
E= -1/2 γ ħB0= - miνi
mi = - ½ , ½
+1/2 νA +1/2 νX
νX
E
νA
νA
+1/2 νA -1/2 νX
-1/2 νA +1/2 νX
νX
-1/2 νA -1/2 νX
E= -∑i miνi
Due spin accoppiati
E= -1/2 γ ħB0= - miνi
Accoppiamento debole
mi = - ½ , ½
J<<∆ν
+1/2 νA +1/2 νX +1/4 JAX
+1/2 νA +1/2 νX
νX
E
νA
νA
νX+ ½ JAX
+1/2 νA -1/2 νX
νA- ½ JAX
νA+ ½ JAX
-1/2 νA +1/2 νX
νX
-1/2 νA -1/2 νX
νX- ½ JAX
+1/2 νA -1/2 νX -1/4 JAX
-1/2 νA +1/2 νX -1/4 JAX
-1/2 νA -1/2 νX +1/4 JAX
E= -∑i miνi +∑ij Jijmimj
Accoppiamento scalare
CH3-CH2-OH
Accoppiamento scalare
2J
3J
2JH H
β β’
3JH H
α β
3JH H
Ν α
3J
Accoppiamento scalare
1J
HC
1J
1J
HN
CC
Molteplicità dell’accoppiamento
n.Spin X
Spin A osservato
Freq. A osservate
0
νA
1
νA± ½ JAX
2
3
νA± ½ JAX ± ½ JAX
νA± ½ JAX ± ½ JAX ± ½ JAX
Molteplicità dell’accoppiamento
Accoppiamento scalare
Accoppiamento scalare
Il segno della costante
α β
α β
A
X
A
X
β α
β α
A
X
L’effetto del campo magnetico
Sistemi del 1°ordine
Accoppiamento debole
J<<∆ν
Separazione in frequenza almeno pari a 10*J
Se aumento il campo magnetico, ∆ν aumenta e J rimane costante
Aumentare il campo magnetico semplifica l’analisi dei sistemi di spin
Torneremo dopo sul concetto di accoppiamento forte e accoppiamento
debole
Ma intanto ricorda che…
Esperimenti in rotating frame (TOCSY, ROESY, DIPSI, sono sempre in
accoppiamento forte)
Gli esperimenti heteronucleari HSQC, HMQC, INEPT di ogni tipo…) sono
sempre in accoppiamento debole
Sistema AX
Sistemi di spin A2X3
Combinando insieme
accoppiamenti diversi
Sistema AMX
Sistema AMX
Spettri del 2°ordine
Accoppiamento forte significa che l’accoppiamento è forte rispetto
alla differenze di energia dei livelli energetici del sistema, che
determinano poi le frequenze di transizione
In effetti un accoppiamento tra due spin non cambia di valore, è il
resto del sistema che cambia nel passaggio da accoppiamento forte
ad accoppiamento debole
Spettri del 2°ordine
ν1,2=ν
νA ±J/2
ν3,4=ν
νB ±J/2
ν1,2,3,4=(ν
νA+ν
νB)/2 ±D/2 ±J/2
Sistema AB
J=5Hz
Sistema AB
Misure dirette
JAB
2C
(2C)2= (νΑ–νΒ)2 +J2
I2/I1=∆ν1,4/∆ν2,3
Sistema AB
Sistema AB
From AX2 to AB2
500 MHz
From AX2 to AB2
200 MHz
From AX2 to AB2
Sistema AB2
Sistema AB2
Sistema AB2
Sistema ABX
Sistema ABX
Accoppiamento forte e
accoppiamento debole
2 spin
Accoppiamento forte e
accoppiamento debole
Accoppiamento debole
Accoppiamento debole
Accoppiamento forte
Accoppiamento forte
Spin Magneticamente Equivalenti
Singlet-triplet basis
Multipletti e larghezza di riga
La larghezza di riga di un segnale NMR dipende dalle proprietà di rilassamento T2.
In prima approssimazione, il T2 dipende a sua volta
dalle dimensione della molecola studiata.
Piu’ la molecola è grande, piu’ il T2 è corto e piu’ i
segnali sono larghi
3-10 Hz
15 Hz
MW ca. 5000
In una proteina, la larghezza di riga di un
Hn o di un Ha è tipicamente maggiore di 10
Hz, ovvero della separazione del doppietto.
In queste condizioni, l’accoppiamento
scalare non da luogo a doppietti osservabili
20-35 Hz
MW. 10-20000
Importante
N
3J
dipendono
dall’angolo
diedro
INFORMAZIONE
STRUTTURALE
IMPORTANTE
3J
HNHα=
Acos2φ + B cosφ
φ +C
Ogni costante di
accoppiamento 3J
sottende un angolo
diedro
3J 1Hb-15N
DeMarco, Llinas, Wutrich, Biopolymers, 1978
3J 1Ha-1Hb
Angolo diedro χ1
Karimi Nejad, Schmidt, Ruterjans, Schwalbe, Grieseinger, Biochemistry, 1994
Per ogni curva di Karplus i coefficenti sono calcolati in
base al confronto tra valori sperimentali e parametri
strutturali e validati con vari strumenti
Schmidt, Blumel, Lohr, Ruterjans, J. Biomol. NMR 1999
13C
Direct Detected COCO-TOCSY
N
3J
C’C’
a. diedro φ
Accoppiamento e Magnetizzazione
Accoppiamento scalare rende possibile un trasferimento di
magnetizzazione tra i spin accoppiati
Questa proprietà é del tutto indipendente dal fatto che un
accoppiamento sia “visibile” o “invisibile” in un esperimento NMR
come
Nella maggior parte dei casi gli accoppiamenti scalari sono
invisibili, ma misurabili anche in modo quantitativo attraverso
NMR multidimensionale
Heteronuclear cases
The scheme of 1J scalar couplings
The 2D Hetcor experiment
Two dimensional Heteronuclear correlation Experiment
2D HETCOR Expriment
2D HETCOR Expriment
Prima dimensione
2D HETCOR Expriment
Prima dimensione
2D HETCOR Expriment
Prima dimensione
Seconda dimensione
2D HETCOR Expriment
Prima dimensione
Seconda dimensione
Esempio
HETCOR
2
3
4
1
5
1J
couplings for backbone resonances
The role of metal cofactor in protein unfolding
Metal triggered protein folding
Apo Cb @ 3.3 M GdmCl
Ca2Cb @ 3.3 M GdmCl
Ca2+
Loss of secondary
structure elements:
unfolded protein
Refolding
Apo vs holo protein, mapping the
environment of the metal ion
15N
95
77
59
35
26
96
3
28
81
85
75
HNε 32
94
65
88
23
36 46
64
83 41
89 48
62
14
99
84 21
24
17
43
25 30
29
86
74
79 47 51
16
58
42
4 1110
76
98 39 22
53
91
69 97
56
93
101
4067 57 19
71
38
52
54 55
68
66
82
5
80
87
78
6
7 90
72
13
37
100
HNδ 28
15
45
8
12
20
60
33
34
27
HNε1 83
102
15H
Ma il legame a idrogeno é una interazione
elettrostatica?
3J
NiC’j
C
O
3J
N
!
Eteronuclei
270-290Hz
o
C
o
205Tl
o
2J 205Tl-13C
in Transferrina
Fe3+
Aramini et al. Biochemistry 1994
Eteronuclei
199Hg
Utschig, Bryson, O’Halloran, Science 1995