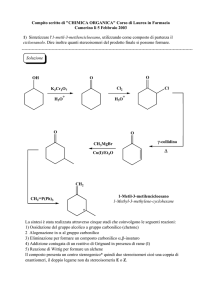
Corso di Laurea Magistrale in Ingegneria Biomedica
Complementi di Chimica e Biochimica per le Tecnologie
Biomediche
Carboidrati
Strutture di base ed esempi dal mondo naturale
•
•
•
•
•
•
•
Generalità
I monosaccaridi: aldosi e chetosi
La chiralità nei monosaccaridi
Conformazione e configurazione
Derivati degli zuccheri
Il legame glicosidico
Disaccaridi, polisaccaridi, glicosamminoglicani
Francesca Anna Scaramuzzo, PhD
Dipartimento di Scienze di Base e Applicate per l’Ingegneria - Centro di Nanotecnologie Applicate all’Ingegneria
[email protected]
Generalità
Saccaridi: dal greco sákcharon, zucchero
Carboidrati: dalla loro formula generale, (C ∙ H2O)n con n ≥ 3
Monosaccaridi: unità base
Polisaccaridi: polimeri formati da n monosaccaridi
Funzioni dei Carboidrati:
• Riserva di energia
• Funzione strutturale
• Funzione di riconoscimento e comunicazione intra- ed extra-cellulare
I Monosaccaridi
• Sono sintetizzati da precursori
semplici (CO2 e H2O) durante la
fotosintesi
• Hanno almeno 3 atomi di carbonio
• Strutturalmente sono derivati
aldeidici o chetonici di alcoli
poliossidrilici a catena lineare
O
CH 2OH
H
CHOH n
CHOH n
O
CHOH m
CH 2OH
CH 2OH
Aldosi
O
Chetosi
H
CH2 OH
n° C totale = 3, 4, 5, 6…..
Triosi, tetrosi, pentosi, esosi…
CHOH
CH2 OH
Gliceraldeide
O
CH2 OH
Diidrossiacetone
La chiralità nei monosaccaridi
O
H
CHOH n
Se n è il numero di centri
stereogenici, per ogni aldoso
sono possibili 2n steroisomeri
C asimmetrico (chirale)
CH 2OH
DOMANDA: Come si può estendere questo calcolo ai chetosi?
• Ai monosaccaridi si applica la convenzione di Fisher per la configurazione dei
centri asimmetrici
CHO
Formule geometriche
Proiezioni di Fisher
HO
HO
C
H
CHO
H
C
OH
CH2 OH
CH2 OH
CHO
CHO
C
H
CH2 OH
L-gliceraldeide
H
C
OH
CH2 OH
D-gliceraldeide
Isomeria e Molecole Chirali
Isomeri: Composti diversi che hanno la stessa formula molecolare
Isomeri Strutturali
Isomeri con un diverso ordine con cui gli atomi sono legati tra
di loro in una molecola
Stereoisomeri
Isomeri con lo stesso ordine con cui gli atomi sono legati tra di
loro in una molecola, ma diversa orientazione nello spazio tra
atomi o gruppi di atomi
Enantiomeri
Stereoisomeri
le
cui
molecole sono immagini
speculari non sovrapponibili
Le molecole otticamente attive non sono sovrapponibili alla
loro immagine speculare
Diastereomeri
Stereoisomeri
le
cui
molecole non sono l’una
l’immagine
speculare
dell’altra
La serie dei D-aldosi con 3 ≤ n°C ≤ 6
O
H
H
OH
CH2 OH
D-gliceraldeide
CHO
H
H
CHO
OH
HO
OH
H
CH2 OH
D-treosio
CHO
CHO
CHO
H
OH
HO
H
OH
H
OH
HO
H
OH
H
OH
H
CH2 OH
H
H
CH2 OH
CHO
CHO
CHO
H
HO
H
H
OH
H
H
OH
H
OH
H
OH
H
OH
HO
H
OH
H
OH
H
OH
H
OH
H
CH2 OH
D-glucosio
CH2 OH
D-mannosio
H
OH
CH2 OH
D-gulosio
CHO
CHO
HO
HO
H
OH
D-lixosio
OH
OH
H
CH2 OH
H
H
D-altrosio
H
H
OH
D-allosio
HO
HO
H
CH2 OH
H
OH
OH
HO
CH2 OH
HO
CHO
OH
H
OH
D-xilosio
H
H
CHO
CH2 OH
D-arabinosio
CHO
OH
CH 2OH
D-eritrosio
D-ribosio
H
HO
H
H
H
CHO
OH
HO
H
OH
HO
H
HO
H
H
HO
H
HO
H
OH
CH2 OH
D-idosio
H
OH
H
CH2 OH
D-galattosio
OH
CH2 OH
D-talosio
• Epimeri: zuccheri che differiscono soltanto per la configurazione intorno a un atomo di C
La serie dei D-chetosi con –CO– in 2 e 3 ≤ n°C ≤ 6
CH2 OH
O
CH2 OH
diidrossiacetone
CH2 OH
O
H
OH
CH2 OH
D-eritrulosio
CH2 OH
CH 2OH
O
O
H
OH
HO
H
OH
H
CH 2OH
D-ribulosio
D-xilulosio
H
H
OH
HO
H
OH
H
OH
HO
H
OH
H
OH
H
CH2 OH
D-fruttosio
O
O
O
H
CH 2OH
CH 2 OH
CH2 OH
O
D-psicosio
OH
CH2 OH
CH 2 OH
CH 2 OH
H
OH
HO
H
H
HO
H
OH
H
OH
CH 2 OH
CH 2OH
D-sorbosio
D-tagatosio
Conformazione e configurazione
• Conformazioni: Disposizioni tridimensionali degli atomi in una molecola risultanti
dalla rotazione attorno a legami σ
• Configurazioni: Forme ottenibili per rottura e formazione di legami covalenti
Dalla chimica organica si ricordi che:
O
R
OH
R'
OH
OH
H
R'
O
H
R'
H
O
R
R
Emiacetale
Emiacetale ciclico
OH
O
R
OH
OH
R'
R'
R''
R'
R''
O
R''
O
R
R
Emichetale
Emichetale ciclico
• C anomerico: Stereocentro che si ottiene quando si forma un emiacetale /
emichetale ciclico
I monosaccaridi formano emiacetali ed emichetali ciclici per reazione intramolecolare
Conformazione e configurazione
Nella ciclizzazione il C carbonilico, detto anomerico, diventa chirale
CH2 OH
O
HO
H
H
H
HOH 2C
CH2 OH
OH
OH
OH
OH
OH
HO
OH
OH
H
H
OH
H
a-D-fruttofuranosio (proiezione di Haworth)
D-fruttosio (forma lineare)
H
H
O
CH2 OH
H
CH2 OH
H
CH2 OH O
O
CH2 OH
OH
H
H
OH
H
OH
CH2 OH
CH2 OH
OH
H
OH
H
H
O
H
O
OH
OH
H
OH
OH
H
OH
H
H
OH
a-D-glucopiranosio (proiezione di Haworth)
D-glucosio (forma lineare)
o
o
furano
pirano
Conformazione e configurazione
CH 2OH
H
O
H
OH
H
OH
H
O
H
OH
HO
H
OH
H
OH
CH 2OH
H
OH
H
OH
H
OH
OH
H
H
OH
H
CH 2OH
a-D-glucopiranosio
O
H
H
OH
b-D-glucopiranosio
I monosaccaridi in forma furanosica o piranosica non sono planari
H
OH
HO
OH
H
OH
H
O
O
HO
HO
OH
H
H
H
H
H
H
OH
H
OH
OH
Derivati degli zuccheri
Gruppi reattivi degli zuccheri:
–CO– (aldeidico o chetonico)
–OH
Derivati degli zuccheri
Gruppi reattivi degli zuccheri:
–CO– (aldeidico o chetonico)
–OH
Ossidazione del gruppo aldeidico ad acido carbossilico per via chimica o enzimatica
O
H
CHOH
O
CHOH
n
CH 2OH
Aldoso
OH
CH 2OH
Acido aldonico
O
H
O
OH
H
OH
H
OH
HO
H
HO
H
H
OH
H
OH
H
OH
H
OH
CH2 OH
D-glucosio
n
CH2 OH
Acido D-gluconico
Derivati degli zuccheri
Gruppi reattivi degli zuccheri:
–CO– (aldeidico o chetonico)
–OH
Riduzione del gruppo aldeidico o chetonico ad alcol (es. NaBH4)
H
O
CH 2OH
CHOH
CHOH
n
CH 2OH
CH 2OH
Aldoso
O
n
Alditolo
H
O
H
H
OH
CH 2OH
H
OH
CH 2OH
D-gliceraldeide
H
OH
CH 2OH
HO
O
H
H
OH
D-glicerolo
HO
H
H
OH
CH2 OH
D-xilosio
H
H
OH
CH2 OH H
OH
H
OH
CH2 OH
HO
H
D-glucosio
H
OH
CH2 OH
D-xilitolo
CH2 OH
H
HO
OH
H
H
OH
H
OH
CH2 OH
D-sorbitolo
Derivati degli zuccheri
Gruppi reattivi degli zuccheri:
–CO– (aldeidico o chetonico)
–OH
Ossidazione specifica di un gruppo alcolico primario degli aldosi ad acido
carbossilico produce acidi uronici
O
H
O
H
H
OH
H
OH
HO
H
HO
H
H
OH
H
OH
H
OH
H
OH
O
OH
CH2 OH
D-glucosio
Acido D-glucuronico
Derivati degli zuccheri
Gruppi reattivi degli zuccheri:
–CO– (aldeidico o chetonico)
–OH
Sostituzione di un –OH con –H produce deossizuccheri
CH 2OH O
H
CH 2OH O
OH
H
H
H
H
OH
OH
H
H
OH
H
OH
b-D-2-ribosio
H
b-D-2-deossiribosio
Sostituzione di uno o più –OH con –NH2 produce amminozuccheri
O
con
produce acetilamminozuccheri
N
H
CH2 OH
O
H
OH
H
OH
H
NH2
O
H
a-D-glucosammina
(2-ammino-2-deossi-a-D-glucopiranosio)
OH
H
OH
H
OH
CH2 OH
CH 3
H
OH
H
H
N
CH 3
O
N-acetil-b-D-glucosammina
Il legame glicosidico
Il gruppo anomerico di uno zucchero può dare reazione di condensazione con un
alcol, formando acetali o chetali ciclici, detti glicosidi
OR''
OR''
R'
R'
H
R''
O
O
R
R
Acetale ciclico
Chetale ciclico
Legame glicosidico: legame tra C anomerico e O dell’alcol
CH 2 OH
CH 2 OH
O
H
H
OH
H
H
+
OH
OH
H
OH
a-D-glucosio
H+
O
H
H
OH
CH 3 OH
CH 2 OH
H
H
H
H
OH
+
OCH3
OH
H
OH
Metil-a-D-glucoside
O
OCH3
H
+
H 2O
H
OH
H
OH
Metil-b-D-glucoside
Legame glicosidico
Legame N-glicosidico: legame tra C anomerico e un gruppo amminico
Polisaccaridi (Glicani)
Generalità
• Polimeri formati da n monosaccaridi
• Possono essere formati da un solo tipo di monosaccaridi (omopolisaccaridi) o da
più tipi di monosaccaridi (eteropolisaccaridi)
• Possono essere lineari o ramificati
Tecniche di indagine per capire la struttura
• Uso di enzimi (es. esoglicosidasi, endoglicosidasi) che idrolizzano i singoli residui
• NMR
Funzione degli oligosaccaridi
• Funzione strutturale
• Funzione di riconoscimento (es. antigeni dei gruppi sanguigni AB0 come
marcatori immunologici)
• Regolazione di processi intracellulari (es. trasporto di proteine)
• Riconoscimento extracellulare
• In alcuni casi, la presenza di glicoforme rende difficile individuare la funzione
della glicosilazione
Lattosio
O-b-D-galattopiranosil-(1→4)-D-glucopiranosio
CH 2 OH
CH 2 OH
OH
4
O
H
OH
O
H
H
OH
4
1(b)
H
O
H
1(b)
H
H
H
H
OH
H
OH
OH
galattosio
glucosio
• Ha un gruppo anomerico libero: è uno
zucchero riducente
• In vivo è idrolizzato dalla b-D-galattosidasi
(lattasi) nell’intestino
• In vivo il galattosio è epimerizzato in glucosio
• In assenza di b-galattosidasi subisce
fermentazione batterica nel colon, con
formazione di CO2, H2 e acidi organici
Saccarosio
O-a-D-glucopiranosil-(1→2)-b-D-fruttofuranoside
CH 2 OH
H
4
O
H
OH
H
OH
CH 2OH O
H
2(b)
1(a )
H
O
H
OH
CH 2OH
H
OH
glucosio
OH
H
fruttosio
• È il comune zucchero da tavola
• È la forma principale in cui vengono trasferiti i
carboidrati nelle piante
Cellulosa
CH 2 OH
CH 2 OH
H
4
H
4
O
H
OH
1(b)
O
O
H
OH
H
1(b)
H
H
H
H
H
OH
OH
glucosio
glucosio
• Polimero lineare di 15k unità di D-glucosio
unite da legami b (1→4) glicosidici
• Componente strutturale della parete delle
piante
• Ogni fibra è composta da 40 catene
parallele con legami H intermolecolari
• Ogni anno ne vengono prodotti e
n degradati 1015 kg
• È degradata dalle cellulasi nell’intestino
degli erbivori
Chitina
CH 2 OH
CH 2 OH
H
4
H
4
O
H
OH
1(b)
O
H
OH
H
1(b)
H
H
H
H
O
HN
CH 3
O
N-acetil-glucosammina
H
HN
CH 3
O
n
N-acetil-glucosammina
• Omopolimero di N-acetil-D-glucosammina
unite da legami b (1→4) glicosidici
• Componente
strutturale
principale
dell’esoscheletro di crostacei, insetti e
ragni
• Componente della parete cellulare di
funghi e alghe
Amido
• Principale forma di conservazione degli zuccheri nelle piante
• Miscela di a-amilosio e amilopectina
amilopectina
a-amilosio
CH 2 OH
O
H
CH 2OH
CH 2 OH
H
4
O
H
OH
H
H
H
4
H
1 (a )
OH
O
4
O
H
OH
H
O
H
H
1(a )
H
O
6
H
1(a )
OH
H
OH
H
O
n
OH
H
4
O
• Polimero lineare di D-glucosio uniti da
legami a (1→4) glicosidici
• Conformazione elicoidale
O
H
OH
H
H
OH
H
1(a )
O
• Polimero ramificato costituito da unità di
D-glucosio unite da legami a (1→4)
glicosidici, con ramificazioni a (1→6) ogni
24-30 residui
• La conservazione del glucosio sotto forma di amido permette il controllo della pressione
osmotica
• La digestione dell’amido avviene tramite amilasi, a-glucosidasi ed enzima deramificante
Glicogeno
• Principale forma di conservazione degli zuccheri negli animali
• Si trova soprattutto in granuli presenti in muscolo scheletrico e fegato
• Struttura simile ad amilopectina, ma con più ramificazioni
Glicosamminoglicani
• Polisaccaridi non ramificati contenenti acidi uronici e esosammine
• Si trovano negli spazi extracellulari del tessuto connettivo (cartilagini, tendini…)
acido ialuronico
eparina
CH2 OH
H
COOH
H
4
4
O
H
OH
HO
H
H
OH
acido D-glucuronico
H
H
1(b)
O
1 (b)
H
O
H
4
O
COO
OH
H
H
CH 2OSO3 -
H
HN
CH 3
O
N-acetil-Dglucosammina
• Polimero lineare di 250 25k disaccaridi uniti da
legami b (1→4) glicosidici
• Le unità del disaccaride sono unite con legami b
(1→3) glicosidici
• Si trova nel tessuto connettivo, nel liquido
sinoviale, nell’umor vitreo
• Molecola rigida con gruppi anionici esposti e
molecole di H2O
H
-
H
H
4
H
2
1 (a )
O
OSO3 -
D-iduronato-2-solfato
O
H
OH
H
H
H
2
1(a )
O
NHOSO 3-
N-solfo-Dglucosammina-6solfato
• Polimero con in media 2.5 gruppi solforici per
disaccaride
• È il polimero più carico nei tessuti dei
mammiferi
• Si trova nei granuli dei mastociti sulle pareti
delle arterie
• Inibisce la coagulazione del sangue e viene
rilasciata a seguito di un danno
• È largamente usata in ambito clinico