FAM
Serie 21: Termodinamica I
C. Ferrari
Premessa: Questa serie è da considerarsi di ripetizione ed è basata sui concetti
visti in II liceo.
Esercizio 1 Processo adiabatico non quasi-statico
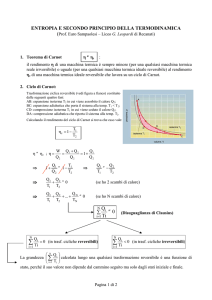
Un cilindro verticale di altezza h ed adiabaticamente chiuso contiene un gas ideale monoatomico (=sistema). Inizialmente la pressione del gas è equilibrata da un
pistone di massa m0 libero di muoversi senza attrito con le pareti del cilindro. La
temperatura iniziale del gas è T0 . Si trascura la pressione atmosferica. Si pone sul
pistone una massa m, poi si lascia. Le situazioni iniziale e finale sono rappresentate
qui sotto.
m0
m
m0
p0 ,V0 ,T0
∆h
h
p,V,T
h − ∆h
1. Calcolare la pressione finale.
2. Calcolare il calore, il lavoro e la variazione di energia in questo processo in
funzione della differenza di altezza ∆h.
Indicazione: La forza che agisce sul sistema è costante.
3. Determina la temperatura finale ed il volume finale del gas in funzione unicamente di m, m0 , T0 e V0 .
4. Determinare la variazione di entropia nei casi m = 12 m0 e m = 2m0 . Dimostra
poi in generale che ∆S > 0. Si ha un processo reversibile? Perché?
Indicazione: Per la dimostrazione utilizza eventualmente una rappresentazione
grafica da effettuare con Maple.
5. Se il processo precedente è rimpiazzato con una successione di L tappe in cui in
cosa puoi dire sulla reversibiltà? Quando
ogni tappa si aggiunge una massa m
L
il processo diventa quasi-statico? Il processo può diventare reversibile per un
certo valore di L? (Utilizza l’ipotesi di assenza d’attrito per concludere che
∆S est = 0, con esterno = masse e pistone).
Indicazione: Utilizza una rappresentazione grafica di ∆S da effettuare con
Maple.
1
Esercizio 2 Processo adiabatico quasi-statico e reversibile
Si riconsidera la situazione dell’esercizio 1 (ricordiamo che il sistema è adiabaticamente chiuso), in cui però il processo segue l’adiabatica (reversibile) pV γ = costante.
Si suppone che la pressione finale è la stessa di quella dell’esercizio 1.
1. Calcolare la variazione di altezza ∆h, la temperatura finale e quindi lo stato
finale (U,V,N).
2. Rappresenta su un diagramma pV la situazione relativa agli stati di equilibrio
iniziali e finali nel caso della trasformazione reversibile e confrontali con quelli
dell’esercizio 1.
3. Verificare che la variazione di entropia è nulla. Perché?
Esercizio 3 Processo adiabatico reversibile
Considera un gas ideale composto da un numero N fissato di particelle, abbiamo le
due equazioni
pV = NkB T
U = cNkB T .
Dimostra che
c+1
.
c
Indicazione: Utilizza il primo principio nel caso di una trasformazione adiabatica e
calcola poi dU in funzione di dT e dV in funzione di dp e dT . Infine utilizza il
risultato
Z x1
dx = ln x1 ,
x
x0
pV γ = cost
dove
γ=
x0
Esercizio 4 Espansione libera ed isoterma di un gas ideale
Considera un cilindro di volume totale V e a contatto con un bagno termico di
temperatura T . Un gas ideale composto da N particelle è inizialmente contenuto
nella metà sinistra del cilindro, occupando un volume V /2. All’istante t0 si lascia
espandere il gas in tutto il pistone. Durante l’espansione si osserva che la temperatura
non cambia.
1. Se p0 è la pressione iniziale, quanto vale la pressione finale?
2. Calcola la differenza di energia interna del gas tra la situazione iniziale e quella
finale.
3. Calcola la differenza di entropia del gas tra la situazione iniziale e quella finale.
Discuti la reversibilità.
2
Esercizio 5 Espansione isoterma reversibile di un gas ideale
Considera un gas ideale (=sistema) contenuto in un cilindro a contatto con un bagno
termico alla temperatura T . Il gas si espande da un volume Vi ad un volume Vf nelle
condizioni in cui è costantemente mantenuto in equilibrio meccanico da una molla
(ciò vuol dire che la molla lascia espandere il gas lentissimamente). Il processo è
reversibile.
1. Calcola la variazione di energia, il lavoro ed il calore relativamente al sistema
in questo processo.
2. Calcola la variazione di entropia del gas e del bagno termico.
Indicazione: Visto che il processo è reversibile δi S = 0 e siccome T = costante
puoi scrivere
δQ
Q
dS =
=⇒ ∆S =
T
T
3. Quanto vale la variazione di entropia del sistema e del bagno termico considerati come nuovo sistema (che è isolato)?
4. Confronta con l’esercizio precedente. Quanto vale ∆S bagno in questa situazione,
e quanto vale ∆S tot ?
Esercizio 6 Equilibrio termico ed entropia
Considera due blocchi di rame identici di massa m = 1,5 kg. Il blocco 1 è a temperatura iniziale T1,i = 60 ◦ C mentre il blocco 2 è a temperatura T2,i = 20 ◦ C. I blocchi
sono ospitati in contenitori termicamente isolati e separati da un diaframma mobile
pure isolante. Se solleviamo il diaframma, i blocchi prima o poi giungono alla temperatura di equilibrio Tf = 40 ◦C. Qual è la variazione di entropia nel sistema dei
due blocchi durante questo processo? Il calore specifico del rame è 386 J/(kg · K).
Discuti la reversibilità.
Esercizio 7 Calore latente
Si mescola del ghiaccio (= Σ1 ) con dell’acqua calda (= Σ2 ). Il sistema Σ = Σ1 ∪ Σ2
è isolato e il tutto è considerato a pressione costante. Si trascura il lavoro tra i due
sottosistemi. Determinare:
1. la temperatura finale, una volta raggiunto l’equilibrio termodinamico;
2. la variazione di entropia del processo.
Dati numerici : situazione iniziale maq = 200 g alla temperatura di 16 oC, e mgh = 20 g
a −4 o C. cp (aq) = 4,18·103 J/(kg · K), cp (gh) = 2,06·103 J/(kg · K) e Ls→ℓ = 3,3 · 105 J/kg.
Esercizio 8 Freccia del tempo
Discuti la relazione tra freccia del tempo, irreversibilità e secondo principio, parte
(b).
3