ENTROPIA:
Definizione e proprietà
Antonio Ballarin Denti
[email protected]
Abbiamo visto che per ogni macchina termica
REVERSIBILE che opera tra T1 e T2 (T2 >T1) vale:
(*)
(*) può scriversi anche:
Inglobando il segno “-” nel termine Q:
Generalizzando:
TEOREMA I
Se un sistema termodinamico compie una trasformazione
ciclica qualsiasi scambiando con sorgenti esterne le quantità
di calore Q1, Q2, ..Qn alle temperature T1, T2, ..Tn, allora vale:
L’ = vale quando la
trasformazione
è reversibile
Dim:
Il sistema S sia formato da varie sorgenti a
T1, T2, .., Tn e un’ulteriore sorgente a T0 <Ti
Considerando n cicli di Carnot tra T0 e Ti si ha :
calore assorbito nel ciclo
Ci dalla sorgente T0
Accoppiamo al ciclo globale C del sistema i singoli cicli
operanti all’inverso. Per ogni sorgente Ti, Qceduto = Qassorbito
Per T0 si avrà:
Dopo il ciclo C il sistema ritorna allo stato iniziale e il Lavoro
compiuto, per il I°principio e per il postulato di Kelvin sarà:
Poiché T0>0 sarà:
Poiché il ciclo è reversibile,
con lo stesso ragionamento:
Se e solo se:
Consideriamo ora scambi infinitesimi δQ.
Nel caso generale, per un ciclo qualsiasi vale:
Per un ciclo reversibile:
T = temperatura della sorgente che fornisce il calore δQ al
sistema e non è necessariamente = alla T’ della parte del
sistema che riceve δQ
T=T’ vale solo nelle trasformazioni REVERSIBILI
TEOREMA II
Data una trasformazione da A a B, l’integrale
Ha lo stesso valore per ogni trasformazione reversibile
tra A e B essendo dipendente solo da A e B e
indipendente dalla trasformazione, ovvero:
Dim:
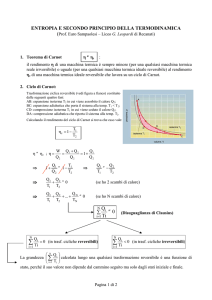
I: AB, reversibile
P
B
II: AB, reversibile
I
I + II: reversibile
II
A
V
CVD
Consideriamo l’integrale:
La funzione f si misura in J/grado
TEOREMA III
Dim:
Trasformazione REV AB passante per lo stato O
Ma, per definizione:
CVD
DEFINIZIONE: definiamo entropia la funzione S
(*)
(*) calcolato lungo una qualsiasi trasformazione reversibile
tra A e B rappresenta la differenza di entropia tra i due
stati del sistema.
δQ = quantità di calore scambiate dal sistema
T = temperatura delle sorgenti che scambiano calore δQ
PROPRIETÀ DELL’ENTROPIA
TEOREMA IV
L’entropia è definita a meno di una costante additiva arbitraria
Dim:
Assumiamo come stato normale, lo stato O’.
Per definizione:
Ma:
CVD
TEOREMA V (additività dell’entropia)
L’entropia di un sistema composto è uguale alla
somma delle entropie relative alle sue parti
Dim:
Siano A e B due sottosistemi di S; si ha:
ΔU = ΔUA + ΔUB
L = LA + LB
Per il primo principio
E dividendo per T:
Q = QA + QB
dS = dSA + dSB