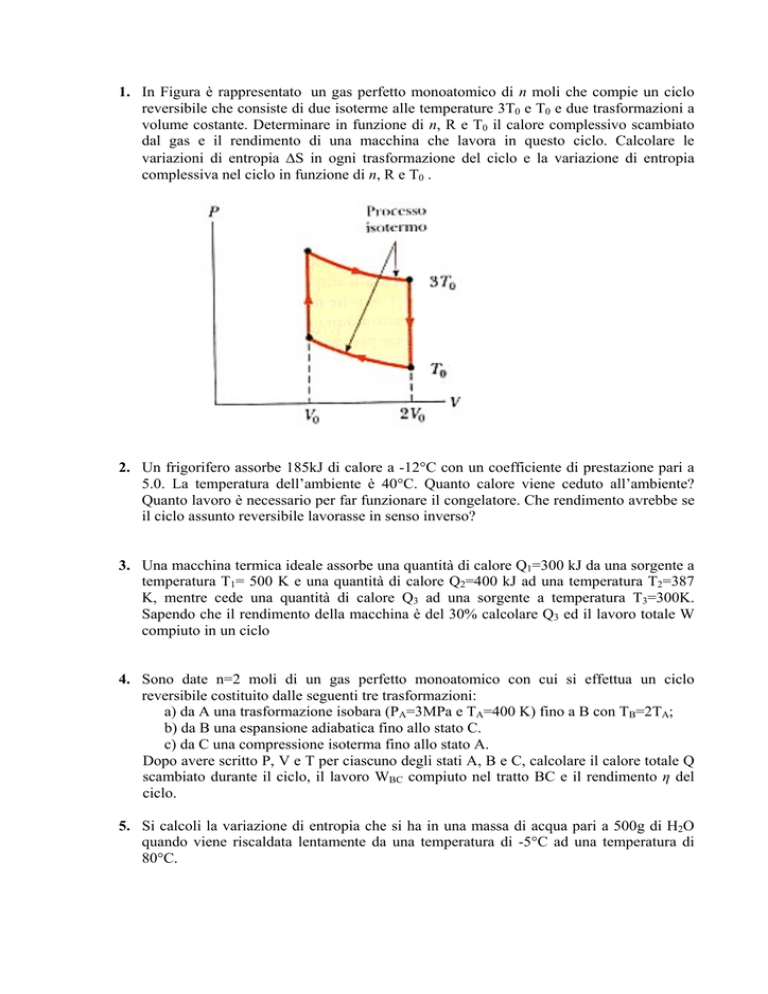
1. In Figura è rappresentato un gas perfetto monoatomico di n moli che compie un ciclo
reversibile che consiste di due isoterme alle temperature 3T0 e T0 e due trasformazioni a
volume costante. Determinare in funzione di n, R e T0 il calore complessivo scambiato
dal gas e il rendimento di una macchina che lavora in questo ciclo. Calcolare le
variazioni di entropia ΔS in ogni trasformazione del ciclo e la variazione di entropia
complessiva nel ciclo in funzione di n, R e T0 .
2. Un frigorifero assorbe 185kJ di calore a -12°C con un coefficiente di prestazione pari a
5.0. La temperatura dell’ambiente è 40°C. Quanto calore viene ceduto all’ambiente?
Quanto lavoro è necessario per far funzionare il congelatore. Che rendimento avrebbe se
il ciclo assunto reversibile lavorasse in senso inverso?
3. Una macchina termica ideale assorbe una quantità di calore Q1=300 kJ da una sorgente a
temperatura T1= 500 K e una quantità di calore Q2=400 kJ ad una temperatura T2=387
K, mentre cede una quantità di calore Q3 ad una sorgente a temperatura T3=300K.
Sapendo che il rendimento della macchina è del 30% calcolare Q3 ed il lavoro totale W
compiuto in un ciclo
4. Sono date n=2 moli di un gas perfetto monoatomico con cui si effettua un ciclo
reversibile costituito dalle seguenti tre trasformazioni:
a) da A una trasformazione isobara (PA=3MPa e TA=400 K) fino a B con TB=2TA;
b) da B una espansione adiabatica fino allo stato C.
c) da C una compressione isoterma fino allo stato A.
Dopo avere scritto P, V e T per ciascuno degli stati A, B e C, calcolare il calore totale Q
scambiato durante il ciclo, il lavoro WBC compiuto nel tratto BC e il rendimento η del
ciclo.
5. Si calcoli la variazione di entropia che si ha in una massa di acqua pari a 500g di H2O
quando viene riscaldata lentamente da una temperatura di -5°C ad una temperatura di
80°C.
6. Due moli di un gas perfetto biatomico inizialmente alla pressione di 1 atm e temperatura
300K si espande con una trasformazione irreversibile fino ad uno stato finale di volume
pari a 70 l e pressione doppia rispetto a quella iniziale. Calcolare la variazione di
entropia del gas.
7. Una macchina termica reversibile lavora con quattro sorgenti a temperature
rispettivamente T1=200°C, T2=100°C, T3= 27°C e T4=5°C. Con queste sorgenti scambia
i calori Q1=12kJ, Q2, Q3= – Q2 e Q4= – 800J. Calcolare il rendimento della macchina.
8. Si consideri il ciclo reversibile mostrato in figura per una mole di He. Allo stato A
corrispondono i valori della pressione e del volume PA=101KPa, VA=22.4 litri. Calcolare
il rendimento del ciclo. Calcolare le variazioni di entropia ΔS in ogni trasformazione del
ciclo e la variazione di entropia complessiva nel ciclo.
9. 32.62 10-2 moli di un gas perfetto biatomico descrivono il seguente ciclo: dallo stato
iniziale A (PA=105Pa, VA=8 10-3m3) si ha una compressione adiabatica reversibile che
dimezza il volume, poi da B segue una trasformazione isoterma irreversibile fino allo
stato C (VC=7 10-3 m3) con assorbimento di calore Q1=550J e ritorno allo stato A con
una trasformazione rettilinea reversibile (pressione che varia linearmente con il volume).
Calcolare rendimento del ciclo e variazione dell’entropia dell’universo.