La tavola periodica
Dr. Fabiano Nart
Gruppo Divulgazione Scientifica Dolomiti “E. Fermi”
www.gdsdolomiti.org
[email protected]
Belluno, 29/01/2011
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
1 / 29
Sommario
1
I primi tentativi
2
Nomenclatura della tavola periodica
3
Equazione di Schrödinger
4
Numeri quantici
Numero quantico principale, n
Numero quantico azimutale, l
Numero quantico magnetico, ml
Numero quantico di spin, ms
5
La costruzione dell’atomo
Principio di esclusione di Pauli
Regola di Hund e principio dell’Aufbau
Regola dell’ottetto
6
Andamento periodico delle proprietà
Raggio atomico
Energia di ionizzazione
Affinità elettronica
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
2 / 29
Parte I
Introduzione storica
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
3 / 29
I primi tentativi
∼ 1850
il numero degli elementi chimici aumentava (63 elementi allora noti);
venivano riconosciute proprietà simili tra atomi diversi;
come ordinarli?
il chimico tedesco Johann Wolfgang Döbereiner1 descrisse triadi di
elementi (massa atomica 2 dell’elemento centrale era la media dei due
agli estremi).
1865
il chimico inglese John Alexander Reina Newlands propose la legge
delle ottave.
Si cominciava ad intravedere una sorta di organizzazione intrinseca della
materia, ma nessuno riusciva a stabilirne un fondamento. . .
1
amico di Goethe il quale si ispirò al lavoro delle affinità chimiche per scrivere nel 1809
“Affinità elettive”.
2
massa atomica detta anche peso atomico, PA.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
4 / 29
I primi tentativi
∼ 1850
il numero degli elementi chimici aumentava (63 elementi allora noti);
venivano riconosciute proprietà simili tra atomi diversi;
come ordinarli?
il chimico tedesco Johann Wolfgang Döbereiner1 descrisse triadi di
elementi (massa atomica 2 dell’elemento centrale era la media dei due
agli estremi).
1865
il chimico inglese John Alexander Reina Newlands propose la legge
delle ottave.
Si cominciava ad intravedere una sorta di organizzazione intrinseca della
materia, ma nessuno riusciva a stabilirne un fondamento. . .
1
amico di Goethe il quale si ispirò al lavoro delle affinità chimiche per scrivere nel 1809
“Affinità elettive”.
2
massa atomica detta anche peso atomico, PA.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
4 / 29
I primi tentativi
∼ 1850
il numero degli elementi chimici aumentava (63 elementi allora noti);
venivano riconosciute proprietà simili tra atomi diversi;
come ordinarli?
il chimico tedesco Johann Wolfgang Döbereiner1 descrisse triadi di
elementi (massa atomica 2 dell’elemento centrale era la media dei due
agli estremi).
1865
il chimico inglese John Alexander Reina Newlands propose la legge
delle ottave.
Si cominciava ad intravedere una sorta di organizzazione intrinseca della
materia, ma nessuno riusciva a stabilirne un fondamento. . .
1
amico di Goethe il quale si ispirò al lavoro delle affinità chimiche per scrivere nel 1809
“Affinità elettive”.
2
massa atomica detta anche peso atomico, PA.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
4 / 29
I primi tentativi
∼ 1850
il numero degli elementi chimici aumentava (63 elementi allora noti);
venivano riconosciute proprietà simili tra atomi diversi;
come ordinarli?
il chimico tedesco Johann Wolfgang Döbereiner1 descrisse triadi di
elementi (massa atomica 2 dell’elemento centrale era la media dei due
agli estremi).
1865
il chimico inglese John Alexander Reina Newlands propose la legge
delle ottave.
Si cominciava ad intravedere una sorta di organizzazione intrinseca della
materia, ma nessuno riusciva a stabilirne un fondamento. . .
1
amico di Goethe il quale si ispirò al lavoro delle affinità chimiche per scrivere nel 1809
“Affinità elettive”.
2
massa atomica detta anche peso atomico, PA.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
4 / 29
I primi tentativi
1860, Congresso di Karlsruhe
Principio di Avogadro
Campioni di gas diversi contengono, a parità di volume, di pressione e di
temperatura, lo stesso numero di molecole a .
a
N a = 6, 022 ∗ 1023
Il tedesco Julius Lotar Meyer 3 ed il russo Dmitri Ivanovič Mendeleev
parteciparono al congresso e ripartirono con una copia dei lavori di Avogadro
...
3
già nel 1864 classificò 28 elementi in 6 famiglie, propose inoltre la disposizione ad anello
degli atomi di Carbonio nel benzene.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
5 / 29
I primi tentativi
1860, Congresso di Karlsruhe
Principio di Avogadro
Campioni di gas diversi contengono, a parità di volume, di pressione e di
temperatura, lo stesso numero di molecole a .
a
N a = 6, 022 ∗ 1023
Il tedesco Julius Lotar Meyer 3 ed il russo Dmitri Ivanovič Mendeleev
parteciparono al congresso e ripartirono con una copia dei lavori di Avogadro
...
3
già nel 1864 classificò 28 elementi in 6 famiglie, propose inoltre la disposizione ad anello
degli atomi di Carbonio nel benzene.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
5 / 29
I primi tentativi
(a) Dmitri Ivanovič Mendeleev.
(b) Julius Lotar Meyer.
Fig.: gli ideatori della tavola periodica.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
6 / 29
I primi tentativi
1869
. . . Mendeleev e Meyer scoprirono che . . .
LEGGE PERIODICA
. . . disponendo gli elementi in ordine di massa atomica si poteva osservare un
andamento ripetitivo e regolare delle proprietà.
Mendeleev cercò un giorno di organizzare in vari modi gli elementi chimici,
secondo la legge periodica, ma non ci riuscı̀; vinto dal sonno si risvegliò con
un nuovo progetto. . .
TAVOLA PERIODICA
Disporre gli elementi in righe per massa crescente, cominciando una nuova
riga quando il ciclo delle proprietà si ripropone.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
7 / 29
I primi tentativi
1869
. . . Mendeleev e Meyer scoprirono che . . .
LEGGE PERIODICA
. . . disponendo gli elementi in ordine di massa atomica si poteva osservare un
andamento ripetitivo e regolare delle proprietà.
Mendeleev cercò un giorno di organizzare in vari modi gli elementi chimici,
secondo la legge periodica, ma non ci riuscı̀; vinto dal sonno si risvegliò con
un nuovo progetto. . .
TAVOLA PERIODICA
Disporre gli elementi in righe per massa crescente, cominciando una nuova
riga quando il ciclo delle proprietà si ripropone.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
7 / 29
I primi tentativi
1869
. . . Mendeleev e Meyer scoprirono che . . .
LEGGE PERIODICA
. . . disponendo gli elementi in ordine di massa atomica si poteva osservare un
andamento ripetitivo e regolare delle proprietà.
Mendeleev cercò un giorno di organizzare in vari modi gli elementi chimici,
secondo la legge periodica, ma non ci riuscı̀; vinto dal sonno si risvegliò con
un nuovo progetto. . .
TAVOLA PERIODICA
Disporre gli elementi in righe per massa crescente, cominciando una nuova
riga quando il ciclo delle proprietà si ripropone.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
7 / 29
I primi tentativi
1869
. . . Mendeleev e Meyer scoprirono che . . .
LEGGE PERIODICA
. . . disponendo gli elementi in ordine di massa atomica si poteva osservare un
andamento ripetitivo e regolare delle proprietà.
Mendeleev cercò un giorno di organizzare in vari modi gli elementi chimici,
secondo la legge periodica, ma non ci riuscı̀; vinto dal sonno si risvegliò con
un nuovo progetto. . .
TAVOLA PERIODICA
Disporre gli elementi in righe per massa crescente, cominciando una nuova
riga quando il ciclo delle proprietà si ripropone.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
7 / 29
I primi tentativi
Fig.: tavola periodica di Mendeelev.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
8 / 29
I primi tentativi
seguendo scrupolosamente la legge periodica venivano a crearsi dei vuoti
nella tavola (e.g. tra Ga e As);
Mendeleev non ignorò il buco, ma ipotizzò un nuovo elemento chimico e
le sue proprietà.
Tab.: Confronto tra Ekasilicio e Germanio 4 .
Proprietà
massa molare (g/mol−1 )
densità (g/cm−3 )
punto di fusione (◦ C)
aspetto
ossido
densità dell’ossido
cloruro
densità del cloruro
4
Ekasilicio (E)
72
5,5
elevato
grigio bruno
EO2 ; s. bianco; anf.
4,7g/cm−3
ECl4
1,9g/cm−3
Germanio (Ge)
72,59
5,32
937
grigio bianco
GeO2 , s. bianco; anf.
4,23g/cm−3
GeCl4
1,84g/cm−3
Scoperto nel 1886 dal chimico tedesco Clemens Winkler.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
9 / 29
I primi tentativi
seguendo scrupolosamente la legge periodica venivano a crearsi dei vuoti
nella tavola (e.g. tra Ga e As);
Mendeleev non ignorò il buco, ma ipotizzò un nuovo elemento chimico e
le sue proprietà.
Tab.: Confronto tra Ekasilicio e Germanio 4 .
Proprietà
massa molare (g/mol−1 )
densità (g/cm−3 )
punto di fusione (◦ C)
aspetto
ossido
densità dell’ossido
cloruro
densità del cloruro
4
Ekasilicio (E)
72
5,5
elevato
grigio bruno
EO2 ; s. bianco; anf.
4,7g/cm−3
ECl4
1,9g/cm−3
Germanio (Ge)
72,59
5,32
937
grigio bianco
GeO2 , s. bianco; anf.
4,23g/cm−3
GeCl4
1,84g/cm−3
Scoperto nel 1886 dal chimico tedesco Clemens Winkler.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
9 / 29
I primi tentativi
la sua perspicacia fù premiata . . .
Fig.: il Germanio.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
10 / 29
I primi tentativi
Un piccolo problema. . .
quando fu isolato l’Ar, sembrava non trovare posto nella tavola;
PA(Ar) ' PA(Ca) ' 40;
ma Ar è un gas inerte, Ca un metallo reattivo.
Forse la massa atomica non era il criterio adeguato per la classificazione . . .
Soluzione:
1913 Henry Mosely 5 analizzando gli spettri X, si rese conto che tutti gli
atomi dello stesso elemento avevano la stessa carica nucleare (stesso
numero di protoni), che identifica il numero atomico Z;
si deve utilizzare Z per classificare gli elementi chimici e non PA!
5
allievo di Ernest Rutherford, morı̀ a 27 anni il 10 agosto 1915 nella Battaglia di Gallipoli.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
11 / 29
I primi tentativi
Un piccolo problema. . .
quando fu isolato l’Ar, sembrava non trovare posto nella tavola;
PA(Ar) ' PA(Ca) ' 40;
ma Ar è un gas inerte, Ca un metallo reattivo.
Forse la massa atomica non era il criterio adeguato per la classificazione . . .
Soluzione:
1913 Henry Mosely 5 analizzando gli spettri X, si rese conto che tutti gli
atomi dello stesso elemento avevano la stessa carica nucleare (stesso
numero di protoni), che identifica il numero atomico Z;
si deve utilizzare Z per classificare gli elementi chimici e non PA!
5
allievo di Ernest Rutherford, morı̀ a 27 anni il 10 agosto 1915 nella Battaglia di Gallipoli.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
11 / 29
I primi tentativi
Un piccolo problema. . .
quando fu isolato l’Ar, sembrava non trovare posto nella tavola;
PA(Ar) ' PA(Ca) ' 40;
ma Ar è un gas inerte, Ca un metallo reattivo.
Forse la massa atomica non era il criterio adeguato per la classificazione . . .
Soluzione:
1913 Henry Mosely 5 analizzando gli spettri X, si rese conto che tutti gli
atomi dello stesso elemento avevano la stessa carica nucleare (stesso
numero di protoni), che identifica il numero atomico Z;
si deve utilizzare Z per classificare gli elementi chimici e non PA!
5
allievo di Ernest Rutherford, morı̀ a 27 anni il 10 agosto 1915 nella Battaglia di Gallipoli.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
11 / 29
Parte II
La tavola periodica moderna
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
12 / 29
Nomenclatura della tavola periodica
Fig.: tavola periodica moderna.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
13 / 29
Nomenclatura della tavola periodica
numero atomico: Z = n◦ (e− ) = n◦ (p+ );
numero di massa atomica: A = n◦ (n) + n◦ (p+ ).
AX
Z
19 F
9
→ n◦ (n) = 19 − 9 = 10
periodo: riga. Il numero dipende dal livello energetico occupato dagli e−
esterni, numero quantico principale, n;
gruppo: colonna. Il numero corrisponde al n◦ (e− ) dell’orbitale esterno;
blocco: insieme di più guppi che condividono l’orbitale esterno, numero
quantico azimutale, l;
elementi di transizione: elementi dei periodi lunghi contenuti tra il
blocco s e p.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
14 / 29
Nomenclatura della tavola periodica
numero atomico: Z = n◦ (e− ) = n◦ (p+ );
numero di massa atomica: A = n◦ (n) + n◦ (p+ ).
AX
Z
19 F
9
→ n◦ (n) = 19 − 9 = 10
periodo: riga. Il numero dipende dal livello energetico occupato dagli e−
esterni, numero quantico principale, n;
gruppo: colonna. Il numero corrisponde al n◦ (e− ) dell’orbitale esterno;
blocco: insieme di più guppi che condividono l’orbitale esterno, numero
quantico azimutale, l;
elementi di transizione: elementi dei periodi lunghi contenuti tra il
blocco s e p.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
14 / 29
Parte III
Struttura elettronica e proprietà atomiche
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
15 / 29
Equazione di Schrödinger
2
~
− 2m
∇2 + V ψ = i~ ∂ψ
∂t
equazione di Schrödinger
Schrödinger stabilı̀ che ogni atomo è contraddistinto da tre numeri detti
numeri quantici:
numero quantico principale, n;
numero quantico azimutale, l;
numero quantico magnetico, ml .
Schrödinger risolse esattamente l’equazione per l’atomo di H 6 :
E = − h<
n2
n=1,2,3,. . .
h = Costante di Planck = 6, 62 ∗ 10−34 J ∗ s
< = Costante di Rydberg = 3, 29 ∗ 1015 Hz
(0)
(0)
(0)
(1)
(1)
(0)
per atomi più pesanti: (H (0) − Ek )ψk + λ[(H (0) − Ek )ψk + (V − Ek ψk ] +
(0)
(2)
(1) (1)
(2) (0)
λ [(H (0) − Ek )ψk ] + (V − Ek ψk − Ek ψk ) + . . . = 0
6
2
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
16 / 29
Equazione di Schrödinger
2
~
− 2m
∇2 + V ψ = i~ ∂ψ
∂t
equazione di Schrödinger
Schrödinger stabilı̀ che ogni atomo è contraddistinto da tre numeri detti
numeri quantici:
numero quantico principale, n;
numero quantico azimutale, l;
numero quantico magnetico, ml .
Schrödinger risolse esattamente l’equazione per l’atomo di H 6 :
E = − h<
n2
n=1,2,3,. . .
h = Costante di Planck = 6, 62 ∗ 10−34 J ∗ s
< = Costante di Rydberg = 3, 29 ∗ 1015 Hz
(0)
(0)
(0)
(1)
(1)
(0)
per atomi più pesanti: (H (0) − Ek )ψk + λ[(H (0) − Ek )ψk + (V − Ek ψk ] +
(0)
(2)
(1) (1)
(2) (0)
λ [(H (0) − Ek )ψk ] + (V − Ek ψk − Ek ψk ) + . . . = 0
6
2
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
16 / 29
Equazione di Schrödinger
2
~
− 2m
∇2 + V ψ = i~ ∂ψ
∂t
equazione di Schrödinger
Schrödinger stabilı̀ che ogni atomo è contraddistinto da tre numeri detti
numeri quantici:
numero quantico principale, n;
numero quantico azimutale, l;
numero quantico magnetico, ml .
Schrödinger risolse esattamente l’equazione per l’atomo di H 6 :
E = − h<
n2
n=1,2,3,. . .
h = Costante di Planck = 6, 62 ∗ 10−34 J ∗ s
< = Costante di Rydberg = 3, 29 ∗ 1015 Hz
(0)
(0)
(0)
(1)
(1)
(0)
per atomi più pesanti: (H (0) − Ek )ψk + λ[(H (0) − Ek )ψk + (V − Ek ψk ] +
(0)
(2)
(1) (1)
(2) (0)
λ [(H (0) − Ek )ψk ] + (V − Ek ψk − Ek ψk ) + . . . = 0
6
2
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
16 / 29
Equazione di Schrödinger
2
~
− 2m
∇2 + V ψ = i~ ∂ψ
∂t
equazione di Schrödinger
Schrödinger stabilı̀ che ogni atomo è contraddistinto da tre numeri detti
numeri quantici:
numero quantico principale, n;
numero quantico azimutale, l;
numero quantico magnetico, ml .
Schrödinger risolse esattamente l’equazione per l’atomo di H 6 :
E = − h<
n2
n=1,2,3,. . .
h = Costante di Planck = 6, 62 ∗ 10−34 J ∗ s
< = Costante di Rydberg = 3, 29 ∗ 1015 Hz
(0)
(0)
(0)
(1)
(1)
(0)
per atomi più pesanti: (H (0) − Ek )ψk + λ[(H (0) − Ek )ψk + (V − Ek ψk ] +
(0)
(2)
(1) (1)
(2) (0)
λ [(H (0) − Ek )ψk ] + (V − Ek ψk − Ek ψk ) + . . . = 0
6
2
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
16 / 29
Equazione di Schrödinger
2
~
− 2m
∇2 + V ψ = i~ ∂ψ
∂t
equazione di Schrödinger
Schrödinger stabilı̀ che ogni atomo è contraddistinto da tre numeri detti
numeri quantici:
numero quantico principale, n;
numero quantico azimutale, l;
numero quantico magnetico, ml .
Schrödinger risolse esattamente l’equazione per l’atomo di H 6 :
E = − h<
n2
n=1,2,3,. . .
h = Costante di Planck = 6, 62 ∗ 10−34 J ∗ s
< = Costante di Rydberg = 3, 29 ∗ 1015 Hz
(0)
(0)
(0)
(1)
(1)
(0)
per atomi più pesanti: (H (0) − Ek )ψk + λ[(H (0) − Ek )ψk + (V − Ek ψk ] +
(0)
(2)
(1) (1)
(2) (0)
λ [(H (0) − Ek )ψk ] + (V − Ek ψk − Ek ψk ) + . . . = 0
6
2
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
16 / 29
Numeri quantici
Numero quantico principale, n
Numero quantico principale, n
E = − h<
n2
n=1,2,3,. . .
n specifica l’energia dell’e− , quindi il livello occupato;
maggiore n, meno negativa E!!!;
e− più lontano dal nucleo, più libero;
n → ∞, raggiunto il continuo, e− libero.
Fig.: livelli atomici (H).
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
17 / 29
Numeri quantici
Numero quantico principale, n
Numero quantico principale, n
E = − h<
n2
n=1,2,3,. . .
n specifica l’energia dell’e− , quindi il livello occupato;
maggiore n, meno negativa E!!!;
e− più lontano dal nucleo, più libero;
n → ∞, raggiunto il continuo, e− libero.
Fig.: livelli atomici (H).
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
17 / 29
Numeri quantici
Numero quantico principale, n
Numero quantico principale, n
E = − h<
n2
n=1,2,3,. . .
n specifica l’energia dell’e− , quindi il livello occupato;
maggiore n, meno negativa E!!!;
e− più lontano dal nucleo, più libero;
n → ∞, raggiunto il continuo, e− libero.
Fig.: livelli atomici (H).
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
17 / 29
Numeri quantici
Numero quantico principale, n
Numero quantico principale, n
E = − h<
n2
n=1,2,3,. . .
n specifica l’energia dell’e− , quindi il livello occupato;
maggiore n, meno negativa E!!!;
e− più lontano dal nucleo, più libero;
n → ∞, raggiunto il continuo, e− libero.
Fig.: livelli atomici (H).
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
17 / 29
Numeri quantici
Numero quantico azimutale, l
Numero quantico azimutale, l
definisce il sottolivello corrispondente ad un dato n;
l governa il tipo di orbitale, la forma.
0<l<n−1
Tab.: Tipologia di orbitali.
Numero quantico azimutale, l
0
1
2
3
4
5
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Tipo di orbitale
s
p
d
f
g
h
Belluno, 29/01/2011
18 / 29
Numeri quantici
Numero quantico azimutale, l
Numero quantico azimutale, l
definisce il sottolivello corrispondente ad un dato n;
l governa il tipo di orbitale, la forma.
0<l<n−1
Tab.: Tipologia di orbitali.
Numero quantico azimutale, l
0
1
2
3
4
5
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Tipo di orbitale
s
p
d
f
g
h
Belluno, 29/01/2011
18 / 29
Numeri quantici
Numero quantico azimutale, l
Numero quantico azimutale, l
definisce il sottolivello corrispondente ad un dato n;
l governa il tipo di orbitale, la forma.
0<l<n−1
Tab.: Tipologia di orbitali.
Numero quantico azimutale, l
0
1
2
3
4
5
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Tipo di orbitale
s
p
d
f
g
h
Belluno, 29/01/2011
18 / 29
Numeri quantici
Numero quantico azimutale, l
Numero quantico azimutale, l
definisce il sottolivello corrispondente ad un dato n;
l governa il tipo di orbitale, la forma.
0<l<n−1
Tab.: Tipologia di orbitali.
Numero quantico azimutale, l
0
1
2
3
4
5
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Tipo di orbitale
s
p
d
f
g
h
Belluno, 29/01/2011
18 / 29
Numeri quantici
Numero quantico magnetico, ml
Numero quantico magnetico, ml
ml , distingue l’orientazione dell’orbitale definito dal sottolivello l.
−l < ml < l
Tab.: Orientazione degli orbitali.
l
0
1
2
ml
0
-1, 0, 1
-2, -1, 0, 1, 2
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
Orientazione dell’orbitale
nessuna orientazione, anisotropo ; sfera
orientazione lungo x, y, z
orientazione lungo xy, xz, yz, z2 , x2 − y2
La tavola periodica
Belluno, 29/01/2011
19 / 29
Numeri quantici
Numero quantico magnetico, ml
Numero quantico magnetico, ml
ml , distingue l’orientazione dell’orbitale definito dal sottolivello l.
−l < ml < l
Tab.: Orientazione degli orbitali.
l
0
1
2
ml
0
-1, 0, 1
-2, -1, 0, 1, 2
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
Orientazione dell’orbitale
nessuna orientazione, anisotropo ; sfera
orientazione lungo x, y, z
orientazione lungo xy, xz, yz, z2 , x2 − y2
La tavola periodica
Belluno, 29/01/2011
19 / 29
Numeri quantici
Numero quantico magnetico, ml
Numero quantico magnetico, ml
ml , distingue l’orientazione dell’orbitale definito dal sottolivello l.
−l < ml < l
Tab.: Orientazione degli orbitali.
l
0
1
2
ml
0
-1, 0, 1
-2, -1, 0, 1, 2
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
Orientazione dell’orbitale
nessuna orientazione, anisotropo ; sfera
orientazione lungo x, y, z
orientazione lungo xy, xz, yz, z2 , x2 − y2
La tavola periodica
Belluno, 29/01/2011
19 / 29
Numeri quantici
Numero quantico magnetico, ml
Fig.: orbitali s, p e d.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
20 / 29
Numeri quantici
Numero quantico di spin, ms
Esiste anche un quarto numero quantico, numero quantico magnetico di
spin, ms :
definisce l’orientazione (“sù ↑” o “giù↓”) dell’e− all’interno di un
orbitale (spin).
ms = + 21 (↑); − 12 (↓)
Fig.: i due possibili spin dell’e− .
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
21 / 29
Numeri quantici
Numero quantico di spin, ms
Esiste anche un quarto numero quantico, numero quantico magnetico di
spin, ms :
definisce l’orientazione (“sù ↑” o “giù↓”) dell’e− all’interno di un
orbitale (spin).
ms = + 12 (↑); − 12 (↓)
Fig.: i due possibili spin dell’e− .
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
21 / 29
Numeri quantici
Numero quantico di spin, ms
Esiste anche un quarto numero quantico, numero quantico magnetico di
spin, ms :
definisce l’orientazione (“sù ↑” o “giù↓”) dell’e− all’interno di un
orbitale (spin).
ms = + 12 (↑); − 12 (↓)
Fig.: i due possibili spin dell’e− .
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
21 / 29
Numeri quantici
Numero quantico di spin, ms
Esiste anche un quarto numero quantico, numero quantico magnetico di
spin, ms :
definisce l’orientazione (“sù ↑” o “giù↓”) dell’e− all’interno di un
orbitale (spin).
ms = + 12 (↑); − 12 (↓)
Fig.: i due possibili spin dell’e− .
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
21 / 29
La costruzione dell’atomo
Principio di esclusione di Pauli
Come si costruisce l’atomo?
PRINCIPIO DI ESCLUSIONE DI PAULI a
a
1925, Wolfgang Pauli.
Nessun orbitale può contenere due elettroni con gli stessi quattro numeri
quantici.
→ 1e−
H si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
4 He → 2e− (uno in più di H)
2
He si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
1H
1
−→ i due elettroni si trovano sullo stesso orbitale e con gli stessi numeri
quantici n, l e ml , quindi devono avere diverso numero quantico di spin, ms
(↑↓ 7 ).
7
Accoppiamento spin-spin.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
22 / 29
La costruzione dell’atomo
Principio di esclusione di Pauli
Come si costruisce l’atomo?
PRINCIPIO DI ESCLUSIONE DI PAULI a
a
1925, Wolfgang Pauli.
Nessun orbitale può contenere due elettroni con gli stessi quattro numeri
quantici.
→ 1e−
H si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
4 He → 2e− (uno in più di H)
2
He si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
1H
1
−→ i due elettroni si trovano sullo stesso orbitale e con gli stessi numeri
quantici n, l e ml , quindi devono avere diverso numero quantico di spin, ms
(↑↓ 7 ).
7
Accoppiamento spin-spin.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
22 / 29
La costruzione dell’atomo
Principio di esclusione di Pauli
Come si costruisce l’atomo?
PRINCIPIO DI ESCLUSIONE DI PAULI a
a
1925, Wolfgang Pauli.
Nessun orbitale può contenere due elettroni con gli stessi quattro numeri
quantici.
→ 1e−
H si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
4 He → 2e− (uno in più di H)
2
He si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
1H
1
−→ i due elettroni si trovano sullo stesso orbitale e con gli stessi numeri
quantici n, l e ml , quindi devono avere diverso numero quantico di spin, ms
(↑↓ 7 ).
7
Accoppiamento spin-spin.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
22 / 29
La costruzione dell’atomo
Principio di esclusione di Pauli
Come si costruisce l’atomo?
PRINCIPIO DI ESCLUSIONE DI PAULI a
a
1925, Wolfgang Pauli.
Nessun orbitale può contenere due elettroni con gli stessi quattro numeri
quantici.
→ 1e−
H si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
4 He → 2e− (uno in più di H)
2
He si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
1H
1
−→ i due elettroni si trovano sullo stesso orbitale e con gli stessi numeri
quantici n, l e ml , quindi devono avere diverso numero quantico di spin, ms
(↑↓ 7 ).
7
Accoppiamento spin-spin.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
22 / 29
La costruzione dell’atomo
Principio di esclusione di Pauli
Come si costruisce l’atomo?
PRINCIPIO DI ESCLUSIONE DI PAULI a
a
1925, Wolfgang Pauli.
Nessun orbitale può contenere due elettroni con gli stessi quattro numeri
quantici.
→ 1e−
H si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
4 He → 2e− (uno in più di H)
2
He si trova nel primo periodo
→ n = 1 → l = n − 1 = 1 − 1 = 0 → −l < ml < l, ml = 0 orbitale s
1H
1
−→ i due elettroni si trovano sullo stesso orbitale e con gli stessi numeri
quantici n, l e ml , quindi devono avere diverso numero quantico di spin, ms
(↑↓ 7 ).
7
Accoppiamento spin-spin.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
22 / 29
La costruzione dell’atomo
Regola di Hund e principio dell’Aufbau
REGOLA DI HUND a
a
1925, Fritz Hund.
La configurazione elettronica dello stato fondamentale dell’atomo di un
elemento di numero atomico Z, si realizza aggiungendo gli e− negli orbitali
disponibili in modo da assicurare la minima energia totale.
16 O
8
→ 8e− , si trova nel secondo periodo
Tab.: Regola di Hund.
n
1
2
0<l<n−1
l=0
l=0
l=1
−l < ml < l
ml = 0
ml = 0
ml = −1
ml = 0
ml = +1
Orbitale
1s
2s
2px
2py
2pz
n◦ e−
2
2
1+1
1
1
Fig.: principio dell’Aufbau.a
a
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
Costruzione progressiva.
La tavola periodica
Belluno, 29/01/2011
23 / 29
La costruzione dell’atomo
Regola dell’ottetto
Domanda: quanti e− al massimo possono starci nel secondo periodo?
Risposta: 8.
Domanda: quanti e− al massimo possono starci nel terzo periodo?
Risposta: 8.
REGOLA DELL’OTTETTO a
a
Regola empirica.
Quando l’atomo ha raggiunto la configurazione elettronica del gas nobile più
vicino (con 8e− ) il livello esterno è completato e l’atomo è stabile a .
a
in prima approssimazione il principio è valido per interpretare le reazioni chimiche.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
24 / 29
La costruzione dell’atomo
Regola dell’ottetto
Domanda: quanti e− al massimo possono starci nel secondo periodo?
Risposta: 8.
Domanda: quanti e− al massimo possono starci nel terzo periodo?
Risposta: 8.
REGOLA DELL’OTTETTO a
a
Regola empirica.
Quando l’atomo ha raggiunto la configurazione elettronica del gas nobile più
vicino (con 8e− ) il livello esterno è completato e l’atomo è stabile a .
a
in prima approssimazione il principio è valido per interpretare le reazioni chimiche.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
24 / 29
La costruzione dell’atomo
Regola dell’ottetto
Domanda: quanti e− al massimo possono starci nel secondo periodo?
Risposta: 8.
Domanda: quanti e− al massimo possono starci nel terzo periodo?
Risposta: 8.
REGOLA DELL’OTTETTO a
a
Regola empirica.
Quando l’atomo ha raggiunto la configurazione elettronica del gas nobile più
vicino (con 8e− ) il livello esterno è completato e l’atomo è stabile a .
a
in prima approssimazione il principio è valido per interpretare le reazioni chimiche.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
24 / 29
La costruzione dell’atomo
Regola dell’ottetto
Domanda: quanti e− al massimo possono starci nel secondo periodo?
Risposta: 8.
Domanda: quanti e− al massimo possono starci nel terzo periodo?
Risposta: 8.
REGOLA DELL’OTTETTO a
a
Regola empirica.
Quando l’atomo ha raggiunto la configurazione elettronica del gas nobile più
vicino (con 8e− ) il livello esterno è completato e l’atomo è stabile a .
a
in prima approssimazione il principio è valido per interpretare le reazioni chimiche.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
24 / 29
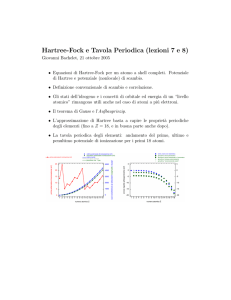
Andamento periodico delle proprietà
Raggio atomico
Raggio atomico
il raggio atomico di un elemento è definito come la metà della distanza
che separa i centri di atomi contigui (A − A).
Il raggio atomico aumenta generalmente discendendo lungo un gruppo e
diminuisce procedendo da sinistra verso destra lungo un periodo.
Fig.: andamento raggio atomico.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
25 / 29
Andamento periodico delle proprietà
Energia di ionizzazione
Energia di ionizzazione
è l’energia necessaria per allontanare l’e− esterno da un atomo in fase
gas (Xg → Xg+ + e− ).
L’energia di ionizzazione diminuisce generalmente scendendo lungo il gruppo
ed aumenta procedendo da sinistra verso destra lungo un periodo.
Fig.: andamento energia di ionizzazione.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
26 / 29
Andamento periodico delle proprietà
Affinità elettronica
Affinità elettronica
è l’energia che si libera quando l’atomo in fase gas cattura un e−
(Xg + e− → Xg− ).
L’affinità elettronica risulta massima per gli atomi vicini all’O.
Fig.: andamento affinità elettronica.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
27 / 29
Bibliografia
Chimica generale. P. Atkins, L. Jones. Zanichelli, 1998.
Appunti di chimica generale. F. Nart, 2000.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
28 / 29
Al gran ballo degli scienziati Mendeleev non partecipò. . .
. . . non gli andava di stare a tavola con certi elementi . . .
Documento scritto in LATEX.
Dr. Fabiano Nart (GDS Dolomiti “E. Fermi”)
La tavola periodica
Belluno, 29/01/2011
29 / 29