Energia e trasformazioni spontanee
Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede
energia.
La termodinamica è quella scienza che studia le variazioni di energia in una
trasformazione
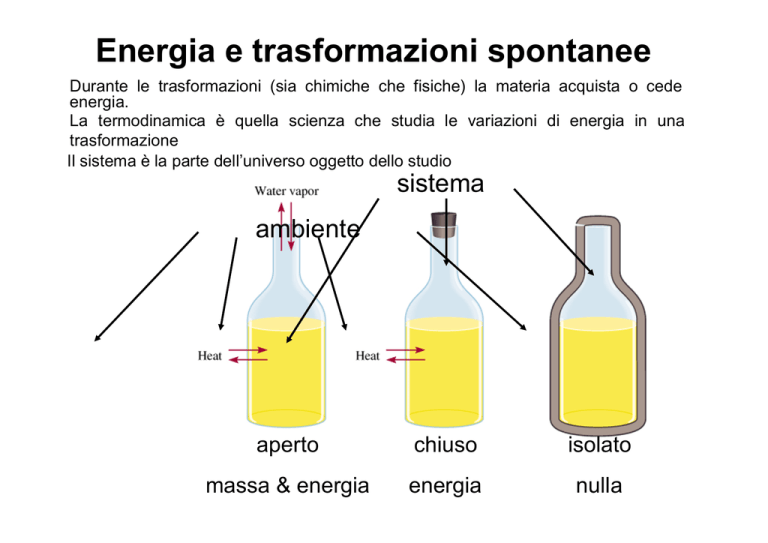
Il sistema è la parte dell’universo oggetto dello studio
sistema
ambiente
aperto
chiuso
isolato
massa & energia
energia
nulla
Trasformazioni ed Energia
L’energia interna U è l’energia totale del sistema ovvero la somma
dell’energia cinetica traslazionale, rotazionale, vibrazionale, l’energia dei
legami chimici , delle interazioni intermolecolari , delle forze di attrazione
nucleo – elettroni e l’energia dei protoni e neutroni nel nucleo.
U = E cin + E pot
U è una funzione di stato ovvero dipende solo dallo stato in cui si
trova il sistema e non dal “percorso” fatto per raggiungerlo.
Non è possibile conoscere il valore assoluto di U
L’Energia potenziale dello
scalatore 1 e dello scalatore 2 è
la stessa anche se i percorsi
sono differenti.
Trasformazioni ed Energia
Principio di conservazione dell’energia: L’energia non può essere creata né
distrutta ma solo trasformata.
Se consideriamo la trasformazione da uno stato 1 (stato iniziale) ad uno stato 2
(stato finale) di un sistema chiuso.
∆U = U2 − U1 = Q−L
I° principio della termodinamica
Q è il calore scambiato fra il sistema e l’ambiente
L è il lavoro fatto dal (o sul) sistema verso ( o dall’)ambiente
Il calore è energia che si trasferisce in virtù di una differenza di temperatura (caloria, Joule)
Il lavoro è una forma di trasferimento dell’energia (lavoro espansivo, lavoro elettrico….) (caloria, Joule)
Trasformazioni ed Energia
Per convenzione:
•Q assorbito dal sistema dall’ambiente ha segno positivo (+Q). La trasformazione si
dice ENDOTERMICA
•Q ceduto dal sistema all’ambiente ha segno negativo (-Q). La trasformazione si
dice ESOTERMICA
•L compiuto dal sistema vs l’ambiente ha segno positivo (+L)
•L compiuto dall’ambiente sul sistema ha segno positivo (-L)
Se consideriamo la trasformazione da uno stato 1 ad uno stato 2 di un
sistema isolato.
∆U= 0
ovvero l’energia totale è costante
Trasformazioni ed Energia
Per una trasformazione che avviene a P costante la principale forma di lavoro
può essere di contrazione (-L) o espansione (+L)
L = ±P∆V
∆U = Q − L = Q ± P∆V
Se la trasformazione avviene invece a volume costante (recipiente
ermeticamente chiuso)
P∆V = 0
∆U = Qv
La variazione di energia interna corrisponde
alla quantità di calore scambiata dal sistema
Trasformazioni ed Energia
Si definisce entalpia H del sistema la somma dell’energia interna U e l’energia
meccanica PV
H = U + PV
Come U anche H è una funzione di stato di cui non si conosce il valore assoluto
Per una trasformazione da uno stato 1 (stato iniziale) ad uno stato 2 (stato finale) che
avviene a P costante (generalità dei casi)
∆H = H2 − H1 = (U2 + PV2 ) − (U1 + PV1) = ∆U + P∆V = Qp
La variazione di entalpia
corrisponde alla quantità di calore
scambiata dal sistema
Trasformazioni ed Energia
∆U = ∆H
Qv = Qp
Quando
a
P
costante
la
trasformazione
avviene
senza
variazione di volume
Trasformazioni che avvengono senza variazione di volume:
H2(g) + I2(g)→2HI(g)
N2(g) + O2(g)→2NO (g)
Trasformazioni che avvengono con variazione di volume:
•2H2(g) + O2(g)→2H2O (l)
•CaCO3(s) →CaO(s) + CO2(g)
•H2O(l) →H2O(g)
•I2(s)→I2(g)
Trasformazioni ed energia
∆U = Qv
cal/mole
∆H = Qp
cal/mole
Q = m ⋅ c p ⋅ (T fin − Tiniz )
Spontaneità delle trasformazioni
Il primo principio della termodinamica non pone limitazioni ai
trasferimenti di energia purché sia rispettato il principio di
conservazione.
Pertanto non è possibile prevedere, con il principio di conservazione
di energia, la direzione in cui una trasformazione chimica o fisica
avviene spontaneamente ovvero senza alcun intervento esterno.
Una trasformazione spontanea è anche irreversibile
Le Transizioni di stato- Spontaneità
solidificazione
Condensazione o
liquefazione
brinamento
∆Hfus >0
→
∆Hsol <0
←
∆Hevaporazione >0
→
∆Hcondensaz <0
←
Processi reversibili e irreversibili
Processo reversibile quando le variabili di stato del sistema (volume,
pressione) variano solo di una quantità infinitesima.
Es: espansione reversibile di un gas
Pi=Pest +dP
Un processo reversibile può essere invertito in ogni momento tramite un
cambiamento infinitesimo delle proprietà dell’ambiente.
Processo irreversibile quando le variabili di stato del sistema variano di una
quantità finita.
Es: espansione irreversibile di un gas
Pi=Pest +∆P
Un processo irreversibile non può essere invertito o arrestato e procede
spontaneamente in una direzione.
Processi reversibili e irreversibili
Lavoro in un processo reversibile:
Es: espansione reversibile di un gas
Pi=Pest +dP
δLrev = Pest ·dV
L rev =
V2
∫ Pest dV
V1
Poichè
Pi ~ Pest
L rev =
L rev
V2
V2
V1
V1
∫ Pi ⋅ dV = ∫
V2
= nRT ln
V1
V2
nRT
dV
⋅ dV = nRT ∫
V
V1 V
Processi reversibili e irreversibili
Lavoro in un processo irreversibile:
Es: espansione irreversibile di un gas
Lirrev = Pest ·(V2-V1) =P2 · (V2-V1)
Lrev > Lirrev
Lrev
Lirrev
Processi reversibili e irreversibili
Calore in un processo reversibile e irreversibile:
Processo reversibile
Processo irreversibile
Qirrev =∆U+ Lirrev
Qrev =∆U+ Lrev
Qrev - Qirrev = Lrev - Lirrev
Poichè
Lrev-Lirrev >0
Qrev-Qirrev >0
Qrev > Qirrev
Le Transizioni di stato- Spontaneità
Un altro fattore che concorre alla definizione della spontaneità di una
trasformazione è la tendenza ad assumere il massimo stato di disordine
La funzione di stato entropia S descrive quantitativamente la
tendenza al disordine di un sistema.
maggiore
probabilità
Stato di
disordine
Stato di
ordine
minore
probabilità
L’entropia è correlata al numero di stati microscopici che lo
descrivono secondo l’equazione:
S = K ln W
dove
K è la costante di Boltzman (1,3807 10-23 J/K)
W è il numero di stati microscopici del sistema.
MAGGIORE E’ IL NUMERO DI STATI MICROSCOPICI MAGGIORE E’ LA
PROBABILITA’ D’ ESISTENZA DEL SISTEMA STESSO
L’entropia è una funzione di stato
II° principio della termodinamica: Tutti i processi
spontanei e irreversibili producono un aumento di
entropia dell’universo (sistema isolato)
∆Stotale= ∆S+∆Samb>0
Entropia di un sistema
Se un sistema subisce una trasformazione isoterma, reversibile e infinitesima
durante la quale scambia la quantità di calore δQrev con l’ambiente
H2O(l) (0°C, 1 atm)
H2O(s) (0°C, 1atm)
il suo contenuto di entropia varia di una quantità infinitesima pari a :
dS =
δQrev
T
Per una trasformazione tra lo stato 1 e lo stato 2 la variazione finita di entropia
sarà:
2
2
∆S = S2 − S1 = ∫ dS = ∫
1
1
δQrev
T
Qrev
=
T
cal moli-1 K-1
Stato iniziale
Stato finale
Per il sistema
Sf < Si
∆ S=-Qrev/T
Per l’ambiente
Sambf > Sambi
∆ Samb= Qrev/T >0
<0
Entropia di un sistema
Se un sistema subisce una trasformazione irreversibile
H2O(l) (0°C, 1 atm)
H2O(s) (0°C, 1atm)
∆ S irrev = − Q irrev / T
∆ S rev > ∆ S irrev
Disuguaglianza di Clausius
Se il sistema si evolve attraverso una trasformazione irreversibile la variazione di
entropia che esso subisce si calcola lungo il cammino di una qualunque
trasformazione reversibile arbitrariamente scelta che consideri i medesimi stato
iniziale e finale
∆S = −Q / T
∆ S totale
∆ S amb = Q / To
⎛ 1
Q Q
1⎞
=− +
= Q ⋅ ⎜⎜
− ⎟⎟ > 0
T To
⎝ To T ⎠
Pertanto per valutare se un processo è spontaneo
occorre valutare:
- La variazione entropica del sistema
- La variazione entropica dell’ambiente
- La somma delle due
Una semplificazione del problema si ottiene
definendo una nuova funzione di stato
“ENERGIA LIBERA” che ci permette di
valutare:
-Se un processo è spontaneo
-Come un cambiamento di temperatura possa
condizionare il carattere spontaneo di un
processo
Per un processo che avviene a T e P costante
∆Stotale= ∆S + ∆Samb
∆Stotale = ∆S – Qrev/T
Τ∆Stotale = T∆S–Qrev = T∆S–∆H
-T∆Stotale = ∆H -T∆S
L’Energia libera di Gibbs G è definita da:
G= H-TS
G è una funzione di stato
∆G= ∆H-T∆S = -T∆Stotale
Ad un aumento dell’entropia totale (processo spontaneo)
corrisponde alla diminuzione dell’energia libera
Trasformazione spontanea
∆G<0 (principio della
minima energia libera)
Trasformazione non spontanea
∆G>0
Sistema all’equilibrio
∆G=0
Spontaneità ed effetto della Temperatura
∆G= ∆H-T∆S
Trasformazione spontanea
∆G<0
∆H>0
e
∆S>0
è spontanea ad alta
temperatura (T>∆H/∆S)
∆H<0
e
∆S<0
è spontanea a bassa
temperatura (T<∆H/∆S)
∆H>0
e
∆S<0
non è spontanea a
qualunque T
∆H<0
e
∆S>0
spontanea a qualunque T
∆H>0 e ∆S>0
Solido
∆H< 0 e ∆S<0
spontanei ad alta temperatura
Liquido
Vapore o
gas
spontanei a bassa temperatura