BIOLOGIA CELLULARE
19/10/05
MEMBRANE
Le membrane:
1 - Delimitano i contorni della cellula e i suoi diversi compartimenti interni, mantenendo le
differenze essenziali tra citosol e ambiente extracellulare.
2 - Sono siti di specifiche funzioni
3 - Contengono le proteine di trasporto per regolare il movimento di sostanze tra interno ed esterno
della cellula o tra i vari suoi organelli interni.
4- Contengono i recettori necessari per rivelare i segnali esterni
5- Forniscono dispositivi per la comunicazione cellula-cellula e per l’adesione cellulare
6- sono eterogenee
Alcune membrane devono essere più forti di altre, come ad esempio quelle dei lisosomi, dove il pH
al loro interno è più basso perché deve degradare le molecole e la membrana deve resistere alla
variazione di pH tra interno ed esterno.
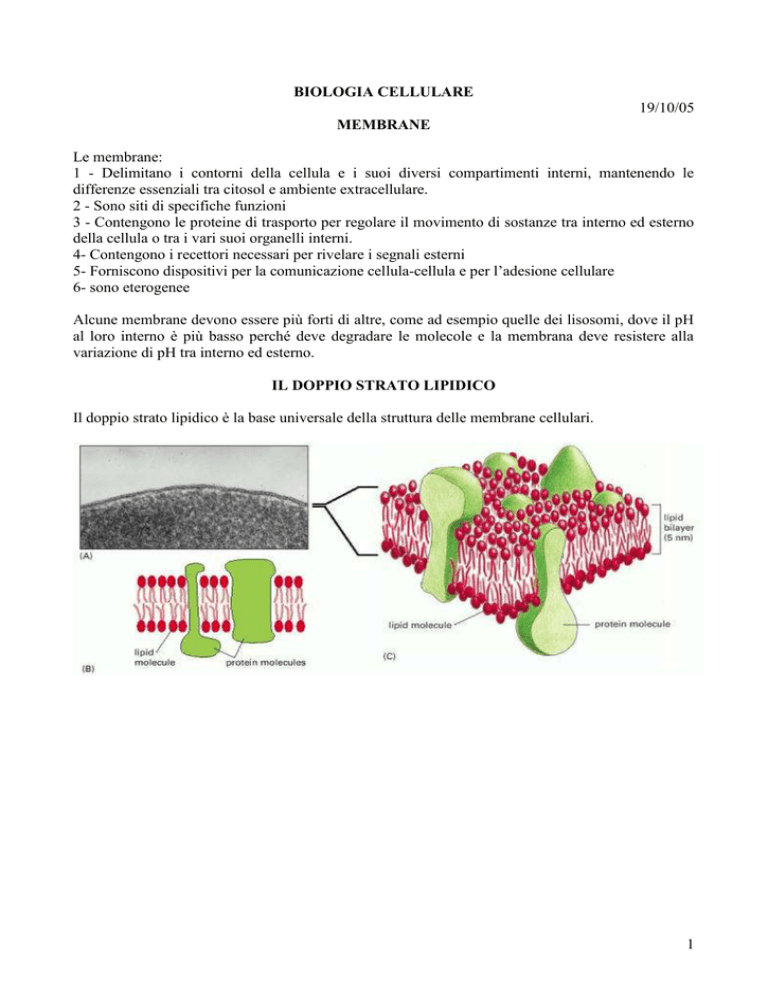
IL DOPPIO STRATO LIPIDICO
Il doppio strato lipidico è la base universale della struttura delle membrane cellulari.
1
Tutte le molecole lipidiche nelle membrane cellulari sono anfipatiche cioè, hanno un’estremità
idrofilica o polare e una idrofobica o apolare.
I lipidi di membrana più abbondanti sono i fosfolipidi. Essi hanno una testa idrofilica costituita da
Glicerolo + Fosfato, e due code idrocarburiche idrofobiche costituite da acidi grassi in genere con
uno o più doppi legami (code insature) che formano una barriera idrofobica per la diffusione dei
soluti polari. Lo spessore ottimale del doppio strato è di 6-8 nm.
Le molecole idrofiliche si dissolvono prontamente in acqua perché contengono gruppi carichi o
gruppi polari privi di carica che possono formare interazioni elettrostatiche favorevoli o legami a
idrogeno con molecole d’acqua. Le molecole idrofobiche invece sono insolubili in acqua perché
tutti, o quasi tutti i loro atomi sono privi di carica o non polari, non formando così interazioni
energeticamente favorevoli con molecole d’acqua. Le molecole fosfolipiche formano quindi forze
di Van der Waals tra loro.
Le molecole fosfolipidiche formano spontaneamente doppi strati in ambienti acquosi, dove le teste
idrofiliche sono a contatto con l’acqua su ciascuna superficie del doppio strato e le code idrofobiche
so dispongono all’interno. Per non avere bordi liberi, il doppio strato di richiude su se stesso,
formando un compartimento sigillato.
DOPPIO STRATO COME FLUIDO BIDIMENSIONALE
Nel 1970 i ricercatori riconobbero che singole molecole di lipidi sono capaci di diffondere
liberamente dentro i doppi strati lipidici. Preparando doppi strati lipidici sintetici, marcando con un
gruppo nitrossile, con un elettrone spaiato, si osservò tramite spettroscopia di risonanza elettronica
di spin (ESR) che le molecole migravano molto raramente da un lato all’altro del doppio strato
(flip-flop), mentre si muovevano diffondendosi lateralmente.
2
La fluidità di un doppio strato dipende dalla sua composizione e dalla sua temperatura. Un doppio
strato passa da uno stato liquido ad uno stato bidimensionale rigido cristallino (o gel) ad un punto di
congelamento caratteristico. Questo cambiamento di stato si chiama transizione di fase e la
temperatura a cui avviene è più bassa se le catene idrocarburiche sono corte o hanno doppi legami.
Una minore lunghezza riduce la tendenza delle code a interagire tra loro e i doppi legami cis
producono pieghe nelle catene che ne rendono più difficile il compattamento, così che la membrana
rimane fluida a temperature più basse.
Il doppio strato lipidico di molte membrane non è composto esclusivamente da fosfolipidi, ma
spesso contiene anche colesterolo e glicolipidi. Le membrane plasmatiche eucaristiche contengono
quantità particolarmente elevate di colesterolo.
COLESTEROLO
Le molecole di colesterolo aumentano le proprietà di barriera di permeabilità del doppio strato
lipidico. Esse si orientano nel doppio strato, con i gruppi ossidrilici vicino alle teste polari delle
molecole fosfolipidiche. In questa posizione, gli anelli steroidei rigidi a forma di piastra
interagiscono con quelle regioni delle code più vicine alle teste immobilizzandole. Impedisce così
alle code di interagire troppo e cristallizzare, inibendo perciò le transizioni di fase troppo brusche
3
Esistono quattro fosfolipidi principali che predominano nella membrana plasmatici di molte cellule:
- Fosfatidilcolina
- Fosfatidiletanolammina
- Fosfatidilserina
- Sfingomielina
Per le molecole sfingolipidiche, le forze attrattive possono essere abbastanza forti da tenere
temporaneamente assieme molecole adiacenti in piccoli microdomini chiamati zattere lipidiche.
Esse possono ospitare meglio certe proteine di membrana che, perciò tendono ad accumularsi al
loro interno. Così si pensa che esse aiutino a organizzare queste proteine, sia concentrandole per il
trasporto di piccole vescicole, sia rendendole capaci di svolgere insieme le loro funzioni.
ASIMMETRIA DELLA MEMBRANA
Le membrane sono asimmetriche. Ad esempio negli eritrociti, quasi tutte le molecole che hanno
colina (fosfatidilcolina e sfingomielina) sono nel monostrato esterno, mentre quasi tutte quelle che
contengono un gruppo amminico primario (fosfatidiletanolammina e fosfatidilserina) sono nel
monostrato interno. I lipidi di membrana sono solventi bidimensionali per le proteine di membrana
e regolano con la loro composizione la funzione delle proteine di membrana, che svolgono la
maggior parte delle funzioni.
GLICOLIPIDI
Sono le molecole con l’asimmetria più estrema sono quelle che contengono zuccheri chiamati
glicolipidi. Si trovano esclusivamente nel monostrato non citosolico del doppio strato, dove si pensa
si ripartiscano di preferenza in zattere lipidiche. I glicolipidi tendono ad associarsi tra loro in parte
tramite legami a idrogeno fra i loro zuccheri e in parte tramite forze di Van Der Waals fra le loro
lunghe e in parte insature code. Due tipi di glicolipidi sono:
- Cerebrosidi
- Gangliosidi
Sono abbondanti in cellule nervose (40%)
- Hanno un effetto protettivo sulle membrane apicali delle cellule epiteliali
- Danno isolamento elettrico alle cellule nervose (Mielina)
- Permettono l’adesione cellulare
In particolare il GM1 agisce da recettore di superficie per la tossina batterica del colera.
4
PROTEINE DI MEMBRANA
Queste proteine possono essere integrali o periferiche.
Le proteine integrali possono essere:
- Proteine transmembrana
- Proteine trattenute nel doppio strato da gruppi lipidici
- Proteine trattenute da legami particolarmente forti con altre proteine
Le proteine transmembrana sono anfipatiche, avendo regioni idrofobiche e idrofiliche. Le loro
regioni idrofobiche passano attraverso la membrana e interagiscono con le code idrofobiche delle
molecole lipidiche del doppio strato. Possono essere monopasso (1) o multipasso (1). Altre proteine
di membrana sono localizzate interamente nel citosol e sono associate con il monostrato citosilico
del doppio strato lipidico da una α elica antipatica esposta sulla superficie della proteina (4) o da
una o più catene lipidiche attaccate covalentemente (5).
Le proteine ancorate ai lipidi possono essere ancorate tramite ancore miristiliche o farnesilica:
Le proteine periferiche di membrana sono invece proteine di membrana che non si estendono
nell’interno idrofobico del doppio strato lipidico e sono invece attaccate a una delle facce della
membrana (7,8).
Soltanto le proteine transmembrana possono funzionare su entrambi i lati del doppio strato lipidico
5
o trasportare molecole attraverso di essa. Le proteine che funzionano su un solo lato del doppio
strato, sono spesso associate o con il monostrato lipidico o con un dominio proteico su quel lato.
I gruppi mercaptani non formano legami a ponte disolfuro all’interno della cellula
26/10/05
Analizzando la struttura primaria di una proteina si riesce a identificare le proteine di membrana,
perché se ci sono zone molto idrofobiche, quelle zone costituiscono l’α elica idrofobica che passa
attraverso il doppio strato lipidico.
6
GLICOCALICE
Le proteine di membrana di regola, non sporgono nude all’esterno della cellula. Sono decorate
invece da carboidrati, che rivestono tutte le cellule eucaristiche. Sono catene di oligosaccaridi legate
covalentemente alle proteine (glicoproteine) e lipidi (glicolipidi) di membrana
PROTEINE DEL GLOBULO ROSSO
Nel globulo rosso sono presenti
- Glicofarina (integrale monopasso)
- Banda 3 (integrale multipasso antiporto per scambio anionico Cl-/HCO3-)
- Spettrina, Anchirina, Banda 4.1 dentro la membrana
La più abbondante proteina nell’eritrocita è la spettrina, un bastoncino sottile e flessibile di 100
nm, componente principale del reticolo proteico (citoscheletro) sottostante alla membrana che
mantiene l’integrità strutturale e la forma biconcava.
Essa è un eterodimero che si associa assieme ad un altro eterodimero per formare un tetramero
lungo 200 nm.
Il citoscheletro di spettrina è attaccato alla membrana tramite la anchirina, che si lega sia alla
spettrina che al dominio citosolico delle proteina Banda 3. E’ anche legato da un altro meccanismo,
tramite la Banda 4.1. Essa si lega sia alla spettrina che all’actina, e al dominio citosolico della
Banda 3 e della Glicofarina.
DIFFUSIONE O2 E CO2 NEL SANGUE
Negli eritrociti, O2 e CO2 diffondono attraverso la membrana plasmatica in risposta alle
concentrazioni interne ed esterne della cellula. La diffusione si associa al trasporto passivo mediante
la Banda 3 che trasporta Bicarbonato e Cloro. Quando la CO2 entra dentro gli eritrociti, avviene la
reazione H2O + CO2 = HCO3- + H+ poiché la CO2 è poco solubile in acqua. Lo ione bicarbonato,
viene trasportato fuori dall’antiporto Banda 3 che per equilibrare la carica, importa ioni Cl-.
7
8
DIFFUSIONE PROTEINE DI MEMBRANA
Le proteine non attraversano in linea retta il doppio strato, ma ruotano attorno ad un asse
perpendicolare al piano del doppio strato (diffusione rotazionale). Inoltre molte proteine di
membrana si muovono lateralmente all’interno della membrana (diffusione laterale). Fondendo una
cellula di topo e una di uomo, producendo un eterocarionte, marcando due anticorpi per distinguere
proteine selezionate dalle due membrane, dopo essere rimaste per un certo periodo confinate nella
rispettivà metà dell’eterocarionte, le due serie di proteine si diffondevano su tutta la superficie
cellulare.
9
TRASPORTO DI MEMBRANA
A causa del suo interno idrofobica, il doppio strato lipidico delle membrane cellulari funge da
barriera al passaggio della maggior parte delle molecole polari. Questa funzione di barriera è
cruciale perché permette alla cellula di mantenere concentrazioni di soluti nel citosol che sono
diverse da quelle nel fluido extracellulare e in ciascuno dei compartimenti intracellulari racchiusi da
membrane.
- Assunzione di nutrienti (Glucosio)
- Regolazione concentrazione ionica (Na+, Ca++, H+)
- Eliminazione prodotti metabolici di rifiuto (CO2)
Piccole molecole non polari come O2 e CO2, si dissolvono rapidamente in doppi strati lipidici e
perciò diffondono rapidamente attraverso essi. Altre passano con una velocità diversa.
10
DIFFUSIONE SEMPLICE
Piccole molecole polari prive di carica, come acqua o urea, diffondono anch’esse attraverso un
doppio strato, anche se molto più lentamente. I doppi strati lipidici sono altamente impermeabili a
molecole cariche (ioni) non importa quanto piccole: l’alta carica e l’alto grado di idratazione
impedisce di entrare nella fase idrocarburica del doppio strato.
Nella cellula, si hanno ioni inorganici piccoli, proteine con delle cariche, molecole metaboliche
(Acidi liberi, Glucosio, Nucleotidi,…) con una loro carica. All’esterno si ha una carica totale che
bilancia la carica interna. La diffusione sposta i soluti verso l’equilibrio, e al minimo contenuto di
energia. Le molecole si muovono secondo il gradiente di concentrazione e, se ioni carichi, si
spostano secondo il gradiente elettrochimico. All’equilibrio non avviene più movimento perché
l’energia libera è minima.
OSMOSI
Movimento di acqua da una camera dove il soluto è più diluito, verso una camera dove il soluto è
più concentrato.
Se le cellule sono poste in una soluzione ipotonica (soluzione che ha una bassa concentrazione di
soluto con alta concentrazione di acqua) c’è un movimento netto di acqua all’interno delle cellule
che ne provoca il rigonfiamento e la lisi.
11
Se poste in soluzione ipertonica (soluzione che ha un’alta concentrazione di soluto e bassa
concentrazione di acqua), l’acqua fluisce all’estrerno delle cellule, raggrinzendole.
TRASPORTO PASSIVO O DIFFUSIONE FACILITATA
Per lasciar passare anche molecole polari come ioni, zuccheri, amminoacidi, nucleotidi e molti
metaboliti cellulari, servono delle proteine che riescano a trasportare questi da una parte all’altra del
doppio strato. Queste sono le proteine di trasporto, molto selettive.
Ci sono due tipi di proteine di trasporto di membrana, le proteine trasportatrici e le proteine canali.
Le proteine trasportatrici (o permeasi) si legano al soluto specifico da trasportare e subiscono
cambiamenti conformazionali per trasferire il soluto legato attraverso la membrana. Le proteine
canale invece interagiscono con il soluto da trasportare molto più debolmente. Formano pori
acquosi che si estendono attraverso il doppio strato e quando aperti, permettono il passaggio di
soluti specifici. Tutte le proteine canale e trasportatrici permettono ai soluti di passare la membrana
soltanto passivamente, ovvero mediante diffusione facilitata.
- Se la molecola è priva di carica, il trasporto è spinto dal gradiente di concentrazione, che
determina la sua direzione.
- Se il soluto ha una carica netta, il trasporto è influenzato sia dal gradiente di concentrazione che
dalla differenza di potenziale elettrico (potenziale di membrana). Questo è il gradiente
elettrochimico.
La diffusione facilitata non ha nessun consumo di energia.
12
31/10/05
TRASPORTO ATTIVO
Determina il movimento dei soluti lontano dall’equilibrio termodinamico e quindi richiede energia.
E’ termodinamicamente sfavorevole (endoergonico) e si verifica quando è accoppiato a un processo
esoergonico.
- Rende possibile l’assorbimento di sostanze nutritive dell’ambiente, anche quando le loro
concentrazioni sono basse rispetto a quelle dentro la cellula.
- Permette la rimozione di sostanze metaboliche di rifiuto, quando la loro concentrazione all’esterno
è più alta che nella cellula.
- Consente alla cellula di mantenere le concentrazioni intracellulari di ioni specifici tra cui Potassio,
Sodio, Calcio e Idrogeno, in una situazione si squilibrio, bilanciando l’effetto del trasporto passivo.
Le cellule svolgono il trasporto attivo in due modi:
1- Trasportatori accoppiati che accoppiano il trasporto attivo a quello passivo.
2- Pompe spinte da ATP che accoppiano il trasporto attivo all’idrolisi di ATP
1- TRASPORTO ACCOPPIATO
Comporta o il trasferimento di un singolo soluto da un lato della membrana all’altro (uniporti)
simultaneo di un secondo soluto nella stessa direzione (simporti) o il trasferimento di un secondo
soluto nella direzione opposta (antiporti).
POMPA Na+ - K+
E’ un antiporto che porta 3 ioni di sodio all’esterno e fa entrare due ioni potassio. Siccome la
concentrazione di potassio è 10-20 volte più alta dentro la cellula rispetto all’esterno, per pompare il
potassio all’interno e il sodio all’esterno, usa un terzo dell’energia creata dalla cellula.
13
Poiché essa idrolizza ATP per pompare sodio fuori e potassio dentro, è nota anche come ATPasi
Na+ - K+.
Il cambiamento conformazionale dell’ATPasi (Allosterico) è dovuto al gruppo fosfato. Il gradiente
elettrochimico tenderebbe a far entrare acqua nella cellula, dato che lo ione sodio tende ad entrare
nella cellula, bilanciando lo squilibrio di cariche e portando l’acqua ad entrare. La Ouabaina blocca
questa ATPasi.
POMPA Ca2+
Anche questa è una ATPasi presente nella membrana plasmatici e nel reticolo sarcoplasmatico dei
muscoli striati. Le cellule eucariotiche mantengono una concentrazione molto bassa di Ca2+ nel
citosol (10-7M) contro le grandi concentrazioni esterne (10-3M).
14
Essa funge da deposito intracellulare di ioni Ca2+. Quando un potenziale d’azione depolarizza la
membrana della cellula muscolare, Ca2+ viene rilasciato dal reticolo sarcoplasmatico attraverso i
canali di rilascio di Ca2+ nel citosol, stimolando il muscolo a contrarsi. All’esterno della cellula esso
serve per l’aggancio delle proteine alla cellula.
POMPA H+ o ATP SINTETASI
Presente sulla membrana interna del mitocondrio. Accoppia le energie del gradiente elettrochimico
protonico e dei legami chimici, trasformando il flusso di protoni in sintesi di ATP.
L’ATP sintasi ha una doppia polarità.
- Idrolizza ATP e pompa ioni H+ nello spazio intermembrana del mitocondrio.
- Utilizza il flusso di protoni dallo spazio intermembrana per produrre ATP e nonostante tutto,
produce la maggior parte dell’ATP della cellula.
15
FIBROSI CISTICA
Difetto genetico di una proteina di trasporto sulla membrana plasmatici. Le cellule CF presentano
un difetto nella secrezione degli ioni Cl-.
Nelle cellule normali c’è secrezione di Cl- in risposta al cAMP. Il passaggio di Cl- verso il lume
forza il passaggio degli ioni Na+ e quello dell’acqua, per effetto della pressione osmotica =
fluidificazione del muco.
Nelle cellule CF il passaggio di Cl- verso il lume è bloccato dalla mancanza della proteina di
trasporto = ispessimento del muco infezioni batteriche.
Il gene difettivo nelle CF codifica per una proteina definita: regolatore della conduttanza
transmembrana nella fibrosi cistica (CTRF gene). E’ una proteina multipasso con due estesi domini
intracellulari, che legano ATP e fungono da domini regolatori. Ci sono 600 mutazioni che ne
impediscono la translocazione in membrana nella Fibrosi Cistica.
16
TRASPORTO ATTIVO INDIRETTO DI GLUCOSIO
Il Glucosio viene trasportato all’interno della membrana come trasporto attivo indiretto accoppiato
alla ATPasi Na+/K+. Nelle cellule epiteliali coinvolte nell’assorbimento di nutrienti, i simporti
collegati a Na+ posti nel dominio apicale, trasportano attivamente nutrienti dentro la cellula,
formando gradienti di concentrazione per questi soluti.
Il processo di trasporto del Glucosio, avviene contro gradiente e perciò sarebbe endoergonico, ma è
sostenuto dal flusso esoergonico del Na+, stabilito a sua volta dalla ATPasi Na+/K+
17
CANALI IONICI E PROPRIETA’ ELETTROCHIMICHE DI MEMBRANA
La funzione dei canali ionici è quella di permettere a ioni inorganici specifici di diffondere
rapidamente lungo i loro gradienti elettrochimici attraverso il doppio strato. Essi mostrano una
selettivià ionica per cui solo determinati possono passare e inoltre, non sono sempre aperti. Sono
provvisti di un cancello che permette loro di aprirsi brevemente e di richiudersi.
I tipi principali di stimoli noti che provocano l’apertura dei canali ionici sono:
- un cambiamento di voltaggio attraverso la membrana (canali voltaggio dipendenti): responsabili
dell’eccitabilità elettrica e mediatori dei segnali elettrici nel SN. Sono presenti su tutti i tipi di
cellule. Quelli più comuni sono i canali del K+, perché permettono di avere il potenziale di
membrana. Le cellule hanno un potenziale di membrana a riposo Vm, dovuto a una maggiore
positività sul lato esterno e una minore negatività sul lato interno.
- uno stress meccanico (canali regolati meccanicamente),
- l’attacco di un ligando (canali regolati da ligando)
CANALI DEL K+
I canali del K+ equilibrano le perdite di ioni Na+ nel citoplasma dovuti alla ATPasi Na+-K+. Con
questi canali, K+ raggiunge quasi l’equilibrio, in cui una forza elettrica esercitata da un eccesso di
cariche negative che attraggono K+ dentro la cellula, bilancia la tendenza di K+ a uscire fuori lungo
il suo gradiente di concentrazione.
La membrana contiene canali del K+ detti a perdita (K+ leak channels) da cui il K+ defluisce,
lasciandosi così dietro una carica negativa non bilanciata e creando un campo elettrico a potenziale
di membrana.
CELLULE NERVOSE
Le cellule nervose e dei muscoli scheletrici possono subire una depolarizzazione della membrana,
spostando il potenziale ad un valore meno negativo. Questa causa un’apertura dei canali del Na+
voltaggio dipendenti, lasciando entrare una piccola quantità di Na+ nella cellula lungo il suo
gradiente elettrochimico. L’influsso di cariche positive depolarizza ulteriormente la membrana,
aprendo così altri canali del Na+ che fanno entrare altri ioni Na+. Quando la forza elettrochimica che
spinge il flusso di Na+ è quasi zero, la cellula, essendo i canali del Na+ aperti instabili, si inattivano
automaticamente, chiudendosi anche se la membrana è polarizzata. I canali del Na+ possono perciò
essere in tre stati distinti: aperti, chiusi e inattivi.
18
Nei muscoli scheletrici, la depolarizzazione apre temporaneamente i canali del Ca++ voltaggio
dipendenti. Poiché la concentrazione di Ca++ fuori dalla cellula è maggiore che all’interno, entra
nella terminazione nervosa. L’aumento di ioni Ca++ nel citosol scatena la fusione delle vescicole
sinaptiche contenenti acetilcolina, un trasmettitore eccitatore.
L’acetilcolina rilasciata si lega ai recettori dell’acetilcolina della membrana plasmatici della cellula
muscolare, aprendo temporaneamente i canali del Na+, che provoca una depolarizzazione della
membrana.
La depolarizzazione locale apre canali del Na+ voltaggio dipendenti permettendo l’ingresso di
ulteriore Na+ e la depolarizzazione si autopropaga.
La depolarizzazione generalizzata della membrana attiva i canali del Ca++ voltaggio dipendenti in
regioni specializzate.
Ciò provoca l’apertura temporanea dei canali di rilascio del Ca++ in una regione adiacente della
membrana del reticolo sarcoplasmatico e il rilascio del Ca++ immagazzinato nel reticolo nel citosol.
Questi sono segnali rapidi, molto più veloci di quelli mediati dai neurotrasmettitori che si associano
a recettori legati a proteine G.
19
02/11/05
COMPARTIMENTI INTRACELLULARI E SMISTAMENTO DELLE PROTEINE
Nella cellula ci sono:
- Nucleo: contiene il menoma principale ed è il sito per la sintesi di DNA e RNA.
- Citoplasma: composto da citosol e organelli vari.
- Reticolo Endoplasmatico (ER): ha molti ribosomi (ER rugoso) impegnati nella sintesi di proteine
solubili e integrali di membrana, la maggior parte delle quali destinata o per altri organelli o per la
secrezione.
- L’apparato di Golgi: consiste in pile organizzate in a forma di disco chiamate Cisterne del Golgi.
Riceve lipidi e proteine dall’ER e le invia a varie destinazioni, in genere modificandole
covalentemente durante il passaggio.
- Mitocondri: generano la maggior parte dell’ATP usato dalla cellula.
- Lisosomi: contengono enzimi digestivi che degradano organelli intracellulari morti
REAZIONI TOPOLOGICHE DEGLI ORGANELLI
La natura dei Mitocondri e la stretta somiglianza di questi con alcuni batteri odierni, suggerisce che
essi si siano evoluti da batteri che sono stati inglobati da altre cellule con le quali vivevano all’inizio
in simbiosi.
La membrana nucleare si pensa sia una invaginazione della membrana plasmatici. Si distinguono
quattro grandi famiglie:
1- Nucleo e Citosol, che comunicano attraverso pori nucleari e sono continui
2- Tutti gli organelli che agiscono nelle vie secretoria e endocitica (ER, Golgi, Endosomi, Lisosomi,
Vescicole di trasporto).
3- Mitocondri
4- Plastidi (solo nei vegetali).
20
MOVIMENTO DELLE PROTEINE
Tutte le proteine iniziano con l’essere sintetizzate sui ribosomi nel citosol, eccetto quelle poche che
sono sintetizzate sui ribosomi nei mitocondri. Il loro destino dipende dalla loro sequenza
amminoacidica,che può contenere segnali di smistamento che dirigono la loro consegna verso
posizioni esterne al citosol.
1- TRASPORTO ATTRAVERSO I PORI: il traffico delle proteine fra citosol e nucleo avviene
tra spazi topologicamente equivalenti, che sono in continuità attraverso i complessi dei pori
nucleari, che fungono da cancelli selettivi.
2- TRASPORTO TRANSMEMBRANA: proteine translocatrici legate alla membrana
trasportano direttamente proteine specifiche attraverso una membrana dal citosol in uno spazio che
è topologicamente distinto.
3- TRASPORTO VESCICOLARE: Intermedi di trasporto racchiusi da membrana, che possono
essere piccole vescicole sferiche di trasporto, traghettano le proteine da un compartimento all’altro.
21
SEQUENZE SEGNALE E ZONE SEGNALE
Ci sono almeno due tipi di segnali di smistamento nelle proteine.
Un tipo si trova in un tratto continuo di sequenza di amminoacidi, o alla fine o all’inizio di una
catena polipeptidica.
L’altro tipo consiste in una disposizione tridimensionale specifica di atomi sulla superficie della
proteina che si forma quando questa si ripiega. I residui di amminoacidi che compongono la zona
segnale possono essere distinti l’uno dall’altro nella sequenza lineare della proteina.
TRASPORTO MOLECOLE FRA NUCLEO E CITOSOL
L’involucro nucleare racchiude il DNA e definisce il compartimento nucleare. Questo involucro
consiste di due membrane concentriche che sono penetrate da complessi di pori nucleari. La
membrana nucleare interna contiene proteine specifiche che agiscono da siti di attacco per la
cromatina e per il reticolo di proteine della lamina basale che fornisce supporto strutturale a questa
membrana. La membrana esterna è in continuità con quella dell’ER.
Un traffico bidirezionale scorre continuamente fra il citosol e il nucleo. Le molte proteine che
agiscono sul nucleo – compresi istoni, DNA e RNA polimerasi, proteine che regolano i geni e
proteine che elaborano l’RNA – sono importate selettivamente nel compartimento nucleare dal
citosol, dove sono prodotte. Contemporaneamente, tRNA e mRNA sono sintetizzati nel
compartimento nucleare e quindi esportati nel citosol.
22
PORI NUCLEARI
Ciascun complesso di pori nucleari contiene uno o più canali acquosi aperti attraverso i quali
piccole molecole solubili in acqua possono diffondere passivamente. Le piccole molecole passano
talmente velocemente che il poro può essere considerato permeabile ad esse. Il complesso ha
quattro unità strutturali. Subunità a colonna, che formano la massa principale della parete del poro,
subunità anulari che estendono raggi verso il centro del poro, subunità luminali, che contengono
proteine transmembrana che ancorano il complesso alla membrana nucleare e subunità ad anello
che formano le facce citosoliche e nucleari del complesso. Delle fibrille sporgono sia dal lato
citosolico che da quello nucleare dove convergono a formare canestri.
Le proteine più grandi vengono importate attraverso i pori in conformazione ripiegata, e i peptidi
segnale non vengono tagliati via poiché c’è una necessità di esporto/importo frequente.
I pori possono essere allargati aumentando la grandezza della proteina, che può entrare consumando
ATP grazie ad alcuni fattori in grado di allargarli.
23
RETICOLO ENDOPLASMATICO
L’ER è organizzato in un labirinto reticolare di tubuli ramificati e sacchi appiattiti chiusi. Questi
spazi chiusi sono chiamati lume dell’ER. L’ER cattura proteine selezionate dal citosol mentre queste
vengono sintetizzate. Queste proteine sono di due tipi: proteine transmembrana, traslocate solo
parzialmente attraverso la membrana e proteine solubili in acqua, completamente traslocate
attraverso la membrana dell’ER e sono rilasciate nel lume. I ribosomi attaccati alla membrana
dell’ER sono impegnati nella sintesi di proteine che stanno contemporaneamente traslocando
nell’ER.
PARTICELLA DI RICONOSCIMENTO DEL SEGNALE IN PROTEINE SOLUBILI
La sequenza segnale dell’ER è guidata alla membrana dell’ER da almeno due componenti: una
particella di riconoscimento del segnale (SRP) che fa la spola tra la membrana dell’ER e il citosol
e si lega alla sequenza segnale, e un recettore SRP nella membrana dell’ER.
La SRP si lega alla sequenza segnale dell’ER non appena il peptide è emerso dal ribosoma. Ciò
provoca una pausa nella sintesi proteica. La pausa dà al ribosoma il tempo per legarsi alla
membrana dell’ER prima che la sintesi della catena sia completa, assicurando così che la proteina
24
non venga rilasciata nel citosol. Il complesso SRP-ribosoma si lega al recettore SRP, che è una
proteina integrale di membrana esposta solo nella superficie citosolica dell’ER rugoso. Il complesso
SRP-ribosoma-rcettore porta a un traslocatore che trasloca la proteina sintetizzata nel lume, mentre
la SRP e il recettore vengono rilasciati.
La sequenza segnale N-terminale dell’ER è rimossa da una peptidasi del segnale sul lato luminale
della membrana. La sequenza segnale non è però sufficiente per il taglio del segnale da parte della
peptidasi, che richiede un sito di taglio adiacente che è riconosciuto specificatamente dalla
peptidasi. La sequenza segnale N-terminale dirige la proteina alla membrana dell’ER e serve da
segnale di inizio di trasferimento che apre il poro. Dopo essere stata tagliata dalla peptidasi essa
rimane attaccata al traslocatore mentre il resto della proteina viene fatto passare attraverso la
membrana come un’ansa. Una volta arrivati al C terminale, la sequenza segnale viene degradata.
25
PROTEINE TRANSMEMBRANA A SINGOLO PASSAGGIO
Una sequenza segnale N-terminale inizia la traslocazione, ma un segmento idrofobica addizionale
nella catena polipeptidica ferma il processo di trasferimento prima della intera traslocazione della
catena polipeptidica. Questo segnale di stop del trasferimento ancora la proteina nella membrana
dopo che la sequenza del segnale dell’ER è stata rilasciata dal traslocatore ed è stata tagliata via.
Se ci sono più amminoacidi carichi positivamente che precedono il nucleo idrofobico della
sequenza di inizio del trasferimento l’orientamento sarà come in (A), con l’N-terminale nel citosol e
il C-terminale nel lume.
Se ci sono amminoacidi carichi positivamente che seguono il nucleo idrofobico della sequenza di
inizio del trasferimento l’orientamento sarà come in (B), con l’N-terminale nel lume e il Cterminale nel citosol.
26
PROTEINE TRANSMEMBRANA MULTIPASSO
La catena polipeptidica passa avanti e indietro ripetutamente attraverso il doppio strato lipidico. La
sequenza segnale interna serve da segnale di inizio del trasferimento in queste proteine per iniziare
la traslocazione, sino alla sequenza di stop del trasferimento.
Nelle proteine multipasso, una seconda sequenza di inizio del trasferimento inizia di nuovo la
traslocazione più a valle lungo la catena fino a che la sequenza di stop non causa il rilascio del
polipeptide, e così via.
TRASPORTO DI PROTEINE NEI MITOCONDRI
Nei mitocondri ci sono due sottocompartimenti: lo spazio della matrice interno e lo spazio
intermembrana.
La traslocazione delle proteine attraverso le membrane mitocondriali è mediata da complessi
proteici che fungono da traslocatori di proteine: il complesso TOM svolge la sua funzione
attraverso la membrana esterna e il TIM23 e TIM22 attraverso quella interna.
Nella traslocazione viene usata la Chaperonina hsp70 (Heat-Shock protein 70) per favorire
l’ingresso della proteina attraverso il doppio compartimento di membrana.
1 -La hsp70 citosolica attaccata è rilasciata dalla proteina in un passaggio che dipende da idrolisi di
ATP. Dopo l’inserzione iniziale della sequenza segnale e di porzioni adiacenti della catena
polipeptidica nel complesso TOM, la sequenza segnale interagisce con un complesso TIM
2 -La sequenza segnale è quindi traslocata nella matrice in un processo che richiede un gradiente
elettrochimico di H+ attraverso la membrana interna, posizionando la catena polipeptidica non
ripiegata in modo che attraversi transitoriamente entrambe le membrane.
3 -La hsp70 mitocondriale si lega a regioni della catena polipeptidica man mano che queste
vengono esposte nella matrice, tirando così la proteina nella matrice. L’idrolisi di ATP rimuove
quindi la hsp70 mitocondriale, permettendo alla proteina importata di ripiegarsi.
27
03/11/05
TRAFFICO VESCICOLARE INTRACELLULARE
Le cellule eucariotiche assumono macromolecole mediante endocitosi e di portarli ad enzimi
digestivi, o di regolare il trasporto di queste all’interno della cellula. La via biosintetica-secretoria
permette di modificare le molecole che produce e di conservarle sino a che non devono essere
trasportate all’esterno mediante esocitosi.
Nel lume dell’ER ci sono comunicazioni costanti tra i compartimenti, mediante unità di trasporto, le
vescicole di trasporto.
Le vescicole gemmano da una membrana e si fondono con un’altra in continuazione, trasportando
componenti di membrana e molecole solubili.
La maggior parte delle vescicole di trasporto si formano da regioni specializzate rivestite delle
membrane. Esse gemmano come vescicole di rivestimento che hanno una gabbia caratteristica di
proteine che ne ricopre la superficie citosolica. Il rivestimento concentra proteine specifiche di
membrana in una zona specializzata e, l’assemblaggio in reticoli curvi a forma di canestro deforma
la zona della membrana e modella le vescicole, rendendole uniformi. Un tipo di vescicole sono le
vescicole rivestite di clatrina.
28
Ciascuna subunità di clatrina consiste in tre catene polipeptidiche grandi e tre piccole, che formano
una struttura a tre gambe, il trischelio. Esso si assembla assieme ad altri formando fosse rivestite
sulla superficie citosolica e delle membrane. Una seconda proteina principale di rivestimento nelle
vescicole con clatrina, è l’adattina, necessaria sia per attaccare il rivestimento di clatrina alla
membrana che per intrappolare varie proteine transmembrana, compresi i recettori transmembrana
che catturano molecole cargo solubili dentro la vescicola.
Al crescere del rivestimento della gemma rivestita di clatrina, proteine citoplasmatiche solubili, tra
cui la dinamina, si assemblano ad anello intorno al colletto della gemma. La dinamina è una
GTPasi, che porta i foglietti citosolici vicini sino a fonderli, staccando la vescicola dalla membrana.
Una volta rilasciata, la clatrina viene rapidamente perduta, mediante una hsp70 che funge da
ATPasi rimuovendo il rivestimento.
29
PROTEINE SNARE E GTPASI DI INDIRIZZAMENTO GUIDANO IL TRASPORTO DI
MEMBRANA
Per assicurare che il traffico proceda in modo ordinato, le vescicole di trasporto devono essere
altamente selettive nel riconoscere la corretta membrana bersaglio in cui fondersi. L’indirizzamento
è assicurato perché tutte le vescicole hanno marcatori di superficie che le identificano, mentre le
membrane bersaglio hanno ricettori a loro complementari. Questo controllo è dato proteine SNARE
e GTPasi di indirizzamento (Rab).
Ci sono SNARE della membrana vescicolare (v-SNARE) e SNARE della membrana bersaglio
(t-SNARE).
Serie complementari di v-SNARE e t-SNARE contribuiscono alla selettività di attracco e fusione
della vescicola. Le v-SNARE sono assieme alle proteine di rivestimento durante la gemmazione e si
legano a t-SNARE complementari. Dopo la fusione le v- e t-SNARE restano associate in un
complesso che deve essere dissociato per permettere alle t-SNARE di accettare una nuova
vescicola. V-SNARE diverse possono essere impacchettate con molecole cargo diverse e così
queste saranno portate a t-SNARE diverse e cioè a membrane bersaglio diverse.
TRASPORTO DALL’ER ATTRAVERSO L’APPARATO DI GOLGI
Le proteine di nuova sintesi entrano nella via biosintetica-secretoria nell’ER attraversando la
membrana dell’ER dal citosol. Esse poi passano attraverso una serie di compartimenti mediante
vescicole di trasporto che le muovono al compartimento successivo o recuperano proteine sfuggite
riportandole indietro.
Dopo che le vescicole di trasporto sono gemmate da un sito di uscita dell’ER hanno perso il loro
rivestimento, iniziano a fondersi fra loro. Questa fusione di membrane dello stesso compartimento
si chiama fusione omotipica, diversa da quella eterotipica. Le strutture formate quando le vescicole
fondono fra loro, si chiamano gruppi vescicolari tubulari, che costituiscono un nuovo
compartimento separato dall’ER. Questi iniziano a gemmare vescicole a loro volta. Queste
vescicole rivestite di COPI riportano indietro all’ER proteine residenti che sono sfuggite, oltre a
proteine coinvolte nella gemmazione che devono essere riportate indietro.
30
Durante il passaggio delle molecole attraverso l’apparato di Golgi, esse subiscono modificazioni.
Ciascuna pila del Golgi ha due facce distinte. La faccia cis e quella trans. Si formano così il reticolo
del Golgi cis (CGN) e quello trans (TGN). Le proteine e i lipidi entrano nel reticolo cis in gruppi
vescicolari tubolari ed escono dal trans verso la superficie cellulare o altri compartimenti.
TRASPORTO DAL RETICOLO DEL GOLGI TRANS AI LISOSOMI
I lisosomi contengono enzimi idrolitici, di circa 40 tipi, tutte idrolisi acide che richiedono un
ambiente acido, fornito dal lisosoma. Le proteine di trasporto in questa membrana permettono ai
prodotti finali di essere trasportati al citosol. Una pompa H+ nella membrana lisosomale usa energia
fornita da ATP per pompare H+ nel lisosoma mantenendo il pH a 5,0.
31
TRASPORTO NELLA CELLULA DALLA MEMBRANA PLASMATICA: ENDOCITOSI
Le vie che portano dalla superficie della membrana cellulare ai lisosomi iniziano il processo con
l’endocitosi, per cui le cellule assumono macromolecole, sostanze particolate, e, in casi speciali,
altre cellule. In questo processo, il materiale da ingerire è progressivamente avvolto da una piccola
porzione della membrana plasmatica, che prima si invagina e quindi si distacca formando una
vescicola endocitica che contiene le sostanze ingerite. Ci sono due vie di endocitosi, la fagocitosi e
la pinocitosi.
FAGOCITOSI
La fagocitosi è una forma speciale di endocitosi in cui grosse particelle come microrganismi e
cellule morte sono ingerite tramite grosse vescicole endocitiche chiamate fagosomi. Nei mammiferi
tre classi di globuli bianchi agiscono da fagociti: macrofagi, neutrofili e cellule dendritiche.
I fagociti hanno una varietà di recettori specializzati di superficie che sono uniti covalentemente al
macchinario fagocitico della cellula. La fagocitosi è un processo che viene attivato da recettori che
trasmettono segnali all’interno della cellula e iniziano la risposta. I segnali di attivazione meglio
caratterizzati sono gli anticorpi.
Sono state classificate varie classi di recettori che promuovono la fagocitosi. Alcuni riconoscono i
componenti del complemento, altri riconoscono direttamente oligosaccaridi sulla superficie di certi
microrganismi.
PINOCITOSI
Tutte le cellule eucariotiche ingeriscono continuamente pezzi ingeriti della loro membrana
plasmatica sotto forma di piccole vescicole pinocitiche (endocitiche) che sono più tardi riportate
sulla superficie cellulare. La stessa quantità di membrana che viene rimossa per endocitosi viene
aggiunta alla cellula per esocitosi. La parte endocitica del ciclo inizia nelle fosse rivestite di clatrina.
Queste regioni specializzate occupano il 2% della membrana . Essa si invagina nella cellula e si
distacca formando una vescicola rivestita di clatrina.
ENDOCITOSI MEDIATA DA RECETTORE
Nella maggior parte delle cellule animali, le fosse e le vescicole rivestite di clatrina, forniscono una
via efficiente per l’assunzione di macromolecole specifiche dal fluido extracellulare. Le
macromolecole si attaccano a recettori transmembrana complementari, si accumulano in fosse
rivestite ed entrano nella cellula come complessi in vescicole rivestite di clatrina.
Un esempio di sostanza ingerita dalla cellula per endocitosi mediata da recettore, è il colesterolo,
che serve per assemblare la membrana.
La maggior parte del colesterolo è trasportata dal sangue come esteri del colesterolo, sotto forma di
particelle note come lipoproteine a bassa densità (LDL) e li inserisce nella membrana plasmatica.
Una volta nella membrana, i recettori delle LDL diffondono fino ad associarsi con fosse rivestite di
clatrina che si stanno formando. Qualunque particella di LDL attaccata a recettori LDL nelle fosse
viene continuamente internalizzata in vescicole.
32
Dopo aver perso il rivestimento di clatrina, le vescicole portano il loro contenuto agli endosomi
precoci, posti vicino alla periferia cellulare. Con il basso pH degli endosomi, le LDL si staccano dal
loro recettore e sono portate ai lisosomi. Lì gli esteri del colesterolo sono idrolizzatia colesterolo
libero, disponibile per la sua funzione.
Se in una cellula si accumula troppo colesterolo libero, la cellula spegne sia la sintesi di colesterolo
che la sintesi di recettori LDL. Questa via non funziona in individui che ereditano geni che
codificano recettori LDL difettosi. Gli alti livelli di colesterolo nel sangue predispongono questi
individui a sviluppare prematuramente aterosclerosi giovanile, morendo di infarto cardiaco. I
recettori possono essere presenti in quantità normali, ma non riescono a localizzarsi nelle zone
rivestite di clatrina. Esse non vengono internalizzate.
ENDOSOMI PRECOCI
Gli endosomi precoci formano un compartimento che agisce da stazione principale di smistamento
nella via endocitica, proprio come i reticoli cis e trans del Golgi. Molti recettori internalizzati
nell’endosoma cambiano la loro conformazione e rilasciano i ligando. I destini dei recettori possono
essere:
1- Riciclaggio ritornando allo stesso dominio della membrana plasmatica da cui deriva
2- Procedono fino a un dominio diverso della membrana, mediando la transcitosi.
3- Proghediscono fino ai lisosomi dove vengono degradati.
Il recettore LDL segue la prima via. Si dissocia dalle LDL nell’endosoma precoce e viene riciclato
nella membrana plasmatica.
33
TRASPORTO DAL RETICOLO DEL GOLGI TRANS ALL’ESTERNO DELLA
CELLULA: ESOCITOSI
La fusione delle vescicole di trasporto formatisi nel TGN con la membrana plasmatica si chiama
esocitosi. In questo modo le cellule producono e secernono i proteoglicani e glicoproteine della
matrice extracellulare.
L’esocitosi è una via secretoria costituitiva. Cellule secretorie specializzate dispongono però di
una seconda via secretoria, dove i materiali vengono conservati in vescicole secretorie per il
successivo rilascio. Questa è la via secretoria regolata, presente soprattutto in cellule specializzate
per la secrezione rapida a richiesta di prodotti.
Ci sono almeno tre classi di proteine che devono essere smistate, uscenti dal Golgi trans.
- quelle destinate ai lisosomi (tramite endosomi precoci)
- quelle destinate a vescicole secretorie
- quelle destinate al trasporto immediato alla superficie
34
La maggior parte delle altre proteine sono trasportate direttamente alla superficie cellulare dalla via
secretoria costitutiva non selettiva. Poichè l’ingresso in questa via non richiede un segnale
particolare, essa si chiama via di default.
04/11/05
COMUNICAZIONE CELLULARE
Regola lo sviluppo e l’organizzazione dei tessuti, controlla la crescita e la divisione cellulare, la loro
sopravvivenza e coordina le diverse attività cellulari. Ci sono quattro tipi di segnalazione, la
segnalazione paracrina, la segnalazione sinaptica, la segnalazione endocrina e la segnalazione
autocrina.
35
SEGNALAZIONE PARACRINA
Le molecole secrete sono trasportate in molecole bersaglio vicine. Questa segnalazione a corto
raggio non è però sufficiente per un organismo multicellulare.
SEGNALAZIONE SINAPTICA
Avviene nelle cellule nervose e organi bersaglio.
SEGNALAZIONE ENDOCRINA
Le cellule endocrine secernono le loro molecole segnale, chiamate ormoni, nel torrente sanguigno,
che porta il segnale alle cellule bersaglio distribuite in tutto il corpo.
SEGNALAZIONE AUTOCRINA
Le cellule possono anche mandare segnali ad altre cellule dello stesso tipo, oltre che a se stesse. In
questa segnalazione autocrina, una cellula secerne molecole segnale che possono legarsi ai propri
recettori. Questa è più efficace quando eseguita simultaneamente da cellule vicine dello stesso tipo
Le cellule si autostimolano, come le cellule tumorali.
36
TIPI DI MOLECOLE SEGNALE
Ci possono essere due tipi di molecole segnale:
- Molecole idrosolubili: non possono attraversare la membrana plasmatica (neurotrasmettitori).
- Molecole liposolubili: Ormoni steroidei e tiroidei che attraversano il doppio strato lipidico.
Nelle cellule ci sono recettori specifici per le molecole segnale, legandosi a loro con alta affinità per
basse concentrazioni e con bassa affinità con elevate concentrazioni.
Una singola cellula è esposta a centinaia di segnali diversi. Essa deve rispondere a questi segnali
selettivamente, secondo il proprio carattere specifico. La cellula di un animale complesso è anche
programmata per dipendere da una combinazione specifica di segnali per sopravvivere. Quando è
privata di essi, attiva un programma suicida = apoptosi.
Ogni cellula ha un proprio set di recettori. Le molecole idrofiliche hanno i recettori sulla membrana,
mentre le lipofiliche gli hanno intracellulari. L’interazione tra le molecole segnale e i loro recettori
impone cambiamenti conformazionali ai recettori che subiscono cambiamenti allosterici.
1- Molecola segnale + recettore (cambiamento allosterico)
2- Attivazione della segnalazione
3- Risposte intracellulari che possono:
- modificare il metabolismo
- attivare trascrizione genica.
37
RECETTORI DI SUPERFICIE
I recettori di superficie funzionano da trasduttori del segnale. Convertono un evento di attacco di un
ligando extracellulare che alterano il comportamento della cellula bersaglio.
Recettori a canali ionici: sono coinvolti nella segnalazione sinaptica rapida fra cellule eccitabili
elettricamente, mediata da neurotrasmettitori che aprono temporaneamente un canale ionico. Sono
proteine transmembrana multipasso.
Recettori collegati a proteine G: agiscono indirettamente nella regolazione dell’attività di una
proteina bersaglio. L’interazione fra bersaglio e recettore è mediata da una proteina G (che lega
GTP).
Recettori collegati a enzimi: o agiscono direttamente come enzimi o sono indirettamente associati
ad enzimi che attivano.
PROTEINE DI SEGNALAZIONE INTRACELLULARI
I segnali ricevuti alla superficie di una cellula da recettori collegati a proteine G o enzimi, sono
trasmessi all’interno da una combinazione di piccole e grandi molecole di segnalazione
intracellulari, chiamate piccoli mediatori intracellulari (secondi messaggeri). Possono essere:
1- Proteine di trasmissione = passano il messaggio al componente successivo
2- Proteine messaggero = portano il segnale da una parte all’altra della cellula
3- Proteine adattatrici = collegano proteine di segnalazione diverse
38
4- Proteine amplificatrici = enzimi o canali ionici che aumentano il segnale ricevuto (cascata di
segnalazione).
5- Proteine trasduttrici = convertono il segnale in forme diverse
6- Proteine di biforcazione = diffondono il segnale in diverse vie di segnalazione
7- Proteine integratrici = integrano diversi segnali ricevuti
8- Proteine latenti che regolano geni = attivate alla superficie cellulare da recetori attivati, che
migrano nel nucleo per stimolare la trascrizione di geni.
9- Proteine modulatrici = modificano attività di proteine di segnalazione, regolando la forza di
segnalazione
10- Proteine di ancoraggio = mantengono proteine specifiche in posizioni precise
39
11- Proteine impalcatura = proteine adattatrici o di ancoraggio che legano insieme proteine
multiple di segnalazione in un complesso funzionale
FOSFORILAZIONE E INTERRUTTORI MOLECOLARI
Molte proteine di segnalazione si comportano come interruttori molecolari. Ci sono due tipidi
interruttori molecolari:
1- Proteine attivate o inattivate da fosforilazione. L’interruttore è spinto da una proteina chinasi.
Molte proteine controllate da segnalazione sono esse stesse proteine chinasi. Esse possono
essere:
- Proteine Serina/Treonina Chinasi: fosforilano proteine su serine o treonine
- Proteine Tirona Chinasi: fosforilano proteine su tirosine.
2- Proteine che legano GTP. Scattano da uno stato inattivo quando è legato GDP ad uno stato
attivo con GTP. Attive, hanno attività GTPasica intrinseca e si spengono da sole.
- Proteine G trimeriche
- Proteine GTPasi monomeriche
40
DOMINI DI LEGAME MODULARI
L’assemblaggio dei complessi di segnalazione stabile dipende da molti piccoli domini di legame
conservati.
Ne sono un esempio:
SH2 (Src Homology 2) e PTB (Phospfotyrosine Bind) si legano a tirosine fosforilate
SH3 (Src Homolgy 3) si lega a una breve sequenza ricca di Proline.
PH (Pleockstrina Homology) si lega a gruppi di testa carichi di inositolo-fosfolipidi fosforilati.
41
SEGNALAZIONE TRAMITE RECETTORI COLLEGATI A PROTEINE G
I recettori collegati a proteine G sono proteine transmembrana a 7 passaggi. Non hanno proprietà
enzimatica e si modificano in risposta al ligando, attivando le proteine G.
Le proteine G sono composte da tre subunità proteiche α, β e γ. Nello stato non stimolato la
subunità α ha attaqccato GDP e la proteina G è inattiva. Quando è stimolata da un recettore attivato,
la subunità rilascia il GDP legato, permettendo al GTP di legarsi al suo posto.
Questo scambio provoca la dissociazione del trimero in due componenti attivate – una subunità α e
un complesso βγ.
42
La subunità α va incontro a una proteina bersaglio che attiva una cascata di segnali diretti verso
altre molecole. Il bersaglio può essere di due tipi:
1. Adenilato Ciclasi
2. Fosfolipasi
TOSSINA DEL COLERA
La tossina colerica è un enzima che catalizza il trasferimento di ADP ribosio da NAD+
intracellulare alla subunità α di Gs. Questa ADP ribosilazione altera la subunità α in modo che non
può più idrolizzare il GTP legato, facendolo rimanere in una forma attiva che stimola
indefinitivamente l’adenilato ciclasi. Ne consegue un innalzamento prolungato dei livelli di cAMP
dentro le cellule dell’epitelio intestinale, che provoca un grave efflusso di Cl- e di acqua
nell’intestino, causando così la grave diarrea che caratterizza il colera.
1. ADENILATO CICLASI E cAMP
La subunità α si lega all’adenilato ciclasi, formando AMP ciclico o cAMP, che amplifica il segnale
dentro la cellula. Tutti i recettori che agiscono tramite cAMP sono accoppiati a una proteina G
stimolatrice (Gs), che attiva l’adenilato ciclasi e aumenta la concentrazione di cAMP. Una proteina
G inibitrice (Gi) inibisce l’adenilato ciclasi, regolando anche i canali ionici.
Il cAMP attivare la Proteina Chinasi dipendente da cAMP (PKA).
43
PKA e CREB
La PKA è una Serina-Treonina Chinasi. Nello stato inattivo, la PKA è un complesso di due
subunità catalitiche e due regolatrici. L’attacco di cAMP alle subunità regolatrici altera la
conformazione, facendole dissociare dal complesso. Le subunità catalitiche sono così attivate per
fosforilare proteine substrato specifiche.
La PKA svolge due funzioni:
a)- Mobilizzazione del Glucosio nelle cellule del fegato:
Fosforila la glicogeno sintetasi, il che scatena simultaneamente la demolizione del glicogeno a
glucosio e inibisce la sintesi di glicogeno, aumentando la quantità di glucosio disponibile alla
cellula muscolare.
b)- Attivazione del fattore trascrizionale CREB nelle cellule epatiche:
La regione regolatrice del gene della somatostatina contiene una sequenza di DNA chiamata CREB
(cAMP Response Element). Una proteina che regola geni chiamata CREB (cAMP Response
Element Binding Protein) riconosce questa sequenza. Quando CREB è fosforilata da PKA su una
singola Serina, recluta un coattivatore trascrizionale CBP (CREB Binding Protein). Questi geni
sono coinvolti nella gluconeogenesi, per produrre enzimi anabolici per formare glucosio da piccoli
precursori
44
45
2. FOSFOLIPASI E PKC-β
Attivazione della fosfolipasi e produzione di diacilglicerolo, inositoltrifosfato e rilascio di ioni Ca++
porta all’attivazione di PKC-β (Serina-Treonina Chinasi dipendente da Ca++).
La fosfolipasi agisce su un inositolo fosfolipide (fosfoinositide) chiamato PIP2, presente nella metà
interna del doppio strato lipidico. Essa è attivata da una proteina G (Gq).
La fosfolipasi taglia PIP2 generando inositolotrifosfato (IP3) e diacilglicerolo.
IP3 si lega ai canali di rilascio di Ca++ regolati da IP3 nella membrana dell’ER e li apre. Il Ca++
conservato è rilasciato, facendo salire la sua concentrazione nel citosol.
46
Contemporaneamente, il diacilglicerolo ha due ruoli di segnalazione. Può essere tagliato in modo da
lasciare acido arachidonico come messaggero o usato per la sintesi di eicosanoidi.
Oppure può attivare la PKC. L’aumento di Ca++ altera la PKC in modo che essa trasloca dal citosol
alla faccia citoplasmatica della membrana plasmatica, dove è attivata da Ca++, diacilglicerolo e
fosfatidilserina. La PKC fosforila le proteine bersaglio.
Negli epatoci fosforila la glicogeno sintetasi e la inattiva, regolando il metabolismo del glicogeno.
Fosforila delle MAPK che poi attivano proteine per geni ben precisi.
Un’altra proteina che lega Ca++ è la Calmodulina.
Si trova in tutte le cellule eucariotiche e funge da recettore intracellulare del Ca++ che serve a molti
scopi, mediando molti processi regolati da Ca++.
Quando è attivata dall’attacco del Ca++, subisce un cambiamento conformazionale, e la sua
attivazione allosterica è analoga all’attivazione a quella della PKA da parte del cAMP, eccetto che
la Calmodulina agisce legandosi ad altre proteine.
Molti effetti del Ca++ sono più indiretti e sono mediati da fosforilazioni di proteine catalizzate da
una famiglia di proteine, le CaM-Chinasi, (Proteina Chinasi dipendenti da Ca++/Calmodulina).
Anch’esse sono Serina-Treonina Chinasi.
47
DISATTIVAZIONE RECETTORI
I recettori possono desenbilizzarsi in tre modi generali:
1- Possono alterarsi in modo da non interagire ulteriormente con proteine G (inattivazione del
recettore).
2- possono essere spostati temporaneamente all’interno della cellula (internalizzati) così che non
abbiano ulteriore accesso al loro ligando (sequestro del recettore).
3- Possono essere distrutti nei lisosomi dopo internalizzazione (down-regolazione).
In ciascun caso, il processo dipende dalla fosforilazione del recettore, da parte di PKA, PKC o un
membro delle GRK (Chinasi del recettore legato a proteina G). La GRK fosforila serine e treonine
multiple su un recettore, solo dopo che il recettore è stato attivato dall’attacco del ligando. Una
volta che il recettore è fosforilato, si lega ad alta affinità ad un membro della famiglia delle
Arrestine.
L’arrestina inattiva il recettore impedendogli di interagire con proteine G. Può servire da proteina
adattatrice per accoppiare il recettore a fosse rivestite da clatrina , inducendo endocitosi mediata da
recettore. L’endocitosi ha come risultato il sequestro o la down-regolazione del recettore.
09/11/05
RECETTORI AD ATTIVITA’ ENZIMATICA INTRINSECA
Proteine di membrana monopasso che posseggono un dominio catalitico con attività enzimatica
intrinseca, in particolare sono delle Tirona Chinasi, e fosforilano la tirosina. Sono recettori per
fattori di crescita, mitogeni e ormoni.
Esempi di questi sono:
- EGF (Epidermal Growth Factor)
- PDGF (Platenet Derived Growth Factor)
- FGF (Fibroblast Growth Factor)
- HGF (Hepatocity Growth Factor)
- Insulina
- IGF-1 (Insuline Growth Factor 1)
- VEGF (Vascular Endotelium Growth Factor)
- MCSF (Macrophage colonies Stimulant Factor)
- NGF (Nerve Growth Factor)
48
La maggior parte sono proteine monopasso dove la zona extracellulare ha domini poco per volta
omologati, come i domini immunoglobunilici. Dentro la cellula, i recettori hanno il dominio ad
attività enzimatica tirosina chinasi, legando il fosforo al residuo di tirosina. Quando il recettore
entra in contatto col ligando, la tasca presente sul dominio ad attività enzimatica, si apre per far
entrare la tirosina. Di solito si ha una transfosforilazione, dove due recettori si associano e uno
fosforila le tirosine dell’altro, oltre a poter fosforilare se stesso e substrati a lui associati.
Le tirone fosforilate servono da ponti di attacco per domini SH2.
SH2 deriva dalle proteine Src. Nella proteina Src, la tirosina fosforilata nella parte iniziale, ha
un’alta affinità per SH2 e si chiude legandosi ad essa. La proteina quindi è inattiva e la tirosina è
inibitoria.
49
FOSFATIDILINOSITOLO 3 CHINASI
Una delle vie di segnalazione per la crescita cellulare coinvolge la Fosfatidilinositolo 3-chinasi
(IP3K). Questa fosforila inositolo fosfolipidi, piuttosto che proteine e può essere attivata da recettori
tirosina chinasi.
IP3K fosforila il PIP2 in PIP3. Le proteine di segnalazione si legano a PIP2 e PIP3 che sono prodotti
da IP3K, tramite il dominio PH. Ad esempio, quando i recettori per l’antigene sui linfociti B
attivano la IP3K, i siti di attracco di inositolo reclutano la tirosina chinasi citoplasmatica (BTK) e la
FosfoLipasi C-γ (PLC). BTK fosforila e attiva la PLC, che taglia PIP2 generando IP3 e
DiAcilGlicerolo (DAG).
IP3 poi si lega ai canali del Ca++ aprendoli. Il Ca++ attiva a sua volta la PKC.
Un modo in cui la IP3K segnala alle cellule di sopravvivere è quello di attivare indirettamente la
proteina chinasi B (PKB). Questa contiene un dominio PH, che la dirige alla membrana plasmatica
quando IP3K è attivata da un segnale di sopravvivenza. Si lega a PIP3 e altera la sua conformazione
per poter essere fosforilata da PKD1 (Proteina chinasi dipendente da Fosfatidilinositolo). La PLB
attivata ritorna nel citoplasma fosforilando molte proteine bersaglio. Essa fosforila la BAD, proteina
che incoraggia le cellule ad andare in apoptosi, inattivandola.
50
PROTEINE RAS
Le proteine Ras appartengono alle GPasi monomeriche. Un proteina Ras funziona come
interruttore, alternando due stati conformazionali distinti – attivo quando è legata a GTPe inattivo
quando è legata a GDP.
La sua attività è influenzata da fattori di scambio del nucleotide guanilico (GEF) che stimolano la
dissociazione di GDP e l’assunzione di GTP dal citosol e le proteine che attivano la GTPasi (GAP)
che aumentano la velocità di idrolisi del GTP legato a Ras inattivandola.
51
L’attivazione di Ras è svolta recettori tirosina chinasi che hanno breve durata. Per stimolare la
cellula Ras attiva una serie di fosforilazione su serine e treonine a valle a cui partecipano molte
serina treonina chinasi, tra cui le proteine chinasi attivate da mitogeni (MAPK). Esse sono attivate
da una MAPKK che fosforila sia la treonina che la tirosina di MAPK. La MAPKK è attivata a sua
volta da una fosforilazione catalizzata da una MAPKKK (Raf). La MAPK attivata trasmette il
segnale a valle fosforilando varie proteine cellulari e che regolano geni e altre proteine chinasi. La
MAPK può entrare nel nucleo e fosforilare uno o più componenti di un complesso che regola geni.
Ciò attiva la trascrizione di geni precoci immediati.
La via di segnalazione Ras-MAPK trasmette segnali dalla superficie cellulare al nucleo e altera lo
schema di espressione dei geni in modi significativi.
52
RECETTORI DELLE EFRINE, PDGF e FGF
11/10/05
Il fattore PDGF ha cinque siti di autofosforilazione in tirosina, a cui tre proteine di segnalazione si
legano.
Esso è un dimero unito covalentemente con due siti che legano il recettore, unendo direttamente due
recettori per la segnalazione. (A) Il fattore FGF , importante per l’angiogenesi, si lega a gruppi in
proteoglicani. (B) La segnalazione bidirezionale delle efrine è necessaria per impedire a cellule in
regioni particolari del cervello in sviluppo di mescolarsi con cellule di regioni confinanti.
La classe più grande di ligandi legati alle membrane nelle tirosina chinasi, è quella delle Efrine, che
regolano l’adesione e la repulsione cellulare durante lo sviluppo animale. I recettori per le efrine
(Eph) sono le tirosina chinasi più numerose. Possono agire simultaneamente da ligandi e da
recettori. In seguito all’attacco a un recettore Eph alcune efrine attivano il recettore Eph e diventano
esse stesse attivate per trasmettere all’interno segnali per la cellula che esprime l’efrina (C).
53
SCHEMA DELLE CINQUE VIE PARALLELE DI SEGNALAZIONE INTRACELLULARE
VIA DI SEGNALAZIONE Jak-STAT
Questa via di segnalazione è stata scoperta negli studi sugli interferoni in risposta alle infezioni
virali.
Gli inteferoni si legano a recettori su cellule non infettate e inducono queste a produrre proteine.I
recettori per gli interferoni attivano le Chinasi Janus (Jak). Le chitochine inducono ai recettori a
oligmerizzare e le Jak sono portate vicine per fosforilarsi a videnda. Esse quindi fosforilano tirosine
su i recettori per le chitochine creando siti di attacco per le STAT (Signal Trasducers and
Activators of Trascription).
54
Ci sono sette STAT ciascuna con un dominio SH2 che:
- media l’attacco della STAT su una fosfotirosina di un recettore attivato per le chitochine.
Quando sono legate alle Jak, esse fosforilano le STAT su tirosine, provocandone la dissociazione.
- SH2 quindi media l’attacco a una fosfotirosina sull’altra STAT formando un dimero STAT. Il
dimero si muove nel nucleo dove, combinandosi con altre proteine che regolano geni, si lega a un
elemento specifico di risposta sul DNA in vari geni e ne stimola la trascrizione.
LE FOSFATASI
Le fosfatasi sono enzimi che defosforilano soltanto fosfotirosine selezionate su una sottoclasse di
proteine fosforilate in tirosina. Assicurano che le fosforilazioni in tirosina siano di breve durata e
che il livello di fosforilazione in cellule a riposo sia molto basso.
Due esempi possono essere la SHP1 e la SHP2, entrambe con un dominio SH2. Entrambe aiutano a
terminare risposte mediate da alcuni recettori tirosina chinasi.
SHP1 attiva Jak2 per un tempo molto più lungo del normale.
55
IL CITOSCHELETRO
E’ un complesso sistema di rete proteica di filamenti e tubuli interconnessi che si estende nel
citosol, dal nucleo alla faccia interna della membrana.
E’ una matrice proteica che fornisce struttura architettonica alle cellule eucariotiche. Conferisce un
elevato livello di organizzazione interna e permette alle cellule di assumere forme precise.
E’ coinvolto nell’organizzazione spaziale del citoplasma, esercita una trazione sui cromosomi
allontanandoli durante la mitosi e quindi taglia la cellula in divisione in due. Spinge e guida il
traffico intracellulare di organelli, trasportando materiali da un punto all’altro della cellula.
E’ caratteristico delle sole cellule eucariotiche. Serve anche ad ancorare le cellule con la matrice
extracellulare ed è coinvolto nellla segnalazione cellulare. Le diverse funzioni del citoscheletro si
basano sul comportamento di tre famiglie di proteine, che si assemblano a formare tre principali tipi
di filamenti. Ciascun tipo di filamento ha proprietàà meccaniche distinte e una dinamica diversa, ma
certi principi fondamentali sono comuni a tutti.
Sono i filamenti intermedi, i microtubuli e i filamenti di actina. Questi non funzionano da soli,
ma associati a proteine accessorie, essenziali per l’assemblaggio di strutture citoscheletriche, e loro
funzionamento. Nell’esempio più semplice, l’ameba usa delle protusioni (falsi piedi).
FILAMENTI INTERMEDI
I microfilamenti, con un diametro di 7 nm, sono polimeri della proteina actina: servono alla
struttura della cellula ed al movimento.
Sono formati da polimeri di proteine diverse, ma tutte simili per dimensione e struttura.
Formano un reticolo in tutto il citoplasma e un intreccio a canestro intorno al nucleo (la lamina
nucleare).
I filamenti intermedi (IF) hanno un diametro di circa 8-12 nm e sono organizzati in fasci proteici
resistenti e durevoli. Hanno un ruolo fondamentale strutturale, di sostegno della tensione cellulare. I
filamenti intermedi sono le strutture più stabili e meno solubili del citoscheletro (si mantengono
intatte anche in soluzioni saline concentrate e detergenti non ionici) e sono specifici per ogni tipo di
tessuto.
La tipizzazione dei filamenti intermedi serve anche come strumento diagnostico in medicina ed è
particolarmente utile nella diagnosi dei tumori, in quanto le cellule tumorali mantengono i filamenti
intermedi caratteristici del tessuto di origine, indipendentemente dalla localizzazione del tumore nel
corpo
Sono proteine fibrose e hanno un dominio centrale ad α-elica a
bastoncello, formato da circa 310-318 amminoacidi, che è conservato
in dimensioni, struttura secondaria e, in alcuni casi, anche in
sequenza.
Due dimeri si assemblano in modo antiparallelo e sfalsato a formare
un tetramero sfalsato. Poichè la subunità tetramerica è composta da
due dimeri che puntano in direzioni opposte, le sue estremità sono le
stesse.I tetrameri non sono polarizzati.
I tetrameri si associano tra di loroper formare il filamento, che
comprende otto protofilamenti paralleli, disposti a tetrameri. Ciascun
filamento intermedio ha quindi una sezione con 32 singoli
avvolgimenti ad α-elica.
La fosforilazione di residui di serina nel dominio amminoterminale
controlla l’assemblaggio.
Es: la lamina nucleare che circonda il nucleo si disassembla quando la serina si fosforila (ciclo
cellulare).
56
Le proteine dei filamenti intermedi vengono suddivise in sei classi.
Le classi I e II comprendono le cheratine, proteine che organizzano i “tonofilamenti” delle cellule
epiteliali che ricoprono la superficie del corpo e le sue cavità.
Ci sono 20 classi di cheratine e 8 cheratine dure, specifiche di capelli ed unghie.
Si distinguono in cheratine acide (I) e cheratine basiche (II) che si assemblano in eterodimeri.
La diversità delle cheratine è utile nella diagnosi di cancri epiteliali (carcinomi) in quanto la serie
particolare di cheratine espresse dà un’indicazione del tessuto epiteliale in cui il cancro si è
originato.
La classe III degli IF include la vimentina, la desmina e la proteina gliale fibrillare acidica
(GFA).
57
La vimentina è localizzata nei tessuti connettivi ed in altre tipi cellulari di origine non epiteliale.
La desmina si trova nelle cellule muscolari, mentre la GFA è caratteristica delle cellule della glia
che circondano ed isolano le cellule nervose.
La classe IV degli IF sono le proteine dei neurofilamenti (NF) che strutturano gli assoni ed i
prolungamenti delle cellule nervose.
I neurofilamenti che si trovano nel sistema nervoso embrionale sono costituiti da nestina, che forma
la classe VI degli IF.
La classe V è costituita dalle lamine nucleari A, B e C, che formano una rete filamentosa lungo la
faccia interna della membrana nucleare di tutte le cellule eucariote.
Hanno un segnale di localizzazione nucleare. La formazione del reticolo è dinamica durante la
divisione cellulare (Fosforilazione in serina).
FILAMENTI DI ACTINA
L’actina è una proteina ubiquitaria ed è presente in tutte le cellule eucariotiche, dove rappresenta il
5% delle proteine cellulari. Il singolo filamento di actina è l’actina G, che polimerizza in
microfilamento actina F.
I microfilamenti, con un diametro di 7 nm, sono polimeri della proteina actina: servono alla
struttura della cellula ed al movimento.
I filamenti di actina sono polari, con un’estremità positiva (+) a crescita veloce ed una negativa (-),
inerte ed a crescita lenta.
58
l'estremità in crescita di un microfilamento è formata da actina F-ATP, mentre il corpo del
filamento è composto da actina F-ADP. L’ATP si idrolizza ad ADP, che resta intrappolato nel
filamento.
Proteine che legano l’actina mascherano i siti di polimerizzazione, come la timosina, piccola
proteina che blocca la polimerizzazione.
La polimerizzazione dell’actina richiede
Mg2+, K+ ed ATP.
Si ha una fase di latenza, in cui si nucleano
nuovi filamenti e poi una fase di
polimerizzazione rapida, in cui si allungano i
filamenti.
Dopo la polimerizzazione, l’ATP si idrolizza
ad ADP, che resta intrappolato nel polimero.
L’estremità con ADP depolimerizza più
rapidamente.
Tuttavia l'idrolisi dell'ATP non è richiesta
per l'allungamento dei microfilamenti.
La profilina accelera lo scambio di ATP con ADP nei monomeri di actina e quindi regola la
polimerizzazione dell’actina durante il movimento cellulare.
La nucleazione dei filamenti di actina avviene più frequentemente alla membrana plasmatica.
Spesso è regolata da segnali esterni che permettono alla cellula di cambiare la sua forma e la sua
rigidità rapidamente in risposta a cambiamenti dell’ambiente esterno. Questa nucleazione è
catalizzata da un complesso di proteine che comprende due proteine correlate ad actina ARP. Il
complesso ARP nuclea la crescita di filamenti di actina dall’estremità meno, permettendo un rapido
allungamento all’estremità più. Il complesso può anche attaccarsi al lato di un altro filamento,
rimanendo attaccato all’estremità meno del filamento che ha enucleato, creando una struttura ad
albero.
Per il
citoscheletro di
actina,
riagganciamenti strutturali
globali in
risposta a
segnali esterni
sono scatenati
tramite diversi
recettori di
superficie.
Tutti i segnali
sembrano
convergere
nelle proteine
Rho. Esse
agiscono da
interruttori
molecolari per
controllare
processi
cellulari
alternandosi tra
59
uno stato attivo (con GTP) ad uno inattivo (con GDP). L’attivazione di Cdc42 scatena la
polimerizzazione e la formazione di fasci di actina dando origine a filopodi o protusioni cellulari
più corte chiamate microspine. L’attivazione di Rac promuove la polimerizzazione dell’actina alla
periferia della cellula, che porta alla formazione di lamellipodi a forma di foglietto e di increspature
della membrana. L’attivazione di Rho promuove sia la formazione di fasci di actina con filamenti di
miosina II in fibre di stress che il raggruppamento di integrine e di proteine associate per formare
contatti focali.
Le actine, all’interno della cellula hanno diverse organizzazioni a seconda della zona della cellula in
cui si trovano: le cellule hanno la caratteristica di migrare perchè tra gli spazi che si trovano tra una
cellula e l’altra si trovano delle molecole gradienti che modulano la migrazione; tali molecole sono
chiamate Chemio-attrattori: ligandi che in seguito attivano una risposta migratoria che si basa
sull’organizzazione dell’actina:
- Fibre di stress = permettono lo stiramento della cellula e sono fasci paralleli con proteine
contrattili (struttura iniziale interna).
- Filopodi = fasci paralleli molto più stretti delle fibre di stress (estremo della cellula)
- Lamellipodi = è un ventaglio che si forma davanti alla cellula per riconoscere il substrato (matrice
extracellulare) e legare i filopodi.
Le actine si associano a
determinate proteine per formare
le fibre di stress, la corteccia e i
filopodi.
La miosina II è presente nei
filamenti di stress e dà la
contrattilità ad essi.
La Fimbrina è presente nel
Filopodio, è piccola con due
domini che legano actina vicini su
una singola catena polipeptidica.
L’α-actinina contiene due domini
che legano actina che sono
maggiormente separata ed è
concentrata nelle fibre di stress,
assieme alla miosina II.
La Miosina II entra dove è presente la α-actinina, mentre con la fimbrina non riesce ad entrare.
Ecco perchè il filopodio non è contrattile. Il Microvillo è costituito da Actina e Fimbrina.
60
Nei lamellipodi è presente la filamina, che promuove la formazione di un gel lasso e altamente
viscoso pinzando insieme due filamenti di actina più o meno ad angolo retto.
PROTEINE MOTRICI: LE MIOSINE
Sono una famiglia di proteine che legano l’actina e idrolizzano l’ATP ad ADP + P.
La miosina II scoperta nel muscolo scheletrico, è la più abbondante ed è presente in molti tipi
cellulari ( 1 mol. miosina ogni 100 di actina).
La miosina I è più piccola ed è presente in cellule non muscolari (forma ancestrale di miosina?),
caratterizzata da testa motrice .
MIOSINA II
Proteina allungata formata da due catene pesanti e da due copie di due tipi di catene leggere.
Ciascuna catena pesante ha un dominio di testa globulare all’N-terminale che contiene il
macchinario che genera la forza, seguito da una sequenza molto lunga di amminoacidi che forma un
coiled coil esteso che media la dimerizzazione della catena pesante. La miosina I è più piccola e
presente in cellule non muscolari.
CONTRAZIONE MUSCOLARE
Il muscolo striato si basa sulla struttura del sarcomero, in cui i filamenti di actina e miosina si
intercalano e scivolano gli uni sugli altri. La contrazione è regolata da ATP e dalla presenza di ioni
Ca++. La fibra muscolare è formata da miofibrille che si uniscono per formare il sincizio. E’
ricchissima di Reticolo Sarcoplasmatico per tener immagazzinato il Ca++.
61
Oltre alla miosina II e l’actina, ci sono proteine accessorie che mantengono l’architettura della
miofibrilla e la rendono elastica.
Titina = molla che si ancora alla miosina e mantiene la miosina nel centro del sarcomero.
Nebulina = è un regolo molecolare che regola la lunghezza del corretto filamento di astina
La miosina è organizzata in fasci. Il movimento è verso il centro e il sarcomero si accorcia.
La quantità di forza che viene generata dal muscolo, dipende dalla quantità di teste di miosina che
fuoriescono dal filamento e prendono contatto con l’actina.
La contrazione muscolare è iniziata da un improvviso aumento della concentrazione di ioni Ca++. Il
segnale nervoso scatena un potenziale d’azione che si diffonde nei tubuli T, che si estendono
all’interno della membrana plasmatici attorno a ciascuna miofibrilla. Il segnale è trasmesso al
reticolo sarcoplasmatico e, le proteine sensibili al voltaggio, aprono i canali di rilascio di Ca++.
Questi ioni, entrando nel citosol, fanno iniziare la contrazione. La tropomiosina blocca l’attacco
della miosina all’actina, compresa la troponina, un complesso di tre polipeptidi, troponina T, I e
C. La troponina I si lega alla troponina T e all’actina. La troponina T si leca alla tropomiosina e, la
troponina C, quando Ca++ aumenta, lega a sé quattro ioni Ca++ e fa rilasciare alla troponina I la sua
presa sull’actina.
Le varie fasi dei cambiamenti strutturali della miosina per camminare lungo un filamento di astina
sono:
ATTACCATA:
All’inizio del ciclo la testa di miosina priva di un nucleotide legato è bloccatasi un filamento di
astina in rigor.
RILASCIATA: Una molecola di ATP si lega alla grossa fessura sul retro della testa, il più lontano
dall’actina e causa subito un lieve cambiamento nella conformazione dei domini che compongono il
sito di attacco all’actina. Ciò riduce l’affinità della testa per l’actina e le permette di muoversi lungo
il filamento.
ARMATA: La fessura si chiude come le valve di una conchiglia intorno all’ATP, cambiando la
conformazione e quindi uno spostamento della testa. Avviene idrolisi di ATP, ma l’ADP e il fosfato
inorganico prodotti restano attaccati alla proteina.
GENERAZIONE DELLA FORZA: Un debole legame della testa di miosina con un nuovo sito
sull’actina provoca il rilascio del fosfato inorganico prodotto assieme a un forte attacco della testa
62
all’actina. Questo rilascio scatena il colpo di potenza, dove la testa riguadagna la sua conformazione
originale. La testa intanto perde l’ADP legato ritornando così al nuovo ciclo.
Nel muscolo liscio le fibre sono fusiformi e i filamenti di actina e miosina non sono disposti in
modo ordinato. La contrazione è più lenta, ma l’ampiezza delle contrazioni è più ampia (movimenti
peristaltici).
Muscolo cardiaco = non ci sono sincizi, ma giunzioni specializzate tra le cellule distinte, per
trasmettere la contrazione in modo uniforme.
63
FUNZIONE DELLE PROTEINE REGOLATRICI REGOLATA
La cellula può regolare l’attività delle proteine motrici, permettendo di cambiare sia il
posizionamento dei suoi orfanelli racchiusi da membrana sia i movimenti dell’intera cellula.
L’attività della miosina può essere regolata mediante fosforilazione. In cellule non muscolari, la
miosina può essere fosforilata sia su catene pesanti che leggere, influenzando sia l’attività del
motore che l’assemblaggio del filamento stesso. La miosina II può trovarsi in due stati
conformazionali diversi in queste cellule, uno esteso, capace di formare filamenti bipolari e uno
stato piegato in cui il dominio di coda apparentemente interagisce con la testa motrice. La
fosforilazione della catena leggera della miosina avviene per stimoli esterni:
L’Acido Lipofosfatidico si lega al recettore a 7 domini transmembrana legato a proteina G. La
proteina G attiva Rho (GDP si stacca e si lega GTP). Rho attiva la Rho Chinasi, che sta al posto
del calcio che attiva la MLCK (Myosin Light Chain Kinase), fosforilandola, ed essa fosforila la
catena leggera della miosina. Dopodichè si ha l’unione della miosina fosforilata all’actina e la
formazione di fibre di stress contrattili.
MICROTUBULI
I microtubuli sono tubi cavi formati da tubulina che formano lunghi polimeri rigidi: governano la
localizzazione degli organelli cellulari e si servono di “motori” molecolari per il trasporto di
vescicole.
64
I microtubuli sono formati da tubulina alfa e tubulina beta, due polipeptidi globulari, che
polimerizzano in 13 protofilamenti lineari, uniti assieme da legami non covalenti.
I protofilamenti sono sono allineati in parallelo con la stessa polarità.
Il microtubulo è polare con un estremità positiva (in crescita veloce) ed una negativa (a crescita
lenta). Sia sulla tubulina alfa e beta c’è un sito di legame per il GTP.
La concentrazione di tubulina legata al GTP è limitante.
Quando la tubulina-GTP è disponibile, dopo una fase di latenza iniziale, viene aggiunta
velocemente al microtubulo, creando un grosso cappuccio di tubulina-GTP.
Se la sua concentrazione diminuisce, tuttavia, la velocità di aggiunta della tubulina diminuisce sino
ad un livello soglia di tubulina-GTP a cui la velocità di idrolisi del GTP ad un estremo del
microtubulo è superiore alla velocità di aggiunta di nuova tubulina-GTP, risultando nella
contrazione del cappuccio di GTP.
Quando il cappuccio scompare, i microtubuli diventano instabili e viene favorita la perdita delle
subunità associate al GDP.
65
I microtubuli sono nucleati da un complesso di proteine che contiene tubuline gamma. In genere
sono nucleati da una posizione intracellulare specifica nota come centro organizzatore dei
microtubuli.
Nella maggior parte degli animali, c’èun singolo centro organizzatore chiamato centrosoma. Da qui
i microtubuli citoplasmatici si estendono in una conformazione astrale a stella. I microtubuli sono
nucleati al centrosoma alle loro estremità negative, così che le estremità positive puntano verso
l’esterno e crescono verso la periferia della cellula. Immersa nel centrosoma poi c’è una coppia di
strutture cilindriche perpendicolari tra loro, i centrioli.
I microtubuli polimerizzano e depolimerizzano continuamente, con una emivita di circa 10 min.
Si parla di “instabilità dinamica” per indicare la fluttuazione nella lunghezza di un singolo
microtubulo (misure effettuate a intervalli di 1 – 2 min)
I microtubuli sono strutture molto labili, sensibili a sostanze antimitotiche.
Ad esempio, il fuso mitotico si forma all’inizio della mitosi e può essere bloccato da sostanze che
bloccano lo scambio di subunità tra microtubuli ed il pool di tubulina libera.
La colchicina (alcaloide) si lega ad una singola molecola di tubulina, ma non alla tubulina
polimerizzata. Impedendo lo scambio di subunità, il fuso si disaggrega e si ha blocco della mitosi.
Vinblastina, vincristina: chemioterapici
Taxolo: ha l’effetto opposto. Si lega ai microtubuli e li stabilizza. Le cellule si arrestano in mitosi,
indicando che i microtubuli devono anche depolimerizzare per render il fuso funzionale.
PROTEINE CHE SI LEGANO AI MICROTUBULI
Una volta che un filamento di citoscheletro si forma per nucleazione e allungamento dal pool di
subunità, la sua stabilità e le sue proprietà meccaniche sono spesso alterate da una serie di proteine
che si legano lungo i lati del polimero.
Le proteine che si legano lungo i lati del microtubulo sono chiamate MAP (Microtubules
Associated Proteins). Le MAP, come il tavolo possono stabilizzare i microtubuli contro il
disassemblaggio. Le MAP hanno almeno un dominio che si lega alla superficie dei microtubuli e un
altro che sporge verso l’esterno. La lunghezza del dominio sporgente può determinare quanto
strettamente i microtubuli rivestiti di MAP si compattano insieme.
66
Li stabilizzano dalla depolimerizzazione e ne mediano l’interazione con altri componenti cellulari:
creazione di un citoplasma funzionalmente diffrenziato.
Ad esempio, nel cervello MAP-1, MAP-2 e tau accelerano la nucleazione nella prima fase di
polimerizzazione e ne inibiscono la dissociazione.
La stabilizzazione dei microtubuli è importante nelle cellule nervose, dove servono alla struttura di
assoni (tau) e dendriti (MAP2).
L’inibizione di tau impedisce la formazione dell’assone, mentre i dendriti si formano lo stesso.
Le MAP motorie, che includono la chinesina e la dineina, sono motori proteici, così chiamate
perché usano ATP per guidare il trasporto di vescicole ed organelli o per creare forze di
trascinamento tra i microtubuli.
67
Chinesine, dineine citoplasmatiche (trasporto organelli e mitosi), dineine ciliari (ciglia e flagelli).
Chinesine e dineine si muovono in direzione opposte lungo un microtubulo.
Hanno una testa globulare che lega ATP ed una coda a bacchetta. L eteste sono motori ad ATPasi
che si attaccano ai microtubuli, mentre le code si attaccano a componenti cellulari specifici.
ADESIONE CELLULARE
Il citoscheletro serviva per controllare la struttura della cellula.
1- Adesione cellula-cellula o cellula-matrice extracellulare: regolata da strutture ben definite
(desmosomi, giunzioni aderenti, giunzioni a setto) importante per le cellule epiteliali.
2- Emidesmosomi, contatti focali (actina, fibre di stress)
Esistono meccanismi selettivi di adesione tra tipi cellulari diversi e tra questi e la matrice
extracellulare, che permettono di dare origine a tessuti definiti negli embrioni.
CELLULA EPITELIALE INTESTINALE
- Base che si lega alla matrice extracellulare (lamina basale) tramite emidesmosomi e contatti
focali (Integrine). Sono adesioni forti che ancorano in modo continuo l’epitelio alla sua lamina
basale.
- Nella prima zona apicale (appena sotto l’apice della cellula) vi sono giunzioni strette che
appiccicano le due membrane in modo che non passi niente attraverso.
- Nelle zone intermedie vi sono tre parti: fascia di adesione (Caderina), desmosoma (Caderina)
giunzione gap.
ADESIONI CELLULA-CELLULA
Esistono 3 tipi di adesione cellula-cellula:
- interazione omofilica
- interazione eterofilica
- interazione attraverso due proteine e una proteina che funge da ponte tra queste due.
Le caderine sono formate da 3 porzioni.
- porzione extracellulare (esterina) costituita da tre zone che legano Ca++ con legami deboli e
permettono una conformazione corretta per legare la cellula.
- porzione interna alla membrana plasmatica ad alfa elica che a sua volta si lega alla terza porzione,
la coda, che lega tre proteine chiamate Catenine α, β e γ che sono associate alla coda formando un
complesso per legare i filamenti di actina.
La beta catenina è la più importante perché è quella che forma la struttura del complesso per legare
l’actina e svolge due funzioni:
1- è attaccata alla caderina
2- quando non è in funzione, si stacca e va nel citoplasma e viene degradata, ma nelle cellule
tumorali può staccarsi e andare nel nucleo comportandosi da fattore trascrizionale attivando
Myc e quindi il ciclo cellulare.
MATRICE EXTRACELLULARE
Rete di macromolecole che riempie gli spazi extracellulari. E’ un continuo susseguirsi di proteine
fibrose (collagene) che formano una struttura reticolare. All’interno dei tessuti connettivi vi sono i
fibroblasti che si muovono da un tessuto all’altro, i macrofagi e i vasi capillari.
La matrice extracellulare forma l’impalcatura del corpo dei vertebrati e viene prodotta dai
fibroblasti, osteoblasti, condroblasti.
68
Oltre al collagene vi è un’altra proteina che è la laminino, che si associa al collagene stesso
formando una rete su cui le cellule possono appoggiarsi.
In genere le proteine che sono presenti sono:
proteine fibrose = collageni
proteine fibrose adesive = fibronectina e laminino
proteoglicani = glicosamminoglicani (GAG) che formano un gel molto idratato in cui sono
immerse le proteine fibrose; assicurano resistenza alla compressione.
CONTATTI CELLULA MATRICE
I contatti cellula-matrice sono mediati dalle integrine.
I recettori per la matrice cellulare sono molecole di membrana (eterodimeri) ognuno con un suo
dominio idrofobico, un dominio extracellulare.
Le interazioni sono regolate da cationi (Mg++) e da integrine che non hanno attività proprie ma si
associano ad altre proteine per esempio:
- nei fibroblasti si legano con i microfilamenti di actina costituendo strutture complesse denominate
contatti focali e inoltre si legano con le fibre contrattili per favorire il movimento cellulare
- nelle cellule epiteliali formano gli emidesmosomi è questi sono associati con i filamenti intermedi
(cheratine).
CICLO CELLULARE E APOPTOSI
La duplicazione del DNA avviene durante la fase S. Dopo la fase S la segregazione dei cromosomi
e la divisione cellulare avvengono nella fase M che richiede molto meno tempo della fase S.
L’involucro nucleare si rompe e i cromosomi replicati si attaccano ai microtubuli del fuso mitotico.
L’improvvisa separazione dei cromatidi fratelli marca l’inizio dell’anafase, dove i cromosomi si
muovono a poli opposti del fuso, dove si ricondensano e riformano nuclei intatti. Per concedere più
tempo alla cellula per crescere, fasi gap extra sono inserite nella maggior parte dei cicli cellulari –
una fase G1, tra la fase M e la fase S e una fase G2, tra la fase S e la mitosi. Così, il ciclo cellulare
eucariotico è tradizionalmente diviso in quattro fasi sequenziali: G1, S, G2 e M. G1, S e G2 sono
chiamate complessivamente interfase, che può occupare 23 ore del ciclo cellulare di 24 ore. Le fasi
G forniscono alla cellula anche il tempo perché essa controlli l’ambiente interno ed esterno per
assicurarsi che le condizioni siano adatte e che le preparazioni siano complete. La fase G1 è la più
importante. La sua lunghezza può variare di molto secondo le condizioni esterne e i segnali cellulari
che provengono da altre cellule. Se le cellule ritardano in progresso attraverso G 1, possono entrare
in uno stato di riposo specializzato chiamato G0.
Il sistema di controllo del ciclo cellulare opera secondo diversi stadi. Per i cicli cellulari embrionali,
funziona come un orologio. Esso non è influenzato dagli eventi che regola e progredirà attraverso
l’intera sequenza di eventi anche se uno di questi eventi non è stato completato con successo.
69
Sensori, rivelano il completamento della sintesi del DNA e, se qualche malfunzionamento
impedisce il completamento corretto del processo, segnali vengono mandati al sistema di controllo
per ritardare la progressione alla fase successiva. Nella maggior parte delle cellule ci sono certi
punti nel ciclo cellulare, chiamati punti di controllo, a cui il ciclo può essere arrestato se gli eventi
precedenti non sono stati completati.
Al cuore del sistema di controllo del ciclo cellulare sta una famiglia di proteine chinasi note come
Cdk (Cicline dependent Kinase). L’attività di queste chinasi aumenta e diminuisce man mano che
la cellula progredisce attraverso il ciclo.
I cambiamenti ciclici dell’attività delle Cdk sono controllati da una serie complessa di enzimi e
proteine. I più importanti regolatori sono le cicline. Le Cdk sono dipendenti dalle cicline per la loro
attività: se non sono legate a una ciclina, non hanno attività chinasica. I cambiamenti ciclici nei
livelli delle cicline portano all’assemblaggio e all’attivazione ciclici dei complessi ciclina-CdK che
scatena a sua volta eventi del ciclo cellulare.
Ci sono quattro classi di cicline, ma solo tre sono necessarie in tutte le cellule eucariotiche:
1. le cicline G1/S legano Cdk alla fine di G1 e impegnano la cellula alla replicazione del DNA
2. le cicline S legano Cdk durante la fase S e sono necessarie per l’inizio della replicazione del
DNA
3. Le cicline M promuovono gli eventi della mitosi
L’aumento e la diminuzione dei livelli di cicline è il determinante primario dell’attività Cdk durante
il ciclo cellulare.
70
La replicazione del DNA inizia a livello
delle origini di replicazione, che sono
sparse in varie posizioni nel cromosoma.
A loro si lega un complesso
multiproteico, noto come complesso di
riconoscimento dell’origine (ORC).
Questi complessi si legano alle origini di
replicazione per tutto il ciclo cellulare e
servono da area di atterraggio per molte
proteine regolatrici, tra cui la Cdc6. Essa
si lega a ORC all’inizio di G1, dove è
necessaria per l’attacco di un complesso
composto da proteine Mcm. Il complesso
che si forma è il complesso
prereplicativo o pre-RC.
L’attivazione di S-Cdk scatena la fase S
e perciò l’inizio della replicazione
assieme a una proteina che fosforila
ORC. S-Cdk fa dissociare Cdc6 da ORC
dopo che un’origine ha funzionato. il
pre-RC si disassembla e impedisce che la
replicazione avvenga di nuovo nella
stessa origine. Inoltre impedisce a Cdc6 e
Mcm di riassemblarsi in qualunque
origine.
Gli eventi della mitosi sono scatenati da M-Cdk che, attivata, inizia l’accumulo di ciclina M, la cui
sintesi aumenta durante G2 e M, a causa soprattutto di un aumento della trascrizione del gene della
ciclina M. Questo aumento porta ad un accumulo graduale di M-Cdk.
Siccome M-Cdk è repressa da due gruppi fosfato, l’attivazione della fosfatasi Cdc25 rimuove i
fosfati inibitori attivano M-Cdk.
71
APOPTOSI
Se le cellule non sono più necessarie, queste si suicidano attivando un programma intracellulare di
morte. Questo programma è la morte cellulare programmata o apoptosi.
Le cellule che muoiono come risultato di un danno acuto tipicamente si rigonfiano e scoppiano,
versando il loro contenuto su tutte le cellule vicine (necrosi cellulare) provocando una risposta
infiammatoria dannosa. Una cellula che subisce apoptosi invece muore senza danneggiare i suoi
vicini. Si raggrinza e si condensa. Il macchinario dell’apoptosi dipende da una famiglia di proteasi
chiamate caspasi, con una cisteina nel loro sito attivo. Sono sintetizzate nella cellula come
precursori inattivi o procaspasi.. Le caspasi tagliano, attivandole, altre procaspasi, una volta
attivate. Alcune tagliano proteine chiave della cellula, altre la lamina nucleare.
Le procaspasi sono attivate dalle proteine adattatrici che portano copie multiple di procaspasi
specifiche, le procaspasi iniziatrici. L’attivazione può essere scatenata dall’esterno della cellula
dall’attivazione dei recettori di morte sulla superficie cellulare. I linfociti killer possono produrre la
Fas ligando che si lega la recettore Fas. Le Fas ligando raggruppate reclutano proteine adattatrici
che legano e aggregano procaspasi 8, che si tagliano e si attivano a vicenda.
Ma quando una cellula è stressata o danneggiata, può suicidarsi, attivando le procaspasi
dall’interno. I mitocondri sono indotti a rilasciare il citocromo c nel citosol, dove si attacca a una
proteina adattatrice l’Apaf-1 attivandola. Essa attiva la procaspasi 9 e la cellula muore per
apoptosi.
Ci sono proteine che regolano l’uscita dal mitocondrio del citocromo c, come Bax o Bak. Più
queste sono presenti e più citocromi c escono dal mitocondrio (questo perché sono proapoptotici).
La famiglia Bcl-2 aiuta a regolare l’attivazione delle procaspasi. Alcuni membri della famiglia,
come Bcl-2 inibiscono l’apoptosi, ma altri come Bad la promuovono. Se i geni che codificano Bax
o Bak sono inattivati le cellule sono resistenti alla maggior parte degli stimoli che inducono
apoptosi.
72