COMPITI DI CHIMICA PRIMA MECCATRONICA
Modulo 1: Stati di aggregazione della materia
1. Scrivi qual è lo stato fisico della sostanza contenuta nelle beute e descrivilo in base a forma,
volume e movimento delle particelle.
2. Assegna il nome descrivi il fenomeno rappresentato dalle seguenti immagini:
1)
2)
4)
3)
5)
6)
3. Per ciascuna sostanza riportata nelle tabelle indicare in quale stato fisico si trova (solido, liquido,
gassoso) alle tre temperature indicate.
SOSTANZA
T fusione
T ebollizione
-50°C
15°C
50°C
Ottano
- 56,8
125,6
Oro
1064,2
2856
esano
- 94
69
Sodio
97,8
882,9
SOSTANZA
Ottano
Oro
esano
Sodio
T fusione
- 56,8
1064,2
- 94
97,8
T ebollizione
125,6
2856
69
882,9
-250°C
130°C
250°C
SOSTANZA
Propano
Argento
Acido nitrico
Mercurio
T fusione
- 188
962
- 42
-39
T ebollizione
-42
2162
83
357
-40°C
85°C
150°C
SOSTANZA
Propano
Argento
Acido nitrico
Mercurio
T fusione
- 188
962
- 42
-39
T ebollizione
-42
2162
83
357
-150°C
115°C
250°C
4.
Per quale motivo in laboratorio si utilizza materiale in vetro?
5.
Rivedi sul libro i pittogrammi di sicurezza e studiane il significato.
6. Se un corpo è allo stato solido si può affermare che: (Una sola corretta)
▪ Ha una sua forma caratteristica e ha il volume del recipiente in cui è contenuto
▪ Ha un suo volume e la forma è quella del recipiente in cui è contenuto
▪ Non ha forma né volume propri dato che può scorrere liberamente
▪ Ha una forma propria caratteristica e anche un volume proprio
7. Quando si raffredda un materiale liquido quali delle seguenti trasformazioni non possono
avvenire? (più di una corretta)
▪ Evaporazione
▪ Condensazione
▪ Solidificazione
▪ Fusione
▪ Sublimazione
▪ Brinamento
8. Un materiale viene trasferito da un contenitore ad un altro più grande; sapendo che la forma del
materiale non cambia, indicare lo stato di aggregazione del materiale. Motiva la risposta.
9. Elenca alcune proprietà chimiche (almeno tre).
10.
Se un corpo è allo stato liquido si può affermare che: (Una sola corretta)
▪ Ha una sua forma caratteristica e ha il volume del recipiente in cui è contenuto
▪ Ha un suo volume e la forma è quella del recipiente in cui è contenuto
▪ Non ha forma né volume propri dato che può scorrere liberamente
▪ Ha una forma propria caratteristica e anche un volume proprio
11.
Quando si riscalda un materiale liquido quali delle seguenti trasformazioni non possono
avvenire? (più di una corretta)
▪ Evaporazione
▪ Condensazione
▪ Solidificazione
▪ Fusione
▪ Sublimazione
▪ Brinamento
12.
Un materiale viene trasferito da un contenitore ad un altro più grande; sapendo che in
entrambi i casi il materiale riempie completamente il contenitore, indicare lo stato di
aggregazione del materiale. Motiva la risposta.
13.
Elenca alcune proprietà fisiche (almeno tre).
Modulo 2: Miscugli
14.
Scrivi e studia lo schema della materia.
15.
Indicare il numero delle fasi che si vedono nei seguenti miscugli e descriverle:
Acqua e anidride carbonica
Coca cola
Acqua e benzina
Acqua e vino Acqua e sale
16.
Acqua e olio
Gelato alla stracciatella
Birra
Sale e pepe
Latte e caffè
Acqua gasata
Acqua e caffè
Fanta
Acqua e benzina
Per ogni materiale indica se è un miscuglio omogeneo (MO) o eterogeneo (ME)
bronzo
vernice
aria
granito
aceto di vino
vino
acqua di sorgente
acqua marina
sabbia
aranciata
17.
Descrivi l’apparecchiatura mostrata nel disegno (scrivi i nomi di ogni parte).
18.
L’apparecchiatura mostrata per quale tecnica di separazione si
utilizza?
torrone
acciaio
19.
Come separeresti la sostanza 1 e la sostanza 2 in base alle loro caratteristiche? Spiega nel
dettaglio.
Sostanza 1: Tfus = -10°C; Teb = 120°C; d = 0,87 g /ml
Sostanza 2: Tfus = - 45°C; Teb = 150°C; d = 1,18 g /ml
Sostanza 1 e sostanza 2 immiscibili tra loro
Sostanza 1: Tfus = 45°C; Teb = 120°C; d = 0,87 g /ml
Sostanza 2: Tfus = - 45°C; Teb = 150°C; d = 1,18 g /ml
Sostanza 1 e sostanza 2 immiscibili tra loro
Sostanza 1: Tfus = 5°C; Teb = 120°C; d = 0,87 g /ml
Sostanza 2: Tfus = - 45°C; Teb = 150°C; d = 1,18 g /ml
Sostanza 1 e sostanza 2 miscibili tra loro
Sostanza 1: Tfus = 45°C; Teb = 120°C; d = 0,87 g /ml
Sostanza 2: Tfus = - 45°C; Teb = 150°C; d = 1,18 g /ml
Sostanza 1 e sostanza 2 miscibili tra loro
Modulo 3: Tavola periodica e sostanze pure
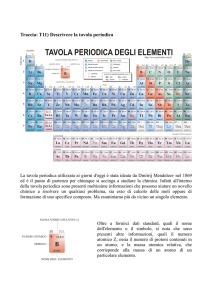
20.
Ripassa la tavola periodica: cosa sono i periodi e i gruppi (principali e secondari), i nome dei
gruppi principali, come si distinguono i non metalli dai metalli.
21.
Ripassa i simboli chimici dei principali elementi della tavola periodica (dall’1 al
20,25,26,27,28,29,30,35,47,50,53,56,78,79,80,82)
Nello schema che richiama la tavola periodica, scrivi nelle caselle appropriate le lettere
corrispondenti alle definizioni:
A
Alogeno del terzo periodo
B
Gas nobile del terzo periodo
C
Elemento del terzo gruppo con
numero atomico maggiore
D
Metallo alcalino con il numero atomico
minore
E
L’elemento appartenente al sesto periodo e al
quinto gruppo
F
Lantanide con numero atomico minore
G
Alogeno del quinto periodo
H
Gas nobile del quarto periodo
I
Elemento del sesto gruppo con numero
atomico minore
L
Metallo alcalino con il numero atomico
maggiore
M
L’elemento appartenente al quarto periodo e al
quinto gruppo
N
Attinide con numero atomico minore
22.
23.
Fe
Cu2O
Per ogni sostanza elencata dire se si tratta di un elemento(E) o di un composto (C):
NaCl
S
KBr
SO2
He
Ne
NO2
Na
Ca
Fe2O3
Modulo 4: Atomo e le particelle subatomiche
24.
Dare la definizione di atomo.
25.
Spiega le differenze tra il modello atomico di Dalton, Thomson e Rutheford.
26.
27.
Elenca le particelle subatomiche e indica le loro caratteristiche in base a massa, carica e
posizione nell’atomo.
Dare la definizione di numero atomico e di numero di massa.
28.
Dare la definizione di ione, catione e anione.
29.
Dare la definizione di isotopo.
30.
Completa la seguente tabella:
31.
Numero
di
protoni
4
Numero
di
neutroni
3
Numero
di
elettroni
2
35
32
36
15
12
15
4
5
2
4
3
4
35
32
35
17
12
18
8
5
10
Numero
atomico
Numero
di
massa
Nome
Ione
elemento (catione
anione)
Completa i seguenti esercizi e dire, per ogni elemento, se si tratta di uno ione e in caso
affermativo stabilire che tipo di ione.
13
12
++
X=
p=
e=
n=
20
16
X=
p=
e=
n=
--
19
17
21
19
X=
p=
e=
n=
+
20
17
X=
p=
e=
n=
-
19
16
X=
p=
e=
n=
X=
p=
e=
n=
Modulo 5: I legami
32.
Cosa significa configurazione elettronica?
33.
Nella configurazione elettronica quali sono gli elettroni esterni?
34.
Perché si da’ tanta importanza agli elettroni esterni? Di cosa sono responsabili?
35.
Fare la configurazione elettronica del Fosforo, del Cloro, del Neon, del Potassio, del Calcio,
dell’Azoto.
36.
Individua nell’esercizio precedente il periodo e il gruppo dell’elemento osservando la
configurazione elettronica e assicurati della corrispondenza con la tavola periodica.
37.
Cosa rappresentano i puntini nella configurazione di Lewis?
38.
Fare la configurazione di Lewis dei seguenti atomi: Iodio, Bario, Alluminio, Indio, Selenio,
Rubidio, Germanio, Arsenico, Bromo, Cesio, Gallio e Fosforo.
39.
Individua nell’esercizio precedente gli elettroni spaiati e i doppietti elettronici.
40.
Disegnare, tramite la configurazione di Lewis, le seguenti molecole:
41.
PH2F
CH2Br2
O2
LiCN
NH2Br
CHF3
Individua nell’esercizio precedente i legami semplici, doppi e tripli.
42.
Dare la definizione di elettronegatività, di come varia nella tavola periodica e di ∆e.
43.
Dare la definizione di legame covalente e legame ionico.
44.
Schematizza come si classificano i legami in base al ∆e.
45.
Stabilisci il tipo di legame presente nelle molecole dell’esercizio 30.
N2
KCN
46.
Individua la relazione tra elettroni esterni, legami ed elettronegatività.
47.
Un atomo ha 17 neutroni e 19 protoni :
a
b
c
d
e
f
g
Qual è il numero atomico dell’atomo?
Qual è il numero di massa?
Quale carica possiede il nucleo dell’atomo?
Quale atomo è?
Quanti elettroni sono presenti nell’atomo neutro?
Disegna la configurazione elettronica nei tre modi visti
evidenzia nel punto precedente gli elettroni esterni (o di legame)
48.
Un atomo ha 17 neutroni e 16 protoni :
a
b
c
d
e
f
g
Qual è il numero atomico dell’atomo?
Qual è il numero di massa?
Quale carica possiede il nucleo dell’atomo?
Quale atomo è?
Quanti elettroni sono presenti nell’atomo neutro?
Disegna la configurazione elettronica nei tre modi visti
evidenzia nel punto precedente gli elettroni esterni (o di legame)
49.
Dare la definizione di orbitale, descrivi i principali orbitali che conosci, indica da quanti
sottolivelli sono formati e disegna la forma dei due tipi visti in classe.
50.
Completa la seguente tabella:
elemento
Br
51.
Z
periodo
31
gruppo
3
3
4
2
Configurazione
Elettroni di
elettronica
legame
1s22s22p63s23p4
1s22s22p63s23p3
Completa la seguente tabella:
Numero
Elemento
di
protoni
A
B
C
D
E
F
G
H
18
16
12
16
20
17
8
20
Numero di
neutroni
15
11
5
13
15
11
5
16
Numero
Numero
Numero
Nome
Ione
di
atomico
di massa
elemento
(catione
elettroni
carica
anione)
18
18
10
18
18
18
10
18
Nella tabella ci sono atomi tra loro isotopi? Motiva la risposta.
52.
Vero o falso? Correggi quelle che ritieni false.
1.
2.
53.
tutti gli elettroni che circondano il nucleo partecipano alla formazione dei legami.
I gas nobili non hanno valore di elettronegatività perché si legano solo tra loro dando origine
ad un legame covalente puro.
Tra quali elementi della tavola periodica è facile che si instauri un legame ionico?
54.
L’elettronegatività è:
1.
L’energia liberata dagli atomi quando assumono carica negativa
2.
L’energia che serve per strappare l’elettrone più esterno così da avere un catione
3.
Un indice rappresentativo della capacità di un atomo di attrarre su di sé una carica
negativa
4.
Un indice rappresentativo della capacità di un atomo di attrarre su di sé una carica positiva
55.
Quando un atomo forma un legame chimico: (una sola risposta giusta)
Assume la struttura del gas nobile che si trova nello stesso periodo con otto protoni nel
nucleo
Cede elettroni e si trasforma nel gas nobile che segue
Si trasforma nel gas nobile più vicino
Assume la configurazione elettronica del gas nobile più vicino
56.
57.
Il legame covalente puro è: (una sola risposta giusta)
1. Un legame in cui due atomi hanno una grande differenza di elettronegatività e condividono
due o più elettroni spaiati
2. Un legame in cui la differenza di elettronegatività è nulla e c’è la condivisione di due o più
elettroni spaiati
3. Un legame in cui la differenza di elettronegatività è nulla e c’è la condivisione di solo due
elettroni spaiati
4. Un legame in cui la la differenza di elettronegatività è nulla e si formano due ioni
Quale dei seguenti modelli spiega meglio il legame metallico? (una sola risposta giusta) (p.4)
Gli ioni positivi del metallo possono muoversi in una direzione e gli elettroni nell’altra
Gli elettroni sono bloccati in posizioni rigide tra gli ioni positivi del metallo
Gli ioni negativi del metallo formano una struttura ordinata e gli elettroni di legame hanno
un’elevata mobilità
Gli ioni positivi del metallo formano una struttura ordinata e gli elettroni di legame hanno
un’elevata mobilità
58.
Il legame covalente polare è: (una sola risposta giusta)
1. Un legame in cui due atomi hanno una discreta differenza di elettronegatività e condividono
due o più elettroni spaiati
2. Un legame in cui due atomi hanno una grande differenza di elettronegatività e condividono
due o più elettroni spaiati
3. Un legame in cui la differenza di elettronegatività è nulla e c’è la condivisione di solo due
elettroni spaiati
4. Un legame in cui la differenza di elettronegatività è nulla e si formano due ioni
Modulo 6: Trasformazioni fisiche e trasformazioni chimiche
59.
Dare la definizione di fenomeno chimico e fenomeno fisico e elencare quali criteri ti permettono
di capire se è avvenuta una trasformazione chimica.
60.
Indica se le seguenti trasformazioni sono di tipo chimico (C) o di tipo fisico (F):
61.
Ghiaccio che si scioglie
Cottura di una torta
Una ringhiera che arrugginisce
Lievitazione del pane
Scoppio dell’airbag
Produzione di sale da acqua di mare
Una banana che annerisce
Fuochi di artificio
Taglio della carta
Bruciare la legna
Colorazione di capelli
Taglio di capelli
Cartavetrare
Sublimazione
Formazione della pioggia
Frutta che marcisce
Indica, per ogni classe di composti, gli elementi che lo costituiscono (metallo, non metallo, H,
O), nell’ordine corretto (la formula generale):
Sale ternario
ossiacidi
Idruri non metallici
ossido basico
Sale binario
Idrossido
Idracido
Ossiacido
62.
Completa la seguente tabella:
Composto
binario/ternario
sostanza
Formula generale
Tipo di composto
Cl2O3
H2SO3
Ca(ClO3)2
NaNO3
CuH2
NH3
FeCl2
Co2O3
Ni2O3
H2SO4
N2O3
NaOH
NH3
Ca(OH)2
FeCl2
Mg(ClO5)2
63.
Completa le seguenti tabelle:
N (+5)
O2
O2
H 2O
H 2O
Mn(OH)3
+
+
Ni(+3)
S (+6)
O2
O2
H 2O
H 2O
+
+
64.Partire dall’oro, fare reagire con ossigeno e il composto che si forma fare reagire con H 2O.
Mostrare le reazioni e bilanciarle.
65.Partire dallo zolfo (+4, +6), fare reagire con ossigeno e il composto che si forma fare reagire con
H2O. Mostrare le reazioni e bilanciarle
66.Partire dal nichel, fare reagire con ossigeno e il composto che si forma fare reagire con H 2O.
Mostrare le reazioni e bilanciarle.
67.Partire dall’azoto (+3, +5), fare reagire con ossigeno e il composto che si forma fare reagire con
H2O. Mostrare le reazioni e bilanciarle.
68.Partire dall’oro, fare reagire con ossigeno e il composto che si forma fare reagire con H 2O.
Mostrare le reazioni e bilanciarle.
69.Partire dal cloro (+1,+3, +5, +7), fare reagire con ossigeno e il composto che si forma fare
reagire con H2O. Mostrare le reazioni e bilanciarle.
70.Partire dal ferro, fare reagire con ossigeno e il composto che si forma fare reagire con H 2O.
Mostrare le reazioni e bilanciarle.
71.Definisci la legge di Lavoisier (entrambi gli enunciati).
72.Indicare il numero di ossidazione di tutti gli elementi nei seguenti composti:
Fe
I2O
MnO
Co2O3
Cr2O3
Mn2O5
73.
P8
H3PO4
FeH2
H2S
Ni(OH)3
CaI2
H2SO3
Mg(NO3)2
Co
Li2O
Mn2O3
Co2O3
Cr2O5
Mn2O7
S8
H2SO4
FeH2
H2S
Co(OH)3
CaI2
H2SO3
Fe(NO3)3
Nella seguente reazione chimica indica quali sono i reagenti e quali i prodotti:
CO + H2O CO2 + H2
74.
Considera le seguenti reazione chimica, già bilanciate e rispondi alle domande:
Na2O + Cl2O5 2 NaClO3
se faccio reagire 3,5g di ossido di sodio (Na2O) con 1,2g di anidride clorica (Cl 2O5) quanti
grammi di clorato di sodio (NaClO3) ottengo?
K2O + Cl2O3 2 KClO2
se faccio reagire 7,5g di ossido di potassio (K2O) con 5,2g di anidride clorosa (Cl 2O3) quanti
grammi di clorito di potassio (KClO2) ottengo?
75.
Bilancia le seguenti reazioni chimiche:
Ca +
H3PO4
SbCl3 +
Li
+
H2S
HCl
FeCl3 +
H2S
H2O
CO
Fe2O3
K3PO4 +
Sb2S3
Mg(NO3)2
Fe2S3
CO2
Co2S3
Na2O +
H2O
NaOH
Li3PO4 +
Ba +
Ca(NO3)2
H3PO4
CoCl3 +
K
Ni2O3
+
H2S
HBr
Be +
CH4
+
HCl
+
Fe
CO2
+
KNO3
HCl
+
Ni
Ca3(PO4)2 +
LiNO3
Ba3(PO4)2 +
Co2S3
+
H2
HCl
H2
Be3(PO4)2 +
H2
O2
CO2 +
Hg(NO3)2
NaNO3
+
HgI2
NaOH +
H3PO4
Na3PO4
+
H2O
K2O +
H2O
NaI
Li
+
H2
KBr +
H3PO4
HCl
Mg3(PO4)2 +
H2S
+
H2
KOH
CoCl3 +
CO
+
LiCl +
K2O +
+
Ca3(PO4)2 +
+
+
Mg +
K3PO4 +
HCl
H3PO4
Mg(NO3)2
H2O
KOH
LiCl +
H2
Mg3(PO4)2 +
Mg3(PO4)2 +
H2
KNO3
Modulo 7: La quantità chimica
76.
Dare la definizione di mole.
77.
Calcola la massa molare di Ni(OH)3
78.
Quanti grammi sono contenuti in 7,7 · 1023 molecole di CoBr2.
79.
Calcola quante molecole sono presenti in 122g di Au(OH)3.
80.
A quante moli corrispondono 9,3 · 10
81.
A quante moli corrispondono 54g di Na3PO4.
82.
Quanti grammi sono contenuti in 11,7 moli di Cr2O3.
83.
Calcola quante molecole sono presenti in 5,3 moli di AlCl 3.
84.
Calcola quante molecole sono presenti in 4,3 moli di Ni(OH) 3?
85.
A quante moli corrispondono 6,4 · 10
86.
Quanti grammi sono contenuti in 9,1 · 1023 molecole di Co2S3?
87.
Calcola quante molecole sono presenti in 87g di Mn(OH)3?
88.
Calcola la massa molare di Fe2(SO3)3
89.
A quante moli corrispondono 120g di BeSO4?
90.
Quanti grammi sono contenuti in 11.7 moli di Fe2O3?
91.
Dare la definizione di unità di massa atomica.
23
24
atomi di zolfo.
atomi di ferro?