SEZIONE SCIENTIFICA - Patologia in pillole
PATOLOGIA IN PILLOLE
Nr. 86
L. Mazzucchelli, M. Maffei
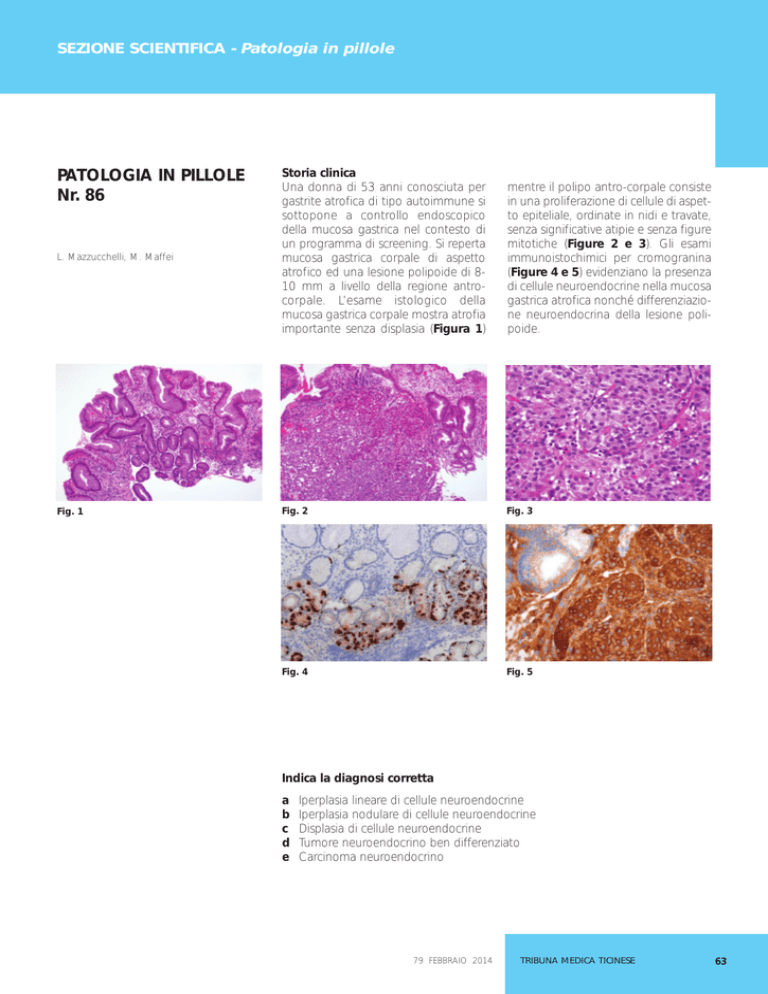
Fig. 1
Storia clinica
Una donna di 53 anni conosciuta per
gastrite atrofica di tipo autoimmune si
sottopone a controllo endoscopico
della mucosa gastrica nel contesto di
un programma di screening. Si reperta
mucosa gastrica corpale di aspetto
atrofico ed una lesione polipoide di 810 mm a livello della regione antrocorpale. L’esame istologico della
mucosa gastrica corpale mostra atrofia
importante senza displasia (Figura 1)
mentre il polipo antro-corpale consiste
in una proliferazione di cellule di aspetto epiteliale, ordinate in nidi e travate,
senza significative atipie e senza figure
mitotiche (Figure 2 e 3). Gli esami
immunoistochimici per cromogranina
(Figure 4 e 5) evidenziano la presenza
di cellule neuroendocrine nella mucosa
gastrica atrofica nonché differenziazione neuroendocrina della lesione polipoide.
Fig. 2
Fig. 3
Fig. 4
Fig. 5
Indica la diagnosi corretta
a
b
c
d
e
Iperplasia lineare di cellule neuroendocrine
Iperplasia nodulare di cellule neuroendocrine
Displasia di cellule neuroendocrine
Tumore neuroendocrino ben differenziato
Carcinoma neuroendocrino
79 FEBBRAIO 2014
TRIBUNA MEDICA TICINESE
63
SEZIONE SCIENTIFICA - Patologia in pillole
Diagnosi differenziale
Tumore neuroendocrino ben differenziato (Tipo I, associato ad iperplasia lineare di cellule neuroendocrine nel contesto di gastrite di
tipo autoimmune)
Commento
La proliferazione iperplastica o neoplastica di cellule neuroendocrine
nello stomaco è un evento abbastanza frequente e spesso di riscontro incidentale a seguito di una gastroscopia.
La diagnosi anatomo-patologica corretta, l’utilizzo di una classificazione e
terminologia di queste lesioni comune
e riconosciuta internazionalmente e
l’inquadramento clinico sono le premesse per la gestione corretta dei
pazienti.
Esiste una grande varietà di cellule
neuroendocrine diffusamente distribuite nella mucosa gastrica. Le cellule
enterocromaffini-simili (enterochromaffin-like, ECL) ne costituiscono la
maggior parte, sono localizzate principalmente negli aspetti intermedi e
profondi delle ghiandole della mucosa
gastrica corpale e producono istamina. Le cellule secernenti gastrina (cellule G) sono invece particolarmente
numerose nella regione del collo delle
ghiandole antrali. La gastrina modula
la secrezione acida (HCl) delle cellule
parietali della mucosa gastrica corpale tramite due meccanismi: quello
diretto agisce sulla produzione acida
delle cellule parietali stimolando il
recettore colecistochinina B, mentre il
meccanismo indiretto stimola il medesimo recettore di membrana delle cellule ECL favorendo la secrezione di
istamina che a sua volta stimola la
secrezione acida delle cellule parietali
agendo tramite il recettore della istamina di tipo 2. Oltre alle cellule ECL e
G che hanno rilevanza clinica, le cellule neuroendocrine della mucosa
gastrica comprendono le cellule D che
producono serotonina, le cellule A
responsabili per la secrezione di glucagone nonchè le cellule entrocromaffi-
64
TRIBUNA MEDICA TICINESE
Tipo
I
II
III
Associazione clinica
Gastrite autoimmune
MEN-1, ZES
Sporadico
Predilezione sesso
Donne (71%)
Nessuna
Uomini (74%)
Età media (anni)
63
50
55
Localizzazione
Corpo/fondo
Corpo/fondo
Antro/corpo/fondo
Distribuzione
Multicentrico
Multicentrico
Isolato
% di NET gastrici
70%-80%
6%-10%
15%-20%
Gastrina sierica
Elevata
Elevata
Normale
Cellule ECL
Iperplastiche
Iperplastiche
Normali
Dimensioni
Piccole: 77%
Intermedie:
< 1 cm, 97%< 1,5 cm tra 1-2 cm
Grandi:
diametro medio 3,2 cm
Metastasi linfonodali
5%-10%
30%
55%
Metastasi epatiche
2%-5%
10%
22%-75%
Conta mitotica
Solitamente
<2/10HPF
Solitamente
<2/10 HPF
Solitamente
2-20/10 HPF
Indice ki67
Solitamente < 2%
Solitamente <2%
Solitamente 3%-20%
Grado (WHO 2010)
G1
G1
G2
Tab. 1: Tipi di tumore neuroendocrino dello stomaco. (NET: neuroendocrine tumor, ECL: enterochromaffin-like, MEN: multiple endocrine neoplasia, ZES: Zollinger-Ellison Syndrome,
HPF:high-power field, WHO: World Health Organization). Tabella tratta e modificata da
Cockburn et al.
ni e le cellule X (dette anche cellule
P/D o A-simili) che secernono rispettivamente serotonina e grelina.
La rilevanza clinica delle cellule neurondocrine dello stomaco è limitata
essenzialmente a tre situazioni. La
prima e più semplice è il riscontro di
un tumore neuroendocrino (neuroendocrine tumor, NET) della mucosa
gastrica di aspetto polipoide, il cosiddetto carcinoide secondo la vecchia
nomenclatura. La seconda situazione
si presenta nella valutazione di atrofia
della mucosa gastrica, spesso associata a iperplasia oppure displasia di cellule neuroendocrine. Infine, l’utilizzo
di inibitori della pompa protonica (IPP)
79 GENNAIO 2014
in approssimativamente un terzo della
popolazione residente in paesi industrializzati ha causato una vera e propria endemia di ipergastrinemia,
endemia che secondo alcuni studi
potrebbe comportare un aumento di
neoplasie gastriche di tipo neuroendocrino.
A fronte di un tumore neuroendocrino
della mucosa gastrica è importante
stabilire se si tratti di un tumore insorto nel contesto di una gastrite corpale
atrofica (tipo I), di un tumore associato a sindrome di Zollinger-Ellison (ZES),
di una sindrome da neoplasia endocrina multipla (MEN) di tipo 1 oppure
SEZIONE SCIENTIFICA - Patologia in pillole
WHO 2010 Grado
Indice mitotico/10 HPF
Indice ki67 (%)
NET G1
<2
≤2
NET G2
2-20
3-20
NEC G3
>20
>20
NET: Neuroendocrine tumor; NEC: Neuroendocrine carcinoma; HPF: High Power Field; WHO
World health Organization
Tab. 2: Classificazione WHO 2010 dei tumori neuroendocrini
Fig. 6: (da Cockburn et al)
Proliferazioni di cellule ECL evidenziate con analisi immunoistochimiche per cromogranina.
A: l’ iperplasia lineare è definita da almeno due gruppi lineari di 5 cellule disposte alla base
delle ghiandole gastriche. B:l’iperplasia nodulare consiste di aggregati di almeno 5 cellule di
diametro inferiore a 150 µm. C: l’iperplasia adenomatoide è definita da un aggregato di
almeno 5 noduli. D: la displasia di cellule neuroendocrine è definita dalla fusione di noduli e
da perdita della membrana basale oppure da aggregati maggiori di 150 µm di diametro.
iperparatiroidismo (tipo II) o infine di
un tumore neuroendocrino sporadico
(tipo III, vedi anche Tabella 1). I NET di
tipo I costituiscono il 70-80% dei NET
gastrici. Essi insorgono nel contesto di
ipergastrinemia secondaria ad atrofia
e scomparsa delle cellule parietali
responsabili della secrezione acida nel
corpo/fondo gastrico. In questo contesto è quindi importante valutare la
mucosa gastrica corpale non neoplastica per escludere o confermare la
presenza di una gastrite atrofica. I NET
di tipo I sono ben differenziati, spesso
79 FEBBRAIO 2014
multicentrici, di piccole dimensioni,
con infiltrazione limitata alla mucosa
gastrica e in genere con prognosi
favorevole. I NET di tipo II sono più rari
(5-8% dei NET gastrici) e vengono
solitamente diagnosticati nel corso di
accertamenti per ZES oppure MEN-1.
La mucosa gastrica corpale si presenta
in questi pazienti come ipertrofica con
allungamento dei corpi ghiandolari,
senza significativa flogosi. I NET sporadici costituiscono circa il 20% dei NET
gastrici e sono più spesso diagnosticati quando diventano sintomatici a
causa delle dimensioni, di sanguinamenti dovuti ad erosione della mucosa oppure in presenza di stadi avanzati con metastasi. La mucosa gastrica
corpale circostante è di regola di
aspetto istologico normale.
La classificazione OMS/WHO dei
tumori del tratto gastrointestinale
pubblicata nel 2010 sottolinea l’importanza di aspetti morfologici e dell’indice di proliferazione per stabilire il
grado di differenziazione di un NET.
L’indice di proliferazione include la
conta delle figure mitotiche e/o la proliferazione determinata dal numero di
cellule neoplastiche con espressione
nucleare di ki67, una proteina che
viene espressa solo durante la replicazione cellulare (Tabella 2). Nella pratica quotidiana le analisi immunoistochimiche per ki67 rivestono un ruolo
importante soprattutto perché il
numero di cellule neoplastiche presenti nelle piccole biopsie gastriche è
spesso insufficiente per valutare il
numero di figure mitotiche, in quanto
ne servirebbero almeno 500-2000.
L’atrofia della mucosa gastrica è caratterizzata dalla presenza di fibrosi o tessuto connettivo in sostituzione di
ghiandole gastriche oppure da alterazioni metaplastiche di tipo intestinale o
pilorico. L’atrofia metaplastica o nonmetaplastica può essere multifocale e
coinvolgere la mucosa antrale e corpale oppure limitarsi al corpo/fondo
gastrico. Nel primo caso, l’atrofia è
TRIBUNA MEDICA TICINESE
65
SEZIONE SCIENTIFICA - Patologia in pillole
spesso secondaria ad infezione da
Helicobacter e, in questa situazione,
una proliferazione di cellule neuroendocrine è estremamente rara. Nel
secondo caso, il coinvolgimento esclusivo del corpo gastrico è virtualmente
sinonimo di gastrite di tipo autoimmune. La scomparsa delle cellule parietali secernenti HCl comporta uno stato
ipergastrinemico che a sua volta stimola la proliferazione delle cellule
ECL. Nella mucosa gastrica corpale
possono quindi essere osservate uno
spettro di lesioni proliferative delle cellule neuroendocrine che spaziano
dalla semplice iperplasia al franco NET
(Figura 6). Le iperplasie di tipo semplice, lineare, micronodulare oppure
adenomatoide hanno un basso potenziale di progressione in NET mentre la
displasia definita dalla fusione di
micronoduli oppure dalle dimensioni
di un nodulo maggiori di 150 µm possono progredire in neoplasie invasive.
Proliferazioni di cellule neuroendocrine di diametro maggiore di 500 µm
sono per definizione classificate come
NET e, indipendentemente se di
riscontro incidentale oppure se identificate come polipi all’esame endoscopico, necessitano di ulteriori accertamenti.
Il tasso di gastrina sierica è generalmente inferiore a 150 pg/ml. Valori
molto alti (> 400 pg/ml) sono suggestivi per ZES oppure gastrite atrofica in
stadio avanzato quando il corpo
gastrico ha perso quasi la totalità delle
cellule parietali e le cellule G cercano
inutilmente di stimolare la secrezione
di HCl liberando grandi quantità di
gastrina. Nella maggior parte di
pazienti in trattamento prolungato
con IPP si osserva un lieve rialzo della
gastrina. Nel 20-25% dei pazienti tuttavia, il rialzo di gastrina è moderato,
da 200 a 400 pg/ml, e in una piccola
frazione di questi ultimi può addirittura superare i 400 pg/ml. Alcuni
pazienti sviluppano un’iperplasia delle
cellule ECL, di solito di tipo lineare e
66
TRIBUNA MEDICA TICINESE
raramente micronodulare. La presenza di NET in pazienti in trattamento
con IPP ha sollevato discussioni a proposito di un possibile rischio di sviluppare neoplasie gastriche neuroendocrine, rischio che tuttavia appare pressoché nullo se si considera che l’incidenza di NET gastrici non è aumentata a fronte di milioni di pazienti trattati in tutto il mondo con IPP.
In conclusione, la valutazione di proliferazioni di cellule neuroendocrine
gastriche richiede un approccio integrato clinico-patologico.
L’endoscopista deve campionare non
solo lesioni della mucosa macroscopicamente visibili ma anche la mucosa
gastrica antrale e corpale non neoplastica, possibilmente con due prelievi
per ogni topografia da inviare separatamente in patologia. L’anatomo patologo, oltre agli aspetti morfologici, utilizza tecniche immunoistochimiche per
valutare estensione e dimensioni di
lesioni iperplastiche o displastiche delle
cellule neuroendocrine (cromogranina
e sinaptofisina) oppure per stabilire in
piccole biopsie il grado di differenziazione di un NET (ki67). Infine, per una
classificazione adeguata di un NET, l’anatomo patologo deve esprimersi sull’estensione ed il grado di atrofia della
mucosa gastrica con particolare attenzione a escludere oppure confermare
la presenza di una gastrite atrofica di
tipo autoimmune.
Decorso
Nel materiale di exeresi endoscopica,
in esiti di pregressa biopsia diagnostica, viene ancora repertato un residuo
tumorale di 0.2 cm, limitato alla mucosa. I margini di exeresi sono indenni. Si
decide di procedere con sorveglianza
endoscopica regolare. La gastroscopia
effettuata a 6 mesi di distanza non
mostra né recidiva locale né altre lesioni sospette per NET. Si decide quindi di
pianificare un controllo endoscopico
regolare ogni 2 anni.
79 GENNAIO 2014
Prof. Dr. med. Luca Mazzucchelli
Direttore
Istituto Cantonale di patologia
6600 Locarno
Dr. med. Massimo Maffei
Medico Caposervizio
Ospedale Regionale di Lugano
Civico e Italiano
Bibliografia
Cockburn AN et al. Neuroendocrine proliferations of the stomach: a pragmatic approach for
the perplexed pathologist. Adv Anat Pathol
2013, 20:148-157
Solcia E et al. Natural history, clinicopathologic
classification and prognosis of gastric ECL cell
tumors. Yale J Biol Med 1998, 71:285-290