II PRINCIPIO DELLA TEMODINAMICA
Trasformazioni reversibili e irreversibili
Si definisce REVERSIBILE una trasformazione nella quale si può invertire il
verso del processo variando di una quantità infinitesima le condizioni
dell’ambiente circostante RIPRISTINANDO SIA PER IL SISTEMA CHE PER
L’AMBIENTE LE CONDIZIONI INIZIALI
Si definisce QUASI STATICA una trasformazione che avviene così
lentamente da fare passare il sistema attraverso una successione
di stati di equilibrio. Una trasformazione reversibile è quasi statica, ma non
è vero il contrario: se per esempio SONO PRESENTI FORZE DI ATTRITO
La trasformazione è IRREVERSIBILE
Ogni trasformazione (isoterma, adiabatica, etc.) può essere
reversibile o irreversibile a seconda di come viene attuata
In una trasformazione irreversibile NON è possibile conoscere lo
stato del sistema durante la trasformazione: è però possibile
determinare la variazione che subiscono nel processo le variabili
di stato SCEGLIENDO UN QUALSIASI (IL PIÙ CONVENIENTE)
PERCORSO REVERSIBILE che colleghi gli stati iniziale e finale
(sono stati di equilibrio) della trasformazione.
- Ad esempio si può calcolare ΔEint -
MACCHINE TERMICHE
Si definisce MACCHINA TERMICA un apparato in grado di convertire
energia CEDUTA AL SISTEMA sotto forma di CALORE in LAVORO
effettuato DAL SISTEMA SULL’AMBIENTE. Può anche avvenire il
processo opposto. Una macchina termica opera in modo CICLICO.
Le trasformazioni possono essere reversibili o irreversibili.
ESEMPIO (trasformazione su un gas ideale):
Trasformazione 1 (ab). Si innalza
la temperatura del gas; si aumenta la
pressione (forza esercitata su un pistone)
mantenendo il volume costante
Trasformazione 2 (bc). Si innalza
la temperatura del gas; si lascia
espandere il gas a pressione costante
temperatura del gas; si abbassa la
pressione (si riduce la forza sul pistone)
mantenendo il volume costante
¾ Nelle prime due trasformazioni
il calore è assorbito (Q>0); è
ceduto (Q<0) nelle altre due
¾ Il lavoro totale nel ciclo è positivo
(ciclo percorso in verso orario)
Trasformazione 3 (cd). Si riduce la
Trasformazione 4 (da). Si riduce la
temperatura del gas lasciando costante
la pressione: il volume diminuisce
Il calore totale ceduto dal sistema è:
Qa = Q1 + Q2 (Qa > 0)
Qc = Q3 + Q4 (Qc < 0)
Il calore totale scambiato nel ciclo è
(+ I principio della termodinamica):
Q = Qa − Qc = L
Il calore totale assorbito dal sistema è:
Si definisce RENDIMENTO di un ciclo il rapporto
η=
L
Qa
=
Qa − Qc
Qa
= 1−
Qc
Qa
Qa > Qc
II PRINCIPIO DELLA TERMODINAMICA
enunciato di KELVIN-PLANK
IN UN PROCESSO CICLICO NON E’ POSSIBILE CONVERTIRE INTERAMENTE
CALORE IN LAVORO SENZA CHE AVVENGANO VARIAZIONI NELL’AMBIENTE
NON E’ POSSIBILE REALIZZARE UN CICLO CHE SOTTRAGGA CALORE AD UNA
SORGENTE A TEMPERATURA UNIFORME E LO CONVERTA COMPLETAMENTE
IN LAVORO
η <1
macchina
termica
ideale
NON ESISTE UNA MACCHINA TERMICA IDEALE
macchina
termica
reale
CICLI FRIGORIFERI
Un frigorifero è essenzialmente una macchina termica che funziona in modo
inverso: il calore QL è assorbito dalla sorgente a temperatura minore TL ; il
calore QH è ceduto al serbatoio a temperatura maggiore TH
Nel ciclo non c’è variazione
di energia interna: L=Q
L = Q = QH − QL
QL > 0 QH < 0
QH > QL
frigorifero ideale (a) e reale (b)
Per un frigorifero
può essere definito
un COEFFICIENTE DI
EFFICIENZA, K:
K=
(a)
(b)
QL
L
=
QL
QH − QL
Caso ideale: L = 0, K =∞
II PRINCIPIO DELLA TERMODINAMICA
enunciato di CLAUSIUS
NON E’ POSSIBILE UN PROCESSO CICLICO NEL QUALE IL CALORE FLUISCA
SPONTANEAMENTE DA UN CORPO PIÙ FREDDO AD UNO PIÙ CALDO SENZA
CHE NULL’ALTRO ACCADA
K ≠∞
NON ESISTE UN FRIGORIFERO IDEALE
EQUIVALENZA DEI DUE ENUNCIATI
Supposto esista una macchina termica ideale (violazione dell’enunciato
di Kelvin-Plank), se la si pone a contatto con un frigorifero anche questo
deve essere ideale (violazione dell’enunciato di Clausius)
QH = L
Q'H = Q'L + L
Q 'H − QH = Q' H − L = Q ' L
La violazione dell’enunciato di Kelvin–Plank implica
la violazione dell’enunciato di Clausius e viceversa,
perciò i due enunciati sono equivalenti
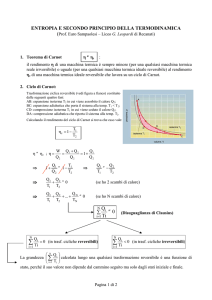
Il ciclo di Carnot (reversibile)
La sostanza di lavoro è un gas ideale, posto in un contenitore cilindrico.
Si usano due termostati alle temperature TH e TL. Il ciclo consiste di
quattro trasformazioni reversibili: due isoterme e due adiabatiche
QH
QL
TH
TL
Trasformazione 1 (ab): espansione isoterma
Il cilindro è posto a contatto con il termostato a temperatura TH (a); si rimuove
gradualmente peso sul pistone lasciando che il gas si espanda fino allo stato b
Q1 = QH
QH = L1 > 0
Il cilindro è isolato termicamente (b); si rimuove ancora gradualmente peso sul pistone
lasciando che il gas si espanda fino allo stato c : viene raggiunta la temperatura minore
ΔEint = − L2 < 0
Lavoro compiuto dal sistema (positivo)
Trasformazione 3 (cd): compressione isoterma
Il cilindro è posto a contatto con il termostato a temperatura minore (c); si aggiunge
gradualmente peso sul pistone comprimendo il gas fino allo stato d
Q3 = − QL
ΔEint = 0
Trasformazione 2 (bc): espansione adiabatica
Q2 = 0
Calore assorbito dal sistema
Calore ceduto dal sistema
ΔEint = 0 QL = L3 < 0
Trasformazione 4 (da): compressione adiabatica
Il cilindro è isolato termicamente (d); si aggiunge ancora gradualmente peso sul pistone
comprimendo il gas fino allo stato a : viene raggiunta di nuovo la temperatura maggiore
Q4 = 0
ΔEint = − L4 > 0
Lavoro compiuto sul sistema (negativo)
RENDIMENTO DEL CICLO DI CARNOT REVERSIBILE
Vb
QH = L1 = nRTH ln
Va
V
QL = L3 = nRTL ln d
Vc
TH Vbγ −1 = TLVcγ −1
TH Vaγ −1 = TLVdγ −1
Qa = QH
Qc = QL
QH
TH ln(Vb Va )
=
QL
TL ln(Vc Vd )
Vbγ −1 Vcγ −1
= γ −1
γ −1
Va
Vd
QH
TH
=
QL
TL
Vb Vc
=
Va Vd
TL TH − TL
η = 1−
= 1−
=
Qa
TH
TH
Qc
per il ciclo
frigorifero:
K=
Il rendimento di una macchina di Carnot reversibile
dipende solo dalle due temperature fra le quali opera
TL
TH − TL
Altri cicli tecnici
Ciclo di Stirling
espansione isoterma reversibile (T2)
isocora reversibile (da T2 a T1< T2)
compressione isoterma reversibile (T1)
isocora reversibile (da T1 a T2)
Ciclo Otto (motore a scoppio)
isobara OA (aspirazione)
adiabatica reversibile (compressione)
isocora reversibile (accensione e combustione)
adiabatica reversibile (espansione)
isocora reversibile (decompressione)
isobara AO (scarico)
Ciclo Diesel (motore Diesel)
isobara OA (aspirazione)
adiabatica reversibile (compressione)
isobara reversibile (iniezione e combustione)
adiabatica reversibile (espansione)
isocora reversibile (decompressione)
isobara AO (scarico)
TEOREMA DI CARNOT
Tutte le macchine reversibili che lavorano fra due sole sorgenti
alle temperature TH e TL hanno lo stesso rendimento (= a quello
della macchina di Carnot reversibile); qualsiasi altra macchina che
lavori fra le stesse sorgenti non può avere rendimento maggiore. Il
risultato è indipendente dal particolare sistema che compie il ciclo.
Si può dimostrare che il teorema di Carnot è conseguenza del II principio
della termodinamica: se si viola il teorema di Carnot si viola anche il II
principio della termodinamica
se
η >η'
L
QH
>
L
Q'H
L = QH − QL = Q ' H − Q ' L
Q'H − QH = Q' L − QL = Q
Q'H − QH
calore totale ceduto
Q'L − QL
calore totale assorbito
Q>0
!
In particolare una macchina irreversibile che lavora fra le due
sorgenti alle temperature TH e TL ha rendimento minore della
macchina reversibile di Carnot
TEOREMA DI CLAUSIUS
ηirrev
Qc
Qc
TL
−
≤−
Qa
TH
TL
= 1−
≤ 1−
Qa
TH
Qc
TL
≥
Qa
−
TH
il segno = vale per
le trasformazioni
reversibili
Qc
TL
+
Qa
TH
≤0
n
Qi
∑1 T ≤ 0
i
oppure
Qc
TL
≥
Qa TH
Qc < 0
Qa > 0
∫
δQ
T
≤0
T è la temperatura della sorgente con cui il sistema scambia calore: se il
processo è reversibile coincide con la temperatura del sistema che compie il ciclo
SCALA TERMODINAMICA DELLA TEMPERATURA
Il rendimento massimo di una macchina reversibile operante fra
due sole temperature è il rendimento della macchina di Carnot,
che dipende solo dalle temperature di lavoro: il rendimento di un
ciclo di Carnot quindi NON DIPENDE DALLA SOSTANZA DI LAVORO
QL
TL
=
TH QH
Si definisce una scala delle temperature, la
SCALA TERMODINAMICA; si fissa per tale scala
la temperatura al PUNTO TRIPLO al valore:
Il termometro è costituito
da una macchina di Carnot
reversibile che opera fra la
temperatura da misurare e
quella del punto triplo
Q
θ
=
θ tr Qtr
θ tr = 273.16 K
θ = 273.16
Q
Qtr
NELLA SCALA TERMODINAMICA Q HA LA FUNZIONE DI PROPRIETA’
TERMOMETRICA
LA SCALA TERMODINAMICA COINCIDE CON LA SCALA DEL GAS IDEALE
(KELVIN)
SI TRATTA DI UNA DEFINIZIONE ASSOLUTA DELLA TEMPERATURA
RENDIMENTI MASSIMI TEORICI
TL TH − TL
= 1−
=
η = 1−
Qa
TH
TH
Qc
QF
QF
TF
K=
=
=
W
QC − QF TC − TF
Per una qualsiasi macchina
termica reversibile
Per una qualsiasi macchina
frigorifera reversibile
ENTROPIA
Qa
TH
=
Qc
TL
Qa e Qc hanno segni opposti:
tralasciando i valori assoluti Ä
Qa Qc
+
=0
TH TL
Un ciclo reversibile è sempre approssimabile con
un insieme di cicli di Carnot: la somma algebrica
del calore totale scambiato e quella del lavoro
compiuto in ognuno dei cicli di Carnot così
individuati sono equivalenti rispettivamente a
calore totale scambiato e lavoro compiuto nel
ciclo determinato dalla linea frastagliata che
approssima il ciclo reale, formata da adiabatiche
ed isoterme. Il ciclo reale può essere
approssimato sempre meglio da un numero via
via più elevato di cicli di Carnot.
Q
∑T =0
∫
δQ
T
=0
(δQ non è un differenziale esatto = non esiste una funzione di cui δQ sia il
differenziale. δQ indica una quantità molto piccola)
Se l’integrale di una funzione esteso ad un cammino chiuso è nullo è
possibile definire una grandezza che dipende solo dallo stato del
sistema e non dal particolare modo con cui lo stato è raggiunto:
la funzione è allora una VARIABILE DI STATO (processi reversibili).
E’ una variabile additiva.
δQ
è allora il differenziale esatto di una variabile di stato
T
dS =
δQ
la nuova variabile di stato è definita ENTROPIA
nel SI l’entropia si misura in J/K
T
∫ dS = 0
b
b
∫ dS = ∫ dS
a
a
percorso 1 percorso 2
b
a
a
b
b
b
a
a
∫ dS + ∫ dS = 0
∫ dS − ∫ dS = 0
percorso 1 percorso 2
percorso 1 percorso 2
b
b
a
a
ΔS = Sb − S a = ∫ dS = ∫
δQ
T
per qualsiasi trasformazione reversibile
Considerando una trasformazione reversibile di un gas ideale:
δQ = dEint + δL
= nCV dT + pdV
nRT
= nCV dT +
dV
V
quindi:
1
nRT
δQ
= (nCV dT +
dV )
V
T
T
dT
dV
= nCV
+ nR
V
T
dS =
Vb
δQ
dT
dV
Tb
Sb − S a = ΔS = ∫
= nCV ∫
+ nR ∫
= nCV ln + nR ln
T
T
V
Ta
Va
Casi particolari:
isoterma reversibile
ΔS = ∫
δQ
1
Q
= ∫ δQ =
T
T
T
δQ
adiabatica reversibile
ΔS = ∫
trasformazione ciclica
ΔS = 0
T
= 0 (δQ = 0)
Nel caso di trasformazioni irreversibili è possibile calcolare la
variazione di entropia nel processo individuando una
qualsiasi TRASFORMAZIONE REVERSIBILE fra gli
stessi stati iniziale e finale
Esempio: ESPANSIONE LIBERA DI UN GAS PERFETTO
Si può scegliere una isoterma per il calcolo di ΔS:
b
ΔS = Sb − S a = ∫
a
δQ
b
1
Q L
= ∫ δQ = =
T
T a
T T
VB
L
ΔS = = nR ln
VA
T
ΔEint = 0
= nR ln 2 (avendo posto : VB = 2VA )
Esempio: SCAMBIO DI CALORE FRA DUE CORPI
trasformazione reversibile
a pressione costante
Sb − S a = ∫
T
V
δQ
= nCV ln b + nR ln b
T
Ta
Va
Tb
Tb
Tb
Tb
= nCV ln + nR ln = nC p ln = mc p ln
Ta
Ta
Ta
Ta
Te
ΔS1 = m1c1ln > 0
T1
Te
ΔS 2 = m2 c2 ln < 0
T2
Durante una transizione di fase la temperatura si mantiene costante per il
calcolo dell’entropia si può scegliere una trasformazione isoterma:
ΔS3 = m fus
λ fus
T fus
>0
ΔS 4 = − msolid
λsolid
Tsolid
<0
A partire dal concetto di entropia è possibile enunciare il II principio della
termodinamica in forma più generale:
IN QUALSIASI TRASFORMAZIONE TERMODINAMICA CHE
EVOLVA FRA DUE STATI DI EQUILIBRIO L’ENTROPIA
DELL’UNIVERSO (SISTEMA + AMBIENTE) PUÒ SOLO
RESTARE COSTANTE O AUMENTARE
• L’entropia rimane costante nelle TRASFORMAZIONI REVERSIBILI;
• l’entropia aumenta in quelle IRREVERSIBILI.
In particolare nel caso di una trasformazione ciclica:
• se il ciclo è reversibile:
ΔSsist = 0 (ciclo) ⇒ ΔS univ = ΔS amb = 0
• se il ciclo è irreversibile:
ΔSsist = 0 (ciclo) ⇒ ΔS univ = ΔS amb > 0
Il calore non può fluire da un corpo freddo ad uno caldo
−Q
ΔS2 =
T2
ΔSuniv =
−Q
T2
Q
ΔS1 =
T1
⎛1 1⎞
+
= − Q ⎜ − ⎟ < 0!!
T1
⎝ T2 T1 ⎠
Q
Ricordando per un gas
ideale in espansione
libera:
ΔS > 0
L
V
ΔS = = nR ln B
T
VA
VB > V A
Il sistema è isolato
La trasformazione è
irreversibile
IL GAS PUÒ SOLO ESPANDERSI
ENTROPIA E PROBABILITÁ
9Lo stato microscopico del sistema (MICROSTATO) è noto quando
sono noti ad ogni istante di tempo posizione e velocità di ogni
parte del sistema (J DINAMICA MOLECOLARE)
9Ad un dato stato macroscopico (MACROSTATO) possono
corrispondere diversi MICROSTATI (J TERMODINAMICA)
La MECCANICA STATISTICA prevede con quale probabilità può
9realizzarsi
un determinato macrostato: quello a cui corrisponde
il numero di microstati più elevato
Un sistema tende spontaneamente al macrostato
più probabile
Esempio: volendo distribuire in modo
casuale n particelle in 2 recipienti
quale è la probabilità che m siano
nel primo e (n-m) nel secondo?
⎛n⎞
n!
Wn = ⎜⎜ ⎟⎟ =
⎝ m ⎠ m!(n − m)!
STATO PIÚ PROBABILE = STATO DI EQUILIBRIO:
É CARATTERIZZATO DAL VALORE MASSIMO
DELL’ENTROPIA DEL SISTEMA
w è il massimo numero di
microstati che corrispondono
ad un dato macrostato =
probabilità termodinamica
S = k B lnw
L’entropia è additiva
(w=w1·w2)
IMPOSSIBILE ¨ ESTREMAMENTE IMPROBABILE
Gli urti tendono a cancellare le differenze: un sistema evolve in modo
spontaneo verso stati in cui le grandezze p e T sono uniformi. Questo
equivale a realizzare il numero massimo di microstati corrispondenti allo
stesso macrostato. Da questo discende l’irreversibilità meccanica e termica.
III PRINCIPIO DELLA TERMODINAMICA
È strettamente legato al secondo principio, e in alcuni casi è
considerato come una conseguenza di quest‘ultimo. Può essere
enunciato dicendo che è impossibile raggiungere lo zero
assoluto con un numero finito di trasformazioni e fornisce
una precisa definizione di ENTROPIA: l'entropia si può pensare
come la misura del grado di disordine di un sistema. Il terzo
principio afferma che l'entropia, cioè il disordine, di un sistema
isolato non può diminuire. Si può anche affermare che quando un
sistema isolato raggiunge una configurazione di massima entropia
non può subire trasformazioni: ha raggiunto quindi una
condizione di equilibrio.
La variazione di entropia associata ad una trasformazione
reversibile di un sistema tende a zero al tendere a zero
della temperatura termodinamica assoluta
perciò:
(a)
Per una isoterma reversibile:
ΔS ⎯T⎯
⎯→ 0
→0
⇒
TΔS = Q → 0
Per TJ0 K diventa sempre più difficile sottrarre calore ad un
corpo: con un numero finito di processi non è possibile
raggiungere T=0 K
(b)
1 ⎛ dQ ⎞ 1 ⎛ dS ⎞ 1 ⎛ dS ⎞
C= ⎜
⎯→ 0
⎟ = T⎜
⎟= ⎜
⎟ ⎯T⎯
→0
n ⎝ dT ⎠ n ⎝ dT ⎠ n ⎝ dlnT ⎠