Scheda ECTS SUA
Descrizone delle singole attività formative (Quadro B1 e sotto quadri)
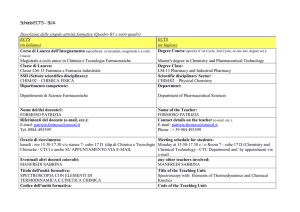
ECTS
(in Italiano)
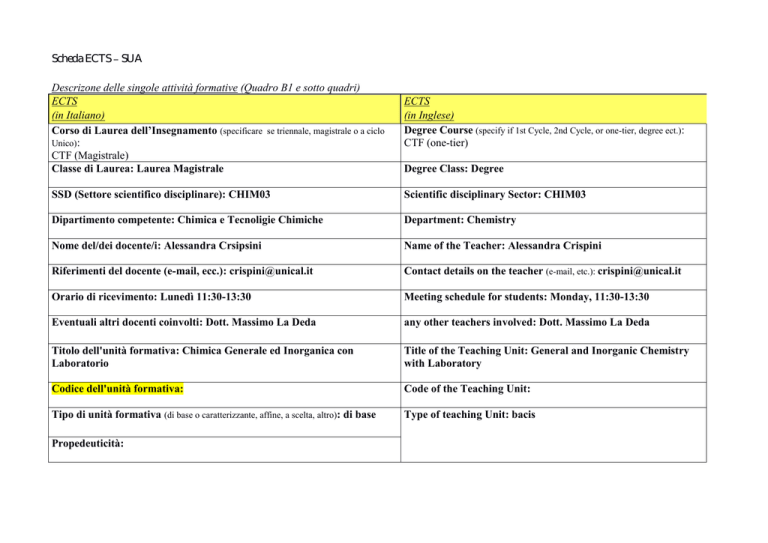
Corso di Laurea dell’Insegnamento (specificare se triennale, magistrale o a ciclo
Unico):
CTF (Magistrale)
Classe di Laurea: Laurea Magistrale
ECTS
(in Inglese)
Degree Course (specify if 1st Cycle, 2nd Cycle, or one-tier, degree ect.):
CTF (one-tier)
Degree Class: Degree
SSD (Settore scientifico disciplinare): CHIM03
Scientific disciplinary Sector: CHIM03
Dipartimento competente: Chimica e Tecnoligie Chimiche
Department: Chemistry
Nome del/dei docente/i: Alessandra Crsipsini
Name of the Teacher: Alessandra Crispini
Riferimenti del docente (e-mail, ecc.): [email protected]
Contact details on the teacher (e-mail, etc.): [email protected]
Orario di ricevimento: Lunedì 11:30-13:30
Meeting schedule for students: Monday, 11:30-13:30
Eventuali altri docenti coinvolti: Dott. Massimo La Deda
any other teachers involved: Dott. Massimo La Deda
Titolo dell'unità formativa: Chimica Generale ed Inorganica con
Laboratorio
Title of the Teaching Unit: General and Inorganic Chemistry
with Laboratory
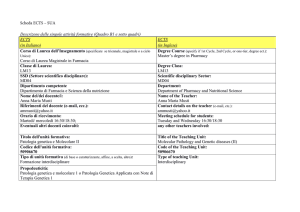
Codice dell'unità formativa:
Code of the Teaching Unit:
Tipo di unità formativa (di base o caratterizzante, affine, a scelta, altro): di base
Type of teaching Unit: bacis
Propedeuticità:
Livello dell'unità formativa (es. I, II, o III ciclo; ove pertinente, livello intermedio) : I
Level of the Teaching Unit: first level
Anno di studio/corso (ove pertinente): I Anno
Year of study: First Year
Anno/Semestre/Trimestre ove l'unità formativa viene erogata:
I Anno, I Semestre
Year, Semester, trimester in which the teaching unit is provided
First Year, first semester
Periodo: dal- al:
Ottobre/ Febbraio
Ore di lezioni frontali: 56
Period: from October to February
Ore studio individuali:
Hours of individual study:
Ore di laboratorio (ove pertinente): 24
Laboratory hours (where applicable): 24
Numero di crediti formativi CFU/ECTS erogati: 9 CFU
Number of Credits CFU/ECTS awarded: 9 CFU
Lingua di insegnamento: Italiano
Teaching language: Italian
Organizzazione della didattica (lezioni, esercitazioni, laboratorio, ecc.): lezioni
frontali e laboratorio
Organization of teaching (lectures, tutorials, laboratory, etc.): Lectures
and Laboratory
Modalità di frequenza (obbligatoria, facoltativa): Obbligatoria
Frequency mode (compulsory, optional): Compulsory
Modalità di erogazione (frontale, a distanza, mista): Frontale
Mode of delivery (front, at a distance, mixed): Front
Metodi di valutazione (Prova scritta, orale, ecc): Prova scritta e Orale,
relazione di laboratorio a seguito di esperienze pratiche
Metodi di valutazione (Prova scritta, orale, ecc): Written and Oral,
Laboratory reports on the practical experiences done
Obiettivi formativi dell’Unità formativa (risultati d'apprendimento previsti e
competenze da acquisire):
Learning outcomes:
Hours of lectures: 56
The main goal of the course consists in the improvement of the basic knowledge
Il principale obiettivo del corso è quello di fornire una adeguata conoscenza della chimica of general and inorganic chemistry. Through the deepness of some fundamental
generale ed inorganica da base, cercando in una prima di fase di ampliare le nozioni di base subject such as atomic structure and chemical bond, it would be possible to give
scolastiche. Attraverso l’approfondimento di fondamentali argomenti quali la struttura students the possibility to correlate theorical concept with chemistry in life.
Therefore, the choice of suitable subjects is devoted to induce students to connect
atomica ed il legame chimico, si intende fornire agli studenti lo strumento concettuale per
gettare un ponte tra ciò che si percepisce e ciò che si immagina succeda. In sintesi, la scelta
dei contenuti è orientata a far sì che gli studenti riescano a comprendere i fenomeni
rifacendosi ad atomi, molecole e reazioni chimiche. Per quanto riguarda la sezione
laboratoristica, obiettivo del laboratorio è quello di stimolare l’interesse dello studente verso
gli aspetti sperimentali della materia. Verranno proposti nell’ambito del corso tra i tanti
esperimenti quelli più interessanti e stimolanti in modo da illustrare adeguatamente gli aspetti
fondamentali delle reazioni chimiche fondamentali.
chemical transformation experienced in life with atoms, molecules and chemical
reactions. As regards as the laboratory section of the course, the idea is to
stimulate the student interests towards the practical aspects of chemistry.
Therefore, the experiences proposed will be related with the fundamental aspects
of chemical reactions in conjunction with the teaching lessons.
Prerequisiti e co-requisiti: Conoscenza scolastiche di base di chimica,
fisica e matematica
Prerequisities/Co-requsities: Basic knowledge of chemistry,
physics and mathematics
Unità formative opzionali consigliate:
Other optional Teaching Units:
Contenuti del corso/programma:
Introduzione alla tavola Periodica degli Elementi. Concetto di valenza.
Composti molecolari e ionici. Concetto di mole. Massa molare degli elementi.
Stechiometria delle reazioni.
Nomenclatura chimica. Reazioni chimiche: bilanciamento. Reazioni di ossido
riduzione e bilanciamento. Resa teorica e percentuale.
Struttura atomica (natura elettrica della materia, la struttura dell'atomo, origini
della teoria quantistica, il modello di Bohr, l'atomo di idrogeno, numeri
quantici, atomi polielettronici)
Il legame chimico (parametri della struttura molecolare, legami ionici, legami
covalenti, orbitali atomici e molecolari, geometria molecolare, polarità dei
legami, legami multipli, legame metallico, legame ad idrogeno)
Orbitali atomi, orbitali ibridi, strutture di Lewis, e teoria VSEPR
Proprietà periodiche (la tavola periodica, potenziali di ionizzazione, affinità
elettronica, elettronegatività, raggi atomici e ionici)
Equilibrio chimico (natura dell'equilibrio chimico, la costante di equilibrio,
principio di Le Chatelier, calcoli con le costanti di equilibrio)
Equilibri ionici in soluzione acquosa (acidi e basi, sali a carattere acido e
basico.
Laboratorio:
Gli esperimenti proposti vengono inseriti nell’ambito dello studio sistematico
delle reazioni chimiche.
Content of the Program/Course:
Introduction to matters. Elements and compounds.
The periodic table. Molecules and ions. Naming of Inorganic
Compounds.
Chemical Equations. Atomic and molecular weight The mole.
Empirical Formulae from analyses. Quantitative informations from
balance equations. Limiting reactants. Solution stoichiometry.
Oxidation numbers. Redox Reactions.
Electronic Structure of Atoms. Bohr’s model of the hydrogen atom.
The dual nature of the electron. Quantum mechanics and atomic
orbitals. Representations of orbitals. Orbitals in many-electron
atoms. Electron configurations and the Period Table. Development
of the Period Table. Electron Shells in atoms. Sizes of atoms.
Ionization Energy. Electronic Affinities. Metals, non-metals and
metalloids.
Basic concept of chemical bonding. Lewis symbols and the octect
rule. Ionic and covalent bonding. Electronegativity. Bond polarity.
Drawing Lewis structures. Resonances structures. Exceptions to the
octet rule. Molecular geometries. The VSEPR model. Polarity of
molecules. Covalent bonding and orbital overlap. Hybrid Orbitals.
Multiple bonds.
The chemistry of solutions. The Equilibrium concept and the Le
Reazioni di precipitazione:
separazione e determinazione dei due componenti di una miscela solida;
analisi di un cloruro incognito
Reazioni acido/base:
titolazione di una acido forte con una base forte
Reazioni di ossido riduzione:
determinazione del reagente limitante in una reazione di ossido-riduzione
Chatelier principle. Ionic equilibria in aqueous solution: acids,
bases.
Laboratory:
Precipitation reactions:
Separation and determination of two different component in a solid
state mixture; Analysis of an unknown chloride.
Acid/Base reactions
Strong acid/ strong basic titration
Redox reactions:
Determination of the limiting reagent in a redox reaction.
Letture consigliate o richieste:
W.L. Masterton, C.N. Hurley, CHIMICA: Principi e Reazioni, Piccin;
D. A. MacQuarrie, P. A. Rock, Chimica Generale, Zanichelli
I. Bertini, C. Luchinat, F. Mani, CHIMICA, Casa Editrice Ambrosiana
R. Breschi, A. Massagli, Stechiometria, ETS/Pisa
P. Michelin Lausarot, G. A. Vaglio, Fondamenti di Stechiometria, Piccin
Slowinski, Wolsey, Masterton Laboratorio di Chimica (Esperimenti ed
Esercizi), Piccin
Suggested texts:
W.L. Masterton, C.N. Hurley, CHIMICA: Principi e Reazioni,
Piccin;
D. A. MacQuarrie, P. A. Rock, Chimica Generale, Zanichelli
I. Bertini, C. Luchinat, F. Mani, CHIMICA, Casa Editrice
Ambrosiana
R. Breschi, A. Massagli, Stechiometria, ETS/Pisa
Slowinski, Wolsey, Masterton Laboratorio di Chimica (Esperimenti
ed Esercizi), Piccin
Attività di apprendimento previste e metodologie didattiche:
Utilizzo di materiale video in aula per consolidamento di concetti teorici ed
esempi di problemi stechiometrici
Metodi e criteri di accertamento del profitto:
Prova finale scritta composta da 10 quesiti a risposta multipla, di cui 5 più
strettamente teorici e 5 stechiometrici.
Eventuale prova di esame orale richiesta dallo studente per miglioramento del
risultato della prova scritta di esame
Valutazione della relazione di laboratorio relativa alle esperienze fatte con
punteggio pesato sul numeri di crediti.
Tirocini/o:
Planned learning activities and teaching methods:
The use of video supports during lessons in order to fix both
theorical and practical concepts as well as stoichoimetry exercises.
Methods and assessment criteria:
Final written exam built up with 10 multiple answer questions, 5 of
which theorical and 5 stoichiometry exercises.
Oral exam on request of the student to improve the written exam
result.
Valuation of the laboratory reports on the practical experiences with
marks relative to the number of credits.
Internships/placements: