Chimica 2010
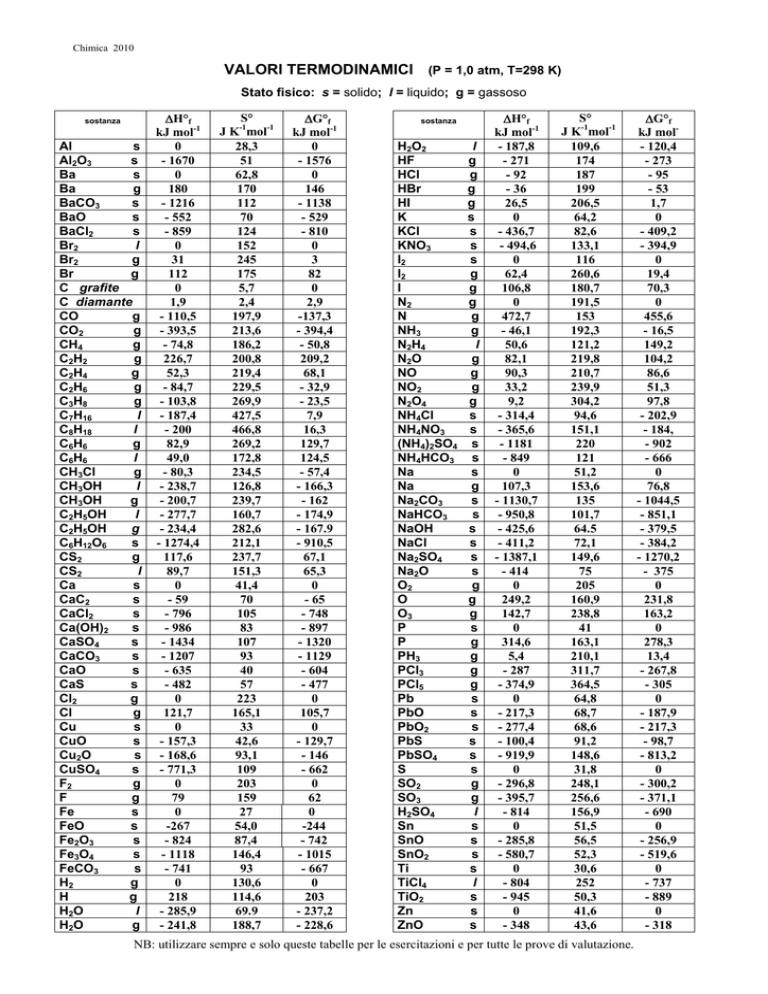
VALORI TERMODINAMICI (P = 1,0 atm, T=298 K)
Stato fisico: s = solido; l = liquido; g = gassoso
sostanza
Al
s
Al2O3
s
Ba
s
Ba
g
BaCO3
s
BaO
s
BaCl2
s
Br2
l
Br2
g
Br
g
C grafite
C diamante
CO
g
CO2
g
CH4
g
C2H2
g
C2H4
g
C2H6
g
C3H8
g
C7H16
l
C8H18
l
C6H6
g
C6H6
l
CH3Cl
g
CH3OH
l
CH3OH
g
C2H5OH
l
C2H5OH
g
C6H12O6
s
CS2
g
CS2
l
Ca
s
CaC2
s
CaCl2
s
Ca(OH)2
s
CaSO4
s
CaCO3
s
CaO
s
CaS
s
Cl2
g
Cl
g
Cu
s
CuO
s
Cu2O
s
CuSO4
s
F2
g
F
g
Fe
s
FeO
s
Fe2O3
s
Fe3O4
s
FeCO3
s
H2
g
H
g
H2O
l
H2O
g
ΔH°f
kJ mol-1
0
- 1670
0
180
- 1216
- 552
- 859
0
31
112
0
1,9
- 110,5
- 393,5
- 74,8
226,7
52,3
- 84,7
- 103,8
- 187,4
- 200
82,9
49,0
- 80,3
- 238,7
- 200,7
- 277,7
- 234,4
- 1274,4
117,6
89,7
0
- 59
- 796
- 986
- 1434
- 1207
- 635
- 482
0
121,7
0
- 157,3
- 168,6
- 771,3
0
79
0
-267
- 824
- 1118
- 741
0
218
- 285,9
- 241,8
S°
J K-1mol-1
28,3
51
62,8
170
112
70
124
152
245
175
5,7
2,4
197,9
213,6
186,2
200,8
219,4
229,5
269,9
427,5
466,8
269,2
172,8
234,5
126,8
239,7
160,7
282,6
212,1
237,7
151,3
41,4
70
105
83
107
93
40
57
223
165,1
33
42,6
93,1
109
203
159
27
54,0
87,4
146,4
93
130,6
114,6
69.9
188,7
ΔG°f
kJ mol-1
0
- 1576
0
146
- 1138
- 529
- 810
0
3
82
0
2,9
-137,3
- 394,4
- 50,8
209,2
68,1
- 32,9
- 23,5
7,9
16,3
129,7
124,5
- 57,4
- 166,3
- 162
- 174,9
- 167.9
- 910,5
67,1
65,3
0
- 65
- 748
- 897
- 1320
- 1129
- 604
- 477
0
105,7
0
- 129,7
- 146
- 662
0
62
0
-244
- 742
- 1015
- 667
0
203
- 237,2
- 228,6
sostanza
H2O2
HF
HCl
HBr
HI
K
KCl
KNO3
I2
I2
I
N2
N
NH3
N2H4
N2O
NO
NO2
N2O4
NH4Cl
NH4NO3
(NH4)2SO4
NH4HCO3
Na
Na
Na2CO3
NaHCO3
NaOH
NaCl
Na2SO4
Na2O
O2
O
O3
P
P
PH3
PCl3
PCl5
Pb
PbO
PbO2
PbS
PbSO4
S
SO2
SO3
H2SO4
Sn
SnO
SnO2
Ti
TiCl4
TiO2
Zn
ZnO
l
g
g
g
g
s
s
s
s
g
g
g
g
g
l
g
g
g
g
s
s
s
s
s
g
s
s
s
s
s
s
g
g
g
s
g
g
g
g
s
s
s
s
s
s
g
g
l
s
s
s
s
l
s
s
s
ΔH°f
kJ mol-1
- 187,8
- 271
- 92
- 36
26,5
0
- 436,7
- 494,6
0
62,4
106,8
0
472,7
- 46,1
50,6
82,1
90,3
33,2
9,2
- 314,4
- 365,6
- 1181
- 849
0
107,3
- 1130,7
- 950,8
- 425,6
- 411,2
- 1387,1
- 414
0
249,2
142,7
0
314,6
5,4
- 287
- 374,9
0
- 217,3
- 277,4
- 100,4
- 919,9
0
- 296,8
- 395,7
- 814
0
- 285,8
- 580,7
0
- 804
- 945
0
- 348
S°
J K-1mol-1
109,6
174
187
199
206,5
64,2
82,6
133,1
116
260,6
180,7
191,5
153
192,3
121,2
219,8
210,7
239,9
304,2
94,6
151,1
220
121
51,2
153,6
135
101,7
64.5
72,1
149,6
75
205
160,9
238,8
41
163,1
210,1
311,7
364,5
64,8
68,7
68,6
91,2
148,6
31,8
248,1
256,6
156,9
51,5
56,5
52,3
30,6
252
50,3
41,6
43,6
NB: utilizzare sempre e solo queste tabelle per le esercitazioni e per tutte le prove di valutazione.
ΔG°f
kJ mol- 120,4
- 273
- 95
- 53
1,7
0
- 409,2
- 394,9
0
19,4
70,3
0
455,6
- 16,5
149,2
104,2
86,6
51,3
97,8
- 202,9
- 184,
- 902
- 666
0
76,8
- 1044,5
- 851,1
- 379,5
- 384,2
- 1270,2
- 375
0
231,8
163,2
0
278,3
13,4
- 267,8
- 305
0
- 187,9
- 217,3
- 98,7
- 813,2
0
- 300,2
- 371,1
- 690
0
- 256,9
- 519,6
0
- 737
- 889
0
- 318
Chimica 2010
POTENZIALI STANDARD di RIDUZIONE a 298 K
OSSIDANTI
FORTI
Forma ossidata (Ox)
F2
S2O82H2O2+2H3O+
MnO4-+ 8H3O+
Au3+
Cl2
Cr2O72-+14H3O+
MnO2+4H3O+
O2+4H3O+
Pt2+
Br2
NO3-+4H3O+
Ag+
Fe3+
ClO3-+3H2O
BrO3-+3H2O
I2
Cu+
O2+2H2O
Cu2+
Hg2Cl2
Sn4+
Cu2+
2H3O+
2+
Pb
Sn2+
Mo3+
Ni2+
Co2+
Tl+
In3+
PbSO4
Cd2+
Fe2+
Cr3+
Zn2+
2H2O
Cr2+
Mn2+
Ti2+
Al3+
Mg2+
Na+
Ca2+
K+
Li+
RIDUCENTI
DEBOLI
Forma ridotta (Red)
-
+2e
+ 2 e+ 2 e+ 5 e+ 3 e+ 2 e+ 6 e+ 2 e+ 4 e+ 2 e+ 2 e+ 3 e+ e+ e+ 6 e+ 6 e+ 2 e+ e+ 4 e+ 2 e+ 2 e+ 2 e+ e-
+ 2 e-
+2e
+ 2 e+ 3 e+ 2 e+ 2 e+ e+ 3e+ 2 e+ 2e+ 2 e+ 3 e+ 2 e+ 2 e+ 2 e+ 2 e+ 2 e+ 3 e+ 2 e+ e+ 2 e+ e+ e-
OSSIDANTI DEBOLI
-
2F
2SO424H2O
Mn2++ 12H2O
Au
2Cl2Cr3++ 21H2O
Mn + 6H2O
6H2O
Pt
2BrNO + 6H2O
Ag
Fe2+
Cl- + 6OHBr- + 6OH2ICu
4OHCu
2Hg + 2ClSn2+
Cu+
H2 + 2H2O
Pb
Sn
Mo
Ni
Co
Tl
In
Pb + SO42Cd
Fe
Cr
Zn
H2 + 2OH Cr
Mn
Ti
Al
Mg
Na
Ca
K
Li
E0(V)
2,87
2,01
1,78
1,51
1,5
1,36
1,33
1,23
1,23
1,2
1,09
0,96
0,8
0,77
0,62
0,61
0,53
0,52
0,4
0,34
0,27
0,15
0,15
0
-0,13
-0,14
-0,2
-0,23
-0,28
-0,34
-0,34
-0,36
-0,4
-0,44
-0,74
-0,76
-0,83
-0,91
-1,18
-1,63
-1,66
-2,37
-2,71
-2,87
-2,93
-3,05
RIDUCENTI FORTI
NB: utilizzare sempre e solo queste tabelle per le esercitazioni e per tutte le prove di valutazione.
Chimica 2010
COSTANTI DI DISSOCIAZIONE DI ACIDI (Ka) IN H2O A 25 °C
acido
Ka
perclorico
»1
iodidrico
»1
bromidrico
»1
cloridrico
»1
solforico
»1
trifluoroacetico
»1
clorico
»1
nitrico
~20
iodico
1,7 ·10-1
ossalico
5,6 ·10-2
fosforoso
3,2 ·10-2
solforoso
1,4 ·10-2
cloroso
1,1 ·10-2
i.idrogenosolfato
1,0 ·10-2
fosforico
7,1 ·10-3
arsenico
5,8 ·10-3
nitroso
7,1 ·10-4
fluoridrioco
6,8 ·10-4
formico
1,8 ·10-4
i.idrogenoossalato 5,4 ·10-5
acetico
1,8 ·10-5
carbonico
4,5 ·10-7
i.idrogenofosfito
1,7 ·10-7
i.diidrogenoarseniato1,1 ·10-7
solfidrico
9,5 ·10-8
i.idrogenosolfito
6,5 ·10-8
i.diidrogenofosfato 6,3 ·10-8
ipocloroso
3,0 ·10-8
cianidrico
9,1 ·10-10
borico
5,8 ·10-10
i. ammonio
5,6 ·10-10
i.idrogenocarbonato 4,7 ·10-11
i.idrogenoarseniato 3,2 ·10-12
i.idrogenofosfato
4,2 ·10-13
i.idrogenosolfuro 1,3 ·10-13
HA
HClO4
HI
HBr
HCl
H2SO4
CF3COOH
HClO3
HNO3
HIO3
(COOH)2
H3PO3
H2SO3
HClO2
HSO4H3PO4
H3AsO4
HNO2
HF
HCOOH
HC2O4CH3COOH
H2CO3
H2PO3H2AsO4H2S
HSO3H2PO4HClO
HCN
H3BO3
NH4+
HCO3HAsO42HPO42HS-
+ H2O → H3O+ + A+ H2O
+ H2O
+ H2O
+ H2 O
+ H2O
+ H2 O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2 O
+ H2O
+ H2 O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2 O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
→
→
→
→
→
→
→
→
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
↔
H3O+ + CIO4H3O+ + IH3O+ + BrH3O+ + ClH3O+ + HSO4H3O+ + CF3COOH3O+ + ClO3H3O+ + NO3H3O+ + IO3H3O+ + HC2O4H3O+ + H2PO3H3O+ + HSO3H3O+ + ClO2H3O+ + SO42H3O+ + H2PO4H3O+ + H2AsO4H3O+ + NO2H3O+ + FH3O+ + HCOOH3O+ + C2 O42H3O+ + CH3COOH3O+ + HCO3H3O+ + HPO32H3O+ + HAsO42H3O+ + HSH3O+ + SO32H3O+ + HPO42H3O+ + ClOH3O+ + CNH3O+ + H2BO3H3O+ + NH3
H3O+ + CO32H3O+ + AsO43H3O+ + PO43H3O+ + S2-
base coniugata
ione perclorato
ione ioduro
ione bromuro
ione cloruro
i.idrogenosolfato
i.trifluoroacetato
i.clorato
i.nitrato
i.iodato
i.idrogenoossalato
i.idrogenofosfito
i.idrogenosolfito
i.clorito
i.solfato
i.diidrogenofosfato
i.diidrogenoarseniato
i.nitrito
i.fluoruro
i.formiato
i.ossalato
i.acetato
i.idrogenocarbonato
i.fosfito
i.idrogenoarseniato
i.idrogenosolfuro
i.solfito
i.idrogenofosfato
i.ipoclorito
i.cianuro
i.diidrogenoborato
ammoniaca
i.carbonato
i.arseniato
i.fosfato
i.solfuro
Gli ioni nella colonna di destra, fino allo ione nitrato compreso, sono più deboli dell’acqua
come basi (ioni spettatori, non reattivi); le specie chimiche nella colonna di sinistra sono acidi
forti ovvero totalmente ionizzati o dissociati in acqua. Fino all’acido nitrico le reazioni sono
totalmente spostate verso i prodotti: trattasi di acidi forti.
Gli acidi medi, deboli e debolissimi riportati in tabella sono estensivamente chiamati deboli,
ma sono comunque in grado di spostare l’acqua a ione H3O+.
NB: utilizzare sempre e solo queste tabelle per le esercitazioni e per tutte le prove di valutazione.
Chimica 2010
COSTANTI DI PROTONAZIONE DI BASI (Kb)
in H2O a 25 °C
base
Kb
B
+ H2O ↔ OH-+ BH+
ione ossido
ione ammide
ione etilato
metilammina
ione fenato
ammoniaca
idrazina
idrossilammina
»1
»1
»1
5,0 · 10-4
7,8 · 10-5
1,8 ·10-5
8,9 ·10-6
9,2 ·10-8
O2NH2C2H5OCH3NH2
C6H5ONH3
N2H4
NH2OH
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
+ H2O
→ OH- + OH→ OH- + NH3
→ OH- + C2H5OH
↔ OH- + CH3NH3+
↔ OH- + C6H5OH
↔ OH- + NH4+
↔ OH- + N2H5+
↔ OH- + NH3OH+
acido coniugato
ione idrossido
ammoniaca
etanolo
ione metilammonio
fenolo
ione ammonio
ione idrazonio
ione idrossilammonio
NB: utilizzare sempre e solo queste tabelle per le esercitazioni e per tutte le prove di valutazione.