Termodinamica
TERMODINAMICA
La termodinamica ci permette di studiare gli scambi
energetici e le possibilità
possibilità di trasformazione di una
porzione di materia macroscopica.
Termodinamica
• Un sistema si dice aperto se può scambiare con
l’ambiente sia calore che materia, chiuso se può
scambiare solamente calore, isolato se non può
scambiare né calore né materia.
Variabili di stato
• La variazione del valore di ciascuna variabile di stato,
causata dal passaggio di un sistema da uno stato A a uno
stato B, non dipende dalle modalità con cui avviene la
trasformazione, ma soltanto dallo stato iniziale (A) e
dallo stato finale (B).
• I valori delle variabili di stato di un sistema
(P, T) devono essere riferite al sistema in
equilibrio; in tale condizione infatti, nella
quale le proprietà fisiche e chimiche di ogni
porzione del sistema restano invariate nel
tempo, i valori delle predette variabili di
stato sono costanti per ogni porzione del
sistema. Il fatto di riferirsi soltanto a
sistemi in equilibrio è una caratteristica
essenziale della termodinamica.
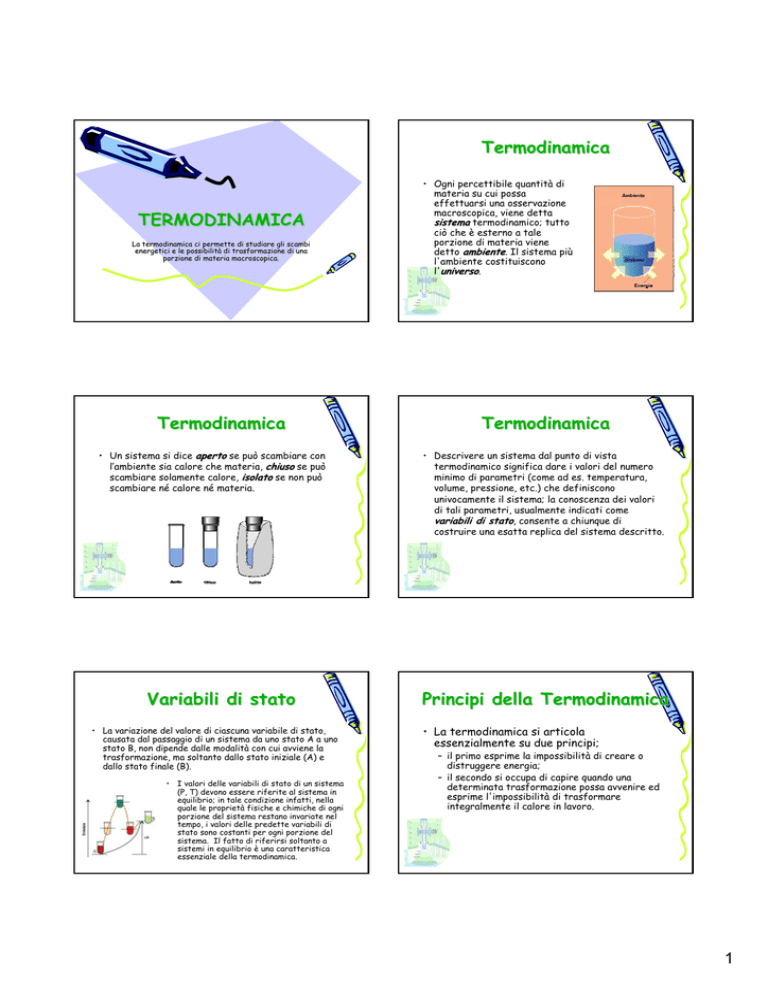
• Ogni percettibile quantità di
materia su cui possa
effettuarsi una osservazione
macroscopica, viene detta
sistema termodinamico; tutto
ciò che è esterno a tale
porzione di materia viene
detto ambiente. Il sistema più
l'ambiente costituiscono
l'universo.
Termodinamica
• Descrivere un sistema dal punto di vista
termodinamico significa dare i valori del numero
minimo di parametri (come ad es. temperatura,
volume, pressione, etc.) che definiscono
univocamente il sistema; la conoscenza dei valori
di tali parametri, usualmente indicati come
variabili di stato, consente a chiunque di
costruire una esatta replica del sistema descritto.
Principi della Termodinamica
• La termodinamica si articola
essenzialmente su due principi;
– il primo esprime la impossibilità di creare o
distruggere energia;
– il secondo si occupa di capire quando una
determinata trasformazione possa avvenire ed
esprime l'impossibilità di trasformare
integralmente il calore in lavoro.
1
I Legge
I Legge
• Il primo principio della termodinamica
postula che l'energia può essere convertita
da una forma in un'altra, ma che non può
essere né creata né distrutta: ciò significa
affermare che il contenuto di energia
dell'universo è costante.
• Ogni sistema ha un suo contenuto di energia,
energia interna (E), nella quale si sommano tutte le
forme di energia legate al suo stato (energia
dovuta agli elettroni, ai legami chimici, energia
cinetica, energia nucleare, etc.).
– Il valore assoluto della E, per un determinato sistema in
un determinato stato, non è noto; ma poiché la
termodinamica prende in esame le trasformazioni, è
sufficiente considerare solo le differenze fra i valori
delle energie interne del sistema stesso, prima e dopo una
trasformazione.
I Legge
Convenzione
• In base al primo principio,
principio perché si abbia una
variazione dell'energia interna di un sistema è
necessario che questo possa scambiare energia con
l’ambiente, cioè che non sia un sistema isolato.
• Ogni scambio di energia fra un sistema e l‘ambiente
avviene o con un intermedio meccanico, ed allora si
parla di lavoro, o per trasferimento di calore,
subordinatamente all'esistenza di una differenza di
temperatura fra il sistema e l‘ambiente
• q = calore scambiato dal sistema con l'ambiente:
viene considerata positiva la quantità di calore
acquistata dal sistema e negativa quella perduta dal
sistema
• w (work) = lavoro scambiato dal sistema con
l'ambiente: viene considerato negativo il lavoro che
il sistema compie sull'ambiente (diminuzione
dell’energia interna del sistema) e negativo quello
compiuto dall'ambiente sul sistema
– lavoro e calore non sono entità materiali, ma modi
equivalenti di trasferimento dell'energia; essi
rappresentano, per così dire, energia in transito.
Energia interna
• Se un sistema la cui composizione resta
costante è chiuso e passa da uno stato A ad
uno stato B deve scambiare energia con
l'ambiente; indicando con q ed w le quantità
di calore e di lavoro scambiate e con ∆E la
variazione di energia interna del sistema
per il primo principio della termodinamica, in
base alle convenzioni viste sopra:
∆E = q + w
q = calore acquistato
q = calore acquistato
w = lavoro subito
Energia interna
• La prima legge della termodinamica
definisce l'energia interna come funzione
di stato, e cioè assegnate le coordinate
termodinamiche di pressione, massa e
temperatura per il sistema in esame, il
valore di E è univocamente determinato a
prescindere dal processo con cui si è
raggiunto tale stato: E rappresenta quindi
una funzione di stato.
w = lavoro subito
2
Calore
Energia interna
• A questo punto va fatta un'osservazione
assai importante: è il valore di ∆E che non
dipende dal cammino percorso, ma non i
valori di q e di w presi singolarmente;
ciascuno di questi infatti varia
generalmente a seconda del cammino
percorso, ed è solo il valore della loro
differenza che resta costante; cioè
soltanto E è una funzione di stato, ma non q
ed w separatamente.
Applicazione
• Consideriamo una trasformazione durante
la quale si compia solamente un lavoro
meccanico di espansione come il processo
di riscaldamento di un litro di ossigeno da
25° C a 30° C in un vaso chiuso.
Energia trasferita in virtù di una
differenza di temperatura
∝ tipo
q ∝ ΔT
q ∝ C ΔT
q ∝ m ΔT
∝ massa del corpo
di corpo (Capacità termica)
q = c ΔT m
c = calore specifico =
quantità di calore
necessaria ad aumentare di
un grado la temperatura di
un grammo di sostanza
Volume Costante
T = 25°
25°C
• Se lavoriamo a V = cost
–
–
–
–
∆V = 0
w = - P∆V = - P x 0 = 0
∆E = q + w
∆E = qV
T = 30°
30°C
Il calore scambiato a volume costante viene descritto
dalla variazione dell’Energia Interna =
Pressione Costante
T = 25°
25°C
• Se lavoriamo a P = cost
–
–
–
–
–
–
w = - P∆V
∆E = q + w
∆E = qP - P∆V
∆E + P∆V = qP
∆H = qP
∆H = ∆E + P∆V
∆E
Calore ed Entalpia
Poiché il calore acquistato dal sistema a
pressione costante viene rappresentato
dalla variazione della funzione di stato
detta ENTALPIA si avrà:
Calore trasferito a pressione costante
ΔH = qp = cp ΔT m
T = 30°
30°C
Il calore scambiato a pressione costante è una somma di funzioni di stato e
può essere descritto con la variazione di una funzione di stato detta
Entalpia =
∆H
3
Processi a P costante
L’entalpia e l’energia sono legate dalla relazione:
∆H = ∆E + P∆V
Poiché i gas sono capaci di espandere notevolmente il loro
volume per riscaldamento mentre i liquidi e i solidi in genere
non lo fanno e quindi per questi ultimi possiamo fare
l’approssimazione che ∆V ≈ 0 e quindi:
Entalpia e reazioni chimiche
Poiché le reazioni chimiche avvengono nella
maggior parte dei casi a pressione costante, per
mezzo della variazione di entalpia possiamo
quindi misurare il calore ceduto o acquistato
durante una reazione chimica, assumendo che il
sistema sia rappresentato dalla reazione chimica
in esame e che tale reazione avvenga a pressione
costante.
∆H ≈ ∆E
Variazioni di Entalpia
Come si misura l’entalpia ??
Mentre le variazioni di entalpia possono essere
determinate sperimentalmente = qP
non è possibile misurare l’entalpia assoluta di
una specie
ΔH < 0
ΔH > 0
TRASFORMAZIONE
ESOTERMICA
TRASFORMAZIONE
ENDOTERMICA
Il calore esce dal sistema e
diminuisce l’entalpia
Il calore entra nel sistema ed
aumenta l’entalpia
Come si misura l’entalpia ??
Tale convenzione è:
Poiché quello che ci interessa è descrivere le
variazioni di entalpia e non l’entalpia assoluta
possiamo porre una condizione che ci permetta
di definire uno stato iniziale fittizio al quale
riferire poi le trasformazioni.
Entalpia di reazione
Poiché l’entalpia è una funzione di stato, la variazione di entalpia
associata ad una reazione chimica è uguale alla somma dell’entalpia
dello stato finale meno l’entalpia dello stato iniziale
ΔHreazione = Hf – Hi
Entalpia di tutti gli elementi nel loro
STATO STANDARD = 0
In generale, il valore dell’entalpia dipende dalla quantità di sostanza, dalla
temperatura, dallo stato di aggregazione e dalla pressione.
Lo STATO STANDARD di una sostanza è caratterizzato dalla pressione di 1
atm, dalla temperatura di 25°C e dallo stato di aggregazione in cui si trova
normalmente la sostanza in tali condizioni, ed è riferito ad una mole di
sostanza.
e quindi dalla somma dell’entalpia dei prodotti
meno l’entalpia dei reagenti
ΔHreazione = ΣHprodotti - ΣHreagenti
∆Hreazione
Ad esempio per la reazione
CH4 + 2O2 → CO2 + 2H2O
= [H(CO2(gas)) + 2H(H2O(gas))] - [H(CH4(gas)) + 2H(O2(gas))]
Inoltre, invertendo il senso di una reazione,
l’entalpia di reazione cambia semplicemente di segno
4
Entalpia di formazione
Legge di Hess
L’Entalpia di formazione di una specie è il calore
trasferito durante la reazione di formazione di tale
specie a partire dagli elementi che lo compongono e
quindi poiché l’entalpia è una funzione di stato
Quando una reazione chimica può essere scritta come somma di due o
più reazioni, l’entalpia della reazione globale è uguale alla somma
delle rispettive entalpie associate alle reazioni intermedie
ΔH°formazione = H°f – H°i = H°prodotti – H°reagenti =
= H°specie – H°elementi
Poiché come abbiamo visto prima è stato posto per
convenzione che H°elementi = 0 avremo
ΔH°formazione = H°specie – H°elementi = H°specie
Grazie alla legge di Hess si possono determinare entalpie di
reazione che non sono misurabili direttamente. Inoltre la
legge di Hess suggerisce un metodo conveniente per
calcolare le entalpie di reazione.
Entalpia di una specie = calore trasferito durante
la reazione di formazione dagli elementi
Entalpia
Esempio
Note le entalpie di reazione delle due reazioni seguenti si può
calcolare per differenza quella della terza, che sperimentalmente
sarebbe difficile da determinare.
ΔH o (kJ mol-1)
1) C(s) + O2 (g) → CO2 (g)
− 393.5
2) CO (g) + ½ O2 (g) → CO2 (g)
− 283.0
3) C(s) + ½ O2 (g) → CO (g)
?
ΔH(3) = ΔH(1) - ΔH(2) = − 110.5
La situazione è riassunta nel seguente diagramma dei livelli di entalpia:
La variazione di entalpia associata ad alcune comuni
trasformazioni sia chimiche che fisiche viene di solito
denominata con il nome della trasformazione stessa
•
•
•
•
•
•
•
Entalpia di Reazione
Entalpia di Formazione
Entalpia di Combustione
Entalpia di Soluzione
Entalpia di Legame
Entalpia di Atomizzazione
Entalpia di Fusione
II Legge
• La II Legge dice che durante una trasformazione
spontanea il disordine dell'universo ( ) aumenta
∆(Disord)
> 0
• Quindi per stabilire se una trasformazione possa o
no avvenire spontaneamente dobbiamo cercare di
misurare il grado di disordine che essa porta
all’intero universo e cioè sia al sistema ( ) che
all’ambiente ( ).
∆(Disord)
= ∆(Disord)
Entropia
• Per definire il disordine del sistema è stata
introdotta una funzione di stato che viene detta
entropia (S) che è proporzionale al numero di modi
diversi in cui si possono disporre le particelle del
sistema (S = k lnW). Come tutte le funzioni di
stato essa è una funzione dello stato del sistema e
non può essere quindi definita né per l'ambiente
né per l'universo.
– ∆(Disord)
= ∆S
+ ∆(Disord)
5
∆(Disord)
• La variazione di disordine che avviene
nell’ambiente è una conseguenza della
trasformazione del sistema da noi
considerato.
• Possiamo cercare quindi di mettere in
relazione la variazione del disordine
dell’ambiente con la variazione di funzioni
di stato del sistema.
∆(Disord)
• Il ruolo essenziale dell’ambiente, durante una
trasformazione, è quello di fornire o sottrarre
calore al sistema, fungendo da enorme “pozzo”
di calore, così grande che la sua temperatura
rimane costante, anche se il suo disordine varia
mediante la cessione o l’acquisto di calore.
• La variazione del disordine dell’ambiente è quindi
direttamente proporzionale alla quantità di calore
trasferita al o dal sistema.
• Anche la temperatura dell'ambiente prima del
trasferimento di calore a o da esso influenza il
disordine dell’ambiente.
∆(Disord)
• Riunendo questi concetti, possiamo dire che la
variazione di disordine dell'ambiente è
direttamente proporzionale a una variazione
opposta di calore del sistema e inversamente
proporzionale alla temperatura dell’ambiente che
possiamo considerare costante.
• Quindi possiamo descrivere la variazione del
disordine dell’ambiente in funzione della variazione
di entalpia del sistema e della temperatura.
∆(Disord)
Energia libera
• ∆(Disord)
= - ∆H/T
Energia libera
∆(Disord)
= ∆S - ∆H/T
• Se moltiplichiamo entrambi i membri di tale
equazione x (–T) otterremo:
-T x ∆(Disord)
= ∆H – T∆S
• Possiamo quindi introdurre una nuova funzione di
stato, G detta energia libera di Gibbs, che non è
altro che l'espressione dell'ordine totale
dell'universo, per cui:
∆G = -∆(Disord)
= ∆S - ∆H/T
– Questa equazione ci dice che è possibile
calcolare la variazione totale di disordine
dell’universo da informazioni sul solo sistema.
Energia libera
• Per cui:
∆G = ∆H – T∆S
Energia libera di Gibbs
x T = ∆(Ordine)
6
Energia libera
• Abbiamo visto che per la seconda legge le
trasformazioni spontanee avvengono se aumenta il
disordine dell'universo il che equivale a dire, se
diminuisce l'ordine dell'universo stesso: poiché
con G indichiamo l'ordine dell'universo, una
trasformazione avverrà spontaneamente se la G
diminuisce e quindi se:
∆G < 0
• Questo succederà se il sistema aumenta il proprio
disordine (∆S > 0) o se si ha una diminuzione
dell'entapia del sistema (∆H < 0) che comporta un
aumento del disordine dell'ambiente.
Spontaneità
• Abbiamo visto come la funzione di stato
energia libera sia la somma di altre due
funzioni di stato, l'entalpia e l'entropia:
questi due termini rappresentano
rispettivamente l'entropia dell'ambiente
(-∆H/T) e l'entropia del sistema (∆S).
Andiamo ora ad analizzare come questi due
fattori influenzino la spontaneità dei
processi.
Spontaneità
• Quando i due fattori entropia del sistema
(∆S) ed entropia dell'ambiente (- ∆H)
hanno tendenze opposte la trasformazione
avverrà solo in determinate condizioni e
cioè quando uno dei due fattori prevarrà
sull'altro rendendo l'entropia totale
dell'universo positiva.
• In questi casi la temperatura avrà un ruolo
importante nel favorire o sfavorire la
spontaneità della reazione.
Energia libera
Esisterà quindi una semplice relazione fra il segno del ∆G associato ad
una determinata reazione e la spontaneità della stessa:
Se ∆G < 0
la reazione avviene spontaneamente da sinistra a destra
Se ∆G = 0
la reazione è all'equilibrio
equilibrio il che equivale a dire che la proporzione tra
reagenti e prodotti rimane invariata nel tempo.
Se ∆G > 0
la reazione non avviene spontaneamente da sinistra a destra ma da
destra a sinistra: perché avvenga la reazione da sinistra a destra
dovremo compiere un certo lavoro.
Energia libera
Se ∆H < 0 (reazione esotermica)
e ∆S > 0 (aumenta il disordine del sistema)
la reazione è spontanea a tutte le T
Se ∆H > 0 (reazione endotermica)
e ∆S < 0 (diminuisce il disordine del sistema)
la reazione non avviene a tutte le T
Energia libera
Se ∆H > 0 (reazione endotermica)
e ∆S > 0 (aumenta il disordine del sistema)
la reazione avviene ad alte temperature
(|T∆
∆H|)
(|T∆S|>|
S|>|∆
H|)
Se ∆H < 0 (reazione esotermica)
e ∆S < 0 (diminuisce il disordine del sistema)
la reazione avviene a basse temperature
(|T∆
∆H|)
(|T∆S|<|
S|<|∆
H|)
7
Cos’è l’Energia Libera
• Ogni processo spontaneo può essere
sfruttato per produrre lavoro: ad esempio
l'acqua di una cascata può servire a
produrre energia elettrica, la combustione
della benzina può servire a far muovere un
veicolo; ma il lavoro ricavabile dall'avvenire
di una determinato processo spontaneo
dipende dal modo in cui tale processo viene
fatto avvenire.
Processi spontanei
• Nella pratica comunque noi non otteniamo mai la
massima quantità di lavoro che si potrebbe
produrre da un qualsiasi processo spontaneo.
• La funzione energia libera di Gibbs ci permette di
calcolare il lavoro massimo ottenibile da un
processo spontaneo.
• A temperatura e pressione costante il massimo
lavoro ottenibile da un processo spontaneo è
uguale alla variazione di energia libera che si ha
durante il processo.
Processi non spontanei
Cos’è l’Energia Libera
• Nel caso opposto, cioè nel caso di un
processo non spontaneo,
spontaneo la funzione di
Gibbs ci dà la misura del minimo lavoro che
dovremmo fare perché il processo possa
avvenire.
• Nella realtà sarà però necessario investire
una quantità di lavoro superiore a causa
delle perdite di efficienza del processo.
• A questo punto è possibile dare una
spiegazione realistica della funzione di
Gibbs: essa rappresenta la parte ordinata
dell'energia interna di un sistema che può
passare in uno stato meno ordinato e quindi
produrre lavoro.
8












