SMID
a.a. 2005/2006
Corso di
Statistica per la Ricerca
Sperimentale
Modelli del sonno
(Stefania Donadio)
15/2/2006
CHE COSA E’ IL SONNO ?
Un comportamento ?
Un istinto ?
Uno stato della mente?
Uno stato del corpo ?
Uno stato del sistema nervoso?
E’ UNA FUNZIONE BIOLOGICA BASICA
•Abolizione (o forte riduzione) del contatto con
l’esterno
•Reversibile spontaneamente
•Reversibile con stimolazioni esterne (più forti)
•Indispensabile per la salute e la vita
dell’organismo
•Ha occorrenza periodica
•Necessita di un ambiente adatto e di
comportamenti adeguati
•E’ plasmato dall’adattamento alla pressione
evolutiva
Il sonno esiste in tutti gli esseri viventi, in modo più
o meno evoluto
MAMMIFERI
Sonno -Veglia
UCCELLI
ANFIBI
RETTILI
PESCI
INSETTI
PROTOZOI-BATTERI
VEGETALI
(BRAC basic rest activity cycle)
Adattamento di alcuni animali per il bisogno
biologico di dormire.
MA A COSA SERVE IL SONNO?
E’ una funzione biologica basica. Come
Alimentazione
Respirazione
Riproduzione
Senza sonno gli esseri viventi muoiono.
Deprivazione di sonno. Dati sperimentali: Ratto
Rechtschaffen anni 80.
Set sperimentale controllato per fattori confondenti
(stress):
• piattaforma rotante
• ciclo luce buio controllato
• temperatura costante neutra
• accesso libero a cibo ed acqua
(http://www.cfah.org/factsoflife/vol3no3.cfm)
Deprivazione di sonno. Dati sperimentali: Ratto
Effetti: morte entro 21 giorni (in media)
Anatomia patologica: unica differenza lieve e
tardivo + volume peso ghiandole surrenali
Peso: - 20% peso corporeo
Senso di fame: aumenta
Utilizzo depositi adiposi: aumenta
Dispendio energetico: aumenta (circa del 30%)
Ormoni: tardivo aumento cortisolo ACTH
Noradrenalina: aumenta
Deprivazione di sonno. Dati sperimentali: Ratto
Dispersione calore: aumenta tardivo
Temperatura corporea: diminuisce tardivo
Aspetto corporeo: pelo giallastro, arruffato,
aspetto vecchieggiante
ulcere cutanee in aree esposte
Comportamento: ipervoracità, ipercinesia (tremori) tardiva
bradicinesia (lentezza), brividi
Metabolismo: aumenta
Sistema immunitario: studi in corso dati equivoci
Deprivazione di sonno negli umani
Patrick & Gilbert 1896 per 90 h, 3 soggetti.
• Sonnolenza vincibile solo da stimoli forti (dopo 50 ore)
più marcata nei picchi circadiani (03.00).
• Illusioni visive. Peso aumenta poi diminuisce.
• Forza muscolare, Memoria, Tempi di reazione
diminuiscono, Acutezza visiva aumenta.
• Presenza di microsonni.
• Recupero molto rapido.
Patrick, G. T. W. & Gilbert, J. A. 1896 On the effects of loss of sleep. The
psychological review. 3, 469-483.
http://ramonycajal.mit.edu/kreiman/academia/sleep2000/Lectures/l01182000.html
Deprivazione di sonno negli umani.
L’esperimento più lungo. 1964 Randy Gardner sveglio per
264 h. (.. He stayed awake for 11 days in a row without
sleeping and made it into the Guinnes Book of Records..)
II notte: difficoltà estrema di mettere a fuoco, stop TV.
III notte:calo umore, lieve atassia (mancanza di
coordinamento dei movimenti), lieve anartria (mancanza
di coordinamento linguistico).
IV: irritabilità, cali di memoria-concentrazione, illusioni
visive.
V-IX: allucinazioni, peggioramento atassia e anartria.
Deprivazione di sonno negli umani.
L’esperimento più lungo.
IV-XI : frammentazione del pensiero, senza tuttavia
elementi psicotici. Allucinazioni criticabili. Visione
fortemente deteriorata. Estrema difficoltà nel
linguaggio.
Dorme per 14.75 h. Si sveglia spontaneamente.
Si sente bene, solo un po' sonnolento. Tutti i disturbi
sono spariti.
Nei 2 sonni seguenti dorme 4 e 2.5 h in più.
TEORIA DEL RECUPERO
Moruzzi 1972, Hartmann 1973, Oswald 1974.
Recupero tissutale in sonno NREM, cerebrale in REM.
Ormoni anabolici: (crescita) GH, prolattina, ormone luteinizzante,
testosterone aumentano. (agiscono sui prodotti nutrienti, presiedendo
la crescita muscolare.)
Ormoni catabolici: cortisolo diminuisce. (ormone prodotto dalla
corticale del surrene, mantiene costante i livelli di glucosio nel
plasma, agendo sui ricambi organici)
Aumento sintesi proteica cerebrale in REM
Ma i dati sperimentali che suggeriscono l’aumento nella sintesi
macromolecole cerebrali nel sonno sono tuttavia pochi e controversi:
il recupero potrebbe essere ascritto all’immobilità di per se.
TEORIA CONSERVAZIONE ENERGIA
Zepelin &Rechtschaffen 1974
Correlazione positiva, nella scala filogenetica, fra lunghezza del sonno
e tasso metabolico.
In NREM il metabolismo cerebrale, il consumo di ossigeno e glucosio
e il flusso ematico cerebrale diminuiscono. Favorendo la
conservazione dell’energia.
Solo 120 calorie in 8 ore.
In REM i parametri metabolici ed energetici sono uguali alla veglia.
TEORIA ADATTIVA
Webb 1992, McGinty 1974
Sonno come comportamento vantaggioso ai fini della sopravvivenza
e favorito dalla pressione evolutiva.
TEORIA ISTINTIVA
Moruzzi 1972, Mc Ginty 1974.
Spinta istintiva verso un comportamento gratificante e vantaggioso.
TEORIA CONSOLIDAMENTO MEMORIA
Crick & Mitichson 1983, Jouvet 1978, McCough &al 1975
Karni &al 1995, Maquet 2001.
Ruolo del sonno REM e del sogno.
Cancellazione/consolidamento delle informazioni in memoria.
Adeguamento dell’immagine e della storia dell’io.
TEORIA DELL’INTEGRITA’ DELLA RETE
SINAPTICA
Mahowald et al. 1992, Krueger et al. 1995, Kavanau 1997.
Stabilizzazione dinamica dei circuiti sinaptici mediante stimolazione dei
circuiti sinaptici insufficientemente stimolati durante la veglia.
REM attività non motorie, NREM circuiti motori.
TEORIA DELLA TERMOREGOLAZIONE
Mahowald et al. (1992)
Legami fra sonno e temperatura corporea.
Fenomeni causati dalla deprivazione di sonno.
Neuroni termosensibili nell’ipotalamo Pre-ottico ed Anteriore.
TEORIA DEL RIASSETTO GENICO
Sahiromani et al. (1996)
Induzione dei neuroni ”immediate early genes “ ( C- fos) che
regolano la trascrizione del DNA e la sintesi proteica.
PRIMA PARTE
CENNI SULLA STRUTTURA
MICROSCOPICA DEL SONNO:
MODELLI MATEMATICI PER LE RETI
NEURONALI
Dal punto di vista microscopico, il sonno è un processo regolato da
diverse famiglie di neuroni, la trasmissione dell'informazione che
questi portano dipende dalla propagazione dei Potenziali d'azione.
I potenziali d'azione sono messaggi digitali.
Molti neuroni sono in grado di generare sequenze di impulsi a
frequenza costante o variabile e questa frequenza può essere
modulata mediante stimoli sensoriali, ingressi sinaptici o correnti
applicate.
attività neuronale in risposta
ad un potenziale d’azione
osservata nell’assone del
calamaro (fibra nervosa).
Nell'assone gigante di calamaro, in risposta ad una corrente
alternata sinusoidale, si ha un treno di potenziali d'azione con
valore soglia dipendente dalla frequenza dello stimolo.
Alcuni recettori si adattano lentamente ad uno stimolo, ovvero
scaricano potenziali d'azione ad una data frequenza o ad una frequenza
che va diminuendo fino ad un valore di stato stazionario, durante tutto
il tempo di stimolazione.
Viceversa vi sono altri recettori che si adattano rapidamente allo
stimolo e la loro risposta consiste solo di un transitorio.
Risposte di quest'ultimo tipo sono tipiche di molti recettori pressori o
di tatto.
“adattamento” della
risposta neuronale ad un
potenziale a gradino
In molte cellule recettrici la membrana cellulare presenta un normale
potenziale di riposo in assenza di stimolazione e si depolarizza solo
dopo che uno stimolo opportuno è stato applicato.
Ma oltre alle cellule che rispondono ripetitivamente a stimoli stazionari applicati, ve ne sono altre che possiedono attività ritmica spontanea
(ad es.le cellule pacemaker del cuore).
OSCILLATORI
BIOLOGICI
L'aver ottenuto, in alcuni esperimenti, delle scariche di
potenziali d'azione dopo completo isolamento di un
neurone, ha fornito la dimostrazione definitiva dell'attività
autoritmica di certe cellule nervose.
OSCILLATORI DI RILASSAMENTO
L’oscillatore di rilassamento è stato descritto per la prima volta
termine smorzante da Van Der Pol (1926).
“ritorno”
d 2ν
dν
2
2
+
a
(
v
−
1
)
+
w
v=0
2
dt
dt
Quando tra α << w, l’oscillatore si comporta come un oscillatore
lineare con una salita molto lenta, e genera una sinusoide che decade
molto lentamente. Quando α =w, il comportamento oscillatorio
diventa meno sinusoidale ma ancora abbastanza regolare. Quando,
comunque, α >>w , le oscillazioni approssimano un’onda quadra.
Van der Pol chiamò queste oscillazioni di rilassamento perché questo
comportamento ricordava la salita e discesa di carica di un condensatore.
Simulazione di un oscillatore di Van Der Pol con Mathematica
Simulazione con α = 0.5 w=1.
2
1
10
-1
-2
20
30
40
50
60
70
Simulazione di un oscillatore di Van Der Pol con Mathematica
Simulazione con α = 10 w=0.1
2
1
10
20
30
40
50
60
70
-1
-2
La caratteristica più importante di un oscillatore di rilassamento è che
le sue oscillazioni facilmente agganciano la fase con un frequenza
esterna di guida (forzamento), anche quando questa non corrisponde
alla loro frequenza naturale.
OSCILLATORI
BIOLOGICI :
Sequenze di segnali ritmici possono essere generate da un oscillatore
centrale o da un circuito riflesso in cui un segnale sensorio di ritorno
da un movimento inizia, innescando una particolare rete neuronale, la
ripetizione del movimento stesso.
Possono essere divisi in due classi:
oscillatori in cui il ritmo è generato da due o più neuroni in funzione
delle loro connessioni sinaptiche chimiche o elettriche.
oscillatori endogeni, in cui la ritmicità deriva da un’oscillazione propria del potenziale elettrico di membrana di un singolo neurone.
1° CLASSE
DUE
TIPI
Il più semplice di tali oscillatori è costituito
da due soli elementi che sono attivi
alternativamente come prodotto di
connessioni inibitorie reciproche.
La ritmicità deriva dalle caratteristiche
proprie delle membrane delle cellule che
formano un sistema elettrotonicamente
accoppiato.
(Es. REM-ON, REM-OFF)
Oscillatori per una rapida trasmissione dell'eccitamento o di un
segnale inibitorio e possono produrre anche attività sincrona.
La cellula con frequenza di scarica piú elevata determina il ritmo
mediante un accoppiamento elettrotonico con tutte le altre cellule
del gruppo. (Es. Zeitgeber)
IL MODELLO DI LOTKA-VOLTERRA
Descrive le popolazioni che interagiscono biologicamente.
Interazioni ad esempio tra due specie in un ecosistema: prede e
predatori.
Per definizione è un “Modello Dinamico”, nel quale il rate del
sopravvento di una delle due popolazioni è una funzione della
densita di entrambe le popolazioni.
Le equazioni usate per descrivere la popolazione sono:
dx
= ax − bxy
dt
dy
= − dy + cxy
dt
Rem On è il predatore
Rem Off è la preda
McCarley e Hobson (1975) usarono il modello di Volterra-Lotka per descrivere
l’alternarsi degli stati di REM-ON e REM-OFF visti come elementi
alternativamente attivi legati da connessioni inibitorie reciproche: mentre il primo
neurone è attivo, il secondo è inibito dall'attivitá di questo e rimane in uno stato
di inibizione fino a che è in grado di attivarsi e inibire il primo neurone con
modalità identiche.
FOTORECETTORI CIRCADIANI
Piccolo sottogruppo di cellule gangliari retiniche che non elabora
informazioni visive bensì trasporta “informazioni sulla luce”
LUCE = Zeitgeber cioè indicatore di tempo in quanto stimolo
che sincronizza un ritmo endogeno con l’orologio circadiano
coni e
bastoncelli
contengono
melanopsina
2° CLASSE
Oscillatore endogeni.
(Es. Il ritmo sonno-veglia, ritmo circadiano)
I possibili meccanismi che possono essere invocati per spiegare
le attività ritmiche spontanee sono più difficili da immaginare e
da definire. Molti fattori esterni e ambientali possono depolarizzare
consistentemente la membrana cellulare.
Ritmi biologici giornalieri in condizioni naturali:
• corrispondono alla durata naturale del giorno, → ritmo circadiano
(24h)
• si automantengono per lunghi periodi (settimane, mesi)→ oscillatore automatico
• sono di natura endogena in quanto indipendente da tutti i fattori ambientali
• il ciclo di questo oscillatore è sincronizzato con il ciclo luce-buio giornaliero.
IL PRINCIPALE REGOLATORE DEI RITMI CIRCADIANI È IL
NUCLEO SOPRACHIASMATICO (NSC) ∼16.000 coppie
di nuclei localizzati nell’Ipotalamo
Il SISTEMA CIRCADIANO è “orchestrato” da
1. Nucleo
Soprachiasmatico
(SNC);
2. Fotorecettori
Retinici, che
proiettano al NSC;
3. Epifisi o Ghiandola
Pineale, che secerne
la Melatonina
che scandisce
la durata della notte;
La sostanza più abbondante del NSC→ acido γ-Aminobutirrico
(GABA) che probabilmente agisce come neurotrasmettitore in tutti i
neuroni di tale complesso
I risultati sperimentali dimostrano che:
•Ogni cellula neuronale del NSC è in grado di generare e regolare
ritmi circadiani.
•Nel NSC c’è un’elevata densità neuronale, quindi si ha un’estesa
sovrapposizione delle membrane cellulari, cioè aumentano gli
scambi intra-cellulari i quali possono favorire la sincronizzazione
dei ritmi circadiani
•Il sistema circadiano è sincronizzato quando oscilla ad una
frequenza vicina alla frequenza più espressa all’interno della
popolazione neuronale del NSC.
Anche nei tessuti periferici si sono osservate oscillazioni circadiane
dell’espressione genica. Si pensa che il NSC abbia il ruolo di
SOSTENERE e SINCRONIZZARE tale ritmicità.
In questo modo gli stimoli provenienti dal NSC vengono convertiti
in “programmi temporali” per l’intero organismo che può così
adattarsi alle variazioni stagionali, alle diverse condizioni
metaboliche ecc.
Il bisogno di dormire e l’intensità del sonno sono regolati
omeostaticamente cioè si tende a mantenere un’uguale quantità di
sonno nelle 24h.
Se ciò non avviene → varia l’espressione dei geni responsabili o
coinvolti nella regolazione del sonno
La regolazione omeostatica del sonno è sotto un forte controllo
genetico. In particolare il cromosoma 13 sembra essere
responsabile della diminuizione di SWS nel sonno (Franken et al.
2001).
SECONDA PARTE
LA STRUTTURA MACROSCOPICA DEL
SONNO:
MODELLI MATEMATICI
Dal punto di vista fisiologico il SONNO è il susseguirsi di stati diversi,
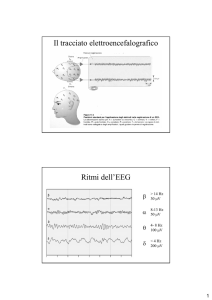
caratterizzati da un diverso tracciato ElettroEncefaloGrafico (EEG)
Per determinare lo stadio e la profondità del sonno:
1. EEG: monitorizza l’attività elettrica sulla superficie del cervello;
2. EKG: monitorizza l’attività cardiaca in battiti / minuto;
3. EMG: monitorizza il tono muscolare;
4. EOG: monitorizza i movimenti oculari
- Sonno tranquillo o profondo: NREM
(No Rapid Eye Movement)
differenti tracciati di EEG EMG EOG
- Sonno attivo: REM (Rapid Eye Movement)
Caratteristiche Principali dello stato di sonno e veglia
Osservazione
Occhi
Veglia
Aperti
NREM
Chiusi
Attività mentale
appropriata
Potenziali
elettrici
EEG
EMG
Basso Voltaggio
Assente o Molto
Ridotta
Alto Voltaggio
EOG
Alta Frequenza
Attività toracica
elevata
Movimenti Rapidi/
Lenti
REM
Chiusi con
movimenti rapidi
Sogno
Basso Voltaggio
Bassa Frequenza
Attività ridotta
Alta Frequenza
Attività Assente
Movimenti Lenti o
Assenti
Movimenti in fase
rapidi
Veglia e Addormentamento
S1 (3’-12’): onde-alpha
(veglia fisiologica) onde-theta
Sonno 2
S2 (10’-20’): fusi (spindles) e complessi K
prevalenza di onde-theta rallentamento del tracciato
Sonno lento
S4: (∼ 30’-50’): onde-deltha >50% per epoca.
Nottambulismo, incubi, sleeptalking.
Sonno REM
• 20’-30’ durata in 4-5 episodi
• Movimenti oculari rapidi a gruppi e isolati
•Compaiono aritmie cardiache e modificazioni
respiratorie con apnee anche di 10”- 30”
Dalle osservazioni compiute, si parla di macro-struttura, ovvero di
un modello con tre processi principali regolanti i cicli del sonno.
Borbely, Achermann (1983)
- Ritmo Omeostatico
(propensione al sonno)
- Ritmo Circadiano
(ciclo sonno- veglia)
-Ritmo Ultradiano
(ciclo REM-NREM)
Si tratta di funzioni matematiche
astratte e schematiche, che descrivono
la ciclicità del sonno nel tempo.
Sperimentalmente la grandezza fisica più significativa è lo SWA
(Slow Wave Activity): la potenza totale delle onde su tutto il tempo
base
dopo deprivazione di sonno
In particolare lo SWA è importante nello studio dei cicli REM–NREM.
Secondo Achermann (1990) la diminuizione dello SWA è guidata
dall’ultradiano che determina, quando scende sotto una certa soglia, il
trigger per gli stati di REM e di NREM, ed è guidata dall’omeostatico
che, provocando la sua decrescita esponenziale nel tempo, rende gli
eventi di REM sempre piu’ durevoli perchè la soglia viene “allungata”.
1.75
1.5
1.25
1
0.75
0.5
0.25
25
50
75
100
125
150
400
SWA of normal sleepers during 8
hours of sleep.
300
200
100
2
4
6
8
500
Slow Wave Activity media di 9
soggetti sani durante 8 ore di
sonno.
400
300
200
100
2
4
6
8
Modello matematico per simulare la serie temporale della SWA e del processo
omeostatico S (modificato rispetto ad Achermann Borbely, 1993).
dS (t )
= rs ( Su − S (t )) − g c Swa (t )
dt
⎛ Swa (t ) ⎞
dSwa (t ) rc
⎟⎟ − f cR ( Swa (t ) − Swa L ) Re mON (t )
=
Swa (t )⎜⎜1 −
S (t ) ⎠
dt
Su
⎝
− f cW ( Swa (t ) − Swa L )W (t )
FUNZIONI NEL TEMPO
S(t) = processo omeostatico
Swa(t) = Slow Wave Activity
RemON (t) = Attività del RemON
W(t) = Veglia
PARAMETRI
rs = tasso di crescita del processo S
Su= Asintoto superiore del processo S
gc = coefficiente di decadimento del processo S
rc= tasso di crescita della Swa
fcR= costante di decadimento della Swa dovuto al
RemON
SwaL= Asintoto inferiore della Swa.
fcW= costante di decadimento della Swa dovuto
alla veglia
Diagramma del modello che descrive l’oscillatore REM-ON REM-OFF (modificato
dall’originale McCarley e Hobson 1975). La variabile REMon simula l’andamento del rate del
decadimento dei neuroni nelle formazioni reticolari pontine. La variabile REMoff descrive the
firing pattern generated dai neuroni del locus coeruleus. Vengono mostrati i percorsi eccitatori
(+) e inibitori (-), l’intensità della loro interazione reciproca è mostrata dai parametri a, b, c, d.
Esempio dei valori
dei parametri per
soggetti sani:
a = 1, c = 1 e
b = α, d = β
+a
REMon
+d
-b
REMoff
-c
L’intensità di b
rispetto d misura
l’inibizione subita dal
RemON per opera del
RemOFF
⎧ d Re mON (t )
= a Re mON (t ) − b Re mON (t ) Re mOFF (t )
⎪
dt
⎨ d Re m (t )
OFF
⎪
= −c Re mOFF (t ) + d Re mON (t ) Re mOFF (t )
dt
⎩
L.Nobili et al, Nocturnal sleep features in narcolepsy: a model-based approach, Rev Neurol
Paris 2001, 157, 5S82-5S86.
Episodi REMS previsti dal modello ottimizzato per i controlli. I Rems sono
ottenuti dall’interazione tra S e il RemOn.
Modello matematico per l’interazione tra la SWA e il processo omeostatico S con il
ritmo circadiano che modula una soglia superiore (H) e una inferiore (L) di oscillazione.
n
C (t ) = ∑ cjsin( jt )
j =1
⎧ H = h − kC ( t )
⎨
⎩ L = l − kC ( t )
FUNZIONI
C(t) = Simulazione del ritmo circadiano.
H = soglia superiore modulata dal circadiano
che determina l’inizio del sonno.
L = soglia inferiore modulata dal circadiano
che determina la fine del sonno
PARAMETRI
cj = coefficienti per la sovrapposizione di sinusoidi che determinano il picco circasemidiano
h, l, k = parametri che determinano la forma delle soglie
When
end.
When
W(t)=1
if
S(t) < H
W(t) = 1;
else
if
S(t) > = H
W(t) = 0
if and only if
RemON > cS
W(t) = 0
if
S(t) > L
W(t) = 0;
else
if
S(t)< = L W(t) = 1
if and only if
RemON > cS
Condizioni poste per l’interazione tra S e
le soglie modulate dal circadiano che
determinano l’inizio (W = 0) e la fine
(W = 1) del sonno. Condizioni poste per
l’interazione tra S e il RemON (soglia
empirica cS), che determina il SOREMP
durante la notte (quando W = 0) o durante
il giorno (W = 1).
SWA
S
RemON
RemOFF
High/Low
threshold
SWA
S
RemON
RemOFF
High/Low
threshold