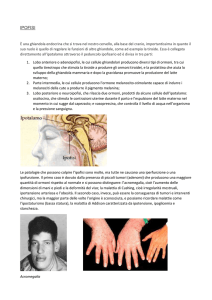
La segnalazione intercellulare
L’evoluzione degli organismi multicellulari dipende
dalla capacità delle cellule di comunicare una con l’altra.
La comunicazione intercellulare regola
lo sviluppo e l’organizzazione dei tessuti,
controlla la crescita e la divisione cellulare, la loro
sopravvivenza e coordina le diverse attività cellulari.
La comunicazione intercellulare negli animali superiori è
complessa, suggerendo che molti geni in questi organismi
siano coinvolti nel suo controllo e coordinazione.
Discuteremo soprattutto dei meccanismi di comunicazione
“indiretti”, cioè mediati da segnali chimici secreti,
dette “molecole segnale”.
Tre strategie di segnalazione chimica:
paracrina, sinaptica ed endocrina
Molte cellule secernono
Le cellule nervose
una o più molecole
secernono i
Le cellule endocrine
segnale,che funzionano
neurotrasmettitori,
secernono gli ormoni
come mediatori chimici
mediatori chimici a
che influenzano cellule
locali
corto raggio, che
bersaglio anche molto
agiscono nelle sinapsi
lontane
La segnalazione autocrina: alcune cellule secernono una o più
molecole segnale, che funzionano come mediatori chimici locali sulle
cellule stesse.
Classificazione funzionale degli ormoni
Endocrino: origina in una ghiandola e agisce su una
cellula-bersaglio distante
Paracrino: origina in una ghiandola e agisce su una cellulabersaglio contigua
Autocrino: agisce sulla stessa ghiandola nella quale origina
Feromone: sostanza che comunica a distanza.
Gli ormoni diffondono a lunga distanza
attraverso il sangue, dove si diluiscono.
Agiscono a bassa concentrazione (10-8M)
I neurotrasmettitori si riversano nelle
sinapsi a concentrazioni elevate
(5 x 10-4 M)
IL SISTEMA ENDOCRINO è un sistema di comunicazione deputato a regolare,
integrare e coordinare svariati processi fisiologici quali:
1. Digestione, utilizzo e immagazzinamento delle sostanze nutritive.
2. Crescita e sviluppo.
3. Metabolismo idrico-elettrolitico.
4. Funzione riproduttiva.
ORMONE
- Regolatore e coordinatore di funzioni biologiche multiple - Molecola organica
potente e specializzata prodotta da cellule endocrine in risposta a stimoli specifici
che esercita la propria azione su specifiche CELLULE BERSAGLIO.
CELLULA BERSAGLIO = cellula dotata di RECETTORE che riconosce per affinità
e specificità l’ormone.
RECETTORE = molecola proteica o glicoproteica che posta sulla superficie della
cellula o all’interno riconosce e lega l’ormone.
I principali organi endocrini sono:
- l’ipofisi,
- la tiroide,
- il timo,
- le paratiroidi,
- il pancreas endocrino,
- le ghiandole surrenali,
- le ovaie e la placenta per le
donne,
- i testicoli per l’uomo.
NATURA CHIMICA DEGLI ORMONI:
•
•
•
•
•
•
1. AMINOACIDICA
2. PEPTIDICA E PROTEICA
3. STEROIDEA
4. PICCOLI LIPIDI
5. PROSTAGLANDINE EICOSANOIDI
6. PROSTACICLINE
ORMONI: MECCANISMO D’AZIONE
• A – ORMONI IDROFILICI (natura proteica o amminoacidica) –
hanno il recettore sulla membrana; agiscono tramite
2°MESSAGGERO:
•
•
•
•
1. Sistema adenilato ciclasi/cAMP
2. Sistema della fosolipasi (fosfatidilinositolo, DAG)
3. Canali ionici (Ca++)
4. Tirosina-chinasi (PO4--)
• B – ORMONI IDROFOBICI (steroidi e tiroidei) – hanno il
recettore intracellulare; agiscono attraverso la regolazione
dell’espressione genica.
Classificazione in base al meccanismo di azione
. Ormoni che legano recettori intracellulari
(lipofili, tiroidei o steroidei)
. Ormoni che legano recettori sulla membrana
plasmatica (idrosolubili), il secondo messaggero
è:
.cAMP
.cGMP
.Ca++ o fosfatidilinositolo
.cascata chinasica o fosfatasica
QUINDI:
Gli Ormoni sono:
Sostanze presenti a concentrazioni molto
basse (10-15- 10-9 M)
Generano alterazioni intracellulari
Agiscono attraverso recettori e secondi
messaggeri
Interazioni ormone-recettore
Analoghe a quelle substrato-enzima:
Saturabili
Michaelis-Menten
Altissima affinità (KD=10-9-10-11 M)
Specificità alta, ma non assoluta
Cinetiche di ordine zero: La risposta dipende dalla densità
dei recettori e non dalla concentrazione di ormone
Agonista/antagonista
•
Un farmaco si dice agonista quando, legandosi a uno specifico recettore cellulare, lo attiva,
determinando quindi una catena di effetti biologici. P.es., l’eroina, la morfina e il metadone
sono agonisti a livello dei recettori µ degli oppioidi.
•
Viceversa, un farmaco si dice antagonista quando, pur legandosi al recettore, non lo attiva e
in sostanza lo "blocca". Tipico antagonista a livello dei recettori µ è il naloxone.
•
La capacità che un determinato farmaco ha di legarsi a un recettore, e che può essere
maggiore o minore, si dice affinità del farmaco per il recettore. Un farmaco con affinità
elevata si legherà al recettore anche "scacciando via" un farmaco già legato, ma con affinità
più bassa.
•
Il naloxone, antagonista ad altissima affinità per i recettori µ degli oppioidi, è capace di
scacciare l’eroina o la morfina eventualmente già presenti, annullandone gli effetti. Per
questo il naloxone è efficace per combattere un’overdose da eroina (e può scatenare una
sindrome da astinenza nella persona dipendente), ma non ha nessun effetto significativo se
preso da solo.
µ, K, ∆ recettori per oppioidi
Inibitori
• Agonisti: analoghi dell’ormone, ne imitano l’attività biologica
– Isoproterenolo (farmaco per asma), imita catecolamine, favorisce
il rilascio dei muscoli bronchiali
• Antagonisti: analoghi dell’ormone, ne bloccano l’attività biologica
– Propranololo (farmaco per cardiopatie), blocca recettori
adrenergici nei vasi sanguigni
Agonista
Antagonista
Le molecole segnale possono essere:
Idrosolubili: tutti i neurotrasmettitori, la maggior parte
degli ormoni e dei mediatori chimici locali.
Sono idrofilici per cui non possono attraversare la
membrana plasmatica e interagiscono quindi con le cellule
rimanendo all’esterno.
Liposolubili: gli ormoni steroidei e tiroidei. Sono idrofobici
ed attraversano il doppio strato lipidico.
Ormoni steroidei e tiroidei: il complesso ormone-recettore si lega ad una regione
specifica del DNA
Ormoni steroidei e tiroidei: Modificano l’espressione genica
o idrofobiche
Gli ormoni idrosolubili viaggiano nel sangue
e raggiungono le cellule bersaglio.
Innescando, in risposta, una cascata di eventi
ed alterando comunque l’espressione
genica.
Gli ormoni liposolubili viaggiano nel sangue
legati a proteine di trasporto,
e questo determina anche la loro emivita
nel sangue
Steroidi
Sono esteri del colesterolo o altri steroli con acidi grassi
Il colesterolo è il principale sterolo di origine animale
Si ritrova:
nelle membrane cellulari
nel sangue (HDL e LDL)
e’ precursore degli ormoni steroidei, degli acidi biliari
e’ precursore della vitamina D
Gli ormoni steroidei possono essere divisi
in due classi: gli ormoni sessuali e
progestinici e gli ormoni surrenalici.
Colesterolo → Ormoni steroidei
18
19
27 atomi C
Ciclopentano
peridrofenantrene
21 atomi C
6 atomi C
Vitamina A
Retinolo
Retinale
Retinoico
α-carotene
2 molecole di vit.A
β-carotene
Biosintesi degli ormoni steroidei
Colesterolo
Pregnenolone
17-OH pregnenolone
deidroepiandrosterone
Progesterone
17-OH progesterone
Androstenedione
11-deossi corticosterone
11-deossi cortisolo
Testosterone
Corticosterone
Cortisolo
Androgeni,19C
Glucocorticoidi, 21C
Aldosterone
Mineralocorticoidi, 21C
Estradiolo
Estrogeni, 18C
Ormoni steroidei: Glucocorticoidi, mineralocorticoidi, androgeni, calcitriolo
(vitamina D), acido retinoico
. Derivano dal colesterolo (liposolubili)
. Richiedono proteine plasmatiche di trasporto (non sono immagazzinabili)
. Lunga semivita nel plasma (ore-giorni)
. Il livello di ormone circolante è determinato dalla velocità di sintesi
. Legano recettori intracellulari (azioni mediate dal complesso ormonerecettore)
Secrezione degli ormoni steroidei
• Non immagazzinabili, liberati nel plasma appena sintetizzati
• Liposolubili, richiedono proteine di trasporto:
– Glucocorticoidi: α-globulina (la sua presenza determina la
permanenza in circolo), il cortisolo ad es. si lega ad una glicoproteina
Sierica: la transcortina, con una vita media di 60-70min
– Mineralcorticoidi: albumina (rapidamente eliminati), ad es
l’aldosterone che non si lega efficacemente alle glicoprot. Sieriche ha
vita media 20min
– Androgeni: captati da gonadi e trasformati in altri ormoni sessuali
• Il livello di ormone circolante è determinato da
– Velocità di sintesi
– Presenza della proteina di trasporto
• Semivita nel plasma più lunga degli ormoni non-steroidei e nontiroidei (non hanno proteine di trasporto)
• La biosintesi e il catabolismo degli ormoni steroidei avviene
nel fegato.
• Il catabolismo prevede reazioni che ne riducono l’attività
biologica e ne aumentano la idrosolubità, in modo da
favorirne l’escrezione urinaria. Ci sono anche reazioni di
coniugazione (glucuronidi e solfati) che hanno lo stesso
effetto.
• La secrezione degli ormoni steroidei viene monitorata
mediante l’escrezione urinaria (clearance)
• Non tutte le modifiche operate sugli ormoni
steroidei sono finalizzate al loro catabolismo,
ad es. la riduzione del testosterone non lo
inattiva, ma lo trasforma in estradiolo per
azione dell’aromatasi;
• oppure la riduzione ad opera della 5αreduttasi a diidrotestosterone, una forma per
cui il recettore per gli androgeni mostra
massima affinità.
Svolgono ruoli legati:
allo sviluppo, alla maturazione ed al
funzionamento di organi e tessuti
connessi con la riproduzione e
agiscono su organi e tessuti non
direttamente connessi con la
riproduzione (caratteri sessuali
secondari)
Gli ormoni polipeptidici che stimolano biosintesi e secrezione degli
ormoni steroidei interagiscono con recettori di membrana che talvolta
usano come secondi messaggeri cAMP, Ca+2 e IP3.
• Un aumento di cAMP secondaria alla stimolazione della
ghiandola da ormoni polipeptidici (ACTH) agisce a breve (sec,
min) e lungo (ore) termine.
• A breve termine: mobilizzazione del colesterolo dal citosol al
mitocondrio;
• a lungo termine produzione di proteine coinvolte nella
produzione che mantengono l’aumento nel tempo, ad es la
proteina regolatrice della steroidogenesi StAR che trasferisce
il colesterolo dalla membrana esterna mitocondriale a quella
interna.
Trasduzione del segnale per ormoni steroidei e tiroidei
Lipofilici, attraversano la membrana e legano recettori intracellulari
(fattori di trascrizione)
Il complesso ormone-recettore lega una regione del DNA e ne
modifica l’espressione
Ormone steroideo
Ormone tiroideo
Recettore dell’ormone steroideo
Recettore dell’ormone tiroideo
DNA
Nucleo
Ormoni steroidei
. Glucocorticoidi, mineralocorticoidi, androgeni, calcitriolo (vitamina D),
acido retinoico
. Derivano dal colesterolo (liposolubili)
. Richiedono proteine plasmatiche di trasporto (non sono immagazzinabili)
. Lunga semivita nel plasma (ore-giorni)
. Il livello di ormone circolante è determinato dalla velocità di sintesi
. Legano recettori intracellulari (azioni mediate dal complesso ormonerecettore)
Cascate ormonali
Stimoli iniziali
neurosensoriali
Anelli di
retroazione
negativa
(feedback)
(ng)
(µ
µg)
(mg)
Ormoni ipofisari e ipotalamici
Impulso nervoso
Ipotalamo
Ormoni di rilascio
Ipofisi anteriore
Ormoni di rilascio
Ipofisi posteriore
(adenoipofisi)
(neuroipofisi)
Ormoni di rilascio
Ormoni di rilascio
Altre ghiandole endocrine
Metabolismo
Bilancio idrico
Produzione latte
5 assi endocrine
Vasopressina (ADH), ossitocina
Asse ipotalamo-ipofisi-tiroide
Ipotalamo → Ormone di rilascio della tirotropina (TRH)
•
Fosfolipasi C e Ca++
•
cAMP, PKA
•
•
•
T4>>T3
T4 inattivo, T3 attivo
Attività di ormoni tiroidei sotto controllo di deiodinasi (tiroide e tessuti
target): T4 → T3
Ipofisi anteriore → Ormone di stimolazione della tiroide (TSH)
Tiroide → triiodiotironina (T3) e tiroxina (T4)
Targets: Gran numero (tutti?) di tessuti
Funzioni esplicate:
•
•
•
Accelerazione del metabolismo basale e termogenesi
Induzione o repressione di determinati geni
Modulazione dei processi di sviluppo:
> Girino → rana
> HbF → HbA
Asse ipotalamo-ipofisi-surrenali
Ipotalamo → Ormone di rilascio della corticotropina (CRH) e
vasopressina (ADH)
•
cAMP
•
•
•
•
•
cAMP
Da pro-opiomelanocortina
Implicato in bioritmi (max 5 AM)
T1/2=10 min
Agisce tramite cAMP come 2°messaggero
Ipofisi anteriore → Ormone adrenocorticotrofico (ACTH)
Surrenali → cortisolo e ormoni steroidei
1,25-Diidrossicolecalciferolo
• La vitamina D è rappresentata da un gruppo di pro-ormoni
liposolubili costituito da 5 diverse vitamine: vitamina D1, D2, D3,
D4 e D5. Le due più importanti forme nella quale la vitamina D si
può trovare sono la vitamina D2 (ergocalciferolo) e la vitamina D3
(colecalciferolo), entrambe le forme dall'attività biologica molto
simile. Il colecalciferolo (D3), derivante dal colesterolo, è
sintetizzato negli organismi animali, mentre l'ergocalciferolo (D2)
è di provenienza vegetale.
• La vitamina D ottenuta dall'esposizione solare o attraverso la
dieta è presente in una forma biologicamente non attiva e deve
subire due reazioni di idrossilazione per essere trasformata nella
forma biologicamente attiva, il calcitriolo.
TI ROI DE
• Ghiandola endocrina preposta al metabolismo dello iodio ed alla
sintesi degli ormoni tiroidei, secreti dalle cellule tiroidee (tireociti, cellule
follicolari)
Apporto e Fabbisogno giornaliero Iodio
• Disponibilità di un sufficiente apporto di iodio per via alimentare: fattore
indispensabile affinchè la tiroide possa sintetizzare gli ormoni tiroidei
• La maggior parte dello iodio entra nell’organismo attraversoil tubo
gastroenterico sotto forma di ioduro (I-);Quote minori sono assorbite
attraverso i polmoni e la cute;
• Circa un terzo dello iodio assunto viene captato dalla tiroide
• I due terzi rimanenti vengono secreti dalle urine
TIROIDE
•
•
•
•
Nella tiroide sono presenti degli enzimi che
ossidano lo Ioduro (I- ) rendendolo capace di iodare
i residui tirosinici della tireoglobulina per formare
Monoiodiotirosina (MIT) e Diiodiotirosina(DIT)
Questi due composti iodati costituiscono i
precursori degli ormoni tiroidei:
• la tiroxina (T4), che possiede quattro atomi di
iodio
• la triiodotironina (T3), che ne possiede tre
GLI ORMONI TIROIDEI: CHIMICA
Gli ormoni tiroidei sono prodotti per iodinazione dei residui di tirosina
contenuti nella tireoglobulina (una proteina dimerica di 620 KDa) e stoccati
all’interno del follicolo tiroideo.
Le cellule follicolari producono prevalentemente tiroxina (T4), poco attiva,
che viene convertita in T3 nei tessuti periferici da parte di specifici enzimi
(deiodasi).
Gli ormoni tiroidei sono poco solubili e circolano legati a proteine di
trasporto (TBG:globulina Tirossina-legante, albumina)
CDL INFERMIERISTICA, Medicina Generale e Specialistica
GLI ORMONI TIROIDEI: SINTESI
L’enzima chiave nella sintesi degli ormoni tiroidei è la tireoperossidasi che
catalizza due importanti fasi della sintesi degli ormoni tiroidei
L’organificazione dello iodio su residui di tirosina della tireoglobulina
La sintesi di T3 e T4 a partire da 2 molecole di iodotirosina.
CDL INFERMIERISTICA, Medicina Generale e Specialistica
GLI ORMONI TIROIDEI: CHIMICA
Tiroxina (T4) (L-3,5,3',5'-tetraiodotironina)
Triiodotironina (T3) (L-3,5,3'-triiodotironina)
reverse T3 (rT3) (3,3',5'- triiodotironina)
CDL INFERMIERISTICA, Medicina Generale e Specialistica
REGOLAZIONE DELLA FUNZIONE TIROIDEA
Iodio + tirosina → MIT o DIT
MIT + DIT → T3
DIT + DIT → T4 (tiroxina)
Tiroide
Tireoglobulina
Patologie degli ormoni tiroidei
Ipotiroidismo (disfunzione ipotalamica, presenza di Ab-anti
TSH, asportazione della tiroide):
•
•
•
•
Sintomi spesso elusivi (aumento di peso, stanchezza)
Diminuzione del metabolismo basale (bradicardia, sonnolenza,
sensazione di freddo…)
Nanismo
Cretinismo (gravi difetti multipli congeniti, ritardo mentale)
Ipertiroidismo (eccessiva produzione di TSH, deficit di I2 o
dei sistemi di trasporto di I2):
•
•
Aumento in volume della tiroide (gozzo)
Tachicardia, ipertensione, sudorazione, sensibilità a caldo
ORMONI TIROIDEI (T3 E T4)
• IL T4 PUO’ ESSERE CONVERTITO IN AC.
TETRAIODOTIROACETICO ED ESCRETO
NELLA BILE E NELLE URINE
• 33-40% DI T4 VIENE CONVERTITO IN T3
FUNZIONALE
• UNA PARTE DI T4 VIENE TRASFORMATO
IN UNA FORMA INATTIVA DI T3,
METABOLIZZATO ED ESCRETO
ORMONI TIROIDEI (T3 E T4)
• T3 E T4 : SONO LIPOSOLUBILI, DIFFONDONO
ATTRAVERSO LA MEMBRANA E SI LEGANO A
RECETTORI NUCLEARI (1) E MITOCONDRIALI (2)
• (1) PROMUOVONO SINTESI PROTEICA
• (2) PRODUZ. DI CALORE E ATP
• AUMENTANO IL METABOLISMO DI GLU, LIPIDI E PROTEINE
FACENDO AUMENTARE LA T° CORPOREA
LE PROT. PLASM. PROLUNGANO
L’EMIVITA DI T3 E T4 (~ 1 SETTIMANA) E
REGOLANO I LORO LIVELLI EMATICI
e vit. D
Complesso
Recettore/inibitore
Ormone
A)
Modello di R intracellulare
l’inibitore è una proteina Hsp90
il legame con l’ormone provoca
il distacco dell’inibitore ed espone
il sito per il legame al DNA.
B) Schematizzazione dei principali
recettori intracellulari.
C) Rappresentazione del recettore
del cortisolo e regioni di funzione.
D) Immagine al microscopio
elettronico di un complesso
ormone-recettore e l’interazione
con i filamenti di DNA:
Il
Elementi di Risposta.
Glucocorticoid responsive elements
Zinc fingers
fenilalanina
leucina
tirosina
cisteina
istidina
Ipotesi di struttura ad ansa a dito di zinco (Zn-fingers), Cisteine (C) Istidine(H),
formano legami di coordinazione con lo Zn: I numeri indicano le posizioni degli aa
I pallini neri indicano le catene a più alta probabilità di interazione con il DNA. In
ogni ansa si trovano sempre una leucina (L) e una tirosina (Y) o una fenilalanina (F)
Ormoni non steroidei e non tiroidei
. Peptidi, polipeptidi, glicoproteine, aminoacidi, catecolamine
. Sintetizzati come precursori inattivi, e convertiti in ormoni attivi con
processi proteolitici
. Idrosolubili
. Non richiedono proteine plasmatiche di trasporto (breve semivita nel
plasma, secondi-minuti)
. Legano recettori sulla membrana plasmatica
. Azioni intracellulari mediate da secondi messaggeri
Pancreas endocrino
ISOLE DEL LANGERHANS:
Cellule β= Insulina
Cellule α= Glucagone
Cellule δ= Somatostatina
Cellule PP= Polipeptide
pancreatico.
Fasi biosintetiche dell’insulina:
• Precursore : PRE-PRO-INSULINA
• PRO-INSULINA: catena B NH2terminale, una catena A
COOHterminale, peptide di
connessione, PEPTIDE C
• Nel REG:
azione delle endopeptidasi che
tagliano il peptide C, generando la
forma matura dell’INSULINA
• L’insulina matura ed il peptide C
vengono impacchettati nel Golgi nei
granuli secretori
Maturazione di insulina
51aa
+ peptide C 32aa
83aa
Pre-pro-insulina
Reticolo
endoplasmico
Pro-insulina
Pro-insulina
5%
Insulina + C
Insulina + C
95%
Apparato di Golgi
Circolazione
Meccanismi di controllo della secrezione
dell’insulina
• Fattori positivi:
* Elevate
concentrazioni di
glucosio
* Aminoacidi e acidi
grassi
• Fattori negativi:
* Stimolazione alfa
adrenergica
* Ipoglicemia
* Somatostatina
Insulina
• Fortemente conservata: insulina bovina e
suina (utilizzate nell’uomo)
• Pro-insulina dà reazioni crociate con insulina
• Livello di peptide C discrimina insulina eso- ed
endogena
l’insulina è ritenuta essere:
• Principale responsabile del diabete
– Insulino-dipendente (10%, o giovanile, bassa secrezione di insulina)
– Non-insulino-dipendente (90% o dell’età adulta, bassa espressione del
recettore)
Esiste la:
• Resistenza all’insulina: bassa espressione, degradazione o
internalizzazione del recettore, causa obesità
Meccanismi di rilascio dell’insulina
glicemia
Recettore dell’insulina
Recettore per insulina
È un tetramero 2 sub. α e 2 sub. β
•
•
Risposte metaboliche veloci
(tendenti a diminuire la glicemia)
– Aumento del trasporto di
glucosio con GLUT-4
– Aumento di glicolisi
– Inibizione di gluconeogenesi
– Inibizione di lipolisi
Risposte lente o a lungo termine
– Aumento della sintesi
proteica
– Stimolazione della
replicazione cellulare
Altri enzimi pancreatici
Glucagone
• Antagonista di insulina
– Stimola gluconeogenesi e lipolisi
– Rallenta glicolisi
•
•
•
•
Cellule α delle isole di Langerhans
Secreto come pro-glucagone
Agisce tramite recettori e cAMP
Inattivato nel fegato
– Breve T1/2
Somatostatina
• Cellule γ delle isole di Langerhans
• Inibisce la secrezione di insulina e
glucagone
• Diminuisce la secrezione di gastrina
– Prolunga il tempo di svuotamento
gastrico
– Rallenta l’assorbimento intestinale
degli zuccheri
– Riduce il passaggio dei nutrienti in
circolo
GLUCAGONE (1)
• Sintetizzato dalle cellule α del
pancreas endocrino
• Polipeptide di 3.5 kDa (29
aminoacidi)
• Lega un recettore associato alla
proteina Gs (GCGR)
IMPORTANTE:
il muscolo non esprime GCGR
(Gprotein coupled Glucagon
Receptor)
1
29
Secrezione positiva:
In risposta alla riduzione dei livelli glicemici
Aumento dei livelli di glucosio ematico
Principale ormone controregolatore
EFFETTI DEL GLUCAGONE
Nel fegato
ORMONE CATABOLIZZANTE
• aumentata liberazione di
glucosio
↑glicogenolisi
↓sintesi di glicogeno
↑gluconeogenesi
• aumentata liberazione di amino
acidi
↑catabolismo proteico
↓sintesi proteica
Nel tessuto adiposo
aumentata liberazione di acidi grassi
↑catabolismo dei grassi (lipolisi)
↓sintesi di grassi
Ormoni pancreatici: insulina,
glucagone
Pancreas
Aumenta il
glucosio
ematico
Cellule α
Cellule β
Glucagone
Insulina
Fegato
↓ Glicolisi
↑ Gluconeogenesi
↑ Glicolisi
↓ Gluconeogenesi
↑ Glucosio
↓ Glicogeno
↓Glucosio
↑ Glicogeno
Diminuisce il
glucosio
ematico
Catecolamine: Ormoni della midollare surrenale
mediano l’adattamento allo stress
• Tyr: precursore (anche Phe)
– Tyr idrossilasi: Reazione limitante
• DOPA, diidrossifenilalanina (carente in Parkinson)
– Passa la barriera emato-encefalica e funge da
farmaco
• Dopammina: non passa la barriera emato-encefalica
– In caso di deficit: DOPA
– In caso di eccesso: metil-DOPA
• Adrenalina e noradrenalina
– Accumulo nei granuli cromaffini
– Rilasciati con stimolazione β-adrenergica
– Metabolizzati rapidamente nel plasma
• catecolo metiltransferasi (COMT) e
monoamina ossidasi (MAO)
• Inibitori di COMT e MAO: eccitatori nervosi
Ormoni non steroidei e non tiroidei
. Peptidi, polipeptidi, glicoproteine, aminoacidi, catecolamine
. Sintetizzati come precursori inattivi, e convertiti in ormoni attivi con
processi proteolitici
. Idrosolubili
. Non richiedono proteine plasmatiche di trasporto (breve semivita nel
plasma, secondi-minuti)
. Legano recettori sulla membrana plasmatica
. Azioni intracellulari mediate da secondi messaggeri
Classi di recettori β (7 segmenti transmembrana)
. β1
.Cuore, aumenta frequenza e forza di contrazione
.Adipociti, aumenta lipolisi
.Intestino, diminuisce motilità
. β2
.Polmone, rilascio della muscolatura
.Fegato, aumenta glicogenolisi
.Intestino, diminuisce motilità
Classi di recettori α (7 segmenti transmembrana)
. α1
.Iride dell'occhio, contrazione
.Intestino, diminuisce motilità
.Ghiandole salivari, secrezione di acqua e di potassio
. α2
.Cellule pancreatiche β, diminuisce la secrezione
.Piastrine, causa aggregazione
.Cellule adipose, diminuisce la lipolisi
.Stomaco, diminuisce la motilità
. α?
.Arteriole, costrizione
.Sfintere della vescica, contrazione
.Organi sessuali maschili, eiaculazione
Recettori (7 segmenti transmembrana)
β
•
α
β1
>
>
>
•
Cuore, aumenta frequenza e forza di
contrazione
Adipociti, aumenta lipolisi
Intestino, diminuisce motilità
•
α1
> Iride dell'occhio, contrazione
> Intestino, diminuisce motilità
> Ghiandole salivari, secrezione
di acqua e di potassio
β2
>
>
>
Polmone, rilascio della muscolatura
Fegato, aumenta glicogenolisi
Intestino, diminuisce motilità
•
Tirosin-chinasi – 1
>
>
>
>
Virus del sarcoma aviario, oncogene
Epidermide, fattore di crescita
Ubiquitario, recettore per insulina
Piastrine, fattore di crescita
Guanilato ciclasi – 1
>
>
Atrio cardiaco, omeostasi dei liquidi
corporei
Endotelio, recettore per NO
α2
> Cellule pancreatiche B,
>
>
>
•
diminuisce secrezione
Piastrine, causa aggregazione
Cellule adipose, diminuisce
della lipolisi
Stomaco, diminuisce motilità
α?
> Arteriole, costrizione
> Sfintere della vescica,
>
contrazione
Organi sessuali maschili,
eiaculazione
Proteina G (GTP-binding protein)
Complesso
ormonerecettore
Proteina G = α + β + γ
α: unità catalitica
•
•
•
•
•
α -GDP, inattiva
α -GTP, attiva
αs, stimola l’effettore
αi, inibisce l’effettore
>20 isoforme α
GTP
GDP
ATTIVO
INATTIVO
α
GDP
β
β
γ
γ
Pi
γ: ancoraggio alla
Stimola o inibisce
GTPasi
membrana
•
>6 isoforme γ
β: alta affinità per subunità
γ, affinità variabile per
subunità α
•
>4 isoforme β
Molte proteine G diverse,
grande flessibilità di
risposta
α
GTP
α
GDP
INATTIVO
Effettore
Meccanismo dei recettori adrenergici mediato dalla
proteina G
Secondi messaggeri
cAMP; Fosfatidil inositolo difosfato; Fosfolipasi
A2; Prostaglandine e leucotrieni;
cAMP
Sistema β-adrenergico - proteina Gs
Meccanismo analogo per
GTP → cGMP → GMP
Protein kinasi A
attivata da cAMP
Target: residui Ser e Thr
di altre proteine
(fosforilazione)
AUMENTA l’attività di
alcuni enzimi
•
Glicogeno fosforilasi,
citrato liasi, fosforilasi b
chinasi, HMG-CoA
reduttasi chinasi e altri...
DIMINUISCE l’attività di
altri enzimi
•
Acetil-CoA carbossilasi,
glicogeno sintasi,
piruvato deidrogenasi,
HMG-CoA reduttasi e
altri...
Fosfodiesterasi (PDE)
termina il segnale di cAMP e cGMP
cAMP → 5’-AMP, cGMP → 5’-GMP
Target di interventi farmacologici
•
•
•
•
•
Metilxantine
Teofilline
Milrinone (cardiotonico)
Attivazione delle piastrine, tono dei muscoli lisci
(broncodilatatori, vasorilassanti etc), contrazione cardiaca
Sildenafil (Viagra)
Sistema fosfolipasi C, PIP2 → DAG + IP3
Fosfatidil inositolo difosfato (PIP2)
DAG, Attiva protein kinasi C
IP3 → reticolo endoplasmico
Mobilizzazione di Ca++
Fosfolipasi - idrolizzano fosfogliceridi generando lipidi
come secondi messaggeri
Fosfolipasi A2 → acido arachidonico (20C, 4 doppi legami)
•
•
Mediatore dell’infiammazione
Precursore degli eicosanoidi (prostaglandine, prostacicline,
trombossani e leucotrieni)
Prostaglandine
Derivano da acido arachidonico via cicloossigenasi (COX)
•
•
COX1 costitutivo, inibito da antiinfiammatori steroidei
(cortisone)
COX2 in risposta a mediatori dell’infiammazione (citochine),
inibito da antiinfiammatori non-steroidei (aspirina e ibuprofen)
Agiscono come ormoni (via proteina G)
•
•
•
•
Inattivate nei polmoni
Precursori dei trombossani (coagulazione)
Infiammazione (artrite reumatoide), sensazione di dolore
Inibiscono secrezione gastrica (la loro inibizione: ulcera)
Leucotrieni
Derivano da acido arachidonico via lipoossigenasi (LOX)
•
•
•
Deficit di LOX in disordini mieloproliferativi (↑
↑ trombossano),
immunologici e coagulativi
3 tipi di acido monoidroperossieicosatetraenoico (HPETE)
Leucotrieni (LTA4)
> T1/2=4h
> Responsabili di reazioni anafilattiche: contrazione protratta dei
muscoli lisci (trachea e del tratto GI) e aumento della permeabilità
capillare
Gli ormoni steroidei e i mediatori chimici
liposolubili attraversano la membrana
plasmatica e si legano a recettori citoplasmatici
Molti mediatori
interagiscono con
recettori posti sulla
membrana cellulare e
innescano una serie di
reazioni chimiche
(trasduzione del
segnale) che portano
alla formazione di un
mediatore
citoplasmatico
(secondo messaggero)
in grado di attivare la
risposta cellulare
specifica.
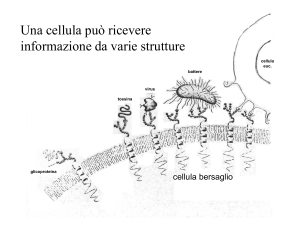
Le cellule comunicano e interagiscono tra loro tramite il
fenomeno della segnalazione cellulare
L’intero processo che traduce
l’informazione portata dal
messaggero extracellulare in
cambiamenti intracellulari è
chiamato:
Trasduzione del
segnale
I messaggeri
extracellulari
inducono risposte
intracellulari
influenzando
l’attività di molte
proteine cellulari
Interruttori di accensione (On) e spegnimento (Off)
La maggior parte dei segnali è transitoria e pure la
risposta dovrebbe essere transitoria. Se si accende un
segnale, c’è anche bisogno di una via per spegnerlo. Per
esempio, il mancato spegnimento di un segnale mitotico è
una delle cause che induce un tumore.
Pertanto, ci sono dei sistemi biochimici in grado di far
passare rapidamente la cellula tra due stati.
Molti sistemi di signalling accensione e spegnimento sono
operati da G proteine e/o da proteine di fosforilazione
Interruttori On-Off – Proteine di fosforilazione
Protein Kinasi – trasferiscono
un fosfato dall’ATP ad amino
acidi specifici
Protein Fosfatasi – rimuovono
un fosfato da specifici amino
acidi
O-fosfoserina
O
C
C
C
NH
O
C
H
Chinasi
ATP
C
NH
C
O
P
O-
O-fosfoserina
P
O-
Pi
O-
C
O
Fosfatasi
ADP
Fosforilazione
C
NH
Serina
O
O-
C
O
O
O
C
C
NH
C
O
H
Serina
Defosforilazione
O
Recettori canali ionici
Il legame del ligando modifica la conformazione del recettore in modo
tale che specifici ioni possono fluire attraverso esso, il risultante
movimento ionico altera il potenziale elettrico della membrana cellulare.
Recettori collegati a proteine G
Il recettore lega una
molecola segnale
extracellulare, subendo
un cambiamento
conformazionale che
consente l’interazione
con “effettori a valle”
(spesso proteine G)
G Proteine
Le proteine G possono essere piccole proteine monomeriche
che legano il GTP o proteine eterotrimeriche costituite da 3
subunità: α, β, γ
γ
β
INATTIVA
Scambio del GDP
legato col GTP
GTP
α
GDP
GDP
GTP
α
ATTIVA
Pi
La subunità α si
riassocia a βγ
α
GDP
La subunità α si
dissocia da βγ
Attività
GTPasica della
subunità α
GTP GDP+Pi
La subunità α attiva
può interagire con lo
step successivo della
catena di ì signalling e
attivarlo
Spegnimento della subunità a della proteina G
Spegnimento attraverso:
>Attività GTPasica di α
> Le proteine RGS
(regolatrici della
segnalazione della proteina
G)
Recettori con attivita’ enzimatica intrinseca
Recettori della membrana plasmatica che presentano 1
segmento transmembrana e contengono ed esprimono attivita’
enzimatiche. Quando uno di questi recettori viene attivato da un
ligando extracellulare, catalizza direttamente la produzione di
un secondo messaggero intracellulare.
Per attivare un recettore tirosina chinasi il ligando deve, in
genere, legarsi simultaneamente a due catene recettoriali
adiacenti
Dimero unito
covalentemente che
unisce insieme due
recettori (PDGF)
Alcuni ligandi monomerici
si legano in gruppi a
proteoglicani, rendendo i
ligandi capace di unire i loro
recettori (FGF: fibroblast
Growth Factor)
Proteine di segnale legate alla
membrana come le efrine (p di
membrana coinvolte nell’adesività),
possono legare i loro recettori anche se
sono monomeriche perché si
raggruppano nella membrana
plasmatica della cellula che segnala
Come funziona un recettore TRK
L’autofosforilazione della coda citosolica dei recettori tirosina chinasi
contribuisce al processo di attivazione in due modi:
La fosforilazione delle tirosine nel dominio catalitico aumenta l’attività
chinasica dell’enzima
La fosforilazione delle tirosine fuori dal dominio catalitico crea siti di
attacco ad alta affinità che consentono il legame di numerose proteine di
segnalazione intracellulare nella cellula bersaglio
Attivazione del recettore per l’insulina
●
eterotetramero (2a, 2b)
●
Il legame con l’insulina porta
ad una variazione della
struttura (differente dagli
altri RTK)
●
Il cambio conformazionale
attiva l’attività tirosina
chinasi della subunità b
●
la subunità b fosforila i
residui Tyr presenti sul
dominio citoplasmatico ed
altri substrati (IRS)
Processi che seguono l’attivazione del recettore per
l’insulina.
●
Fosfatidil inositolo 3idrossi chinasi (produce
PIP2,PIP3)
●
Grb2, Sos, activano Ras
●
Attivazone della PLC γ
QUINDI
Alcuni recettori di membrana non attivano direttamente la
risposta cellulare, ma un’altra proteina di membrana, denominata
proteina G, la quale attiva un effettore, direttamente legato alla
formazione del secondo messaggero (es. adenilato ciclasi)
Altri recettori
di membrana
possiedono
direttamente
una funzione
enzimatica in
grado di
formare il
messaggero
intracellulare,
come il
recettore per
l’insulina
LE VIE DI
TRASDUZIONE DEL
SEGNALE SI BASANO
SU PROTEINCHINASI E
FOSFATASI CHE
ATTIVANO
PROTEINE TRAMITE
L’AGGIUNTA O
ELIMINAZIONE DI
GRUPPI FOSFATO
La risposta cellulare inizia generalmente con
l’attivazione di proteine chiave. Uno dei meccanismi
principali di attivazione/inibizione proteica nella
trasduzione del segnale è basato sul grado di
fosforilazione o defosforilazione della proteina stessa
Gli enzimi che aggiungono gruppi fosfato sono
chiamati protein-chinasi, mentre gli enzimi che
eliminano gruppi fosfato sono detti fosforilasi
Gli enzimi che determinano la scissione del glicogeno
(fosforilasi) o la sua formazione (glicogeno sintetasi)
vengono attivati nelle cellule a seconda della richiesta
intracellulare o extracellulare di glucosio
L’adenosin monofosfato ciclico
(cAMP), che viene
formato a partire
dall’ATP, è un
esempio di secondo
messaggero molto
utilizzato nelle
cellule. Il cAMP
attiva diverse
chinasi in grado di
iniziare processi
cellulari differenti
La formazione di
cAMP a partire
dall’ATP è
catalizzata
dall’enzima
adenilato ciclasi,
presente nella
membrana
plasmatica.
Questo enzima
viene attivato
solo dopo il
legame del
recettore con un
mediatore
chimico specifico
PROTEINA G ETEROTRIMERICA
Esempio di
come
l’attivazione
della
adenilato
ciclasi nelle
cellule
epatiche da
parte del
glucagone
attiva la
scissione del
glicogeno e il
rilascio del
glucosio nel
sangue
Es. ACETILCOLINA
DIACILGLICEROLO
FOSFOLIPASI C
INOSITOLO 3P
SECONDI MESSAGGERI DERIVATI DAL FOSFATIDIL
INOSITOLO (DAG → PKC; IP3 → recettore/Ca++)
Risposte cellulari mediate dalla PKC
Tessuto
Risposta
Piastrine del sangue
Rilascio di serotonina
Mastociti
Rilascio di istamina
Midollare del surrene
Secrezione di adrenalina
Pancreas
Secrezione di insulina
Cellule dell’ipofisi
Secrezione di GH ed LH
Tiroide
Secrezione di calcitonina
Neuroni
Rilascio di dopamina
Cellule muscolari lisce
Aumento della contrattilità
Fegato
Idrolisi del glicogeno
Tessuto adiposo
Sintesi del grasso
RECETTORI
TIROSIN
CHINASICI
Il legame con il ligando
attiva la fosforilazione di
residui di tirosina
(all’interno di sequenze
specifiche di 7 aa dette
motivi fosfotirosinici)
presenti nei domini
citoplasmatici delle
catene Beta e di substrati
dei recettori insulinici
Motivo fosfotirosinico
Dominio SH2
di una proteina
che si lega al
recettore ISR
Gli ISR fosforilati sono a loro volta in grado di legarsi a
proteine diverse aventi in comune una sequenza simile di
aminoacidi, detta dominio SH2
Un altro esempio di recettori
enzimatici è rappresentato dai
recettori tirosin chinasici
(RTK), presenti sulla
membrana nella forma
monomerica inattiva. Il
legame del recettore con
almeno due RTK permette la
formazione del dimero attivo,
in grado di aggiungere gruppi
fosfato ai residui di tirosina
presenti nel segmento
citoplasmatico dei RTK. Le
tirosine fosforilate vengono
riconosciute da molecole
citoplasmatiche specifiche, che
vengono a loro volta attivate
MOLTI
RECETTORI PER
ORMONI DI
CRESCITA SONO
RTK, CHE SI
ATTIVANO SOLO
IN SEGUITO ALLA
DIMERIZZAZIONE
CAUSATA DAL
LIGANDO
Un esempio molto
importante di recettori
RTK è rappresentato dai
recettori di molti fattori
di crescita, come EGF e
PDGF. In questo caso, la
fosforilazione dei residui
tirosinici determina
l’attivazione della
proteina RAS, una
proteina estremamente
importante nel controllo
della proliferazione
cellulare.
LA PROTEINA RAS E’
UNA PROTEINA G
MONOMERICA CHE
TRASDUCE IL
SEGNALE DI MOLTI
RTK PER ORMONI DI
CRESCITA (egf, pdgf)
L’attivazione di RAS porta
all’attivazione della via MAP
chinasica, che a sua volta
determina l’attivazione di TF
per geni coinvolti nel controllo
del ciclo cellulare
Per capire come un segnale cellulare possa essere trasmesso
attraverso
l’interazione
cellula-cellula
o
cellula-matrice
extracellulare, basta ricordare che tali rapporti richiedono sempre
la partecipazione di specifiche proteine di membrana, in grado di
sostenere l’organizzazione della connessione tra cellule o della
matrice extracellulare.
La proteina integrina, è
in grado di modificare
la propria struttura
tridimensionale nei
punti in cui la matrice
extracellulare o le
connessioni tra cellule
subiscono alterazione,
attivando un segnale
intracelluare che porta,
ad esempio, alla
proliferazione cellulare
Analogamente, una
modificazione della
struttura tridimensionale
della proteina integrina
può determinare
l’attivazione di un
secondo messaggero in
grado di iniziare la
sintesi di nuove proteine,
come miosina ed actina
La risposta cellulare ai
cambiamenti
dell’ambiente esterno
richiedono spesso
l’attivazione coordinata
di processi cellulari
multipli. In questo caso,
l’epinefrina e l’EGF
attivano processi
intracellulari diversi ma
coodinati, aventi come
risposta finale
l’attivazione metabolica
e la proliferazione
cellulare.