5 Secondo principio della termodinamica .................................................................. 2
5.1 Motori termici .................................................................................................... 2
5.1.1
Rendimenti termici .................................................................................... 3
5.2 Secondo principio della termodinamica secondo Kelvin-Planck ...................... 4
5.3 Macchine frigorifere .......................................................................................... 4
5.3.1
Coefficiente di prestazione (COP) ............................................................ 4
5.4 Pompe di calore.................................................................................................. 5
5.4.3
Coefficiente di prestazione (COP) ............................................................ 5
5.5 Secondo principio della termodinamica secondo Clasius ................................. 5
5.6 Equivalenza fra i due enunciati.......................................................................... 6
5.7 Trasformazioni reversibili e irreversibili ........................................................... 6
5.8 Il ciclo di Carnot ................................................................................................ 7
5.9 I teoremi di Carnot ............................................................................................. 8
5.10 Rendimento termodinamico di macchina reversibile e rendimento
isentropico .................................................................................................................. 8
6 Entropia.................................................................................................................. 10
6.1 Diseguaglianza di Clausius .............................................................................. 10
6.2 Definizione di Entropia.................................................................................... 10
6.3 Principio dell’aumento dell’entropia (principio di non diminuzione
dell’entropia) ............................................................................................................ 11
6.4 Bilancio di entropia.......................................................................................... 12
6.4.1
Sistemi Chiusi.......................................................................................... 12
6.4.2
Volumi di Controllo ................................................................................ 12
6.5 diagramma T-s ................................................................................................. 13
6.6 Variazione di entropia...................................................................................... 14
6.6.1
solidi e liquidi.......................................................................................... 14
6.6.2
gas perfetti ............................................................................................... 15
6.7 Trasformazioni isentropiche ............................................................................ 15
6.7.1
Solidi e liquidi ......................................................................................... 15
6.7.2
Gas ideali................................................................................................. 15
6.8 Lavoro in VC per Flusso stazionario ............................................................... 16
5
Secondo principio della termodinamica
Le trasformazioni avvengono spontaneamente in solo verso.
(sistema che si fredda se in ambiente a T minore)
Il lavoro si converte spontaneamente in calore (viceversa no)
Serbatoi di energia termica (sorgenti o pozzi)
Sistemi capaci di scambiare energia termica senza variare la loro
temperatura
5.1
Motori termici
• ricevono calore da una sorgente ad alta temperatura
• convertono parte di questo calore in lavoro
• Cedono il rimanente calore ad un pozzo a
temperatura minore
• Funzionano secondo un ciclo
• Lavorano utilizzando un fluido (fluido evolvente)
Es. impianto a vapore
Ln ,u = Lu − Le
Per il primo principio, essendo ∆u = 0 (ciclo chiuso)
L n , u = Q n = Q e − Qu
5.1.1 Rendimenti termici
Efficienza = energia ottenuta/energia fornita
Per motore termico
ηt =
Ln ,u Qe − Qu
Q
=
=1− u
Qe
Qe
Qe
Tipo motore
Accensione comandata (benzina)
Diesel
Impianti turbina a gas
Impianti a vapore
0 < ηt < 1
ηt (circa)
0.2
0.3
0.3
0.4
Quindi Qu è elevato……
Serbatoi a Ts e Ti con macchina ciclica che opera asportando Qs e fornendo Ln,u e Qi
(scarico)
5.2
Secondo principio della termodinamica secondo Kelvin-Planck
Per qualsiasi apparecchiatura che operi secondo un
ciclo è impossibile ricevere calore da una sola
sorgente e produrre una quantità di calore utile
Nessun motore termico può avere efficienza del 100%
Un motore termico deve sempre scambiare calore con
una sorgente e con un pozzo
5.3
Macchine frigorifere
•
•
•
•
•
prelevano calore da un pozzo a bassa temperatura (effetto utile)
assorbono lavoro
Cedono calore ad un serbatoio a temperatura maggiore
Funzionano secondo un ciclo
Lavorano utilizzando un fluido (fluido evolvente)
Es frigorifero
5.3.1 Coefficiente di prestazione (COP)
COPF =
Qi
Qi
=
Ln ,u Qs − Qi
5.4
Pompe di calore
• prelevano calore da un pozzo a bassa temperatura
• assorbono lavoro
• Cedono calore ad un serbatoio a temperatura
maggiore(effetto utile)
• Funzionano secondo un ciclo
• Lavorano utilizzando un fluido (fluido evolvente)
5.4.3 Coefficiente di prestazione (COP)
COPPdC =
Qs
Qs
=
Ln ,u Qs − Qi
COPPdC = COPF + 1
5.5
Secondo principio della termodinamica secondo Clasius
È impossibile realizzare una macchina con funzionamento
ciclico il cui unico effetto sia il trasferimento di una
quantità di calore da un corpo a bassa temperatura ad un
altro a temperatura maggiore
5.6
Equivalenza fra i due enunciati
5.7
Trasformazioni reversibili e irreversibili
Trasformazione reversibile:
trasformazione che può essere eseguita in senso inverso senza che se ne trovi
traccia nell’ambiente circostante
trasformazione tale che la trasformazione inversa riporti il sistema e l’ambiente
nelle condizioni iniziali
Trasformazione irreversibile = non reversibile
Le trasformazioni reversibili:
sono ideali
Forniscono il massimo di lavoro
Richiedono il minimo lavoro
Le irreversibilità sono dovute a :
attrito
espansioni o/e compressioni NON quasi statiche
Scambio termico
Trasformazione internamente reversibile = reversibilità per il sistema
Trasformazione esternamente reversibile = reversibilità per l’ambiente
Trasformazione (totalmente) reversibile = reversibilità per il sistema+ambiente
5.8
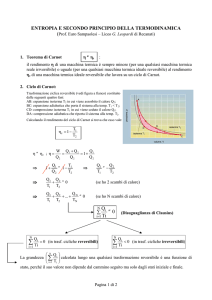
Il ciclo di Carnot
Ciclo motore reversibile
Due isoterme reversibili e due adiabatiche reversibili
Può essere anche compiuto all’inverso
Esempio con gas e sistemi chiusi
5.9
I teoremi di Carnot
Il rendimento di un motore termico irreversibile è sempre inferiore a quello di uno
reversibile operante tra le due stesse riserve di calore.
I rendimenti di tutti i motori termici reversibili operanti tra le due stesse riserve di
calore sono gli stessi
Dimostrazione per assurdo che porta a macchine in contrasto con il secondo principio
della termodinamica
5.10 Rendimento termodinamico di macchina reversibile e rendimento
isentropico
ηt ,rev = 1 −
Qs
= f A ( Ts ,Ti )
Qi
1 f (T ) 2 T
Qs
= f B ( Ts ,Ti ) = C s = s
f C ( Ti ) Ti
Qi
In quanto dipendente solo dalle sorgenti
1) perché vale anche deve valere anche con sorgenti intermedie
Q s Q s Qm
=
= f B ( Ts ,Tm ) ⋅ f B ( Tm ,Ti )
Qi Q m Qi
2) scelta arbitraria della fC dovuta a Lord Kelvin
Utilizzando come serbatoio l’acqua al punto triplo e imponendogli Ti = 273.16 (K) si
può sempre calcolare la T dell’atro serbatoi di una macchina di Carnot operante fra
questi due serbatoi
Per una macchina diretta di Carnot
Per un frigorifero di Carnot
Per una pompa di calore di Carnot
ηt ,rev = 1 −
COPF ,rev =
COPPDC ,rev
Ti
Ts
1
Ts
−1
Ti
1
=
T
1− i
Ts
ηisen =
ηt
ηt ,rev
COP
rendimento isentropico η
=
isen
COPrev
se ηisen <1 allora la macchina funziona in maniera irreversibile
se ηisen =1 allora la macchina funziona in maniera reversibile
se ηisen >1 allora la macchina è impossibile da realizzare
6
Entropia
6.1
Diseguaglianza di Clausius
Vale per tutti i cicli termodinamici chiusi
T = Temperatura assoluta (K) misurata alla superficie di scambio
Se il ciclo è (internamente) reversibile:
6.2
δQ
∫ T =0
Definizione di Entropia
δQ
∫ T int .rev . = 0
Definisce una nuova grandezza di stato chiamata entropia
δQ
J
dS =
T int .rev . K
Variazione di entropia durante una trasformazione internamente reversibile
δQ
J
∆S = S 2 − S1 = ∫
1
T
int .rev . K
2
Solo variazione, non valore assoluto
La differenza di entropia viene calcolata su una trasformazione almeno internamente
reversibile.
Se si vuole calcolare la variazione di entropia per una trasformazione irreversibile, si
dovrà utilizzare una trasformazione reversibile che collega i due stati iniziale e finale
6.3 Principio dell’aumento dell’entropia (principio di non diminuzione
dell’entropia)
δQ
∫ T ≤0
2
1
δQ
δQ
∫1 T + ∫2 T int .rev . ≤0
2
∫
1
δQ
+ S1 − S 2 ≤0
T
2
∆S = S 2 − S1 ≥ ∫
1
dS ≥
δQ
T
δQ
T
Se la trasformazione è irreversibile
2
∆S = S 2 − S1 > ∫
1
2
∆S = ∫
1
dS >
δQ
+ S gen
T
δQ
T
; S gen > 0
δQ
T
Se la trasformazione è (internamente) reversibile
2
∆S = S 2 − S1 = ∫
1
δQ
T
S gen = 0
dS =
δQ
T
Se il sistema è isolato (adiabatico = δQ = 0 )
∆S = S gen ≥ 0
Durante una trasformazione l’entropia di un sistema isolato non diminuisce mai; al
più rimane costante se la trasformazione è reversibile
Sgen > 0 trasformazione irreversibile
Sgen = 0 trasformazione reversibile
Sgen < 0 trasformazione impossibile
Le trasformazioni possono avvenire spontaneamente solo in modo che S gen ≥ 0
L’entropia si conserva solo durante le trasformazioni reversibili (ideali)
L’entropia non si conserva durante le trasformazioni reali
Nell’universo (sistema isolato con trasformazioni reali) l’entropia aumenta
sempre
L’entropia generata è “misura” delle irreversibilità delle trasformazioni reali
Quanto più è piccola l’entropia generata, quanto più siamo vicini ad una
trasformazione reversibile
L’entropia è “indice del grado di disordine” generato dalla trasformazione
6.4
Bilancio di entropia
Variazione di entropia = entropia scambiata
+entropia generata
per scambio termico
o/e di massa
6.4.1 Sistemi Chiusi
Qk
J
+ S gen
K
punti k contorno Tk
Q& k &
dS
W
=
+ S gen
∑
dt punti k contorno Tk
K
S 2 − S1 =
∑
Se il sistema è adiabatico
S 2 − S1 = 0 con trasformaz. (internamente) reversibili
S2 − S1 = S gen > 0 con trasformaz. irreversibili
6.4.2 Volumi di Controllo
dS
=
dt
Q& k
+ ∑ m& e se − ∑ m& u su +S&gen
∑
T
punti k contorno k
W
K
Se VC con trasform. con flusso stazionario
0=
Q& k
∑ T + ∑ m& e se − ∑ m& u su +S&gen
punti k contorno k
VC a flusso staz. ad una corrente
Q& k
+ m& ( se − su ) + S&gen
0=
∑
T
punti k contorno k
W
K
W
K
VC a flusso staz. ad una corrente adiabatico
0 = m& ( se − su ) + S&gen
W
K
es. nel moto in un tubo adiabatico l’entropia aumenta a causa dell’attrito
6.5
diagramma T-s
δQint .rev . = TdS
2
Qint .rev . = ∫ TdS
(J )
(J )
1
Note
Trasformazione internamente
reversibile e adiabatica>linea
verticale>Q=0
Ciclo di Carnot = un rettangolo
Per trasformazione isoterma
internamente reversibile Q=T0(S2-S1)
δqint .rev . = Tds
2
qint .rev . = ∫ Tds
1
( J / kg )
(J / kg )
6.6
Variazione di entropia
δQint .rev . = Tds
δLint .rev . = pdV
δQ − δL = dU
TdS = dU + pdV
Prima equaz.Tds
Tds = du + pdv
h = u + pv
dh = du + pdv + vdp
Tds = du + pdv
Seconda equaz.Tds
Tds = dh − vdp
Combinazione di variabili di stato > valgono sempre:
per trasformazioni reversibili
per trasformazioni irreversibili
per sistemi chiusi
per sistemi aperti
du pdv
+
T
T
dh vdp
ds =
−
T
T
ds =
6.6.1 solidi e liquidi
dv = 0 du = cdT
du cdT
ds =
=
T
T
2 c( T )dT
s2 − s1 = ∫
1
T
T
s2 − s1 = cmed ln 2
T1
J
kg
K
6.6.2 gas perfetti
dT
dv
+R
T
v
dT
dp
−R
ds = c p
T
p
ds = cv
1
s2 − s1 = ∫ cv ( T )
2
v
dT
+ R ln 2
T
v1
1
s2 − s1 = ∫ c p ( T )
2
p
dT
− R ln 2
T
p1
s2 − s1 = cv ,med ln
T2
v
+ R ln 2
T1
v1
J
kg K
s2 − s1 = c p ,med ln
T2
p
− R ln 2
T1
p1
J
kg
K
6.7
Trasformazioni isentropiche
Adiabatiche internamente reversibili
J
s1 = s2
kg K
6.7.1 Solidi e liquidi
cmed ln
T2
= 0 ⇒ T2 = T1
T1
6.7.2 Gas ideali
ln
c p − cv v 2
T2
v
R v
ln = (k − 1)ln 1
= − ln 2 = −
T1
cv v1
cv
v1
v2
v
T
ln 2 = ln 1
T1
v2
T2
T1
k −1
v
= 1
s =cos t v 2
k −1
k −1
T2
T1
v
= 1
s =cos t v 2
T2
T1
p
= 2
s =cos t p1
⇒ Tv k −1 = cos t
k −1
k
⇒ Tp
k −1
k
= cos t
k
p2
v
= 1 ⇒ pv k = cos t
p1 s =cos t v 2
6.8
Lavoro in VC per Flusso stazionario
δqrev − δl rev = dh + dec + de p = Tds + vdp + dec + de p = δqrev + vdp + dec + de p
2
l rev = − ∫ vdp + ∆ec + ∆e p
1
2
a sistema fermo l rev = − ∫1 vdp
per liquidi ad un solo flusso
lrev
w22 − w12
= v( p1 − p2 ) +
+ g ( z2 − z1 )
2
J
kg
per liquidi ad un solo flusso in assenza di lavoro (equazione di Bernoulli)
w22 − w12
+ g ( z2 − z1 )
0 = v( p1 − p2 ) +
2
J
kg