Soluzioni tampone
ed equilibri acido base
Se in una soluzione acquosa sono presenti un acido debole e la
sua base coniugata (CH3COOH e CH3COO-;H2CO3 e HCO3-,
etc.) in concentrazioni approssimativamente uguali si ha una
soluzione tampone
Un tampone può essere costituito da :
• Un acido debole e la sua basa coniugata (CO2/HCO3CH3COOH/CH3COO- )
• Una base debole e il suo acido coniugato (NH3/NH4+)
Tale soluzione RESISTE (si oppone…tampona!) al cambiamento
di pH in seguito ad aggiunte contenute di un acido o di una base
Le soluzioni tampone hanno proprietà chimiche peculiari:
•Il pH tende a rimanere costante per piccole aggiunte di
un acido o di una base forte
•Il potere tamponante della soluzione è ottimo quando il
pH della soluzione è = al pK dell’acido debole +o- 1
unità di pH
•Il rapporto ottimale tra l’acido e la base coniugata deve
essere circa 1 perché il tampone sia alla massima
efficienza, può differire al massimo di un fattore 10
affinché la soluzione mantenga il potere tampone.
•Un tampone è tanto più efficace, quanto è più
concentrato e tollera l’aggiunta di acidi o basi forti fino
ad 1/50 della sua concentrazione.
Un tampone sfrutta l’equilibrio di dissociazione dell’acido debole:
CH3COO- + H3O+
CH3COOH + H2O
Il CH3COO- tampona piccole aggiunte di H+(proveniente da un acido forte)
perché l’equilibrio della reazione si sposta verso sinistra, per il principio
dell’equilibrio mobile, consumando idrogenioni; e H3O+tampona piccole
aggiunte di OH – (proveniente da una base forte) e l’equilibrio si sposta verso
destra, producendo idrogenioni.
[CH3COO-] [H3O+]
Ka =
[CH3COOH]
dalla quale si ha:
1/[H3O+] = 1/Ka
[CH3COO-]
[CH3COOH]
e quindi:
[CH3COO-]
pH = pKa + log
[CH3COOH]
Questa è l’equazione di Handerson Hasselbach
Se le concentrazioni delle due specie CH3COOH e CH3COO- sono uguali,
pH=pKa perciò si ha il massimo potere tamponante, e poiché gli acidi deboli si
dissociano poco, per avere una concentrazione sufficiente di base coniugata è
necessario aggiungere un sale dell’acido.
Un tampone funziona bene se: pKa -1<pH >pKa +1
cioè per oscillazioni entro 1 unità di pH
dove pKa -1 si ha per CH3CCO-/CH3COOH = 1/10
e pKa +1 si ha per CH3CCO-/CH3COOH = 10
Per l’acido acetico il pKa=4.74
Qual è il range di pH a cui lo usereste come tampone?
CH3COOH + H2O
H3O+ + CH3COO-
A bassi valori di pH (per es. pH 3.7) la forma dominante nell’equilibrio
chimico è l’acido acetico, mentre ad alti valori di pH (per es. pH 5.7) la
forma dominante è quello dello ione acetato.
Quando il pH = pKa, l’acido acetico (CH3COOH) è dissociato al 50%.
Ad un pH pari al pKa si ha il massimo potere tampone di una soluzione.
IMPORTANTE
La scelta di una soluzione tampone dipende sempre dal valore di
pH che deve essere mantenuto costante
N.B. Tampone acido acetico/acetato
è un tampone utile a mantenere il pH di una soluzione intorno a 5, e non al
valore fisiologico di 7,4 quindi non è adatto all’utilizzo negli organismi
viventi.
pH=pKa + log [base]/[acido]
Se vogliamo preparare una soluzione ad un determinato pH si sceglie una
coppia acido/base il cui acido abbia un pka vicino più possibile al pH
desiderato e poi si modificherà il rapporto [base]/[acido]
Es TAMPONI FOSFATO
L’acido fosforico e i suoi anioni possono dar luogo a tre diversi tipi di
tampone di particolare interesse.
Esso è infatti un acido triprotico:
H3PO4
H+ + H2PO4- a 37°C pKa1=2.5
H2PO4-
H+ + H PO42-
pKa2=7.21
H PO42-
H+ + PO43-
pKa3=12
e possono essere individuate tre coppie acido-base coniugate
H3PO4 / H2PO4H2PO4- / H PO42-
pKa2=7.21
H PO42- / PO43-
di cui è particolarmente importante la seconda coppia, con un
pKa2=7.21, che permette di preparare tamponi a pH intorno a 7.4
Riassumendo, i passaggi necessari per preparare un tampone sono:
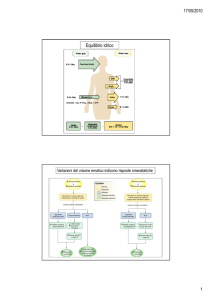
I tamponi del sangue
Il pH del sangue è mantenuto costante da alcuni soluti che
svolgono una efficace azione tampone
Nell’uomo sano a riposo il pH del sangue è in un range molto
stretto: 7,35-7,45 e si ha acidosi e alcalosi sotto e sopra tale range
In particolare i valori normali del sangue sono:
• Sangue arterioso pH =7,4
• Sangue venoso
pH =7,37
Se non viene rispettato tale range, si possono manifestare :
coma acidosico
se pH<7.0 (se pH< 6.9 morte)
tetania alcalosica se pH>7.5 (se pH> 7.6 morte)
Pertanto le variazioni massime dal pH ottimale di 7.4 non possono
superare il valore di ± 0.4 per non andare incontro a gravi patologie.
I tamponi più importanti del sangue sono:
1. CO2/HCO3- « tampone bicarbonato»
2. H2PO4-/HPO42- «tampone fosfato»
3. Tampone proteina/proteinato (Hb)
Oltre alle proteine plasmatiche, l’emoglobina, presente nei
globuli rossi ad alta concentrazione, ha una azione tampone a
livello intracellulare
Controllo del pH è essenziale per numerose funzioni
fisiologiche che sono:
• L'attività metabolica dei tessuti causa un'enorme produzione di H+
(es.: produzione di CO2)
• La cellula è quindi costretta ad un costante lavoro per eliminare H+
in eccesso
Perché è importante mantenere il pH costante,
sia all’interno che all’esterno delle cellule?
Lo ione idrogeno come specie altamente reattiva
Legame con le proteine
(enzimi, proteine contrattili,
proteine di trasporto etc.)
Alterazioni strutturali
Alterazioni funzionali
pH INTRACELLULARE e pH EXTRACELLULARE
Attività enzimatica
il pH può influenzare il legame di un
enzima con il substrato, l’attività
catalitica dell’enzima, o addirittura può
alterare la stabilità dell’enzima
Trasporto di ioni e molecole
i siti di legame delle proteine che
trasportano ioni e molecole da un versante
all'altro delle membrane biologiche
presentano gruppi funzionali il cui grado di
ionizzazione è essenziale per il legame con lo
ione o molecola da trasportare.
TRASPORTATORE degli ACIDI BILIARI
Emoglobina
Emoglobina è una proteina di trasporto
posta non nella membrana ma nel
citoplasma del globulo rosso; la sua
capacità di legare l'O2 è alterata da
variazioni di pH: una acidificazione
diminuisce la forza con cui l'emoglobina
lega l’ossigeno (effetto Bohr)
Contrazione muscolare
abbassando il pH intracellulare
nel muscolo cardiaco si ottiene
una riduzione della forza di
contrazione
Regolazione acido base nel metabolismo
Produzione metabolica ed eliminazione di acidi ed alcali
Le variazioni di pH nel fluido extracellulare (LEC)
devono essere mantenute entro limiti molto ristretti
(mammiferi tra 6.8 – 7.8)
La stabilità del pH è insidiata da acidi forti prodotti nel
corso del metabolismo proteico.
Liquidi corporei
pH
Bile cistica
5,6 – 8,0
Citoplasma cellule
muscolari scheletriche
6,9
Feci
5,9 – 8,5
Liquido cerebro-spinale
7,35
Saliva
5,8 – 7,1
Sangue arterioso
7,40
Sangue venoso
7,35
Succo gastrico
0,7 – 3,8
Succo intestinale
7,0 – 8,0
Succo pancreatico
7,5 – 8,8
Urina
4,5 – 8,0
Esempi
Produzioni giornaliere di H+ e CO2 di un adulto a riposo e in attività:
• H+:
adulti: 50-70 millimoli
infanti: 1-2 millimoli/Kg
• CO2
A riposo: 12 000 - 15 000 millimoli (288-360 litri)
In attività: fino a 50 000 millimoli
• CO2 + H2O H+ + HCO3 Ogni giorno l’organismo produce fino a 15 litri di
acido cloridrico 1 molare, o 1.5 litri di acido
cloridrico fumante, ma il pH deve assolutamente
rimanere 7.37-7.43
Difese dell’organismo contro CO2 e H+:
Sistemi tampone del sangue (secondi)
Fosfati, proteine, bicarbonato
Regolazione della respirazione (minuti)
Regolazione renale (ore/giorni)
Contenuto di
CO2 in lattina
di Coca Cola:
258 millimoli
PRODUZIONE ed ELIMINAZIONE di H+
nell’organismo a livello metabolico
Produzione di idrogenioni nell’organismo dal Metabolismo ossidativo
degli AA di proteine solforate assunte con la dieta (circa 60
mmol/giorno).
Eliminazione degli idrogenioni con le urine, infatti in una dieta ricca di
proteine animali, si hanno urine molto acide.
Produzione di idrogenioni nell’organismo anche dal Metabolismo
ossidativo di glucidi, lipidi e proteine che producono CO2 e H2O.
La CO2 in acqua forma un acido debole = acido carbonico che si
dissocia in H+ e HCO3Eliminazione della CO2 attraverso la respirazione (Acido carbonico è un
acido volatile)
Queste quantita’ di H+ formate possono sbilanciare l’equilibrio acidobase.
L’equilibrio acido-base può essere sbilanciato non solo da un’eccessiva
produzione di idrogenioni, ma anche da una loro scarsa eliminazione,
com si verifica in patologie date da insufficienza respiratoria o renale.
Ogni giorno il nostro organismo produce acidi.
La produzione di H3O+ nell’organismo può variare fino a
40-80 mmol/die.
La maggior quantità di acido prodotto è conseguenza della
respirazione cellulare:
CO2 + 2H2O
H2CO3+ H2O
H3O+ + HCO3Acido carbonico
anidrasi carbonica velocizza
la reazione di idratazione della
CO2 (600.000 CO2/sec)
A pH fisiologico l’H2CO3 si trova
prevalentemente come HCO3-
oltre all’acido carbonico si ha la produzione di altri acidi
quali: acido solforico, acido fosforico, acido cloridrico,
acido lattico, corpi chetonici
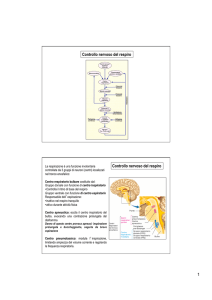
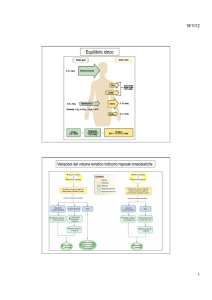
Regolazione dell’Equilibrio Acido-Base
Gli ioni H3O+ non appena prodotti, vengono immediatamente
neutralizzati attraverso sistemi tampone
Il sistema tampone Acido Carbonico/Bicarbonato
CO2 + H2O ↔H2CO3 ↔ H+ + HCO3• Rene: elimina acidi o basi in eccesso, con una risposta lenta
• Respirazione: regola in pochi minuti, cioè attraverso una
risposta rapida, la ventilazione e quindi l’eliminazione della
CO2
[H+] 35-45 nmol/l
dove a 35 nmol/l corrisponde un pH=7.45 e a 45 nmol/l un pH =7.35
Il pH dei fluidi dell'organismo, in particolare del sangue, è regolato
attraverso un complesso meccanismo omeostatico.
Dal punto di vista chimico, ad esso concorrono
principalmente tre sistemi tampone:
1. diidrogenofosfato - idrogenofosfato
H2PO4- + H2O = H3O+ + HPO422. acido carbonico - idrogenocarbonato
CO2 + H2O = H2CO3 = H+ + HCO3 3. proteine - anioni proteinato
proteina = H++ ione proteinatoIl pH del sangue deve essere mantenuto entro limiti abbastanza rigidi.
Il valore normale nel sangue arterioso è 7.4 (7.37 nel sangue venoso);
già a valori inferiori a 7.35 e superiori a 7.45, i patologi parlano
rispettivamente di acidosi e alcalosi.
Valori di pH <6.9 e di pH>7.6 sono INCOMPATIBILI con la vita
Equilibrio acido-base del sangue: mantenimento del pH ematico
il pH arterioso è attentamente regolato affinché rimanga entro il normale intervallo tra 7,35 e 7,45.
L’acidosi è una diminuzione del pH sotto il valore di 7,35, mentre l’alcalosi è un aumento sopra il
valore di 7,45
Cause di squilibrio dell’equilibrio acido-base del sangue: l'acidosi respiratoria è causata da un
aumento della pressione di anidride carbonica (Pco2 ), mentre l'alcalosi respiratoria è causata da una
diminuzione della Pco2.
L'acidosi e l'alcalosi metabolica sono alterazioni del pH del sangue causate da motivi diversi dalle
variazioni della Pco2 ma esse sono correlate allo ione bicarbonato
Tre "linee di difesa“ dell’equilibrio acido-base: proteggono contro le modificazioni del pH
del sangue:
1. azione dei sistemi tampone già presenti
2. compensazione respiratoria
3. compensazione renale
Il meccanismo della compensazione fisiologica
compensazione respiratoria: il sistema respiratorio contribuisce all’equilibrio acido-base regolando
i livelli di anidride carbonica nel sangue. Il sistema respiratorio agisce entro alcuni minuti
eliminando ioni idrogeno sotto forma di anidride carbonica , iperventilando, o nel caso siano in
difetto, ipoventilando
compensazione renale: il sistema renale richiede invece ore o giorni per sintetizzare nuovo
bicarbonato e per eliminare gli ioni idrogeno in eccesso o per eliminare gli ioni bicarbonato stessi in
caso di alcalosi
Sistemi tampone
• Il sangue contiene una miscela di tamponi.
• Nel plasma e nel fluidi extracellulari il sistema
tampone più importante dell’organismo è il
sistema acido carbonico-bicarbonato:
H2O + CO2
H2CO3
Base
coniugata
Acido
debole
Componente
respiratoria
pKH CO
2
H+ + HCO3-
3
= 6.1
Perché è un ottimo
tampone?
Componente
metabolica
Sistema Acido Carbonico-Bicarbonato
K1
K2
CO2 + H2O ↔H2CO3+ H2O ↔ H3O ++ HCO3Riassumendo, poiché l’acido carbonico è trascurabile, risulta che:
K’1
CO2 + 2H2O ↔ H3O ++ HCO3pH = pK’1+ Log
[HCO3-]
Equazione di
Henderson-Hasselbalch
[CO2]
Dove pK’1= 6,1 e si ottiene moltiplicando K1x K2 dell’equilibrio multiplo,
il pKa dell’acido carbonico nel plasma risulta essere minore di 6,37 (valore
che risulta nell’acqua) per la presenza di altri ioni.
Inoltre poiché si ha: CO2gas↔ CO2plasma
[CO2] = pCO2
Legge di Henry
Sistema Acido Carbonico-Bicarbonato
In condizioni normali:
• pK’1 = 6.1
• = 0,03
• pCO2 = 40 mmHg
• [HCO3-] = 24 mmol/L
pH = pK’1+ Log
[HCO3-]
p CO2
pH = 6,1+Log (24/1,2)=6,1+Log 20=6,1+1,3=7,4
pH ‘ideale’
Il sistema anidride carbonica-bicarbonato è il tampone più concentrato nel sangue umano.
I tessuti producono continuamente CO2, il polmone elimina CO2 con la respirazione ed il rene
elimina HCO3- nell’urina.
Questi meccanismi, agendo di concerto, mantengono costante il rapporto [HCO3-]/[CO2]
e conseguentemente il pH del sangue, anche se il suo potere tampone è modesto perché
pH ≠ pK
Poiché i sistemi biologici sono sistemi aperti non all’equilibrio, o meglio, in
disequilibrio stazionario, la frazione di saturazione per una reazione in vivo sarà
soggetta a fluttuazioni dovute ai cambiamenti delle condizioni.
Ad esempio, lo ione HCO3- , che forma il sistema tampone più importante del
sangue, si trova in una condizione di equilibrio dinamico, in risposta alle
variazioni del pH e alla concentrazione di CO2 nei vari tessuti umani.
pK= 6.1
H2O +CO2 ↔ H2CO3 ↔ HCO3- + H+
Se pH > 7.45
Se il pH nel sangue si alza (se pH > 7.45)
i meccanismi compensativi, per riportare il
pH del sangue entro valori fisiologici, sono:
A livello polmonare si ha ipoventilazione per
trattenere più CO2 che, reagendo con l’H2O
forma H2CO3 che dissocia un H+ e HCO3A livello renale si ha aumento
dell’escrezione dello ione HCO3-
Se pH < 7.35
Se il pH nel sangue si abbassa (se pH < 7.35)
i meccanismi compensativi, per riportare il
pH del sangue entro valori fisiologici, sono:
A livello polmonare si ha iperventilazione per
eliminare più CO2
A livello renale si ha aumento del
riassorbimento dello ione HCO3-
Il tampone acido carbonico-bicarbonato tampona da pH 5.1
a pH 7.1 ma in realtà è riesce a tamponare a pH 7.4 perché si
considerano le concentrazioni fisiologiche di [HCO3-]e pCO2
che sono rispettivamente pari a 24 mM e 40 mmHg
La concentrazione del bicarbonato è regolata principalmente
dal sistema renale, mentre la pressione parziale della CO2 nel
fluido extracellulare è controllata dalla «rate» respiratoria (che
però corrisponde a frequenza+profondità del respiro) cioè da
iper o ipoventilazione.
Questo tampone ha quindi il vantaggio di essere sotto il
controllo di due sistemi che giocano nella regolazione del pH.
Quando un’alterazione dell’equilibrio acido-base deriva da
variazioni del bicarbonato si parla di disordini acido-base
metabolici.
Quando l’alterazione deriva da variazioni della PCO2 si parla di
disordini acido-base di tipo respiratorio.
acidosi
HCO3-
PA=pressione alveolare
Pa=pressione arteriosa
PaCO2
metabolica
respiratoria
Diminuzione
della filtrazione
di bicarbonato
Aumento
della
CO2 nel plasma
H2O +CO2
alcalosi
HCO3metabolica
Aumento del
bicarbonato nel
plasma
HCO3- + H+
PaCO2
respiratoria
Diminuzione della
CO2 per
iperventilazione
Il tampone ACIDO CARBONICO /BICARBONATO
è il più efficace tampone fisiologico a pH 7.4
Come avviene la regolazione a livello polmonare?
H + + HCO3 SANGUE
Fase acquosa
Equilibrio 1
H2CO3 plasma
Equilibrio 2
Disciolta nel
sangue
CO2 + H2O
Equilibrio 3
Spazi aerei dei
polmoni
(fase gassosa)
CO2gas
sangue
Il tampone ACIDO CARBONICO /BICARBONATO è un
tampone extracellulare molto potente perché è un SISTEMA
APERTO e ha due meccanismi di regolazione:
Regolazione respiratoria per la CO2
Regolazione renale per l’HCO3In condizioni fisiologiche si ha che:
[HCO3-]= 24 mM e [CO2]= 1,2 mM, cioè per pCO2 =40 mmHg
quindi dall’equazione di H.H.si ha:
pH=6.1+ log 24/1.2= 6.1+log20=6.1+1.3=7.4
• Se viene acidificato l’ambiente con HCl 5 mM, in un sistema
chiuso si ha:
pH=6.1+ log(24-5)/(1.2+5)=
6.1+log19/6.2=6.1+log3.06=6.1+0,5=6.6
• In un sistema aperto, invece, la CO2 viene eliminata attraverso
iperventilazione e si ha che:
pH=6.1+ log(24-5)/1.2=6.1+log19/1.2=6.1+log15.8=6.1+1.20=7.3
Il tampone H2CO3/HCO3- e l’acidosi metabolica
• Il sistema tampone H2CO3/HCO3– è un ottimo sistema per
equilibrare il pH solo se riesce a scambiare CO2 con l’ambiente
esterno
in condizioni normali
HCO3–
CO2
20
=1
aumentata acidità
2H+
• la sola aumentata velocità di scambio della CO2 tra capillare e
alveolo è sufficiente in un sistema aperto per compensare
parzialmente l’aumento di H+ (acidosi) o di OH– (alcalosi)
32
Acidosi e alcalosi plasmatica
pH del sangue dipende dal rapporto
HCO3–
non dai valori assoluti di [HCO3–] e [CO2]
CO2
basta variare il rapporto per riequilibrare il pH plasmatico
il contenuto di CO2 plasmatica può essere regolato velocemente attraverso la respirazione
(ventilazione)
la regolazione renale dei bicarbonati è lenta ma efficace e riporta l’[HCO3–] al suo valore
assoluto di equilibrio (24 mM/litro)
il
l’acidosi si verifica quando: [H+]
pH
[CO2]
[HCO3–]
il riequilibrio avviene attraverso:
1 – chemotrasduzione (glomi carotidei e aortici,
chemorecettori centrali)
2 – stimolazione dei centri nervosi del respiro
3 – iperventilazione
4 – riduzione della CO2
l’alcalosi si verifica quando: [H+]
pH
[CO2]
[HCO3–]
il riequilibrio avviene attraverso gli stessi meccanismi che controllano l’acidosi
Acidosi e alcalosi metabolica
cause dell’acidosi
cause dell’alcalosi
fatica muscolare (acido lattico)
diabete mellito (acidi dal metabolismo dei lipidi)
insufficienza renale (accumulo di H+ nel plasma)
diuretici inibitori dell’anidrasi carbonica (minor riassorbimento di HCO3–, [HCO3-]
plasmatica)
vomito (perdita di HCl)
aldosterone (aumentata secrezione renale di H+)
assunzione di sali alcalini (NaHCO3)
sono compensate per via respiratoria (chemocettori centrali)
i valori di pH si riequilibrano perché viene riaggiustato il rapporto HCO3–/CO2 ma non i loro valori assoluti (bassi
nell’acidosi e alti nell’alcalosi)
il completo riequilibrio del pH e dei valori assoluti avviene attraverso la funzione renale
Acidosi e alcalosi respiratoria
causate da una ridotta o aumentata ventilazione alveolare
sono entrambe compensate dal riequilibrio acido-base a livello renale coinvolgendo tamponi
non bicarbonato (fosfati, proteine plasmatiche)
Tampone Fosfato
pKa1=2,5
pKa2=7,21
pKa3= 12
Tra i tre equilibri di dissociazione, consideriamo efficace come tampone solo quello con
pKa2=7,1, vicino al pH fisiologico.
Il tampone fosfato, costituito dalla coppia H2PO4-/HPO42-è meno importante del tampone
bicarbonato perché nei fluidi extracellulari è molto meno concentrato, pari a 1,2 mM.
Risulta invece un sistema importante a livello renale perché il fosfato si concentra nel tubulo
renale ed inoltre il pH nel tubulo è inferiore a 7.4 portandosi quindi molto vicino al pK del
sistema fosfato che quindi ha un ottimo potere tampone.
Il sistema fosfato è un ottimo tampone intracellulare dove risulta molto concentrato ed inoltre
anche qui il pH intracellulare è molto vicino al pK del sistema rendendolo quindi molto efficace.
Tampone proteina/proteinato
Le proteine rappresentano il 75% del potere tampone dell’organismo e
sono nel plasma (70 g/l) e nei globuli rossi (300 g/l)
• Emoglobina= 21 mM H+/pH
• Albumina e altre proteine del plasma= 3-4 mM H+/pH
Emoglobina è un tampone intracellulare
Albumina è un tampone extracellulare
La capacità tampone è nei gruppi ionizzabili delle proteine
quali:
gruppi carbossilici e gruppi aminici
gruppi delle catene laterali come il gruppo imidazolico
dell’Hys che ha un pka=6.5
L’Hys è un efficace tampone a pH fisiologico
Affinità dell’emoglobina per l’ossigeno
(effetto Bohr)
Il pKa dell’emoglobina dipende dal suo stato di
ossigenazione, mostrando un comportamento diverso nei
tessuti e nei polmoni:
HbO2+H3O+ ↔ O2+ HbH+
(per il
Nei tessuti si ha
produzione di CO2,
quindi di H3O+, che
diminuisce l’affinità
dell’Hb per l’O2, con il
suo rilascio
O2+ HbH+ ↔ HbO2+H3O+
principio dell’equilibrio mobile)
Nei polmoni si ha
rilascio di CO2, quindi
diminuisce H3O+, ma
aumenta la pO2 che
permette la formazione
dell’HbO2
Ricordiamo che….
Le oscillazioni del pH fisiologico dipendono da una parte
dai processi metabolici che possono produrre acidi
organici (acido lattico, acido ß-idrossibutirrico, acido
acetacetico, etc) e acidi inorganici (acido carbonico, ione
diidrogenofosfato), e dall'altra parte le variazioni di pH
dipendono dall'alimentazione che può far introdurre sali
alcalini di Na+, K+, Ca++ e Mg++.
In particolare i carnivori hanno una dieta ricca di
composti acidi e sono quindi prevalentemente tendenti
all'acidosi, mentre l'inverso succede agli erbivori
(tendenza all'alcalosi).
Ricordiamo quindi che:
Il pH del sangue viene mantenuto più o meno costante dal suo
potere tampone dovuto ai tre sistemi acido-base coniugati:
1) acido carbonico/bicarbonato
2) diidrogenofosfato/idrogenofosfato
3) proteine/proteinati
Il primo sistema, il tampone dato da acido carbonico/
bicarbonato, è il più importante perché viene direttamente
regolato dalla respirazione.
Ricordiamo inoltre che….
Sistema CO2-bicarbonato
CO2 + H2O H2CO3 H+ + HCO3 Reazione di idratazione della CO2
Lenta (secondi), ma accelerata da anidrasi carbonica
(presente nei globuli rossi)
Reazione di ionizzazione dell’acido carbonico
Molto veloce: l’acido carbonico praticamente non esiste al
pH del sangue (7.4)
CO2 + H2O H+ + HCO3pK=6.1
È importante sottolineare che il pH del sangue non dipende
dalla quantità assoluta di bicarbonato e CO2, ma dal loro
rapporto, per cui un aumento o una diminuzione
proporzionali dei due composti non fa variare il pH del
sangue.
Tuttavia una riduzione dei composti basici nel sangue, ad
esempio a causa di diete carenti di queste sostanze o di
eccessiva sudorazione, farebbe diminuire la quantità di
bicarbonato senza alterare la quantità di CO2 disciolto e
quindi, diminuendo il rapporto [base]/[acido], si avrebbe un
abbassamento del pH del sangue con conseguente acidosi.
La diminuzione del pH sanguigno stimola però la
respirazione e la iperventilazione che ne consegue porta
alla eliminazione della CO2 in eccesso fino a ristabilire il
normale rapporto [base]/[acido].
CO2 + H2O H+ + HCO3-
Viceversa un aumento delle basi nel sangue farebbe
aumentare la quantità di CO2 combinata con esse (cioè lo
ione bicarbonato) e di conseguenza anche il rapporto
[base]/[acido], per cui si alzerebbe il pH del sangue con
conseguente alcalosi.
In questo caso la respirazione viene inibita, trattenendo così la
CO2 nel sangue con conseguente aumento della
concentrazione di idrogenioni e quindi abbassando il pH,
senza però causare ipossiemia per una eccessiva
ipoventilazione!
In tal modo viene compensata l'alcalosi, spostando
destra la serie di equilibri:
verso
CO2 + H2O H+ + HCO3-
polmoni
CO2 (g)
H2O + CO2
1
H2CO3
20
HCO3- + H+
reni
HCO3-
polmoni
CO2 (g)
iperventilazione
H2O + CO2
H+
1
H2CO3
20
HCO3- + H+
riassorbimento
reni
HCO3-
polmoni
CO2 (g)
ipoventilazione
H2O + CO2
OH-
H2O
1
H2CO3
20
HCO3- + H+
escrezione
reni
HCO3-
Ossa e tessuto connettivo
Se il sistema tampone raggiunge i propri limiti e la capacità del
rene di eliminare gli acidi è esaurita, per mantenere condizioni
metaboliche ottimali l’organismo deve provvedere a togliere questi
acidi immediatamente “dalla circolazione”. Ciò avviene mediante
il deposito degli acidi nel tessuto connettivo che per le sue
caratteristiche fisiche risulta particolarmente adatto ad assorbire gli
acidi: un po’ come una spugna che si gonfia d’acqua.
In alternativa vengono liberate dalle ossa delle sostanze basiche
(ad esempio bicarbonato e fosfato di calcio) ciò che a lungo andare
può compromettere la salute delle ossa.
APPLICAZIONI CLINICHE
“Stato acido-base” fa riferimento al pH ematico.
L’alterazione dell’equilibrio acido-base (non è una malattia), ma
può derivare da:
Produzione d chetoacidi o acido lattico (diabete, digiuno, sforzo
muscolare)
ritenzione di scorie acide
eccessiva perdita di acidi (vomito ripetuto)
perdita di liquidi alcalini (diarrea)
l’aumentata eliminazione della CO2 (aumento della frequenza
respiratoria)
la riduzione della ventilazione (coma o intossicazioni)
la ritenzione di CO2 (pneumopatia ostruttiva cronica)
QUINDI…
A qualsiasi tipo di disequilibrio acido-base l’organismo reagisce
innescando un processo di segno contrario, di tipo
compensativo, per riportare il pH verso valori normali.
DISEQUILIBRIO ACIDO-BASE
PROCESSO COMPENSATIVO
Acidosi respiratoria
↑pCO2
↓ pH
↑ HCO3-
Alcalosi respiratoria
↓ pCO2
↑ pH
↓ HCO3-
Acidosi metabolica
↓ HCO3-
↓ pH
↓ pCO2
Alcalosi metabolica
↑ HCO3- ↑ pH
↑ pCO2
È fondamentale, cioè, mantenere costante il rapporto [HCO3-]/pCO2
Esempi di compensazione…
Lo scopo della compensazione è quello di riportare il pH a valori normali
•Disturbo primario: acidosi respiratoria, con una pCO2 > 40 mmHg per una
respirazione inadeguata.
•Compensazione: alcalosi metabolica, con [HCO3-] > 24 mM con ritenzione del
bicarbonato da parte del rene che riporta il pH verso i valori normali.
•Disturbo primario: acidosi metabolica, con [HCO3-] < 24 mM, dovuta ad un
aumento di idrogenioni che si legano al bicarbonato facendolo diminuire (ad
esempio alla produzione di acido lattico in deficit d’ossigeno) o dovuta ad una
semplice diminuzione dello ione bicarbonato.
•Compensazione: alcalosi respiratoria, che può essere data da iperventilazione
alveolare, stimolata da acidosi metabolica, per eliminare la CO2, evento che porta
ad una pCO2 < 40 mmHg, che riporta il pH verso valori normali.
…. L’organismo reagisce con un meccanismo compensativo diverso
dal meccanismo che ha provocato lo scompenso e nella direzione
opposta, cioè ad uno scompenso respiratorio risponde compensando
per via metabolica e viceversa….
Visione d’insieme delle anomalie dell’equilibrio acido-base
e dei meccanismi di compensazione
Fig. 18.28 di Germann-Stanfield, Fisiologia umana, EdiSES, 2003
Emogasanalisi (EGA)
campione di sangue prelevato dall’arteria radiale a livello del polso
Misurazione diretta di pH, pCO2 e pO2 tramite emogasanalizzatore,
Dall’equazione di Henderson-Hasselbach,
lo strumento CALCOLA la concentrazione dello ione bicarbonato, detta
[HCO3- ] reale, in quanto deriva dai valori misurati di pH e di pCO2
La concentrazione dello ione bicarbonato è 24 mM a pH 7,4
quando la pCO2 è 40 mm Hg
Lo strumento ci permette anche di calcolare la quantità di bicarbonato atteso per
quella particolare pressione di CO2 misurata, attraverso il calcolo del BE o eccesso di
basi.
Questa quantità è nota come [HCO3-]attesa
La differenza tra la concentrazione di HCO3- reale e quella attesa è detta BE,
cioè rappresenta l’eccesso (o il deficit) di Base, cioè di bicarbonato rispetto a
quello atteso per quel particolare valore pCO2.
[HCO3-]reale-[HCO3-]attesa =BE ossia [HCO3-]attesa = [HCO3-]reale- BE
I valori di BE se sono compresi tra -2 e +2 significa che non abbiamo differenze
significative tra lo ione bicarbonato reale e quello atteso
Se BE=0 (-2 ≤BE≤+ 2 mmoli/l) significa che [HCO3-]reale=[HCO3-]attesa, cioè non
c’è né acidosi né alcalosi metabolica.
Se BE>2 mM significa che [HCO3-]reale>[HCO3 -]attesa, quindi si ha alcalosi
metabolica
Se BE< -2 mM [HCO3-]reale<[HCO3 -]attesa, allora c’è acidosi metabolica
Il BE permette di definire lo stato di acidosi o alcalosi metabolica quando la
pCO2 si discosta dal valore normale di 40 mm Hg.
Esempi…..
Esempio 1
EGA:
pH=7,16
pCO2 = 80 mm Hg,
[HCO3- ]reale =28 mM
BE=0
Interpretazione:
Il paziente è in acidosi, solo di origine respiratoria perché il
pH< 7,35, e la pCO2 > 40 mmHg, e il BE=0 il che significa
che anche la [HCO3- ]attesa=28 mM per quel valore di
pCO2=80 mm Hg,
(Considerazione: l’organismo non ha attivato nessun
meccanismo di compenso di tipo metabolico)
Esempio 2
EGA:
pH=7,12
pCO2 = 80 mm Hg,
[HCO3- ]reale =25.5 mM
BE=-2,4 mmol/l
Interpretazione:
Il paziente è in acidosi sia respiratoria che metabolica
perché il pH < 7,35, e la pCO2 > 40 mmHg, e il BE < -2,
infatti [HCO3- ]attesa=27.9 mM, che deriva da 25,5+2,4, cioè da
[HCO3-]reale-BE, il che significa che il valore dello ione
bicarbonato reale è inferiore a quello atteso.
(Considerazione: l’organismo non ha attivato nessun
meccanismo di compenso)
Esempio 3
EGA:
pH=7,52
pCO2 = 30.4 mm Hg,
[HCO3- ]reale =24 mM
BE=1.1 mmol/l
Interpretazione:
Il paziente è in alcalosi respiratoria acuta (cioè non
compensata) perché il pH >7,45, e la pCO2 < 40 mm Hg.
La [HCO3- ]attesa=22.9 mM (24-1,1) significa che abbiamo
una lieve alcalosi metabolica, perché la [HCO3- ]reale è
lievemente maggiore della [HCO3- ]attesa ma trascurabile in
quanto il BE < 2 (entro il range di normalità)
Esempio 4
EGA: pH=7,05
pCO2 =12 mmHg
[HCO3- ]reale =5 mM
BE=-30 mmol/l
Interpretazione:
Il paziente è in una condizione di gravissima acidosi metabolica
(testimoniata dal pH < 7,35 e soprattutto dal BE < <-2, il che
significa che la [HCO3- ]reale è molto minore di [HCO3- ]attesa=35
mM).
Tale acidosi ha causato iperventilazione alveolare (data da una
pCO2< 40 mmHg) che cerca di compensare. Inoltre ci si sta
avvicinando ad un pH molto pericoloso; tutto ciò richiede un
intervento terapeutico immediato.
Esempio 5
EGA: pH=7,27
pCO2 =25 mmHg
[HCO3- ]reale =11 mM
BE= -14 mmol/l
Interpretazione:
E’ lo stesso caso dell’esempio 4 dopo intervento terapeutico dato
da somministrazione di insulina, fluidi e bicarbonato.
L’acidosi metabolica è ancora presente (infatti BE <-2 ancora)
ma con una iperventilazione meno marcata (pCO2=25 mmHg),
ma tale da compensare parzialmente e alzare il pH.
Esempio 6
EGA: pH=7,10
pCO2=60 mmHg
[HCO3- ]reale=18 mM
BE= -15 mmol/l
Interpretazione:
È una condizione di acidosi (pH è 7,10) mista: respiratoria (PaCO2
è 60) e metabolica (BE è -15). Il valore del BE conferma questo
perché la [HCO3- ]attesa=18+15=33 mM; cioè il valore dello ione
bicarbonato reale è inferiore a quello atteso, quindi siamo anche in
acidosi metabolica.
Esempio 7
EGA: pH=7,52
pCO2=55 mmHg
[HCO3- ]reale =42 mM
BE=17mmol/l
Interpretazione:
Alcalosi (pH è 7,52) metabolica (BE è 17) parzialmente
compensata da acidosi respiratoria (PaCO2 è 55).
Esempio 8
EGA: pH=7,36
pCO2=75 mmHg
[HCO3- ]reale=42 mM
BE=16mmol/l
Interpretazione:
Acidosi respiratoria compensata perchè: il pH è ai limiti inferiori
della norma, ma la PCO2 elevata (75 mmHg) evidenzia un’acidosi
respiratoria e il BE un’alcalosi metabolica (BE è +16). La [HCO3]attesa=42-16=26 mM; cioè il valore dello ione bicarbonato reale è
superiore a quello atteso, quindi siamo in alcalosi metabolica.
Poiché il rene ha già attivato meccanismi di compensazione, e infatti
trattiene i bicarbonati per normalizzare il pH, posso pensare che
l’acidosi respiratoria sia dovuta ad una insufficienza respiratoria di
tipo cronico.
Esempio 9 (con referto EGA)
pH
pCO2
HCO3BE
7,162
76,7 mmHg
26,8 mmol/l
-1,8 mmol/l
L’EGA fornisce altri dati utili, in
questo caso l’ossigenazione
(data da pO2 e SO2) è adeguata
perché il paziente sta ricevendo
ossigenoterapia.
Esempio 9
EGA:
pH=7,162
pCO2 = 76,7 mm Hg,
[HCO3- ]reale =26,8 mM
BE=-1,8 mmol/l
Interpretazione:
È una condizione di acidosi (pH <7,35) respiratoria acuta perché la
pCO2 è > 40 mm Hg.
Anzi dai dati si capisce che c’è anche una lieve acidosi metabolica,
perché la [HCO3- ]reale è lievemente minore della [HCO3- ]attesa (infatti
[HCO3- ]attesa=26,8+1,8=28,6 mM) ma trascurabile perché il BE è
compreso tra meno-2 e +2.
Esempio 10
EGA:
pH= 7,15
pCO2 = 22 mm Hg,
[HCO3- ]reale = 9 mM
BE= -30 mmol/l
Interpretazione:
Il paziente è in una condizione di gravissima acidosi
testimoniata dal pH < 7,35 metabolica perché [HCO3- ]reale =9
mM (e soprattutto dal BE <-2, significa che la [HCO3]attesa=39
mM), Tale acidosi ha causato iperventilazione alveolare (data da
una pCO2< 40 mmHg) che cerca di compensare.
Esempio 11
EGA:
pH= 7,21
pCO2 = 60 mm Hg,
[HCO3- ]reale = 24 mM
BE= -4 mmol/l
Interpretazione:
Il paziente è in una condizione di acidosi mista testimoniata dal
pH < 7,35 respiratoria perché la pCO2>40 mmHg; inoltre il
BE<-2 indica che la [HCO3]attesa=28 mM ( 24+4); il che significa
che il valore dello ione bicarbonato reale è inferiore a quello
atteso, quindi siamo anche in acidosi metabolica.
Elettroneutralità e Gap anionico
In ogni soluzione il numero delle cariche
positive deve eguagliare quello delle
cariche negative.
Il Gap Anionico (AG)
rappresenta la concentrazione
di tutti gli anioni non misurati
nel plasma.
Il Gap anionico si ottiene sottraendo dalla concentrazione plasmatica
dello ione sodio, la somma delle concentrazioni plasmatiche di ione
cloruro e ione bicarbonato secondo la seguente formula:
AG = [Na+] – ([Cl-]+[HCO3-])
Il range di riferimento è 8 - 16 mmol/l.
Nell’insufficienza renale la [K+]può presentare variazioni più ampie e alcuni usano
la formula: AG = ([Na+]+[K+]) – ([Cl-]+[HCO3-])
Gap anionico
Il Gap Anionico aiuta a differenziare cause
diverse di acidosi metabolica
Nell’acidosi metabolica si osserva sempre, per mezzo
dell’EGA, una diminuzione dello ione HCO3-.
Per il principio dell’elettroneutralità si possono osservare due situazioni:
AG aumentato per aumento degli anioni non misurabili.
AG normale con aumento della [Cl-] per perdita di
bicarbonati o apporto di cloruri acidosi ipercloremica
Gap anionico
AG elevato si ha nell’acidosi lattica (es. nello shock),
nella chetoacidosi (es. nel diabete scompensato),
nell’insufficienza renale avanzata con ridotta eliminazione
di solfati, fosfati e accumulo di H+ che si legano ai
bicarbonati formando acido carbonico,che è eliminato
come CO2 , facendo diminuire la quantità di bicarbonati.
AG normale si ha nella diarrea, nella fase iniziale
dell’insufficienza renale per perdita di bicarbonati nelle
urine che viene controbilanciata dagli ioni cloro riassorbiti
o non escreti dal rene in modo proporzionale.