FISIOLOGIA
CdL in Medicina e Chirurgia
Regolazione del pH
Dott.ssa Michela Anna Pia Ciliberti
FUNZIONI OMEOSTATICHE INTEGRATE
•regolazione della temperatura corporea;
•controllo del pH dell’organismo;
•regolazione endocrina del metabolismo di calcio, fosforo e glucosio;
•regolazione della pressione arteriosa;
•regolazione delle funzioni sessuali e riproduttiva.
In una soluzione acquosa una piccola parte delle molecole di acqua : OH- e
H+ (protoni).
I protoni, la carica positiva elementare, alterano la distribuzione delle
cariche in soluzione e lo stato delle cariche associate a molecole inorganiche
e organiche (proteine).
Allora la [protoni] deve essere mantenuta in ambiti molto ristretti di
variazione in ogni liquido corporeo grazie a sistemi tampone e a meccanismi
di trasporto di protoni.
ACIDI, BASI E P
ACIDO:
ACIDO: forma di molecola che può liberare un protone.
BASE: forma di molecola che può legare un protone.
ACIDI, BASI E Ph
SOSTANZA ACIDA: forma non protonata molto più stabile di quella protonata.
A- + H+ AH
Base
Acido
sostanza acida
SOSTANZA BASICA o ALCALINA: forma protonata molto più stabile di quella
non protonata
B + H+ BH
Base
Acido
sostanza basica
AH A- + H+ tale sistema è in equilibrio quando k- = k+
k+: costante di associazione
k-: costante di dissociazione
KA: costante acida = [A- ]* [H+]/ [AH] = k- / k+ = concentrazione di H+ a cui forma
acida e basica sono presenti in uguale concentrazione.
ACIDO(HA) FORTE: KA elevata, cioè buona parte della sostanza è
all’equilibrio in forma dissociata, cioè il sistema tende a liberare molti
protoni.
ACIDO(HA) DEBOLE: KA piccola, la frazione dissociata è bassa, scarsa
capacità dell’acido di cedere protoni.
Maggiore è la [protoni], tanto più la reazione si sposta verso la forma acida.
La concentrazione dei H+ nei liquidi organici è in generale molto bassa,
nell’ordine di 10-8 – 10-6 M, perciò si parla di pH, che è il logaritmo decimale
negativo della concentrazione di H+.
pH= -log10 [H+].
Per ogni sostanza si può definire una pKA = -log KA
Per ogni sostanza le concentrazioni di acido e base sono uguali quando [H+]=
KA e quando pH= pKA.
SISTEMA TAMPONE DEL pH:
un acido o una base debole (pKA non lontano da 7, valore neutro di pH),
presente in rilevante concentrazione, tende a stabilizzare la [H+] attorno al
suo valore di KA, potendo legare o cedere protoni senza che cambi molto il
rapporto base/acido e compensando così l’immissione o sottrazione di H+
alla soluzione.
Bisogna considerare :
•pKA del sistema, valore attorno a cui l’efficienza del tampone è massima,
cioè al valore di pH uguale al pKa, metà del tampone è presente nelle due
forme, protonata e non, e perciò la situazione compensa sia aumenti sia
diminuzioni della [H+];
•capacità tampone, per sistema chiuso è tanto più alta quanto più alta è la
[tampone].
SISTEMA TAMPONE APERTO, cioè i prodotti finali della/e reazione/i, che
svolge la funzione tampone, non si accumulano o esauriscono.
IMPORTANZA DEL CONTROLLO DEL Ph
Protoni + gruppi nucleofili di proteine
- stato conformazionale,
- equilibrio tra varie conformazioni,
- struttura e funzione delle proteine.
cambiamento di:
IMPORTANZA DEL CONTROLLO DEL Ph
Assunzione ed eliminazione di acidi e basi con dieta, respirazione e produzione di
urina
modificazione del pH dei liquidi organici
ASSORBIMENTO E PRODUZIONE DI EQUIVALENTI ACIDI
-
PRODUZIONE - METABOLISMO CELLULARE
substrati metabolici
H2O + CO2
H2CO3
HCO3- (ioni
in soluz.
bicarbonato) + H+ (idrogenioni)
CO2 da combustione di substrati energetici= fonte di equivalenti acidi volatili
-
ASSORBIMENTO - DIETA
fegato
equivalenti acidi non volatili:
- acido solforico (Aa con S, Met, Cys)
- acido cloridrico (Aa cationici)
- fosfato (direttamente in alimenti)
Aa bicarbossilici anionici e anioni organici in dieta (citrato)
bicarbonato (parte di HCO3- contenuto e prodotto da alimenti è perso in
feci)
Acidi non volatili sono tamponati dal bicarbonato, che è rigenerato da CO2
con escrezione attiva di H+ in urine.
PRODUZIONE DI EQUIVALENTI ACIDI NON VOLATILI METABOLISMO ENERGETICO
Metabolismo energetico no fino a prodotti terminali perché no
O2 per ossidare substrati energetici (es. metab. glicolitico anaerobico
del muscolo
acido piruvico e acido lattico )
ELIMINAZIONE DI EQUIVALENTI ACIDI
POLMONI: eliminazione di CO2 prodotta da metabolismo cellulare, se
eccessiva att. respiratoria
alcalosi respiratoria (N.B. non tutti gli
equiv. acidi non volatili in eccesso vanno neutralizzati, altrimenti si
esaurisce la riserva di HCO3- , princ. tampone dei LEC)
RENI:
porz. pross. di tubulo renale
H+ secreti + HCO3- filtrato
H2O + CO2 che rientrano nella cellula
epiteliale
H+ + HCO3HCO3- va nell’interstizio con scambio con Cl- o con cotrasporto con
Na+
Risultato: riassorbimento netto di sodio bicarbonato e preservazione di
riserva di HCO3-
porz. dist. di tubulo renale- in cellula glutamina
H+ + NH3 + bicarbonato
porz. dist. di tubulo renale
in cellula: glutamina
H+ + NH3 + bicarbonato
con ATPasi protonica i H+ vanno nel lume + NH3
NH4+ che
non può rientrare passivamente
bicarbonato va nell'interstizio e rimpiazza quello consumato
nell'organismo per tamponare equivalenti acidi non volatili
RISERVA ALCALINA DELL’ORGANISMO-RA:
-Circa 350 mEq di BICARBONATO per un LEC di circa 14 l in un soggetto normale
di 70kg;
-due processi la consumano: filtrazione renale, combinazione con protoni per
neutralizzare gli acidi non volatili;
-due processi compensatori:
1-riassorbimento,
rene- anidrasi carbonica: in lume H2CO3
H2O + CO2 che rientrano in cellula
H2CO3
Ma servono protoni nel lume tubulare, che sono forniti su membr.apicale
verso lume tubulare da:
- scambio Na+ - H+
- secrezione attiva di H+
allora riassorbimento di HCO3- in parallelo con riassorbimento
di Na+
2-sintesi de novo, per compensare quantità di bicarbonato perso per neutralizzare acidi
non volatili
rene- produzione di bicarbonato con produzione simultanea di H+ o ione ammonio
(NH4+), prodotto dalla glutammina nelle cellule del tubulo contorto prossimale
e distale e poi o è estruso al posto dei H+ o si scinde in H+ e ammoniaca (NH3),
che diffonde liberamente al lume, dove il basso pH ne favorisce la
ricombinazione con protoni a generare NH4+, che é intrappolato nel lume
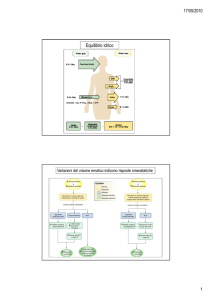
ALTERAZIONI DELL’EQUILIBRIO
ACIDO-BASE
ACIDOSI METABOLICA: riduzione di RA, aumento o meno di Pco2
ALCALOSI METABOLICA: aumento di RA, diminuzione o meno di Pco2
ACIDOSI RESPIRATORIA: aumento di RA, aumento di Pco2, basso pH
ALCALOSI RESPIRATORIA: diminuzione di RA, diminuzione di Pco2, alto pH
Nella pratica clinica:
ACIDOSI/ALCALOSI RESPIRATORIA: solo scostamenti di Pco2
ACIDOSI/ALCALOSI METABOLICA: solo alterazioni RA
ACIDOSI RESPIRATORIA: Pco2 > 45 mmHg a livello arterioso per:
- ridotta ventilazione alveolare con ridotta capacità di eliminare CO2
es. patologie bronchiali e polmonari, ostruzioni di vie aeree, respirazione artificiale
sotto anestesia, neuropatie;
- eccessiva produzione metabolica di CO2,
es. iperpiressia maligna, iperpiressia, dieta ricca di carboidrati con parziale
compromissione della ventilazione.
ALCALOSI RESPIRATORIA:
Pco2< 35mmHg per eliminazione eccessiva di CO2, alterazione ventilazione/perfusione
(V/Q) con conseguente ipossia e iperventilazione compensatoria e bassa pressione
parziale di O2 (PO2).
ACIDOSI METABOLICA:
Eccesso di acidi (che consumano bicarbonato) per:
- troppa produzione di acidi organici da metabolismo anaerobico per
ipoperfusione (es. ipovolemia, shock cardiogeno);
- sepsi o intossicazioni (cianuro) che interferiscono con l’utilizzzo di O2;
- chetoacidosi diabetica (le cellule per carenza di insulina come fonte energetica
usano, invece di glucosio, grassi producendo corpi chetonici);
- inadeguata escrezione di protoni per disfunzione tubulare renale.
Riduzione di RA (alterazioni renali che compromettono il riassorbimento o la
neosintesi renale di bicarbonato- HCO3-) per:
- perdita massiccia di HCO3- per
- perdita di contenuto intestinale ,
- diarrea persistente,
- uso di farmaci che inibiscono l’anidrasi carbonica (acetazolamide,
mal di montagna e glaucoma).
ALCALOSI METABOLICA:
- eccessiva perdita di H+ (vomito prolungato con perdita di secreto gastrico ricco
di H+);
- eccessivo riassorbimento di HCO3-, riduzione di Cl- per vomito prolungato
(secrez.gastrica ha molto Cl-), diuretici che comportano il riassorbimento di Cl(es. tiazidici);
- eccessiva assunzione di alcali es farmaci antiacidi.
RISPOSTE COMPENSATORIE
1- AZIONE TAMPONE CHIMICA
Riduce lo scostamento di pH, che un carico acido o basico produce, ma si esaurisce subito tranne
quando l’escrezione dei H+ è molto efficiente, altrimenti varia la [HCO3-] che può dare
alcalosi/acidosi metabolica: azione efficace ma limitata.
2- COMPENSAZIONE RESPIRATORIA DELLE ALTERAZIONI DEL pH DI ORIGINE
METABOLICA (maggior interesse clinico per ACIDOSI METABOLICA)
Risposta dei centri respiratori del tronco encefalico, iperventilazione per ridurre Pco2 e ristabilire
il pH, ma non si ha compenso completo perché la Pco2 non può scendere sotto un certo limite e si
ha alcalosi respiratoria.
3- COMPENSAZIONE METABOLICA DELLE ALTERAZIONI DEL pH DI ORIGINE
RESPIRATORIA
-ACIDOSI RESPIRATORIA (aumento di Pco2), si produce bicarbonato (HCO3-), si
aumenta la riserva alcalina, si riduce il pH e si determina ALCALOSI METABOLICA.
-ALCALOSI RESPIRATORIA (riduzione di Pco2), si consuma bicarbonato, si riduce
la riserva alcalina, si aumenta il pH e si determina ACIDOSI METABOLICA.
4- COMPENSAZIONE RENALE
Modulazione del riassorbimento tubulare di HCO3- e dell’escrezione di H+ , meccanismo lento
(anche giorni) ma unico per ripristinare il valore corretto di RA.
VALUTAZIONE CLINICA DEGLI SQUILIBRI ACIDO-BASE
1- SEMPLICE MISURA DEL pH PLASMATICO
2- MISURAZIONE DI Pco2 e MISURAZIONE DI RA
equazione di Henderson-Hesselbach - pH= 6,1+log ([HCO3-]/0,03*Pco2)
ogni alterazione respiratoria, che alteri la Pco2 , oppure metabolica, che alteri i livelli
plasmatici di bicarbonato, modifica il pH plasmatico.
3- MISURAZIONE DI GAP ANIONICO (soprattutto per acidosi metabolica):
differenza tra [Na+] e [Cl- + HCO3-], che in condizioni fisiologiche riflette le cariche
negative associate alle proteine plasmatiche, perché gli altri cationi (K+, Ca2+, Mg2+)
sono bilanciati da fosfati, solfato e anioni organici;
gap anionico normale con acidosi per perdita extrarenale di HCO3- (diarrea, vomito
biliare) o per disfunzione renale (nefropatie).
4- MISURAZIONE DI ECCESSO DI BASI
-BE (base excess, eccesso di basi): quantità di acido o base da aggiungere in vitro al
sangue intero per riportare il pH a 7,4 mantenendo la Pco2 fissa a 40 mmHg;
- nel sangue: vari sistemi tampone (emoglobina, fosfati, albumina) allora
- SBE (standard base excess, eccesso di basi standard);
- HID (differenza titolabile di idrogenioni);
- CSBE (standard base excess corretto).
CONTROLLO DEL Ph NEL LIC
TAMPONE del Ph:
1- GRUPPI CARICHI DI PROTEINE E AMMINOACIDI
2- FOSFATI PRESENTI IN GRANDE […] NEL CITOSOL
(sistemi tampone chiusi, i più importanti del LIC)
H3PO4
H2PO4- + H+
HPO42- + 2 H+
fosfato monobasico fosfato bibasico
CONTROLLO DEL Ph NEI LEC
Il sistema tampone deve essere aperto, cioè i prodotti finali della/e reazione/i che
svolge la funzione tampone non si accumulano o esauriscono.
RUOLO DI TAMPONE DI Ph:
1- AZIONE TAMPONE DELLE PROTEINE
2- TAMPONE EMOGLOBINA A LIVELLO PLASMATICO
pH basso, < affinità per O2, >affinità per CO2, no accumulo di CO2 nel plasma,
sottrazione di CO2 dalla soluzione circostante e tamponamento indiretto della
produzione di protoni.
3- SISTEMA TAMPONE PRINCIPALE -ANIDRIDE CARBONICA-ACIDO
CARBONICO- BICARBONATO
CO2 + H20
H2CO3
H+ + HCO3L’organismo produce di continuo CO2, ma l’eccesso è eliminato dai polmoni
con attività respiratoria.
I protoni non accompagnati da HCO3- sono escreti dal rene.
Sistema aperto e come tale:
- capacità tampone in condiz. fisiologiche è virtualmente illimitata;
- la concentr. plasmatica delle due forme del tampone è regolata in modo
indipendente, cioè la respirazione regola la Pco2 e il rene mantiene le
corrette [HCO3- ].
TESTO CONSIGLIATO
FISIOLOGIA MEDICA a cura di Fiorenzo Conti – Volume 2, edi-ermes, Seconda edizione
CONTATTI
[email protected]
Laboratorio di Fisiologia
Dipartimento di Medicina Clinica e Sperimentale
Università degli Studi di Foggia
Viale L. Pinto, 71100 - Foggia
Tel. 0881 / 711716
Tutorato: lunedì e giovedì 10.00-11.00