Poste Italiane s.p.a. - Spedizione in Abbonamento Postale - D.L. 353/2003
(conv. in L. 27/02/2004 n° 46) art. 1, comma 1, LO/MI
In caso di mancato recapito inviare al CMP/CPO di Roserio
per la restituzione al mittente previo pagamento dei resi
ISSN Stampa 1590-170X
ISSN Online 1720-8351
Suppl. al No. 5, Vol. 14 - Ottobre 2013
Focus su
Carenza iodica
Guest Editors
Massimo Tonacchera
Paolo Vitti
Editrice Kurtis s.r.l.
Via Arluno, 4
20010 Casorezzo (MI)
Visita il nostro sito Internet: www.kurtis.it
Con il grant educazionale di
IBSA Farmaceutici Italia
Rivista fondata da Aldo Pinchera
Organo Ufficiale della Società Italiana di Endocrinologia (SIE)
Società Affiliate
Società Italiana di Andrologia e Medicina della Sessualità (SIAMS)
Società Italiana di Endocrinologia e Diabetologia Pediatrica (SIEDP)
Società Italiana dell’Obesità (SIO)
Associazione Italiana della Tiroide (AIT)
Associazione Medici Endocrinologi (AME)
DIREZIONE SCIENTIFICA
Ezio Ghigo
Francesco Trimarchi
Paolo Vitti
DIRETTORE EDITORIALE
CAPIREDATTORI
Michele Marinò, Emanuela Arvat
COORDINATORI
Marco Centanni, Renato Cozzi, Paola Fierabracci, Fabio Lanfranco
SETTORI
AUTOIMMUNITÀ
ENDOCRINA
ENDOCRINOLOGIA
GINECOLOGICA
MALATTIE DELLA
TIROIDE
Corrado Betterle
Paolo Moghetti
Stefano Mariotti
CHIRURGIA
ENDOCRINA
ENDOCRINOLOGIA
ADOLESCENZIALE
MALATTIE ENDOCRINE
E METABOLICHE DELL’OSSO
Nicola Palestini
Antonio Agostino Sinisi
Salvatore Minisola
DIABETE
ENDOCRINOLOGIA
MOLECOLARE
ONCOLOGIA
ENDOCRINOLOGICA
Domenico Salvatore
Rossella Elisei
DIAGNOSTICA DI
LABORATORIO
ENDOCRINOLOGIA
PEDIATRICA
MEDICINA
NUCLEARE
Marco Ferdeghini
Marco Cappa
Marco Salvatore
ENDOCRINOLOGIA
ANDROLOGICA
IPERTENSIONE, SURRENE
E DISORDINI DEL RICAMBIO
IDRO-SALINO
OBESITÀ
E DISLIPIDEMIA
Uberto Pagotto
Csilla Gabriella Krausz
Ferruccio Santini
Marco Boscaro
NEUROENDOCRINOLOGIA
Anna Spada
RUBRICHE
UNO SGUARDO
ALLA STORIA
IMMAGINI IN
ENDOCRINOLOGIA
NOVITÀ IN
ENDOCRINOLOGIA
Roberto Toni
Andrea Lania
Francesco Latrofa
ASSISTENTI DI REDAZIONE
Andrea Benso, Caterina Di Cosmo, Valentina Gasco, Lucia Montanelli
SEGRETARIA DI REDAZIONE
Raffaella Menconi
ORGANO UFFICIALE
SOCIETÀ ITALIANA DI ENDOCRINOLOGIA (SIE)
Presidente: F. Trimarchi
Segretario generale: E.A. Jannini
Presidente Eletto: A. Lenzi
Past President: E. Ghigo
Tesoriere: M. Gasperi
Consiglio direttivo:
G. Aimaretti, M. Arosio, A. Avogaro, M.G. Castagna, C.G. Krausz,
A. Colao, R.C. Melcangi, G. Napolitano, R. Pasquali, F. Pecori Giraldi, M. Tonacchera
SOCIETÀ E ASSOCIAZIONI AFFILIATE
SOCIETÀ ITALIANA DI ANDROLOGIA E MEDICINA DELLA SESSUALITÀ (SIAMS)
Presidente: M. Maggi
Segretario: L. Di Luigi
Presidente Eletto: E.A. Jannini
Past President: C. Foresta
Tesoriere: A.E. Calogero
Consiglio direttivo:
A. Garolla, A.M. Isidori, P. Limonta, D. Pasquali, R. Pivonello, M. Simoni, L. Vignozzi
SOCIETÀ ITALIANA DI ENDOCRINOLOGIA E DIABETOLOGIA PEDIATRICA (SIEDP)
Presidente: M. Cappa
Revisori Conti: S. Bernasconi,
G Russo, D. Iafusco
Vice Presidente: A. Franzese
Presidente Eletto: M. Maghnie
Tesoriere: S. Zucchini
Consiglio direttivo:
G. Cesaretti, A. Franzese, G. Grugni, L. Mazzanti, G. Scirè
SOCIETÀ ITALIANA DELL’OBESITÀ (SIO)
Presidente: E. Nisoli
Segretario: F. Vignati
Presidente Eletto: P. Sbraccia
Past President: R. Vettor
Tesoriere: R. Dalle Grave
Consiglio direttivo:
R. Barazzoni, S. Buscemi, L. Busetto, R. Dalle Grave, C. Maffeis, U. Pagotto, V. Ricca, S. Savastano
ASSOCIAZIONE ITALIANA DELLA TIROIDE (AIT)
Presidente: G. Fenzi
Presidente Eletto: P. Beck-Peccoz
Segretario Tesoriere: P. Vitti
Coordinatore Commissione Scientifica: L. Chiovato
Segreteria Scientifica: C. Di Cosmo, R. Rocchi, M. Tonacchera
Consiglio direttivo:
L. Bartalena, B. Biondi, M.G. Castagna, M. Centanni, F. Frasca, A. Frasoldati, L. Fugazzola,
R. Guglielmi, S. Mariotti, E. Molinaro, F. Orlandi
ASSOCIAZIONE MEDICI ENDOCRINOLOGI (AME)
Presidente: R. Castello
Segretario: M. Schiesaro
Presidente Eletto: R. Guglielmi
Past President: G. Borretta
Tesoriere: G. Reimondo
Consiglio direttivo:
M. Attard, N. Cremonini, O. Disoteo, E. Guastamacchia, S. Settembrini
vol. 14, Suppl. al n° 5, Ottobre 2013
Focus su
Carenza iodica
Guest Editors:
Massimo Tonacchera, Paolo Vitti
Introduzione
Massimo Tonacchera, Paolo Vitti
Lo iodio nella fisiopatologia tiroidea
Caterina Di Cosmo, Paolo Beck-Peccoz
Epidemiologia della carenza iodica
r
t
i
d
K
e
ic
s
i
t
ur
Lucia Antonangeli, Fabrizio Aghini-Lombardi, Stefano Mariotti
E
,
3
1
2
7
Monitoraggio della iodoprofilassi in Italia
1
0
©2
Antonella Olivieri, Daniela Rotondi, Paolo Stacchini, Augusto Pastorelli, Roberto Raschetti,
Roberto Da Cas, Carlo Corbetta, Vera Stoppioni, Giuseppe Parlato,
Osservatori Regionali per la Prevenzione del Gozzo
14
Carenza iodica e gravidanza
Lucia Montanelli, Luca Chiovato
18
Carenza iodica e sviluppo intellettivo
Francesco Vermiglio, Mariacarla Moleti, Francesco Trimarchi
22
Carenza iodica e gozzo nodulare
Massimo Tonacchera, Fabio Orlandi, Paolo Vitti
27
Profilassi iodica: attualità e prospettive
Massimo Tonacchera, Gianfranco Fenzi, Paolo Vitti
34
Conclusioni
Massimo Tonacchera, Paolo Vitti
40
Vol. 14, Suppl. al n° 5, ottobre 2013
INTRODUZIONE
La causa più frequente della patologia tiroidea nella popolazione mondiale è la carenza di iodio, che può provocare
gozzo, noduli, ipotiroidismo o ipertiroidismo nei soggetti più anziani. Particolare importanza ha la carenza iodica
della madre durante la gravidanza per le ripercussioni sulla funzione tiroidea del feto e del neonato, che portano a
difetti dello sviluppo cerebrale e delle funzioni cognitive. Si tratta di un problema di salute pubblica, diffuso a livello
mondiale, che oggi colpisce in modo particolare i Paesi in via di sviluppo, ma è anche presente in Europa. In Italia è
stato calcolato che oltre 6 milioni di persone sono affette da gozzo o patologia nodulare tiroidea. Negli ultimi 20 anni
sono stati fatti sostanziali progressi in questo settore con l’introduzione di efficaci programmi di iodoprofilassi basati sul
consumo di sale arricchito con iodio.
I programmi di iodoprofilassi, promossi e sostenuti dall’OMS, dall’UNICEF e da Micronutrient Initiative con la
consulenza tecnico-scientifica dell’ICCIDD, sono stati posti in essere in base alla constatazione che oltre due miliardi di
individui della popolazione mondiale erano soggetti a rischio di carenza iodica, oltre 700 milioni i soggetti colpiti da
gozzo clinicamente manifesto, oltre 30 milioni i soggetti con vario grado di menomazione mentale cognitiva da inadeguato apporto iodico durante la vita fetale e neonatale e oltre 6 milioni con deficit conclamato dello sviluppo mentale da
gravissima carenza durante la vita intrauterina (cretinismo endemico).
Questi ultimi rilievi hanno indotto il vertice mondiale della salute ad includere la carenza iodica tra le prime dieci
emergenze della salute pubblica da eliminare entro pochi anni. Nel 2008 la Commissione preposta alla redazione del
Copenhagen Consensus, costituito da 8 eminenti economisti tra i quali 5 premi Nobel, ha valutato il valore economico
in termini di costo/beneficio dei programmi di lotta contro la Fame e la Malnutrizione nel mondo e ha indicato tra le
massime priorità la correzione della carenza iodica attraverso l’arricchimento con iodio del sale. Il successo dei programmi di iodoprofilassi ha ridotto da 110 a 47 i Paesi nel mondo con gradi significativi di carenza iodica nel 2007.
In questo supplemento verrà descritta l’epidemiologia della carenza iodica in Italia, il monitoraggio della iodoprofilassi, il ruolo del corretto apporto di iodio in gravidanza e sullo sviluppo intellettivo dei neonati, e gli effetti della
carenza iodica nello sviluppo del gozzo nodulare. Infine verranno affrontati sia il tema della iodoprofilassi attualmente
prevista nel nostro Paese sia la proposta di nuovi metodi di arricchimento con iodio degli alimenti.
1
0
©2
E
,
3
r
t
i
d
K
e
ic
s
i
t
ur
Massimo Tonacchera, Paolo Vitti
1
Vol. 14, Suppl. al n° 5, ottobre 2013
INTRODUZIONE
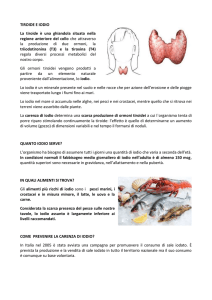
Lo iodio è un micronutriente essenziale per la sintesi degli ormoni tiroidei, che sono gli unici ormoni nei
vertebrati a contenere atomi di iodio
nella loro molecola. Gli ormoni tiroidei, e di conseguenza lo iodio, sono
fondamentali durante l’intero arco
della vita umana, svolgendo nel feto e
nel bambino un ruolo centrale nello
sviluppo del sistema nervoso centrale
e scheletrico e regolando nell’adulto
il metabolismo basale, lipidico, glucidico ed osseo e l’apparato cardiovascolare. La carenza nutrizionale di
iodio rappresenta la causa più frequente della patologia tiroidea nella
popolazione mondiale. A seconda
della sua gravità essa può determinare ipotiroidismo, gozzo, deficit di
accrescimento, ritardo nello sviluppo
psicomotorio e ritardo mentale irreversibile (cretinismo) (1, 2).
Lo iodio (sotto forma di ioduro) è
ampiamente ma non uniformemente
distribuito nel nostro pianeta. Le
acque degli oceani ne sono ricche,
mentre a seguito degli eventi climatici verificatisi nel tempo, la quantità di
iodio presente nel suolo è scarsa in
vaste aree. Lo ioduro nell’acqua del
mare è ossidato a iodio elementare,
che volatilizza nell’atmosfera e ritorna
nel terreno tramite la pioggia, completando in questo modo il ciclo
(Figura 1). In molte regioni, tuttavia,
il ciclo dello iodio è lento e incompleto e lascia il suolo e l’acqua potabile
poveri di iodio. Colture provenienti
da questi terreni avranno pertanto
basso contenuto di iodio e uomini ed
animali che le assumono svilupperanno carenza del micronutriente. Terreni
iodocarenti sono comuni nelle aree
montane e nelle aree colpite frequentemente da inondazioni. La carenza di
iodio può tuttavia colpire anche le
regioni pianeggianti e costiere.
1
0
©2
Lo iodio nella
fisiopatologia tiroidea
Caterina Di Cosmo1, Paolo Beck-Peccoz2
Dipartimento di Medicina Clinica e Sperimentale, Sezione di Endocrinologia,
Università degli Studi di Pisa; 2Dipartimento di Scienze Cliniche e di Comunità,
Unità di Endocrinologia e Diabetologia, Università degli Studi di Milano
1
gli animali. Tuttavia, le concentrazioni di iodio presenti nella maggior
parte dei cibi e bevande sono basse.
In generale, i cibi di più largo consumo forniscono da 3 a 80 µg di iodio
a porzione (3). Solo alcune popolazioni, come per esempio quelle delle
coste giapponesi che consumano
grandi quantità di alghe, hanno un
elevato introito di iodio con l’ali-
r
t
i
d
Figura 1
Ciclo dello iodio.
E
,
3
mentazione. Le alghe, infatti, come
gli animali marini, sono in grado di
concentrare lo iodio dall’acqua.
Il contenuto di iodio è estremamente variabile nei diversi alimenti.
Secondo dati della Food and Agricolture Organization (FAO) e della
World Health Organization (WHO)
del 2004 (Tabella 1), le concentrazioni più elevate si riscontrano nel
K
e
ic
s
i
t
ur
FONTI DELLO IODIO
Gli alimenti costituiscono la principale fonte di iodio per gli uomini e
Corrispondenza: Paolo Beck-Peccoz, Dipartimento di Scienze Cliniche e di Comunità, Unità di Endocriologia e Diabetologia,
Padiglione Granelli, Via Francesco Sforza 35, 20122 Milano. E-mail: [email protected]
2
Lo iodio nella fisiopatologia tiroidea
Tabella 1
Contenuto medio di iodio negli alimenti di
comune consumo secondo dati FAO/WHO
del 2004.
Alimenti
Pesce di mare e crostacei
Pesce d'acqua dolce
Carne
Latte
Uova
Cereali
Legumi
Vegetali
Frutta
Contenuto
medio di iodio
(µg/100 g p.f.)
800
30
50
50
90
50
30
30
20
p.f.: peso fresco.
pesce di mare e nei crostacei. Carne
e latte presentano valori medi intorno a 50 µg/100 g di peso fresco
(p.f.), le uova ne contengono circa
90 ed il pesce d’acqua dolce 30
µg/100 g di p.f. Per quanto riguarda
gli alimenti di orgine vegetale, i
valori più elevati si trovano nei
cereali, seguiti dai legumi e dalle
altre verdure e infine dalla frutta.
All’interno di ciascuna categoria le
variazioni possono essere comunque
molto ampie e va sottolineato come
tali dati siano soltanto indicativi,
dal momento che la localizzazione
geografica influenza notevolmente il
contenuto di iodio. Nella società
moderna l’apporto di iodio è complesso e dipende non tanto dal contenuto di iodio del suolo e delle
acque di irrigazione, ma dalla qualità e varietà dell’alimentazione.
Negli alimenti industriali e quindi
presenti nelle grandi catene di
distribuzione è presente, infatti, una
quantità di iodio maggiore rispetto
agli alimenti naturali. Va aggiunto
inoltre che la quantità di iodio presente nei mangimi per gli animali
di allevamento influisce sulla quantità di iodio presente nei derivati. In
molti paesi, infine, l’uso del sale
iodato fornisce alla dieta un addizionale apporto di iodio.
1
0
©2
3
Accanto all’alimentazione, fonti
minori di iodio sono rappresentate
dai coloranti presenti nei cosmetici,
dai farmaci ad uso topico e sistemico
(per esempio, tintura di iodio, diiododrossichinolina crema, iodio-povidone, amiodarone) e dai mezzi di
contrasto radiografici (per esempio,
sodio amidotrizoato, ipodato,
LipiodolTM).
ASSORBIMENTO E
METABOLISMO DELLO IODIO
Lo iodio è ingerito sotto diverse
forme chimiche. Lo ioduro è assorbito direttamente nell’intestino mentre lo iodato, largamente usato nella
iodazione del sale, è ridotto e assorbito come ioduro. Lo iodio è quasi
completamente assorbito nell’intestino tenue (circa il 90% della quota
ingerita) e solo una piccola parte è
escreta nelle feci (4).
r
t
i
d
Lo iodio assorbito dall’intestino,
insieme a quello derivante dal metabolismo periferico degli ormoni
tiroidei, costituisce il pool plasmatico dello iodio. Questo viene concentrato nella tiroide che lo utilizza per
la sintesi ormonale ed in parte viene
escreto dal rene. Un adulto sano utilizza per la sintesi ormonale 80 µg
di iodio, che provengono direttamente dalla dieta per circa 55 µg e
dal metabolismo periferico degli
ormoni tiroidei per circa 25 µg
(Figura 2). Con un apporto di iodio
normale (150 µg), lo iodio plasmatico è escreto con le urine per il 90%
(135 µg), di cui 95 µg provengono
dallo iodio assorbito dall’apparato
digerente e 40 µg dal metabolismo
periferico degli ormoni tiroidei.
Dunque, in condizioni di equilibrio,
lo iodio che si ritrova nelle urine
corrisponde a quello assorbito dall’apparato digerente.
K
e
ic
s
i
t
ur
Figura 2
Rappresentazione schematica della cinetica dello iodio in un adulto sano in condizioni di adeguato
apporto di iodio. Modificata da: Glinoer D 2004 The regulation of thyroid function during normal pregnancy: importance of the iodine nutrition status. Best Pract Res Clin Endocrinol Metab 18:133-152. .
E
,
3
95 g
Apporto di iodio
(150 g)
55 g
Tiroide
(captazione del 35%)
Rene (135 g)
80 g
Ormone tiroideo
Metabolismo periferico
ormone tiroideo
40 g
25 g
80 g
Feci
(15 g)
CATERINA DI COSMO, ET AL.
Figura 3
A) Rappresentazione schematica del metabolismo intratiroideo dello iodio. Nel tireocita, lo iodio captato dal NIS sotto foma di ioduro (I-) viene organificato e
legato ai residui tiroisilici della tireglobulina (Tg) dalla tireoperossidasi (TPO) per formare iodotironine. Modificata da (15). B) Struttura della T4 e della T3.
A
B
Colloide
T3
T4
Membrana
apicale
I
HO
O
I
T4
T4
I–
T3
I
HO
O
I–
TSHr
Lisosoma
I–
CH2CHNH2COOH
I
I–
I–
I
Plasma
E
,
3
La tiroide concentra lo iodio sotto
forma di ioduro (I-) attraverso il symporter sodio/ioduro (NIS), localizzato
nella membrana basolaterale dei
tireociti. Il NIS è una glicoproteina
di membrana in grado di concentrare mediante trasporto attivo lo iodio
nella tiroide e in altri tessuti (5). La
clearance renale dello iodio è piuttosto costante, mentre quella tiroidea
varia con l’apporto iodico, arrivando
a più dell’80% della quota assorbita
in condizioni di iodocarenza cronica
(6). Piccole quantità di iodio sono
captate anche dalla mucosa gastrica,
dalle ghiandole salivari, dal plesso
coroideo e, durante l’allatamento,
dalle ghiandole mammarie (5).
L’identificazione del NIS e studi
successivi condotti in animali hanno
chiarito i meccanismi molecolari che
mediano l’assorbimento intestinale
dello ioduro. Il NIS è abbondantemente espresso nell’orletto a spazzola
degli enterociti in tutti i segmenti
dell’intestino tenue, dal duodeno
all’ileo, con livelli di espressione che
diminuiscono dall’apice del villo alla
r
t
i
d
K
e
ic
base (7). La localizzazione apicale è in
accordo con un ruolo del NIS nel trasporto dello ioduro dal lume intestinale all’enterocita, da dove può successivamente raggiungere il circolo
attraverso altri trasportatori o canali.
Lo iodio è assorbito in alcuni tratti
del canale alimentare e secreto in
altri. Lo iodio inorganico è, infatti,
presente nel succo gastrico e nella
s
i
t
ur
I
T3
Membrana
basolaterale
TSH
1
0
©2
I
CH2CHNH2COOH
saliva (4). Studi nei ratti hanno
dimostrato come il NIS, localizzato
nella membrana basolaterale delle
cellule epiteliali, medi, almeno in
parte, il trasporto dello ioduro dal
circolo alle cellule epiteliali gastriche
(8). L’efflusso dello ione dalla cellula
epiteliale al lume gastrico può essere
passivo o mediato da altri trasportatori. Nonostante queste acquisizioni,
Tabella 2
Meccanismi di autoregolazione tiroidea in condizioni di eccesso o carenza di iodio. Il contributo di
ciascun fattore va da 0 (nessuno) a +++ (importante). Modificata da: Bürgi H et al 2010 Iodine
excess. Best Pract Res Clin Endocrinol Metab 24:107-115.
Meccanismi
Ruolo nell'eccesso
di iodio
Ruolo nella carenza
di iodio
TSH
NIS
Effetto Wolff-Chaikoff
Blocco della secrezione ormonale dai depositi
Ridistribuzione dello iodio organico nella colloide
Secrezione dello iodio non ormonale
0
+++
+++ (solo in acuto)
++
+
++
+++
+++
0
0
++
0
TSH: ormone tireotropo; NIS: symporter sodio/ioduro.
4
Lo iodio nella fisiopatologia tiroidea
restano ancora da chiarire i meccanismi di regolazione e il significato
funzionale del trasporto dello ioduro
nel lume gastrico. Alcuni studi suggeriscono che la secrezione gastrica
dello ioduro sia parte di un sistema
di ricircolo entero-tiroideo dello
ioduro che consente il risparmio
dello iodio (9), altri sostengono che
abbia un’azione antiossidante (10) ed
antimicrobica (11).
Il corpo di un adulto contiene 1520 mg di iodio, di cui il 70-80%
nella tiroide (12). Lo I- trasportato
dal NIS a livello della membrana
basolaterale diffonde dal tireocita al
lume follicolare mediante la pendrina, che media a livello della membrana apicale lo scambio secondo
gradiente elettrico di uno ione I- con
uno Cl- (13) (Figura 3 A). Una volta
raggiunto il lume follicolare, lo Iviene ossidato a iodio molecolare
dalla tireoperossidasi (TPO), che
utilizza come cofattore il perossido
d’idrogeno (H2O2), generato a sua
volta dalla dual oxidase (DUOX) 2,
una flavoproteina NADPH-dipedente (14). Lo iodio organico viene
legato tramite un legame covalente
ai residui tirosilici della tireoglobulina (Tg), una grossa glicoproteina
localizzata nel lume del follicolo,
dalla TPO con formazione di molecole di monoiodotirosina (MIT) e di
diiodotirosina (DIT). Lo stesso enzima catalizza la coniugazione di due
molecole di DIT con produzione di
tetraiodotironina o tiroxina (T4) e in
piccola parte di una di DIT e una di
MIT con produzione di triiodotironina (T3) (Figura 3 B). Dopo essere
stata prelevata dal lume follicolare
mediante endocitosi, la Tg iodinata
è idrolizzata nei lisosomi e la T4 e
T3 liberate nel citosol raggiungono
attraverso trasportatori di membrana il circolo (15). Le molecole di
MIT e DIT, anch’esse liberate dalla
proteolisi della Tg, sono deiodinate
dalle dealogenasi citosoliche (16),
con recupero dello iodio. In generale, un adulto sano utilizza circa 80100 µg di iodio al giorno per produrre gli ormoni tiroidei. Più del
90% dello iodio ingerito è alla fine
escreto con le urine, per cui in con-
1
0
©2
5
Tabella 3
Introito giornaliero minimo di iodio raccomandato in base all’età e alle condizioni fisiologiche. Modificata da (24).
Età e condizioni
fisiologiche
Introito minimo di
iodio raccomandato
(µg/die)
Bambini 0-5 anni
90
Bambini 6-12 anni
120
Adulti >12 anni
150
Gravidanza
250
Allattamento
250
dizioni di equilibrio, lo iodio assorbito nell’intestino equivale a quello
escreto con le urine (Figura 2).
K
e
ic
MECCANISMI DI ADATTAMENTO
DELLA TIROIDE ALLE VARIAZIONI
DELL’APPORTO IODICO
r
t
i
d
La tiroide è in grado di mantenere
un’adeguata sintesi e secrezione
ormonale a fronte di ampie variazioni nell’apporto iodico. I meccanismi
operanti in caso di carenza o eccesso
di iodio sono di seguito elencati e
riassunti nella Tabella 2.
E
,
3
un aumento del volume della tiroide
(gozzo), all’inizio diffuso, successivamente nodulare; il TSH, infatti,
oltre alla produzione di ormoni
tiroidei, stimola anche la proliferazione delle cellule follicolari.
Il caratteristico pattern ormonale
presente nei bambini provenienti da
zone di moderata-grave carenza iodica
è costituito da un aumento dei livelli
sierici del TSH associati a bassi livelli
di T4 e concentrazioni di T3 normali o
ai limiti alti; queste alterazioni ormonali sono incostanti negli adulti.
L’insufficienza tiroidea e il cretinismo
si sviluppano solamente nelle condizioni di grave carenza cronica di iodio.
Gli effetti della carenza iodica sullo
sviluppo della ipofunzione tiroidea e
sul gozzo variano tra le diverse popolazioni ed anche tra gli individui residenti nella stessa area endemica. Tale
variabilità è imputabile a fattori dietetici, ambientali ed anche genetici, in
gran parte non ancora identificati.
Diverse sostanze, presenti negli alimenti e nell’ambiente, possono interferire con il metabolismo tiroideo,
aggravare gli effetti della carenza
iodica ed interferire sui meccanismi
di compenso. Per esempio le crucifere
(cavoli, cavolfiore, broccoli) e la cassava contengono sostanze i cui metaboliti compentono con lo iodio per la
captazione tiroidea (17). Il fumo di
sigaretta aumenta i livelli di tiocianati che sono inibitori competitivi del
NIS sia a livello tiroideo che della
ghiandola mammaria durante l’allattamento (18). Tra gli interferenti
ambientali, il perclorato, prodotto
dagli scarichi industriali, agisce come
inibitore competitivo del NIS (19).
CARENZA DI IODIO E FATTORI
INTERFERENTI
Quando l’introito di iodio è insufficiente (inferiore a 100 µg/die), la
secrezione dell’ormone tireotropo
(TSH) aumenta. Il TSH stimola la
captazione dello iodio da parte delle
cellule follicolari tiroidee tramite
una maggiore espressione del NIS,
la degradazione della Tg e la sintesi
preferenziale dell’ormone biologicamente più attivo, la T3.
Fino a quando l’introito giornaliero di iodio supera la soglia di circa
50 µg/die, nonostante la riduzione
dei livelli circolanti dello iodio inorganico, la captazione tiroidea dello
iodio è ancora adeguata ed il contenuto intratiroideo dello iodio nei
limiti della norma. Al di sotto di
questa soglia la captazione e la riserva intratiroidea dello iodio si riducono e molti individui sviluppano
s
i
t
ur
ECCESSO DI IODIO
Diversi sono i meccanismi di autoregolazione messi in atto dalla tiroide in caso di eccesso di iodio, tutti
TSH-indipendenti (Tabella 2).
Effetto Wolff-Chaikoff
Wolff e Chaikoff dimostrarono
come nei ratti una singola iniezione
di 500 µg di ioduro (dose eccedente
di 100 volte il fabbisogno giornaliero)
bloccasse l’incorporazione di iodio
CATERINA DI COSMO, ET AL.
all’interno dei residui tirosilici della
Tg, cioè l’organificazione (20).
Questo blocco autoregolatorio TSHindipendente si basa sulle elevate concentrazioni intracellulari di ioduro. I
meccanismi molecolari alla base dell’effetto Wolff-Chaikoff sono ancora
controversi. Uno dei meccanismi proposti è rappresentato dall’eccessiva
formazione dell’anione triioduro che
si forma per l’aumentata disponibilità
dello ioduro dalla reazione I-+I2⇔I3.
In presenza di elevate concetrazioni di
ioduro, questa reazione è spostata a
destra con sequestro di I2, che è un
intermedio nel processo di organificazione dello iodio (21).
L’effetto inibitorio dell’eccesso di
iodio è transitorio e dura 26-50 ore;
successivamente, infatti, si instaura
il fenomeno dell’escape, che garantisce il ripristino dell’organificazione
e quindi la sintesi ormonale (22).
Blocco della secrezione degli ormoni
contenuti nei depositi di colloide
La tiroide accumula grandi quantità di ormoni nel lume follicolare
sotto forma di residui tirosilici della
Tg. In caso di blocco della sintesi
ormonale, da assunzione per esempio di antitiroidei di sintesi, la
secrezione di ormoni tiroidei si riduce solo dopo che significative quantità dei depositi intratiroidei sono
state utilizzate; questa evenienza
richiede nell’uomo diverse settimane. L’eccesso di iodio, al contrario,
abbassa i livelli della T4 sierica quasi
istantaneamente, suggerendo che lo
iodio non blocca solo la sintesi, ma
anche la secrezione dell’ormone
preformato accumulato.
©2
01
Tg e il loro iodio può essere secreto
come iodio non ormonale, liberando
pertanto la tiroide dall’eccesso di
iodio.
FABBISOGNO GIORNALIERO
DI IODIO
Studi basati sulla misura della
captazione e del turnover giornalieri
dello iodio hanno stabilito la quantità di iodio necessaria in base alle
differenti età e condizioni fisiologiche (23, 24). Queste quantità sono
elencate nella Tabella 3.
L’introito di iodio raccomandato
nell’adulto non sembra cambiare
con l’età tranne che in alcune condizioni fisiologiche quali gravidanza e
allattamento. Durante la gravidanza
e l’allattamento la dose di iodio raccomandata aumenta a causa dell’aumentato fabbisogno di ormoni tiroidei della madre, della richiesta fetale
di iodio, dell’aumento della clearence
renale dello iodio e del passaggio
dello iodio nel latte.
E
,
3
Ridistribuzione dello iodio organico
In caso di eccesso di iodio prevale
la formazione di DIT su quella di
MIT, che favorisce a sua volta la sintesi della T4, molecola meno attiva
della T3.
Secrezione dello iodio non ormonale
MIT e DIT sono rilasciate come
prodotti collaterali della lisi della
r
t
i
d
9. Josefsson M, Grunditz T, Ohlsson T, Ekblad
E 2002 Sodium/iodide-symporter: distribution
in different mammals and role in entero-thyroid circulation of iodide. Acta Physiol Scand
175:129-137.
10. Venturi S, Venturi M 1999 Iodide, thyroid
and stomach carcinogenesis: evolutionary story
of a primitive antioxidant?. Eur J Endocrinol
140:371-372.
11. Fite A, Dykhuizen R, Litterick A, Golden
M, Leifert C 2004 Effects of ascorbic acid, glutathione, thiocyanate, and iodide on antimicrobial activity of acidified nitrite. Antimicrob
Agents Chemother 48:655-658.
12. Fisher DA, Oddie TH 1969 Thyroid iodine
content and turnover in euthyroid subjects:
validity of estimation of thyroid iodine accumulation from short-term clearance studies. J
Clin Endocrinol Metab 29:721-727.
13. Everett LA, Glaser B, Beck JC et al 1997
Pendred syndrome is caused by mutations in a
putative sulphate transport gene (PDS). Nature
Genet 17:411-422.
14. Dunn JT, Dunn AD 2001 Update on
intrathyroidal iodine metabolism. Thyroid
11:407-414
15. Di Cosmo C, Liao XH, Dumitrescu AM,
Philp NJ, Weiss RE, Refetoff S 2010 Mice
deficient in MCT8 reveal a mechanism regulating thyroid hormone secretion. J Clin Invest
120:3377-3388.
16. Gnidehou S, Caillou B, Talbot M et al 2004
Iodotyrosine dehalogenase 1 (DEHAL1) is a
transmembrane protein involved in the recycling of iodide close to the thyroglobulin iodination site. Faseb J 18:1574-1576.
17. Gaitan E 1990 Goitrogens in food and water.
Annu Rev Nutr 10:21-39.
18. Laurberg P, Nohr SB, Pedersen KM,
Fuglsang E 2004 Iodine nutrition in breast-fed
infants is impaired by maternal smoking. J Clin
Endocrinol Metab 89:181-187.
19. Tonacchera M, Pinchera A, Dimida A et al
2004 Relative potencies and additivity of perchlorate, thiocyanate, nitrate, and iodide on the
inhibition of radioactive iodide uptake by the
human sodium iodide symporter. Thyroid
14:1012-1019.
20. Wolff J, Chaikoff IL 1948 Plasma inorganic
iodide as a homeostatic regulator of thyroid
function. J Biol Chem 174:555-564.
21. Wolff J 1969 Iodide goiter and the pharmacologic effects of excess iodide. Am J Med
47:101-124.
22. Eng PH, Cardona GR, Fang SL et al 1999
Escape from the acute Wolff-Chaikoff effect is
associated with a decrease in thyroid sodium/iodide symporter messenger ribonucleic acid
and protein. Endocrinology 140:3404-3410.
23. International Council for Control of Iodine
Deficiency Disorders 2008 UNICEF Report
2008. In: IDD Newsletter.
24. World Health Organisation/International
Council for Control of the Iodine
Deficiency Disorders/United Nations
Children Fund (WHO/UNICEF) 2001
Assessment of Iodine Deficiency Didorders and
monitoring their elimination.
K
e
ic
BIBLIOGRAFIA
1. Delange F 1994 The disorders induced by
iodine deficiency. Thyroid 4:107-128.
2. Zimmermann MB, Jooste PL, Pandav CS
2008 Iodine-deficiency disorders. Lancet
372:1251-1262.
3. Haldimann M AA, Blanc A, Blondeau K
2005 Iodine content of food groups. J Food
Comp Anal 18:461-471.
4. Alexander WD, Harden RM, Harrison MT,
Shimmins J 1967 Some aspects of the absorption and concentration of iodide by the alimentary tract in man. Proc Nutr Soc 26:62-66.
5. De La Vieja A, Dohan O, Levy O, Carrasco
N 2000 Molecular analysis of the sodium/iodide symporter: impact on thyroid and
extrathyroid pathophysiology. Physiol Rev
80:1083-1105.
6. DeGroot LJ 1966 Kinetic analysis of iodine
metabolism. J Clin Endocrinol Metab 26:149173.
7. Nicola JP, Basquin C, Portulano C, ReynaNeyra A, Paroder M, Carrasco N 2009 The
Na+/I- symporter mediates active iodide uptake
in the intestine. Am J Physiol Cell Physiol
296:C654-662.
8. Josefsson M, Evilevitch L, Westrom B,
Grunditz T, Ekblad E 2006 Sodium-iodide
symporter mediates iodide secretion in rat gastric mucosa in vitro. Exp Biol Med (Maywood)
231:277-281.
s
i
t
ur
6
Vol. 14, Suppl. al n° 5, ottobre 2013
EPIDEMIOLOGIA DELLA CARENZA
IODICA IN ITALIA
CENNI STORICI
La presenza del gozzo e del cretinismo era già nota in Italia sin dall’antichità. In opere di storici del primo
secolo d.C. come Plinio il Vecchio e
Giovenale sono state ritrovate citazioni relative al gozzo e ad una sua
possibile relazione con alcune caratteristiche delle acque potabili.
I primi rapporti ufficiali sul gozzo
e sul cretinismo in Italia risalgono al
1848, quando una apposita Commissione nominata dal Re di Sardegna ne
identificò estesi focolai in Piemonte,
Liguria, Alta Savoia e Sardegna
(Figura 1), ed al 1856 quando
l’Istituto Lombardo di Scienze e
Lettere documentò la presenza di
gozzo in tutta la Lombardia. Nella
seconda metà dell’800, Cesare
Lombroso ipotizzava una patogenesi
comune tra gozzo e cretinismo.
Solo in epoche più recenti si è
Epidemiologia
della carenza iodica
Lucia Antonangeli1, Fabrizio Aghini-Lombardi1, Stefano Mariotti2
1
U.O di Endocrinologia 1, Università degli Studi di Pisa
Dipartimento di Scienze Mediche, Università degli Studi di Cagliari
2
cominciato a capire la relazione tra
carenza iodica e gozzo endemico.
Tuttavia solo negli anni ’50 sono state
condotte le prime indagini epidemiologiche utilizzando criteri moderni in
tutte le regioni italiane. Contrariamente a quanto ritenuto fino ad allora, la presenza della carenza iodica e
del gozzo sono state documentate non
solo in circoscritte ed isolate località
di montagna, ma anche in molte aree
pianeggianti, prevalentemente rurali,
dell’intero territorio nazionale (1).
E
,
3
r
t
i
d
K
e
ic
Figura 1
Relazione della commissione nominata nel 1848 dal Re di Sardegna per studiare il gozzo ed il cretinismo.
1
0
©2
Una prima rassegna delle indagini
epidemiologiche condotte in Italia
tra il 1978 e il 1991, limitata agli
studi conformi alle raccomandazioni
della World Health Organization
(WHO), ha permesso di costruire
una prima “mappa” della carenza
iodica e della endemia gozzigena in
Italia (Tabella 1). Le indagini considerate hanno riguardato la popolazione in età scolare residente in aree
extraurbane, perlopiù collinari e
montane di numerose località distribuite su tutto il territorio nazionale
(2). La popolazione esaminata comprendeva oltre 70.000 bambini,
5.000 dei quali residenti in aree
urbane di controllo. Nella maggior
parte delle osservazioni l’escrezione
urinaria media di iodio (EUI) era
compresa tra 50 e 75 µg/g cr. ed in
alcune aree addirittura inferiore a 50
µg/g cr. e la carenza iodica non era
limitata alle sole regioni settentrionali ma era presente anche nelle
regioni centro-meridionali e anche in
pianura ed in alcune località costiere.
Nelle aree urbane venivano riscontrati valori più elevati di ioduria,
compresi tra 85 e 175 µg/g cr. La
prevalenza di gozzo, determinata
mediante palpazione del collo, nella
stessa popolazione giovanile era compresa tra il 14 e il 73% ed era inversamente correlata alla EUI. In generale la prevalenza di gozzo risultava
più elevata nelle regioni centromeridionali che nelle regioni
dell’Italia centro-settentrionale.
Nelle aree di controllo, la prevalenza
di gozzo era inferiore al 10% (2).
s
i
t
ur
Corrispondenza: Lucia Antonangeli, U.O di Endocrinologia 1, Università degli Studi di Pisa, Via Paradisa 2, 56124 Pisa.
E-mail: [email protected]
7
LUCIA ANTONANGELI, ET AL.
Tabella 1
Prevalenza di gozzo ed escrezione urinaria di iodio in alcune regioni italiane, in base ai risultati delle
indagini epidemiologiche condotte nel periodo 1978-1991.
Regione
Aree endemiche
% gozzo (popolazione giovanile)
Ioduria (media)
24
37-59
15
21-69
22-59
17-41
21-73
47-60
14
55
48
22-57
41-67
19-40
10*
85-122*
125*
45-110*
35-97*
54-84*
35-60*
64*
46*
38*
58-80*
19-76**
66-105*
Trentino Alto Adige
Friuli
Veneto
Emilia-Romagna
Toscana
Marche
Campania
Abruzzo
Molise
Basilicata
Puglia
Calabria
Sicilia
Sardegna
Regione
Aree di controllo
% gozzo (popolazione giovanile)
Toscana
Marche
Campania
Calabria
Sicilia
Sardegna
6
8
<10
<10-15
2,2-6,6
10
1
0
©2
E
,
3
K
e
ic
Ioduria (media)
r
t
i
d
88-175*
165*
85*
90-110*
88-114**
105*
Soggetti esaminati in zone endemiche: 60.066. Soggetti esaminati in zone di controllo: 5.046. *µg/g di creatinina; **µg/l.
SITUAZIONE ATTUALE
Le indagini epidemiologiche condotte nel periodo 1992-2004 hanno
confermato la tendenza all’incremento della EUI rispetto alle indagini condotte in precedenza. Nel
2004 la ioduria risultava, infatti,
80-90 µg/l. In linea generale, valori
più bassi sono stati documentati
nelle regioni centro-meridionali ed
insulari (EUI 72 µg/l) rispetto alle
regioni settentrionali (EUI 90 µg/l).
La prevalenza di gozzo, determinata
mediante ecografia tiroidea, nella
popolazione scolare risultava del 1020%, con una prevalenza del 6-10%
nelle regioni centro-settentrionali e
del 15-20% nelle regioni centromeridionali (Tabella 2) (3). Nelle
aree esposte ad una più grave carenza iodica, lo studio di campioni di
popolazione adulta ha evidenziato
una elevata prevalenza di gozzo
tinella. In ciascun area sentinella e
di controllo, sono stati studiati il
consumo di sale iodato per uso alimentare, la EUI di campioni di
bambini di età compresa tra 11 e 13
anni e la frequenza di ormone tireotropo (TSH) neonatale superiore a 5
mU/l. Nelle tre regioni studiate la
EUI è risultata aumentata rispetto a
quanto documentato nel recente
passato sia nelle aree sentinella che
nelle aree di controllo. Tuttavia,
nelle aree sentinella del Piemonte e
soprattutto della Calabria, la EUI
mediana è risultata ancora inferiore
a 100 µg/l, ed il numero dei bambini con ioduria inferiore a 50 µg/l
superiore al 20% dei casi. In particolare, nelle aree sentinella della
Calabria la mediana della EUI era
sovrapponibile a quanto osservato
nel recente passato. Nella maggior
parte delle aree urbane di controllo
delle due regioni la EUI risultava
superiore a 100 µg/l o di poco inferiore.
Per quanto riguarda la Toscana, le
aree sentinella scelte (Garfagnana e
Val Tiberina), erano state oggetto di
precedenti indagini epidemiologiche condotte rispettivamente negli
anni ’80 e ’90 (5, 6). In Garfagnana,
è stato documentato un ulteriore
incremento della EUI, che ha
ampiamente superato i valori normali già osservati nel 1991, con un’ulteriore riduzione della prevalenza di
gozzo nella popolazione scolare,
nodulare, come conseguenza della
prolungata esposizione al deficit
nutrizionale di iodio. In generale,
nel periodo considerato, circa 5
milioni di italiani, pari al 12% della
popolazione nazionale era affetto da
gozzo.
Recentemente, dopo l’attuazione
delle Legge sulla prevenzione del
gozzo e delle altre malattie da carenza iodica, l’Osservatorio Nazionale
per il monitoraggio della iodoprofilassi in Italia (OSNAMI), ha iniziato
un’indagine pilota in tre regioni
rappresentative rispettivamente
dell’Italia settentrionale (Piemonte),
centrale (Toscana) e meridionale
(Calabria). In ciascuna regione sono
state scelte alcune aree, definite
“aree sentinella”, nelle quali era
stata documentata in passato la presenza di endemia gozzigena e nel
comune capoluogo di ogni area sen-
s
i
t
ur
Tabella 2
Escrezione urinaria di iodio e prevalenza di
gozzo nella popolazione scolare (6-14 anni)
in Italia nel 2004. I dati sono distinti per regioni centro-settentrionali e regioni centro-meridionali.
Regioni centro-settentrionali*
Escrezione urinaria di iodio
Prevalenza di gozzo
90 µg/l
4-6%
Regioni centro-meridionali*
Escrezione urinaria di iodio
Prevalenza di gozzo
72 µg/l
10-20%
*Popolazione scolare, area extraurbana.
8
Epidemiologia della carenza iodica
Figura 2
Modificazioni della prevalenza di gozzo nella popolazione scolare (6-14 anni) residente in Garfagnana (Toscana) prima (1981) e in seguito all’attuazione di
profilassi volontaria con sale iodato nell’alimentazione quotidiana.
Garfagnana: prevalenza di gozzo
Profilassi volontaria
80
80
80
Prevalenza (%)
1981
60
1991
61,0%
8,1%
60
60
40
40
40
20
20
20
0
1-5
6-8
9-11
12-14
Popolazione scolare
attualmente di poco superiore al 6%
(Figura 2). In Valtiberina, è stata
invece documentata una EUI di poco
inferiore a 100 µg/l, sovrapponibile a
quanto osservato nella precedente
indagine condotta nel 1995. La prevalenza di gozzo nella popolazione
scolare è comunque risultata del 6%,
sovrapponibile a quanto osservato in
Garfagnana, anche in questo caso
invariata rispetto al recente passato.
Va ricordato, tuttavia, che in
Garfagnana la carenza iodica documentata alla fine degli anni ’70 era
molto grave, con valori di ioduria
inferiori a 40 µg/l ed in alcune località inferiori a 20 µg/l. In una recente estesa indagine che ha interessato
la popolazione scolare di 8 regioni
dell’Italia meridionale, la mediana
della EUI determinata in 23.000
campioni estemporanei di urine è
risultata di 75 µg/l indicando la persistenza di una carenza iodica di
grado lieve/moderato, anche se differenze significative sono state osservate tra aree urbane ed aree extraurbane (81 µg/l vs 73 µg/l) e tra aree
con maggiore densità di popolazione
rispetto alle aree meno abitate (87
µg/l vs 66 e 61 µg/l) (7).
Il TSH neonatale è un indicatore
biologico indiretto molto sensibile
ed affidabile per monitorare l’appor-
1
0
©2
9
2006
0
1-5
6-8
9-11
12-14
Popolazione scolare
E
,
3
1-5
EPIDEMIOLOGIA DELLE TIREOPATIE
ED APPORTO IODICO
Una menzione particolare deve
essere riservata alle indagini epidemiologiche volte a valutare la prevalenza e la distribuzione delle tireopatie in rapporto alle modificazioni
dello stato di nutrizione iodica. Di
grande interesse a questo proposito,
lo studio trasversale condotto nell’intera popolazione residente a
Pescopagano, un paese dell’Appennino Lucano caratterizzato da carenza iodica di grado lieve-moderato
(8). All’epoca dello studio nessuno
faceva uso di sale iodato e la EUI,
espressa come mediana, era 55 µg/l,
con valori inferiori a 100 µg/l
nell’81% dei campioni. Gozzo era
s
i
t
ur
6-8
9-11
12-14
Popolazione scolare
K
e
ic
to iodico di una popolazione. Una
frequenza inferiore al 3% di neonati
con TSH sierico superiore a 5 mU/l
indica un adeguato apporto iodico.
Nelle 3 regioni esaminate, la percentuale di neonati con valori di
TSH superiore a 5 mU/l è risultato
3,3% in Toscana, 3,8% in Piemonte
e 4,8% in Calabria. Queste percentuali non sono diverse da quelle
osservate nel 2004, anno precedente
l’entrata in vigore della Legge sulla
iodoprofilassi (4).
r
t
i
d
0
6,2%
presente nel 46% della popolazione
generale ed aumentava progressivamente con l’età dal 16% nella popolazione infantile fino al 59% nella
popolazione anziana. Gozzo nodulare era assente nell’infanzia, raro nei
giovani fino a 25 anni ed aumentava
progressivamente fino al 28,5% nei
soggetti di 56-65 anni.
Nel 2010 – a distanza di 15 anni
dallo studio precedente e dopo 5 anni
dall’attuazione della Legge sulla
iodoprofilassi – è stata condotta una
nuova indagine utilizzando gli stessi
criteri metodologici. I risultati
mostrano che circa il 66% della
popolazione usa regolarmente il sale
iodato e che l’escrezione urinaria di
iodio è pari a 98 µg/l, significativamente più elevata rispetto a quella
osservata nella precedente indagine.
Nella popolazione infantile e nei giovani adulti di età <25 anni non è
stato osservato alcun caso di gozzo.
Gozzo nodulare è stato documentato
solo in soggetti di età >35 anni (9).
CONSIDERAZIONI CONCLUSIVE
Nonostante l’indubbio miglioramento dell’apporto nutrizionale di
iodio, in parte dovuto al miglioramento delle comunicazioni ed alla
diversificazione alimentare (“profilas-
LUCIA ANTONANGELI, ET AL.
si silente”), l’Italia è ancora caratterizzata da una carenza iodica di grado
lieve anche se in alcune aree l’apporto
iodico è da considerare adeguato o
quasi adeguato. Le indagini epidemiologiche condotte negli ultimi
anni hanno evidenziato un sensibile
incremento della EUI ed una drastica
riduzione della prevalenza di gozzo
nella popolazione scolare. Questi
risultati sono più evidenti nelle
regioni centro-settentrionali rispetto
a quelle centro-meridionali, e nei
centri a maggiore densità urbana
rispetto alle comunità più piccole.
In buona parte, a questi risultati
ha certamente contribuito l’attuazione della Legge 55 del 2005, come
testimoniato dal generale aumento
del consumo di sale iodato in tutto
il territorio nazionale, sia pure con
alcune differenze anche significative
da regione e regione.
EPIDEMIOLOGIA DELLA CARENZA
IODICA IN EUROPA
E
,
3
CENNI STORICI
La carenza iodica ed il gozzo endemico appartengono alla storia del
continente europeo e sono noti da
oltre centocinquant’anni. Tutti i
paesi europei, ad eccezione dell’Islanda, hanno sperimentato in diversa
misura questa piaga e tutte le sue
conseguenze sanitarie e socio-economiche. Il cretinismo endemico è
stato ampiamente descritto nel passato in molte regioni europee,
soprattutto in circoscritte aree montane in Austria, Bulgaria, Croazia,
Francia, Spagna e Svizzera, ed era
così frequente che il termine “ cretino delle Alpi” divenne di uso
comune. Agli inizi del diciannovesimo secolo, è stato suggerito per la
prima volta che l’uso del sale fortificato con iodio potesse migliorare le
condizioni di salute delle popolazioni residenti in aree montane (10). La
Svizzera è stato il primo paese europeo in cui la carenza iodica è stata
completamente eradicata con l’attuazione di un programma di iodoprofilassi mediante l’uso di sale iodato
esteso a tutta la popolazione e seguito da un costante monitoraggio.
1
0
©2
Tra la fine degli anni ’80 e l’inizio
degli anni ’90, la Società Europea
della Tiroide, insieme con altre Società
internazionali, quali WHO e UNICEF, ha affermato che ad eccezione dei
paesi scandinavi, della Svizzera e
dell’Austria, la maggior parte dei
paesi europei o alcune aree di questi,
soprattutto nella parte meridionale del
continente, erano ancora esposti alle
conseguenze della carenza iodica (11).
A partire dagli anni ’90, è stato
introdotto l’uso dell’ecografia e standardizzato il metodo per la valutazione del volume tiroideo per la
stima della prevalenza di gozzo (12).
Di particolare interesse è l’indagine
multicentrica (“Thyro-Mobil” study),
condotta nella seconda metà degli
anni ’90 in 32 aree iodocarenti di 12
paesi europei utilizzando un automezzo attrezzato con ecografo portatile. In tutti i soggetti è stata eseguita l’ecografia tiroidea e sono stati
raccolti campioni di urina per la
determinazione della ioduria. Da
questa indagine è emerso che
l’Olanda aveva raggiunto un adeguato apporto iodico, ottenuto dapprima con la iodazione delle acque
potabili ed in seguito con l’utilizzo
r
t
i
d
dello iodio nella panificazione industriale. Gli altri paesi europei interessati da questa indagine, ancora
privi di strumenti legislativi in
materia di iodoprofilassi, risultavano
caratterizzati da una deficienza iodica di grado moderato o lieve (13).
SITUAZIONE ATTUALE
A partire dai primi anni del 2000,
è stato condotto un numero crescente di studi su vari aspetti della deficienza iodica ed il suo controllo in
Europa, basati su indagini locali,
regionali e nazionali (14, 15).
Nell’ultima revisione dello stato di
nutrizione iodica in Europa condotta dall’International Council for the
Control of Iodine Deficiency
Disorders (ICCIDD) West-Central
Europe (16, 17), 14 paesi europei
erano ancora iodocarenti. In 13 la
carenza iodica era di grado lieve ed
in uno (Albania) di grado moderato/grave. In 15 paesi l’apporto iodico era adeguato ed in 4 (Islanda,
Lussemburgo, Norvegia, Svezia)
quasi sufficiente. Di 8 nazioni non
erano disponibili dati recenti o
attendibili (Tabella 3).
K
e
ic
s
i
t
ur
Tabella 3
Stato di nutrizione iodica nei paesi dell’Europa centro-occidentale, in base all’escrezione urinaria di
iodio (vedi testo).
Adeguato
Austria
Bosnia
Bulgaria
Cipro (Nord)
Croazia
Finlandia
Inghilterra
Macedonia
Olanda
Polonia
Portogallo
Repubblica Ceca
Repubblica Slovacca
Serbia
Svizzera
Quasi
adeguato
Moderatamente
insufficiente
Gravemente
insufficiente
Islanda
Lussemburgo
Norvegia
Svezia
Belgio
Danimarca
Francia
Germania
Grecia
Irlanda
Italia
Iugoslavia
Montenegro
Romania
Slovenia
Spagna
Turchia
Ungheria
Albania
10
Epidemiologia della carenza iodica
Nell’ultima rassegna mondiale
della WHO-UNICEF, pubblicata
nel 2007, sono riportati i dati sulla
EUI di 32 su 40 paesi dell’Europa
centro-occidentale, relativi alle
indagini effettuate prima del 2004
(18). Di 18 nazioni erano disponibili dati nazionali, delle altre 14
dati subnazionali. Delle restanti 8
nazioni non erano disponibili dati.
La EUI variava tra 30 µg/l in
Albania a 228 µg/l in Macedonia.
Apporto iodico insufficiente era
presente in 11 paesi, in 10 dei
quali la carenza era di grado lieve e
solo in uno (Albania) moderata/grave. Negli altri 20 paesi l’apporto iodico era adeguato, con una
ioduria compresa tra 100 e 199
µg/l (Figura 3). Nella stessa rassegna sono stati riportati i dati relativi alla prevalenza di gozzo in 23
paesi. In 13 nazioni erano disponibili dati nazionali, nelle altre 10
dati subnazionali. La prevalenza di
gozzo valutata mediante palpazione
variava dall’1,3% in Serbia e
Montenegro al 47% in Slovenia. La
prevalenza di gozzo determinata
mediante ecografia variava dallo
0% in Svizzera ed in Croazia al
31,8% in Turchia.
Figura 3
Apporto nutrizionale di iodio in Europa in base ai dati forniti dalla World Health Organisation (WHO) 2007.
Svezia
Islanda
Finlandia
Norvegia
Danimarca
Olanda
Irlanda
UK
Germania
Apporto nutrizionale di iodio
1. Stato sconosciuto
2. Carenza grave
3. Carenza moderata
4. Carenza lieve
5. Quasi carenza
6. Sufficienza
7. Quasi sufficienza
8. Eccesso
d
E
,
3
1
0
©2
itr
K
e
ic
Francia
Belgio
Svizzera
Italia
s
i
t
ur
Polonia
Republica Ceca
Austria
Slovacchia
Ungheria
Romania
Bulgaria
Spagna
Turchia
Slovenia
Portogallo
Croazia
Bosnia & Erzegovina
Yugoslavia
Albania
Grecia
Cipro
Macedonia
EPIDEMIOLOGIA DELLA CARENZA
IODICA NEL MONDO
CENNI STORICI
Nel 1960 la WHO ha pubblicato
la prima rassegna sulla estensione
della carenza iodica e alla conseguente
diffusione del gozzo endemico, relativa a 115 nazioni. Tale rassegna è stata
determinante nel focalizzare l'attenzione sulla dimensione del problema
di salute pubblica rappresentato dalla
carenza iodica, considerata per certe
aree un fenomeno naturale permanente. Da allora, molti paesi hanno iniziato ad attuare programmi di iodoprofilassi con sale iodato. Negli anni
’70, due endocrinologi di fama mondiale, John Stanbury di Harvard e
Basil Hetzel di Adelaide, fortemente
impegnati nella lotta contro i disordini da carenza iodica, furono i primi a
riconoscerne gli effetti negativi
s u l l o sviluppo cerebrale. Questi
11
scienziati hanno avuto un ruolo di
primo piano nella costituzione nel
1986 a Kathmandu della ICCIDD.
Negli anni successivi, l’ICCIDD
insieme con WHO, UNICEF e le
Associazioni Scientifiche della Tiroide
di tutti i continenti, hanno sancito
per mezzo di risoluzioni e dichiarazioni che l’eliminazione della carenza
iodica e la conseguente eradicazione
del gozzo endemico erano tra gli
obiettivi primari da raggiungere
entro l’anno 2000 (Figura 4).
SITUAZIONE ATTUALE
Nella rassegna pubblicata dalla
WHO nel 2004, viene riportato lo
stato nutrizionale di iodio a livello
mondiale in base ai dati della EUI
raccolti tra il 1993 ed il 2003 in
126 paesi nelle diverse regioni
WHO (19). In 54 paesi la popolazione aveva un insufficiente apporto
iodico. Di questi paesi, uno solo nel
Mediterraneo Orientale aveva una
grave carenza iodica, 13 (6 in
Africa, 4 in Europa, 2 nel Pacifico
occidentale ed 1 nelle Americhe)
avevano una carenza iodica moderata e 40 una carenza iodica di grado
lieve. L’apporto nutrizionale di
iodio risultava adeguato in 43 paesi,
con una EUI compresa tra 100 e
199 µg/l. In 24 paesi la EUI era
compresa tra 200 e 299 µg/l e superiore a 300 µg/l in 5 paesi. Le regioni WHO maggiormente interessate
dal problema erano l’Europa (60%)
ed il Mediterraneo Orientale (55%),
seguiti dall’Africa e dal Sud-Est
Asiatico (40% ciascuna), dal Paci-
LUCIA ANTONANGELI, ET AL.
Figura 4
Dichiarazione mondiale WHO/UNICEF per la sopravvivenza, protezione e sviluppo dell’infanzia, sottoscritta da 150 Capi di Governo.
E
,
3
fico Occidentale (26%) e dalle
Americhe (10%). La prevalenza di
gozzo nella popolazione generale
dei paesi inclusi nella rassegna era
del 15,8%, variando tra 4,7% nelle
Americhe al 37,3% nel Mediterraneo Orientale. Ad eccezione delle
Americhe e del Pacifico Occiden-
1
0
©2
r
t
i
d
apparentemente in contraddizione
con il corrispondente stato nutrizionale di iodio, può essere spiegato
con l’intervallo di tempo piuttosto
lungo intercorso tra l’attuazione
della iodoprofilassi e la scomparsa
del gozzo clinicamente rilevante.
Una rassegna del 2007 relativa ai
193 stati membri della WHO,
riporta che 2 miliardi (35,2%) di
persone nel mondo, dei quali un
terzo di bambini in età scolare, sono
ancora esposti alle conseguenze di
un insufficiente apporto iodico e che
ancora oggi in 47 paesi la carenza
iodica rappresenta un grave problema di salute pubblica (18, 20)
(Tabella 4).
La prevalenza più bassa di carenza
iodica è stata osservata nelle regioni
americane (10,6%), dove il consumo
di sale iodato ad uso domestico è
risultato il più alto al mondo (circa
90%). Al contrario, la più alta prevalenza di carenza iodica si ha in
Europa (52%), dove solo il 25%
della popolazione consuma sale
iodato e dove molti paesi non
dispongono ancora di efficienti programmi di sorveglianza degli effetti
della carenza iodica. Rispetto al
recente passato, tuttavia, sono stati
osservati indubbi progressi. Infatti,
12 paesi hanno raggiunto un apporto ottimale di iodio e la percentuale
di bambini a rischio di sviluppare
disordini da carenza iodica si è
K
e
ic
tale, dove la prevalenza di gozzo era
inferiore rispetto a quella osservata
nel 1993, in tutte le altre regioni
risultava aumentata, con un incremento compreso tra il 18,5% nel
Sud-Est Asiatico e l’81,4% nelle
regioni dell’Africa. Questo incremento della prevalenza di gozzo,
s
i
t
ur
Tabella 4
Percentuale di popolazione e numero di soggetti con insufficiente apporto di iodio in età scolare e nella popolazione generale (tutte le fasce di età). Dati
della World Health Organisation 2007 (vedi testo).
Carenza iodica nel mondo
Apporto di iodio insufficiente (<100 µg/l)
Regioni WHO
Africa
Americhe
Sud-Est Asiatico
Europa
Mediterraneo Orientale
Pacifico Occidentale
Totale
Popolazione scolare
Popolazione generale
Percentuale (%)
N totale (milioni)
Percentuale (%)
N totale (milioni)
40,8
10,6
30,3
52,4
48,8
22,7
31,5
57,7
11,6
73,1
38,7
43,3
41,6
263,7
41,5
11,0
30,0
52,0
47,2
21,2
30,6
312,9
98,6
503,6
459,7
259,3
374,7
2000
12
Epidemiologia della carenza iodica
Tabella 5
Situazione della nutrizione iodica: numero di nazioni in termini di “situazione iodica e numero totale
di paesi stimati”.
Apporto iodico
Insufficiente: grave carenza iodica
Insufficiente: moderata carenza iodica
Insufficiente: lieve carenza iodica
Sufficiente
Più che sufficiente
Eccessivo
Paesi con dati disponibili
Totale n. paesi
Paesi senza dati
2003
13
2011
N
%
N
%
N
%
1
13
40
43
24
5
126
192
66
1%
10%
32%
34%
19%
4%
0
10
37
49
27
7
130
192
62
0%
8%
28%
38%
21%
5%
0
9
23
69
34
11
148
193
45
0%
6%
16%
47%
24%
7%
ridotta al 5%. In Australia e negli
Stati Uniti, due nazioni in precedenza iodosufficienti, l’apporto iodico si è ridotto rispetto al passato,
tanto che l’Australia è caratterizzata
da una carenza iodica di grado
moderato, mentre gli Stati Uniti
hanno una escrezione urinaria di
iodio mediana di 160 µg/l, che
risulta ancora adeguata, ma è circa la
metà del valore osservato negli anni
’70. L’apporto nutrizionale di iodio
risulta più che sufficiente o eccessivo
in 34 nazioni.
L’ultimo aggiornamento sullo
stato nutrizionale di iodio è riportato in una rassegna del 2012 riguardante circa il 96% della popolazione
mondiale (21). Sono stati osservati
notevoli progressi rispetto al 2003
ed al 2011 in molte regioni. Il
numero di paesi classificati come
iodocarenti si è ridotto da 54 a 32,
mentre la percentuale di paesi con
un adeguato stato nutrizionale di
iodio è salito dal 34% al 47%.
Contemporaneamente si è osservato
un incremento del numero di paesi
con un apporto iodico più che sufficiente o eccessivo da 29 a 47
(Tabella 5). Per completare il quadro
dello stato nutrizionale di iodio, i
progressi verso il raggiungimento
della Iodazione Universale del Sale
(USI) sono stati valutati sulla base
1
0
©2
2007
dell’uso domestico regolare di sale
iodato.
Tra il 2011 ed il 2012 il consumo
percentuale di sale iodato ad uso
domestico è risultato del 71% nei
paesi sviluppati (21). Il consumo
domestico di sale iodato era globalmente circa il 70% negli anni
novanta. Questo dato potrebbe pertanto sembrare un mancato miglioramento rispetto ai due decenni precedenti. È da sottolineare tuttavia
che il numero di paesi valutati circa
il consumo domestico di sale iodato
è cresciuto da 90 nel 2002 a 128 nel
2012, indicando pertanto che la percentuale è riferita ad un numero
maggiore di paesi monitorati.
E
,
3
r
t
i
d
6. Aghini-Lombardi F, Pinchera A, Antonangeli et al 1993 Iodized salt prophylaxis of
endemic goiter: an experience in Toscana (Italy.
Acta Endocrinol 129:497-500.
7. Aghini-Lombardi F, Vitti P, Antonangeli L
et al; Southern Italy Study Group for Iodine
Deficiency Disorders 2013 The size of the
community rather than its geographical location better defines the risk of iodine deficiency:
results of an extensive survey in Southern Italy.
J Endocrinol Invest 36:282-286.
8. Aghini-Lombardi F, Antonangeli L, Martino
E, et al 1999 The spectrum of thyroid disorders
in an iodine deficient community: The
Pescopagano Survey. J Clin Endocrinol Metab
84:561-566.
9. Aghini-Lombardi F, Fiore E, Tonacchera M
et al 2013 The effect of 15 years voluntary
iodine prophylaxis through iodized salt in a
small rural community: the Pescopagano experience. J Clin Endocrinol Metab 98:1031-1039.
10. Burgi H, Supersaxo Z, Sel B 1990 Iodine
deficiency diseases in Switzerland one hundred
years after Theodor Kocher’s survey: a hystorical
review with some new goitre prevalence data.
Acta Endocrinol (Copenh) 123:577-590.
11. WHO, UNICEF, ICCIDD 1994 Indicators for
assessing iodine deficiency disorders and their
control through salt iodization. Geneva:
WHO/NUT/94.6.1994.
12. Vitti P, Martino E, Aghini-Lombardi F et al
1994 Thyroid volume measurement by ultrasound in children as a tool for the assessment of
mild iodine deficiency. J Clin Endocrinol
Metab 9:600-615.
13. Delange F, Benker G, Caron P et al 1997
Thyroid volume and urinary iodine in European
schoolchildren: standardization of values for
assessment of iodine deficiency. Eur J
Endocrinol 136:180-187.
14. Delange F, Robertson A, McLoughney E,
Gerasimov G 1998 Elimination of iodine deficiency disorders in central and eastern Europe,
the Commonwealth of Independent States, and
the Baltic States. Geneva: WHO, WHO/
Euro/NUT/98.1.1998.
15. WHO, UNICEF, ICCIDD 2001 Assessment
of the iodine deficiency disorders and monitoring their elimination. Geneva: WHO,
WHO/NHD/01.1.2001.
16. Vitti P, Delange F, Pinchera A, Zimmermann MB, Dunn JT 2003 Europe is iodine
deficient. Lancet 361:1226.
17. Iodine deficiency in Europe: National reports
on iodine status in West-Central European
countries. First symposium of ICCIDD WestCentral Europe. J Endocrinol Invest 2003; 26
(9 Suppl): 1-62.
18. WHO/ICCIDD/UNICEF 2007 Assessment of
the iodine deficiency disorders and monitoring
their elimination. 2nd edition. Geneva: WHO.
19. WHO. Iodine status worldwide. WHO Global
database on iodine deficiency. Geneva 2004
20. Zimmermann MB 2009 Iodine deficiency.
Endocr Rev 30:376-408.
21. Timmer A 2012 Iodine nutrition and universal
salt iodisation: a landscape analysis in 2012.
IDD Newsletter 40:5-9.
K
e
ic
BIBLIOGRAFIA
1. Baschieri L, Costa A, Basile A eds 1978 Il
Gozzo. Roma: Pozzi Editore.
2. Aghini-Lombardi F, Antonangeli L, Vitti P
et al 1993 Status of iodine nutrition in Italy.
In: Delange F, Dunn JT, Glinoer D eds. Iodine
deficiency in Europe. A continuing concern.
New York: Plenum Press; 403.
3. Aghini-Lombardi F Proceedings of the 3rd
West-Central Europe Symposium, Istambul,
September 2004.
4. Aghini-Lombardi F, Antonangeli L 2007
Controlling iodine deficiency in Italy IDD
Newsletter 25:4-5.
5. Fenzi GF, Aghini-Lombardi F, Giusti LF et
al 1986 Epidemiological studies on endemic
goiter and IDD in Tuscany, Italy. IDD
Newsletter 2:8-10.
s
i
t
ur
Vol. 14, Suppl. al n° 5, ottobre 2013
INTRODUZIONE
L’emanazione nel marzo del 2005
della legge n. 55 “Disposizioni finalizzate alla prevenzione del gozzo endemico e
di altre patologie da carenza iodica”
mette a disposizione a livello nazionale un importante strumento legislativo volto a ridurre la frequenza
dei disordini derivanti dalla carenza
di iodio. La normativa prevede una
serie di misure finalizzate a promuovere il consumo di sale arricchito di
iodio (30 mg/kg) su tutto il territorio
nazionale, quali la presenza obbligatoria di sale iodato nei punti vendita,
la fornitura del sale comune soltanto
su specifica richiesta dei consumatori,
l’uso di sale arricchito di iodio nella
ristorazione collettiva e la possibilità
di utilizzazione nella preparazione e
nella conservazione dei prodotti alimentari. Recentemente il Ministero
della Salute ha predisposto una lista
di sanzioni a carico di quegli esercenti che non assicurano la disponibilità
del sale iodato sia nei punti vendita
che nella ristorazione collettiva. Tali
provvedimenti saranno varati a breve,
non appena sarà terminato l’iter procedurale previsto.
A supporto dello strumento legislativo, e coerentemente con le linee
guida internazionali (1) che indicano
il monitoraggio della iodoprofilassi
come strumento necessario per garantirne il successo, l’intesa StatoRegioni del 26 febbraio 2009 ha istituito, presso l’Istituto Superiore di
Sanità, l’Osservatorio Nazionale per
il Monitoraggio della Iodoprofilassi
in Italia (OSNAMI). Questo rappresenta la struttura epidemiologica
mediante la quale viene effettuata la
sorveglianza del programma nazionale di iodoprofilassi. L’OSNAMI ha il
compito di valutare periodicamente
l’efficienza e l’efficacia del programma di prevenzione, ma anche di effettuare il monitoraggio dei nuovi casi
1
0
©2
Monitoraggio della
iodoprofilassi in Italia
Antonella Olivieri1, Daniela Rotondi1, Paolo Stacchini2,
Augusto Pastorelli2, Roberto Raschetti3, Roberto Da Cas3,
Carlo Corbetta4, Vera Stoppioni5, Giuseppe Parlato6,
Osservatori Regionali per la Prevenzione del Gozzo*
Dipartimento di Biologia Cellulare e Neuroscienze, 2Dipartimento di Sanità Pubblica
Veterinaria e Sicurezza Alimentare, 3Centro Nazionale di Epidemiologia Sorveglianza e
Promozione della Salute, Istituto Superiore di Sanità, Roma; 4Laboratorio Regionale per
lo Screening Neonatale Regione Lombardia, Ospedale dei Bambini “Vittore Buzzi”,
Milano; 5Laboratorio Regionale per lo Screening Neonatale Regione Marche, Ospedale
S.Croce, Fano; 6Laboratorio Regionale per lo Screening Neonatale Regione Calabria,
Università degli Studi “Magna Graecia”, Catanzaro
1
di ipertiroidismo, e di sostenere le
campagne di informazione sull’uso di
sale iodato presso la popolazione.
r
t
i
d
K
e
ic
VALUTAZIONE DEGLI INDICATORI
DI EFFICIENZA E DI EFFICACIA
DELLA IODOPROFILASSI
E
,
3
EFFICIENZA DELLA IODOPROFILASSI
La valutazione dell’efficienza della
iodoprofilassi si basa sull’analisi di
indicatori che consentono di verificare l’apporto nutrizionale di iodio
alla popolazione. Come indicato in
Tabella 1, gli indicatori utilizzati a
tale scopo sono: il contenuto di
iodio nelle confezioni di sale immesse in commercio, i dati di vendita
del sale iodato, la determinazione
della ioduria in campioni della
popolazione in età scolare reclutati
in specifiche “aree sentinella” opportunamente individuate.
Relativamente alla valutazione del
contenuto di iodio nel sale commercializzato, è importante ricordare che,
oltre ai controlli di qualità eseguiti a
livello di produzione, ad ulteriore
tutela della salute dei consumatori è
s
i
t
ur
operativa sul territorio nazionale una
fitta rete di controlli ufficiali delle
ASL territoriali che prevedono analisi di campioni di sale per uso alimentare in tutte le Regioni (Figura
1). Le analisi sono finalizzate alla
valutazione della conformità alla
normativa vigente del contenuto di
iodio rilevato nei campioni raccolti
sul territorio. La legge, infatti, prevede limiti di tolleranza compresi tra
24 e 42 mg di iodio per kg di sale.
Laddove siano riscontrate non
conformità alla legge sono previste
sanzioni pecuniarie a carico delle
industrie produttrici. Anche nell’ambito delle attività di monitoraggio dell’OSNAMI sono previste analisi del contenuto di iodio in campioni di sale per uso alimentare prelevati presso la grande distribuzione.
I risultati finora raccolti, che hanno
riguardato 163 campionamenti,
hanno mostrato un adeguato contenuto di iodio (29,8±2,5 mg/kg).
Nella Figura 2 sono riportati i
dati di vendita del sale iodato su
tutto il territorio nazionale. Grazie
alla collaborazione dei principali
Corrispondenza: Antonella Olivieri, Dipartimento di Biologia Cellulare e Neuroscienze, Istituto Superiore di Sanità, Viale
Regina Elena 299, 00161 Roma. E-mail: [email protected]
**Osservatori Regionali per la Prevenzione del Gozzo: S. Andò (Calabria), M. Bagnasco (Liguria), P. Bellitti (Basilicata), M. Cignarelli (Puglia), E. Consiglio
(Campania), M. D’Armiento (Lazio), E. Degli Uberti (Emilia Romagna), G. Doveri (Valle D’Aosta), M. Gasperi (Molise), C. Mian (Veneto e Friuli Venezia
Giulia), S. Mariotti (Sardegna), G. Napolitano (Abruzzo), F. Orlandi (Piemonte), G. Radetti (Trentino Alto Adige), C. Regalbuto (Sicilia), F. Santeusanio
(Umbria), A. Taccaliti (Marche), M.L. Tanda (Lombardia), M. Tonacchera (Toscana).
14
Monitoraggio della iodoprofilassi
Tabella 1
Criteri di valutazione per il monitoraggio della iodoprofilassi e risultati dell’OSNAMI relativi alla situazione attuale.
Obiettivi
Risultati del monitoraggio
30 µg I/g sale
(limiti di tolleranza : 24-42 µg I/ g sale)
90%
29,8±2,5 µg I/g sale
Indicatori di efficienza
Contenuto di iodio
nel sale venduto
Percentuale di vendita
del sale iodato
Valore mediano della ioduria
nella popolazione scolare
100-199 µg /l
54% grande distribuzione
23% ristorazione collettiva
7% industria alimentare
98 µg/l Centro-Nord
78 µg/l Sud-Isole
Indicatori di efficacia
Percentuale di gozzo
nella popolazione scolare
Percentuale di TSH neonatale >5 µU /ml
Incidenza di ipotiroidismo congenito
0-4,9%
<3%
< 1:2.400 (periodo 2000-2006)
4-10% Centro-Nord
10-15% Sud-Isole
7,2%
1:2.400
TSH: ormone tireotropo.
produttori e/o distributori di sale
che operano in Italia e che annualmente mettono a disposizione i loro
dati, è stato possibile accertare che
attualmente il 54% di tutto il sale
venduto presso la grande distribuzione è sale iodato, mentre la percentuale di vendita nella ristorazione collettiva non supera il 23%.
Questo dato è piuttosto significati-
1
0
©2
K
e
ic
vo dal momento che la ristorazione
collettiva comprende mense scolastiche, mense aziendali, caserme,
ecc., e in Italia corrisponde a circa
due miliardi di pasti all’anno (2).
Ancor più critica è la situazione
nell’industria alimentare presso la
quale la percentuale di vendita del
sale iodato non supera il 7% di
tutto il sale venduto.
E
,
3
r
t
i
d
Figura 1
Sistema di monitoraggio e valutazione del processo produttivo del sale iodato.
Sale iodato
15
È stata inoltre analizzata la concentrazione urinaria di iodio su campioni estemporanei di urine di bambini in età scolare reclutati dagli
Osservatori Regionali per la Prevenzione del Gozzo successivamente
all’introduzione della legge n. 55. I
dati raccolti negli ultimi tre anni
hanno mostrato che i valori mediani
di ioduria, rilevati in circa 4.000
bambini residenti in 11 Regioni italiane (Figura 3), sono ancora al di
sotto di 100 µg/l (Regioni del
Centro-Nord 98 µg/l, Regioni del
Sud-Isole 78 µg/l), indicato dal
World Health Organization (WHO)
quale valore soglia al di sotto del
quale la popolazione esaminata
viene identificata come iodocarente
(1). È importante ricordare che la
ioduria rappresenta un indicatore di
recente intake di iodio, in quanto
circa il 92% dello iodio introdotto
con l’alimentazione viene assorbito a
livello intestinale e, in soggetti con
adeguato apporto iodico, oltre il
90% viene escreto nelle urine nelle
24-48 ore successive (3, 4). Quanto
minore è l’apporto nutrizionale di
iodio, pertanto, tanto più ridotta
sarà la ioduria. Inoltre, data l’ampia
variabilità giornaliera del contenuto
di iodio urinario, che è fortemente
condizionato dall’assunzione di
iodio con gli alimenti nelle 24 ore
precedenti al campionamento, la
ioduria misurata in campioni estemporanei non può essere utilizzata
come indicatore di intake di iodio a
livello individuale ma solo in ampi
studi epidemiologici per i quali il
bias dovuto a tale variabilità diventa
trascurabile (5).
Monitoraggio interno
(siti di produzione e/o distribuzione)
Adesione a programmi di controllo e
assicurazione di qualità da parte di
produttori e distributori
Monitoraggio esterno
(siti di produzione e/o distribuzione)
Ispezioni del Ministero della Salute nei
complessi industriali di produzione
e/o distribuzione
Monitoraggio esterno
(punti vendita)
Controlli ufficiali delle ASL territoriali
per la verifica della conformità
alla legge del contenuto di iodio
rilevato nelle confezioni di sale venduto
s
i
t
ur
EFFICACIA DELLA IODOPROFILASSI
La valutazione degli effetti positivi della iodoprofilassi sulla popolazione, in termini di riduzione delle
patologie correlate alla iodocarenza,
viene effettuata attraverso l’analisi
della prevalenza di gozzo in campioni della popolazione in età scolare
reclutati in specifiche “aree sentinella”, dell’andamento nel tempo dei
valori di ormone tireotropo (TSH)
neonatale, dell’incidenza di ipotiroi-
ANTONELLA OLIVIERI, ET AL.
Figura 2
Trend temporale delle percentuali di vendita del sale iodato in Italia. I dati si riferiscono alla grande distribuzione e alla ristorazione collettiva.
Grande distribuzione
Ristorazione collettiva
60
50
54
47
44
Vendita sale iodato (%)
Vendita sale iodato (%)
53
43
39
40
60
34
30
20
10
50
40
30
20
14
17
14
23
13
10
Legge
55/2005
0
25
20
Legge
55/2005
2005 2006 2007 2008 2009 2010 2011 2012
dismo congenito a livello nazionale
(Tabella 1). Un altro importante
obiettivo dell’azione di monitorag-
0
K
e
ic
gio dell’OSNAMI è quello di evitare l’esposizione della popolazione ad
un eccesso di iodio, che può provo-
E
,
3
r
t
i
d
Figura 3
In rosa sono indicate le 11 regioni italiane che hanno partecipato al monitoraggio della ioduria e della
prevalenza del gozzo nella popolazione scolare.
1
0
©2
s
i
t
ur
2005 2006 2007 2008 2009 2010 2011 2012
care un aumento (generalmente
transitorio) dell’incidenza di ipertiroidismo e di autoimmunità tiroidea
(6, 7). Relativamente a questo
punto, l’azione di monitoraggio
attualmente è focalizzata sulla sorveglianza dell’ipertiroidismo perché
clinicamente più importante. Tale
obiettivo è raggiunto attraverso la
sorveglianza delle prescrizioni di
farmaci anti-tiroidei, quale misura
indiretta dei nuovi casi di ipertiroidismo nella popolazione.
Per ciò che riguarda la frequenza
di gozzo in età scolare, questa è stata
stimata sugli stessi bambini per i
quali è stata valutata la ioduria, grazie alla collaborazione degli Osservatori Regionali per la Prevenzione
del Gozzo. Coerentemente con le
indicazioni del WHO (1), che indicano una percentuale di gozzo in età
scolare del 4,9% quale valore soglia
al di sopra del quale viene indicata
una condizione di iodocarenza, i dati
raccolti confermano il permanere di
un insufficiente apporto nutrizionale
di iodio nella popolazione scolare
italiana (Regioni del Centro-Nord
4-10%, Regioni del Sud-Isole 1015%). A tale proposito è importante
ricordare che la prevalenza di gozzo
è un indicatore di intake di iodio a
lungo termine poiché, sebbene il
16
Monitoraggio della iodoprofilassi
volume tiroideo si riduca all’aumentare dell’intake di iodio, è necessario
che i bambini siano nati e cresciuti
in condizioni di iodosufficienza perché la prevalenza di gozzo nella
popolazione scolare possa raggiungere valori <5,0% (8).
L’altro indicatore utilizzato per
valutare l’efficienza della iodoprofilassi è il TSH neonatale (1), che in Italia
viene determinato in tutti i neonati
per l’esecuzione dello screening neonatale dell’ipotiroidismo congenito. I
neonati sono più sensibili degli adulti
alla carenza di iodio in quanto nella
tiroide neonatale è presente un accelerato turn over dello iodio (9, 10).
Pertanto, in popolazioni neonatali
esposte ad un insufficiente apporto
nutrizionale di iodio durante la vita
fetale e nei primi giorni di vita, la
tiroide viene iperstimolata dal TSH
per far fronte all’accelerato turn over
dello iodio e per garantire un’adeguata attività secretoria. Di conseguenza
il TSH alla nascita risulterà più frequentemente elevato (>3% con valori
di TSH >5,0 mU/l) rispetto a quello
osservato in popolazioni neonatali
esposte ad un adeguato apporto iodico
(11). Numerose variabili, quali il
metodo di dosaggio, l’età al prelievo,
l’età gestazionale, l’utilizzo di disinfettanti iodati, possono influenzare i
valori di TSH nei primi giorni di vita
(12); è quindi importante tener conto
di tali fattori quando si utilizza questo indicatore dello stato nutrizionale
di iodio nella popolazione neonatale.
L’OSNAMI, grazie alla collaborazione dei Centri di Screening di tre
Regioni rappresentative del Nord,
Centro e Sud del paese (Lombardia,
Marche, Calabria), ha analizzato i
dati relativi al TSH dei nati in queste
regioni tra il 2004 ed il 2011
(N=600.000). I risultati di questa
analisi hanno confermato il permanere in Italia di una frequenza ancora
superiore al 3% (6,3% nel 2004;
7,3% nel 2011) di valori di TSH
>5,0 mU/l.
1
0
©2
17
Infine, attraverso i dati dell’Osservatorio Nazionale sull’Impiego dei
Medicinali (OsMed) analizzati
dall’Istituto Superiore di Sanità, è
stato possibile monitorare l’andamento delle prescrizioni di metimazolo in Italia. L’analisi ha dimostrato
che l’incremento del consumo di
metimazolo osservato nel periodo
2006-2011 è significativamente più
ridotto rispetto all’incremento rilevato nel periodo 2000-2005 (8,5%
vs 23,2%, p=0,01).
SOSTEGNO ALLE CAMPAGNE
DI INFORMAZIONE
L’azione di sostegno alle campagne
di informazione presso la popolazione sull’uso di sale iodato viene realizzata attraverso la cooperazione
dell’OSNAMI con i medici del territorio e l’aggiornamento costante
del sito web www.iss.it/osnami i cui
contenuti sono destinati non solo
agli addetti ai lavori, ma anche a
cittadini comuni che vogliano trovare informazioni semplici su carenza
di iodio e iodoprofilassi in Italia.
E
,
3
r
t
i
d
efficace, possa cioè tradursi in una
tangibile riduzione della frequenza
delle patologie correlate alla iodocarenza con un conseguente risparmio
in termini di costi socio-sanitari.
BIBLIOGRAFIA
1. World Health Organization 2007 Assessment
of iodine deficiency disorders and monitoring
their elimination : a guide for programme managers. 3rd ed. Available at: http://www.who.int/
nutrition/publications/micronutrients/iodine_d
eficiency/9789241595827/en/.
2. Biondi A, Antonini A, Pasca Raymondo F,
Tarsitani G 2006 The HACCP method for
personnel education. Ann Ig 18:31-39.
3. Nath SK, Moinier B, Thuillier F et al 1992
Urinary excretion of iodide and fluoride from
supplemented food grade salt. Int J Vitam Nutr
Res 62:66-72.
4. Jahreis G, Hausmann W, Kiessling G et al
2001 Bioavailability of iodine from normal
diets rich in dairy products – results of balance
studies in women. Exp Clin Endocrinol
Diabetes 109:163-167.
5. König F, Andersson M, Hotz K et al 2011
Ten repeat collections for urinary iodine from
spot samples or 24-h samples are needed to reliably estimate individual iodine status in
women. J Nutr 141: 2049-2054.
6. Bürgi H, Kohler M, Morselli B 1998
Thyrotoxicosis incidence in Switzerland and
benefit of improved iodine supply. Lancet
352:1034.
7. Aghini Lombardi F, Fiore E, Tonacchera M
et al 2013The effect of voluntary iodine prophylaxis in a small rural community: the
Pescopagano survey 15 years later. J Clin
Endocrinol Metab 98:1031-1039.
8. Zimmermann MB, Andersson M 2012
Assessment of iodine nutrition in populations:
past, present, and future. Nutr Rev 70:553570.
9. Delange F 1998 Screening for congenital
hypothyroidism used as an indicator of the
degree of iodine deficiency and of its control.
Thyroid 8:1185-1192.
10. Delange F 2007 Iodine requirements during
pregnancy, lactation and the neonatal period
and indicators of optimal iodine nutrition.
Public Health Nutr 10:1571-1580.
11. Zimmermann MB, Aeberli I, Torresani T,
Bürgi H 2005 Increasing the iodine concentration in the Swiss iodine salt program markedly
improved iodine status in pregnant women and
children: a 5-y prospective national study. Am J
Clin Nutr 82:388-392.
12. Li M, EastmanCJ 2010 Neonatal TSH screening: is it a sensitive and reliable tool for monitoring iodine status in populations?. Best Pract
Res Clin Endocrinol Metab 24:63-75.
K
e
ic
CONCLUSIONI
Ad otto anni dall’approvazione
della legge, i dati dell’OSNAMI
indicano che solo la metà del sale
per uso alimentare venduto è rappresentato da sale iodato e, in base
all’analisi di specifici indicatori biologici, è confermato il persistere in
Italia di una condizione di carenza
nutrizionale di iodio che, seppure
non severa, determina ancora un’alta
frequenza di gozzo e di altri disordini correlati. È quindi importante
rafforzare l’informazione e la sensibilizzazione della popolazione sui
benefici derivanti dall’utilizzo del
sale iodato e tenere alta l’attenzione
degli operatori del Sistema Sanitario
Nazionale, affinché la iodoprofilassi
possa essere anche in Italia un programma di prevenzione efficiente ed
s
i
t
ur
Vol. 14, Suppl. al n° 5, ottobre 2013
INTRODUZIONE
Lo iodio è un micronutriente
essenziale per la sintesi degli ormoni tiroidei. Un apporto di iodio
adeguato con la dieta è fondamentale per assicurare la normale crescita degli organismi animali e dell’uomo (1). Lo iodio è presente nel
corpo umano solo in piccole quantità (15-20 mg) e il suo fabbisogno
giornaliero è di appena 150 µg/die,
ma aumenta in gravidanza e durante l’allattamento. Purtroppo in
molti paesi del mondo, tra cui
l’Italia, lo iodio è presente in quantità così esigue nel suolo, nelle
acque e negli alimenti che il suo
fabbisogno minimo giornaliero non
è comunque soddisfatto (2, 3). Lo
iodio, dopo essere stato ingerito
con l’acqua e gli alimenti, viene
rapidamente assorbito dall’intestino. Il rene è la via di escrezione
principale dello iodio, ma la maggior parte dello iodio presente nel
sangue viene attivamente captata
dalla tiroide per la sintesi degli
ormoni tiroidei [tiroxina (T 4 ) e
triiodotironina (T3)]. Quando l’apporto di iodio si riduce, i meccanismi che controllano l’omeostasi
degli ormoni tiroidei provocano
prima un aumento della captazione
tiroidea dello iodio e successivamente un’ipertrofia della ghiandola, che determina la formazione del
gozzo. Quando la carenza di iodio è
prolungata questi meccanismi di
compenso diventano insufficienti e
può insorgere un ipotiroidismo da
ridotta produzione di ormoni tiroidei. Le conseguenze dell’ipotiroidismo sono tanto più gravi quanto
più precoce è la sua comparsa nel
corso della vita. Gli ormoni tiroidei
esplicano, infatti, un ruolo essenziale nei processi di maturazione di
tutti gli organi e apparati. La
carenza prolungata di ormoni tiroidei nel feto, nel neonato e nel bambino può causare un ritardo di crescita e danni irreversibili del sistema nervoso centrale.
1
0
©2
Carenza iodica
e gravidanza
Lucia Montanelli1, Luca Chiovato2
1
Dipartimento di Medicina Clinica e Sperimentale, Università degli Studi di Pisa;
Unità di Medicina Interna ed Endocrinologia, Fondazione Salvatore Maugeri IRCCS,
Università degli Studi di Pavia
2
EPIDEMIOLOGIA
DELLA CARENZA IODICA
La carenza iodica e i disordini che
da essa derivano (iodine deficiency
disorders, IDD) non costituiscono un
problema di salute pubblica in
Giappone, negli Stati Uniti e in
alcuni paesi del Nord Europa dove la
dieta è ricca di iodio, o dove da
molti anni sono stati adottati programmi di iodioprofilassi. Nel 2011
l’International Council for the
Control of Iodine Deficiency Disorders (ICCIDD) ha stimato che quasi
due miliardi di individui della popolazione mondiale continuino ad avere
un apporto insufficiente di iodio, 1/3
di questi sono bambini in età scolare. In pratica, la carenza iodica rimane un problema di salute pubblica in
32 paesi (4). Fortunatamente, un
aggiornamento dei dati epidemiologici al 2013 ha mostrato un incoraggiante aumento del numero dei paesi
iodio-sufficienti (5).
E
,
3
r
t
i
d
di gozzo e, in caso di gozzo pre-esistente, ne determina il suo aumento.
Quando il grado di carenza iodica è
grave, può causare ipotiroidismo
nella gestante e associarsi a un’aumentata frequenza di aborto, parto
prematuro e mortalità perinatale. Il
cretinismo endemico, una condizione
morbosa caratterizzata da ritardo
mentale grave, rappresenta la conseguenza più temibile della carenza
iodica grave in gravidanza e dell’ipotiroidismo materno-fetale. Nel neonato la carenza iodica provoca un ipotiroidismo congenito transitorio;
questa disfunzione tiroidea contribuisce allo sviluppo di deficit sia di crescita che mentali, più o meno gravi a
seconda della durata dell’ipotiroidismo (7).
K
e
ic
CONSEGUENZE DELLA CARENZA
IODICA
I disordini da carenza iodica comprendono un ampio spettro di condizioni morbose che variano a seconda del momento della vita in cui si
verificano (6). I neonati, i bambini e
le donne in gravidanza sono più
esposti ai danni da carenza iodica in
quanto hanno un fabbisogno maggiore di iodio.
In gravidanza la carenza iodica
lieve o moderata provoca la comparsa
s
i
t
ur
CARENZA IODICA,
FUNZIONE TIROIDEA
E GOZZO IN GRAVIDANZA
La carenza iodica è la causa principale di alterazioni morfo-funzionali
tiroidee nelle donne gravide senza
malattie tiroidee preesistenti (8, 9).
In gravidanza si assiste ad un aumento fisiologico della clearance renale
dello iodio con conseguente maggiore perdita di questo elemento dall’organismo. La perdita di iodio aumenta
nella seconda parte della gravidanza
poiché una parte del pool inorganico
dello iodio materno si sposta nell’unità feto-placentare per alimentare la
produzione di ormoni tiroidei nella
tiroide fetale. La perdita di iodio
Corrispondenza: Lucia Montanelli, Dipartimento di Medicina Clinica e Sperimentale, Università degli Studi di Pisa,
Via Paradisa 2, 56124 Pisa. E-mail: [email protected]
18
Carenza iodica e gravidanza
1
0
©2
80
70
L’associazione tra aumento di volume del collo e gravidanza è nota fin
Tabella 1
Indici di iperstimolazione tiroidea in gravidanza.
Ipotiroxinemia relativa
- FT4 ai limiti inferiori della norma
Secrezione preferenziale di T3
- Rapporto T3/T4 elevato
Aumento del TSH
Aumento della tireoglobulina
FT4: tiroxina libera; T3: triiodotironina; T4: tiroxina; TSH:
ormone tireotropo.
Non gravide
Gravide
60
50
40
30
20
10
0
Scozia
Area iodio-carente
r
t
i
d
s
i
t
ur
Islanda
Area iodio-sufficiente
K
e
ic
dall’antichità, già nell’Egitto dei
Faraoni questo segno era considerato
patognomonico dello stato gravidico.
Nel corso degli anni molto studi
hanno dimostrato la correlazione tra
aumentata prevalenza del gozzo e
ridotto apporto iodico (11) nelle
donne gravide rispetto a quelle non
gravide (Figura 1) e l’aumento progressivo delle dimensioni del gozzo
con il progredire della gestazione
(12). Nei paesi con apporto iodico
sufficiente, come negli Stati Uniti, la
prevalenza del gozzo in gravidanza è
bassa e non differente da quella
osservata nelle donne non gravide
(13). A partire dagli anni ’90 l’avvento dell’ecografia ha permesso di
misurare con precisione il volume
tiroideo. È stato così dimostrato che
anche nelle aree iodio-sufficienti il
volume della tiroide aumenta del
10-15% durante la gravidanza.
Nelle aree a carenza iodica, anche
lieve, il volume tiroideo aumenta
durante la gravidanza in misura
maggiore (16-31%) (8). Studi condotti in Belgio hanno dimostrato che
in una popolazione non selezionata
di donne gravide il volume tiroideo
aumentava in media del 20% (10,
14, 15). Nelle donne con gozzo preesistente alla gravidanza l’aumento di
E
,
3
EFFETTO GOZZIGENO
DELLA GRAVIDANZA
19
Figura 1
Prevalenza di gozzo (ghiandola tiroidea visibile e palpabile) in donne non gravide e gravide residenti in
una zona iodiocarente (Scozia) e in una zona a sufficiente apporto iodico (Islanda) negli anni ’60. Dati
modificati da (11).
Prevalenza di gozzo
durante la gravidanza ha uno scarso
rilievo funzionale nei paesi con
apporto iodico ottimale (superiore a
150-200 µg/die), mentre nei paesi a
carenza iodica grave o moderata l’aumento del fabbisogno di iodio durante la gravidanza può precipitare l’ipotiroidismo della madre, soprattutto
nella seconda parte della gestazione
(6). Nei paesi a carenza iodica lieve
(apporto iodico giornaliero tra 50 e
100 µg/die) lo iodio contenuto nell’alimentazione è spesso appena sufficiente per far fronte ai normali fabbisogni dell’adulto. In gravidanza,
quando si assiste alle fisiologiche
modificazioni dell’economia tiroidea,
si manifestano gli effetti del ridotto
apporto iodico sia sulla madre sia sul
feto e sul neonato. Fin dalle prime
fasi della gestazione il ridotto apporto iodico è evidenziato da indici sierologici indicativi di iperstimolazione ghiandolare: ipotiroxinemia relativa [valori di T4 libera (FT4) ai limiti
inferiori della norma], secrezione preferenziale di T3 (rapporto T3/T4 elevato) e valori di ormone tireotropo
(TSH) e tireoglobulina più alti
(Tabella 1) (8-10). L’iperstimolazione
tiroidea durante tutta la gravidanza
spiega la comparsa di gozzo o l’aumento di volume di un gozzo preesistente nelle gestanti che vivono in
aree geografiche con apporto iodico
insufficiente (9, 10).
volume della tiroide variava dal 17 al
55% (16). Un ulteriore studio belga
ha mostrato che, mentre molti parametri di funzione tiroidea si normalizzavano 6 mesi dopo il parto (14),
il 40-50% delle donne mostrava
ancora un gozzo di modeste dimensioni e la persistenza del rapporto
T3/T4 elevato e della tireoglobulina
sierica alta. Questi dati indicano che
l’aumento del volume tiroideo
durante la gravidanza è solo parzialmente reversibile dopo il parto e
dimostrano che l’apporto iodico deve
essere aumentato non solo in gravidanza, ma anche nel post partum,
soprattutto nelle donne che allattano. L’effetto gozzigeno della gravidanza è ancora più evidente nelle
Tabella 2
Effetto della gravidanza sulla funzione e sulla
morfologia tiroidea in donne affette da gozzo
diffuso o nodulare preesistente alla gestazione. Modificata da (16).
↑ Tireoglobulina sierica
↑ Dimensioni del gozzo
↑ Tendenza all’autonomia funzionale
↑ Numero e dimensioni dei noduli tiroidei
LUCIA MONTANELLI, ET AL.
donne gravide già affette da gozzo
diffuso e nodulare prima della gravidanza (Tabella 2) (7, 16).
TERAPIA DEL GOZZO
NON TOSSICO IN GRAVIDANZA
Nei paesi iodio-insufficienti la
maggior parte delle tireopatie gravidiche è rappresentata da gozzi non
tossici diffusi o nodulari. In questa
condizione la terapia con L-tiroxina
non è controindicata poiché l’ormone attraversa la barriera placentare
solo in minima quantità e non
influenza lo stato tiroideo dei feti
normali e, d’altra parte, può ridurre
le dimensioni del gozzo nella madre
o almeno prevenirne l’aumento ulteriore. Uno studio del 1995 evidenziava l’efficacia della supplementazione iodica sul volume tiroideo e
della supplementazione iodica associata a L-tiroxina rispetto a un gruppo di donne gravide trattate con placebo (17) (Tabella 3). La L-tiroxina
deve essere somministrata a dosi
capaci di sopprimere, almeno parzialmente, la secrezione del TSH.
Prima di iniziare la terapia è opportuno effettuare un dosaggio degli
ormoni tiroidei liberi e del TSH per
verificare lo stato di eutiroidismo
della madre. Nei primi mesi di gravidanza la presenza di elevati valori
di gonadotropina corionica umana
(hCG) può stimolare la funzione
tiroidea per cui si deve adottare una
certa cautela nella scelta della dose
iniziale di L-tiroxina, che dovrà essere inferiore a quella (1,5-1,8
µg/kg/die) consigliata nel gozzo al di
fuori della gravidanza. La terapia
con L-tiroxina in gravidanza richiede controlli, almeno trimestrali, di
TSH, FT4 e FT3 al fine di aggiustare
la dose in base ai cambiamenti del
fabbisogno dell’ormone tiroideo. La
terapia non è controindicata e deve
essere continuata anche nel post partum durante l’allattamento.
CARENZA IODICA E FUNZIONE
TIROIDEA FETALE E NEONATALE
Nelle aree a carenza iodica il feto e
il neonato hanno un rischio molto
più elevato di sviluppare ipotiroidismo rispetto a tutte le altre fasce di
età (6). Sebbene la funzione tiroidea
della madre e del feto siano regolate
in maniera autonoma, non sono
indipendenti. La funzione tiroidea
del feto dipende totalmente dallo
iodio proveniente dal circolo materno attraverso la placenta. L’apporto
iodico materno è molto importante
anche nei neonati allattati al seno; lo
iodio è concentrato attivamente
dalla mammella per cui nel latte
sono presenti quantità rilevanti di
questo elemento. La carenza iodica
della madre durante la gravidanza,
pertanto, si può ripercuotere sul feto
e sul neonato e, a seconda del deficit
di iodio, può provocare gozzo neonatale, ipotiroidismo neonatale transitorio e/o deficit dello sviluppo intellettivo di gravità variabile fino al
cretinismo endemico (7).
E
,
3
1
© 20
r
t
i
d
K
e
ic
METABOLISMO DELLO IODIO
NEL NEONATO
Il contenuto di iodio nella tiroide
fetale varia a seconda dell’età gesta-
Tabella 3
Effetto della gravidanza sul volume tiroideo (VT) in 3 gruppi di donne senza gozzo trattate con placebo (gruppo A), iodio (gruppo B) e iodio + L-tiroxina (gruppo C) e sui loro neonati. Modificata da (17).
Gruppo
VT iniziale (ml)
Incremento del VT al parto (%)
VT dei neonati (ml)
A
13,3±0,7
+30 (20-37)
1,05±0,05
B
13,5±0,7
+15 (4-27) p 0,05*
0,76±0,05 p 0,0001*
C
13,0±0,6
+8 (3-13) p 0,05*
0,75±0,05 p 0,0001*
*p statisticamente significativa verso gruppo A.
zionale: è molto basso durante le
prime fasi di sviluppo fetale,
aumenta rapidamente dopo la 15a
settimana di gestazione, quando la
tiroide comincia a captare attivamente lo iodio, e raggiunge un plateau nei neonati a termine (18).
Tuttavia, il contenuto totale di iodio
nella tiroide dei neonati a termine
dipende dall’apporto alimentare di
questo elemento nella popolazione.
In condizioni di carenza iodica alcuni neonati, in particolare quelli pretermine che hanno un contenuto di
iodio intratiroideo minore, hanno
difficoltà a far fronte alla produzione
giornaliera di T4. Questa difficoltà
si traduce, a seconda del grado di
carenza iodica, in un aumento di
dimensioni della tiroide, in una
ipertireotropinemia transitoria associata a T4 sierica normale o in un
ipotiroidismo neonatale transitorio
(6); la carenza iodica, inoltre, provoca una maggiore frequenza di valori
borderline elevati di TSH neonatale.
s
i
t
ur
GOZZO NEONATALE
In presenza di carenza iodica lieve,
come in molti paesi europei, per
mantenere una tiroxinemia normale
in presenza di depositi intratiroidei
di iodio ridotti è necessaria una iperstimolazione della tiroide neonatale,
che si traduce in un aumento del
TSH e della tireoglobulina circolanti,
e in un aumento del volume tiroideo
(17, 19). In altre parole, un apporto
iodico anche solo lievemente ridotto
in gravidanza comporta la comparsa
di gozzo sia nella madre sia nel neonato (17) (Tabella 3). Glinoer e coll.
mostravano come il volume tiroideo
dei neonati nati da madri non trattate durante la gestazione fosse significativamente maggiore rispetto a
quello dei neonati nati da madri trattate con iodio e/o iodio associato a Ltiroxina (Tabella 3) (17). La supplementazione con iodio durante la gravidanza (250 µg/die) (20) provoca una
marcata riduzione dei valori di tireoglobulina sierica alla nascita e la normalizzazione del volume tiroideo nel
neonato (7, 8) (Tabella 3). In pratica,
un’adeguata supplementazione iodica
20
Carenza iodica e gravidanza
in gravidanza contrasta, nei paesi
iodio-carenti, i processi che portano
allo sviluppo di gozzo.
IPOTIROIDISMO NEONATALE
TRANSITORIO
Nelle popolazioni esposte a grave
carenza iodica si assiste alla comparsa
di ipotiroidismo transitorio nel 7,513,3% dei neonati. La frequenza dell’ipotiroidismo neonatale transitorio è
correlata al grado di deficit alimentare
di iodio e alla prevalenza dei disordini
da carenza iodica della popolazione
adulta. La somministrazione di iodio
alle madri durante la gravidanza previene il deficit tiroideo neonatale.
Studi condotti in Europa negli anni
’80-’90 hanno mostrato che nelle
popolazioni esposte a deficit di iodio
moderato o lieve l’incidenza dell’ipotiroidismo neonatale transitorio era
fino a 6 volte superiore a quella delle
popolazioni degli Stati Uniti (21, 22).
Nei neonati, una ioduria bassa era
inversamente correlata a valori più
elevati di TSH. In Toscana, negli anni
1990-1992, i valori del TSH rilevati
allo screening neonatale erano significativamente più elevati in Garfagnana,
zona iodio-carente, rispetto a Livorno,
zona iodio-sufficiente (23).
giornaliero di iodio variabile con la
fascia di età previene la comparsa di
gozzo nelle nuove generazioni. Alcuni
studi hanno stabilito la quantità di
iodio necessaria in base alle differenti
età e alle condizione fisiologiche (3, 7,
20). Moleti e coll. hanno inoltre
dimostrato un significativo miglioramento della funzione tiroidea nelle
donne trattate con supplementazione
iodica a lungo termine (2 anni prima
della gravidanza) rispetto a quelle
trattate con iodio all’inizio della gravidanza (24) con conseguenti benefici
sullo sviluppo della progenie.
1. Zimmermann MB Iodine deficiency and
endemic cretinism. In: Braverman LE,
CooperDS EDS. Werner and Ingbar’s The
Thyroid: a fundamental and clinical text. 10th
ed. Philadelphia: Lippincott Williams and
Wilkins; 217-241.
2. Hetzel BS 1989 The story of iodine deficiency.
Oxford: Oxford University.
3. International Council for Control of Iodine
Deficiency Disorders 2008. UNICEF Report
2008. IDD Neswletter 30, no. 4.
4. Andersson M, Karumbunathan V, Zimmermann MB 2012 Global iodine status in 2011
and trends over the past decade. J Nutr 2012;
142:744-750.
5. Pearce EN, Andersson MA, Zimmermann
MB 2013 Global iodine nutrition: where do we
stand in 2013?. Thyroid 23:523-528.
6. Delange F 1994 The disorders induced by
iodine deficiency. Thyroid 4:107-128.
7. Zimmermann MB 2012 The effect of iodine
deficiency in pregnancy and infancy. Paedriatric
and Perinatal Epidemiology 26 (Suppl 1):108117.
8. Glinoer D 1994 The thyroid gland and pregnancy: iodine restriction and goitrogenesis
revealed. Thyroid Int 5:1-16.
9. Glinoer D 2004. The regulation of thyroid
function during normal pregnancy: importance
of the iodine nutrition status. Best Pract Res
Clin Endocrinol Metab 18:133-152.
10. Glinoer D, De Nayer P, Bourdoux P et al
E
,
3
1
© 20
CORREZIONE
DELLA CARENZA IODICA
È stato ampiamente documentato
che la correzione della carenza iodica
può prevenire il gozzo endemico e gli
altri disordini da carenza iodica, compresi quelli che si verificano durante
la gravidanza e nel periodo neonatale.
È stato dimostrato che un apporto
21
12.
13.
14.
15.
16.
BIBLIOGRAFIA
r
t
i
d
11.
17.
1990 Regulation of maternal thyroid during
pregnancy. J Clin Endocrinol Metab 71:276-287.
Crooks J, Tulloch MI, Turnbull AC,
Davidsson D, Skulason T, Snaedel G 1967
Comparative incidence of goiter in pregnancy
in Iceland and Scotland. Lancet 2: 625-627.
Bauch K, Meng W, Ulrich FE et al 1986
Thyroid status during pregnancy and post partum in regions of iodine deficiency and endemic goiter. Endocrinol Exp. 20:67-77.
Levy RP, Newman DM, Rejali LS, Barford
DA 1980 The myth of goiter in pregnancy. Am
J Obstet Gynecol 137:701-703.
Glinoer D, Lemone M, Bourdoux P et al
1992 Partial reversibility during late postpartum
of thyroid abnormalities associated with pregnancy. J Clin Endocrinol Metab 74:453-457.
Glinoer D, Lemone M 1992. Goiter and pregnancy: a new insight into an old problem.
Thyroid 2:65-70.
Glinoer D, Fernandez Soto M, Bourdoux P
et al 1991. Pregnancy in patients with mild thyroid abnormalities: maternal and neonatal repercussions. J Clin Endocrinol Metab 73:421-427.
Glinoer D, De Nayer P, Delange F et al 1995
A randomized trial for the treatment of mild
iodine deficiency during pregnancy: maternal
and neonatat effects. J Clin Endocrinol Metab
80:258-269.
Delange F, Bourdoux P, Laurance M, Peneva
L, Walfish P, Willgerodt H 1993 Neonatal
thyroid function in iodine deficiency. In:
Delange F, Dunn J, Glinoer D eds. Iodine deficiency in Europe. New York: Plenum Press; 199.
Glinoer D 1996 Maternal and neonatal thyroid
function in mild iodine deficiency. In: Nauman J,
Glinoer D, Braverman LE, Hostalek U eds. The
thyroid and iodine. Stuttgart: Schattauer; 129.
World Health Organisation (WHO) 2007
Assessment of Iodine Deficiency Disorders and
Monitoring their Elimination. 2nd ed. Geneva:
World Health Organisation.
Burrow GN, Dussault JH 1980 Neonatal
thyroid screening. New York: Raven Press.
Zimmermann MB 2009. Iodine deficiency.
Endocr Rev 30:376-408.
Chiovato L, Lapi P, Santini F et al 1994
Ipotiroidismo neonatale transitorio e carenza
iodica. Ann Ist Super Sanità 30:309.
Moleti M, Lo presti VP, Campolo MC et al
2008 Iodine prophylaxis using iodized salt and
risk of maternal thyroid failure in conditions of
mild iodine deficiency. J Clin Endocrinol
Metab 93:2616-2621.
K
e
ic
18.
19.
20.
21.
22.
23.
24.
s
i
t
ur
Vol. 14, Suppl. al n° 5, ottobre 2013
INTRODUZIONE
Nonostante i notevoli progressi
compiuti negli ultimi 20-30 anni
grazie alla implementazione di programmi di iodoprofilassi, la carenza
iodica rappresenta ancora oggi la più
importante causa di danno neurologico prevenibile.
Secondo le più recenti stime fornite dalla World Health Organization
(WHO) e dall’International Council
for the Control of Iodine Deficiency
Disorders (ICCIDD), l’apporto
nutrizionale di iodio risulta ancora
inadeguato in circa 30 degli oltre
150 paesi nel mondo di cui si dispone di dati nazionali/subnazionali (1).
Tale valutazione, basata sulla determinazione dell’escrezione urinaria di
iodio (EUI) in bambini e ragazzi in
età scolare, è verosimilmente sottostimata, e probabilmente destinata
ad attestarsi su valori più alti quando si disporrà dei risultati, ancora
limitati e frammentari relativi alle
singole fasce di popolazione (neonati, bambini, adolescenti, adulti,
donne in età fertile, donne in gravidanza). Questo problema è stato
oggetto di specifica valutazione da
parte di un gruppo di ricerca nordamericano, che ha dimostrato come,
all’interno di una medesima popolazione, lo stato di nutrizione iodica
sia tutt’altro che omogeneo: a fronte, infatti, di uno stato di assoluta
iodosufficienza documentato nei
bambini di 6-11 anni (mediana EUI
213 µg/l), nella sottopopolazione
delle donne in gravidanza l’apporto
nutrizionale di iodio risultava assolutamente subottimale (mediana
EUI 129 µg/l) (2). Tale discrepanza,
oltre a sottolineare l’inadeguatezza
delle valutazioni epidemiologiche
basate su dati non stratificati, rende
ragione della progressiva evoluzione
dello spettro dei disordini da carenza iodica. L’attenzione è, infatti,
oggi pressoché esclusivamente focalizzata su quelle che, per severità ed
irreversibilità, sono a diritto considerate le principali conseguenze del
1
0
©2
Carenza iodica
e sviluppo intellettivo
Francesco Vermiglio, Mariacarla Moleti, Francesco Trimarchi
Dipartimento di Medicina Clinica e Sperimentale, Università degli Studi di Messina
deficit nutrizionale di iodio, patogeneticamente correlate all’esposizione
alla carenza del micronutriente
durante la vita intrauterina.
FABBISOGNO IODICO
IN GRAVIDANZA E CONSEGUENZE
DELLA IODOCARENZA SULLA
FUNZIONE TIROIDEA MATERNA
E FETALE
K
e
ic
Come è noto, il fabbisogno iodico
non è costante nelle varie epoche
della vita, andando da un minimo di
90-130 µg/die nel lattante ad un
massimo di 250-300 µg/die nella
gestante e nel puerperio (3). L’esigenza di una maggiore disponibilità
di iodio durante la gravidanza è
fisiologicamente correlata ad almeno
quattro ordini di fattori:
- aumento del 50% e più della produzione di ormone tiroideo materno;
- aumento della clearance renale dello
iodio;
- desiodazione placentare delle iodotironine materne;
- trasferimento diretto di iodio inorganico all’unità feto-placentare.
Tutti gli eventi sopra citati concorrono al progressivo depauperamento del pool iodico materno che,
se non adeguatamente precostituito
e/o reintegrato durante la gravidanza, può, più o meno rapidamente,
diventare insufficiente a soddisfare
le esigenze funzionali della madre e
del feto.
In condizioni di restrizione iodica,
la tiroide materna va rapidamente
incontro ad una serie di modificazio-
E
,
3
r
t
i
d
ni adattative, in massima parte indipendenti dall’ormone tireotropo
(TSH), nel loro insieme finalizzate a
garantire una adeguata produzione
giornaliera di ormone tiroideo. Tali
modificazioni sono principalmente
rappresentate da incremento della
vascolarizzazione ghiandolare e della
captazione dello iodio, aumento in
altezza delle cellule follicolari e, non
ultimo, secrezione preferenziale di
triiodotironina (T3 ) rispetto alla
tiroxina (T4). Quest’ultimo evento si
traduce in una riduzione più o meno
marcata delle concentrazioni plasmatiche di T4, laddove quelle della
T3 si mantengono su livelli normali,
o persino aumentati, e tali sia da
garantire adeguate concentrazioni
intracellulari dell’ormone (eutiroidismo tissutale), sia da prevenire l’incremento soprafisiologico del TSH.
Tale condizione, caratterizzata da
bassi livelli di T4 libera ma normali
concentrazioni di TSH, è indicata in
letteratura come ipotiroxinemia isolata, ed è espressione di un compenso funzionale tiroideo alla inadeguata disponibilità di substrato per la
biosintesi ormonale. In condizioni
di esaltata richiesta funzionale, come
quella osservata durante la gravidanza, se la condizione di iodocarenza
non viene opportunamente corretta,
il meccanismo adattativo di secrezione preferenziale della T3 è destinato progressivamente a fallire, per
esaurimento dei depositi intratiroidei di iodio, e conseguente evoluzione biochimica e clinica verso l’ipotiroidismo conclamato. È da notare,
tuttavia, che i meccanismi di auto-
s
i
t
ur
Corrispondenza: Francesco Vermiglio, Azienda Ospedaliera Policlinico Universitario “G. Martino”, Via Consolare Valeria 1,
98125 Messina. E-mail: [email protected]
22
Carenza iodica e sviluppo intellettivo
regolazione tiroidea sopra descritti
valgono solo per la tiroide della
madre ma non per quella del feto,
dal momento che diventano operativi soltanto in epoca post-natale. Ne
consegue che, nelle condizioni di
insufficiente apporto iodico, mentre
la madre è esposta al rischio di ipotiroxinemia isolata, il feto è potenzialmente esposto al rischio di insufficienza funzionale tiroidea conclamata, le cui conseguenze sono tanto
più gravi quanto più precocemente
tale situazione si stabilisce (4).
Figura 1
Rappresentazione schematica delle fasi di sviluppo del sistema nervoso centrale del feto in relazione
con il contributo tiroideo tiroideo materno e fetale. T4: tiroxina; TSH: ormone tireo-stimolante; TRs: recettori per gli ormoni tiroidei. Modificata da (6).
1° Trimestre
2° Trimestre
14/40
3° Trimestre
28/40
Post-natale
Termine
6/12
Proliferazione neuronale
Inizio della migrazione neuronale
Corteccia
Ippocampo
Coclea
RUOLO DEGLI ORMONI TIROIDEI
SULLO SVILUPPO DEL SISTEMA
NERVOSO CENTRALE FETALE
Gli ormoni tiroidei sono essenziali per lo sviluppo del sistema nervoso centrale fetale (SNCf). A
seconda della severità, della durata
e dell’epoca di esposizione alla
carenza iodica durante le 40 settimane di gestazione, la compromissione della funzionalità tiroidea
materna e/o fetale può indurre
danni di entità variabile a carico
del SNCf, che esitano in fenotipi
estremamente eterogenei: dal cretinismo endemico, che rappresenta la
forma più severa di compromissione dello sviluppo cerebrale, ai
cosiddetti “disordini neurologici
minori” (5), caratterizzati da deficit
cognitivo-intellettivi meno gravi e
variamente associati a disturbi percettivo-motori (Tabella 1).
©2
01
Cervelletto
s
i
t
ur
Mielinizzazione
Proliferazione delle cellule gliali
K
e
ic
Formazione delle sinapsi
Migrazione/Arborizzazione di assoni e dendriti
0
0
0
Livelli di T4
(pmol/l)
E
,
3
r
t
i
d
Materni
Materni+Fetali
Espressione
dei TRs
Apo-TRs
TRs occupati
Formazione
della ghiandola
tiroidea
D3
Neonatali
Produzione degli
ormoni tiroidei
TSH fetale
1° Trimestre
D2
2° Trimestre
14/40
3° Trimestre
28/40
Post-natale
Termine
6/12
Tabella 1
Disordini neuromotori e intelletivi in nati da madri residenti in aree di carenza iodica lieve e moderata. Modificata da (5).
Regione
Test
Risultati principali
Spagna
Adattati localmente: Bayley, McCarthy, Cattell
Basso sviluppo psicomotorio e mentale
Bleichrodt, 1989
Italia (Sicilia)
Bender-Gestalt
Bassa capacità integrativa percettiva e
anomalie neuromuscolari e neurosensoriali
Vermiglio, 1990
Italia (Toscana)
Wechsler, Raven
Livelli inferiori di QI verbale, percezione,
attenzione e funzioni motorie
Fenzi, 1990
Italia (Toscana)
Tempo di reazione WISC
Velocità inferiore di risposta motoria
agli stimoli visivi
Vitti, 1992;
Aghini-Lombardi, 1995
India
Verbale, test di apprendimento figurati, test di motivazione
Capacità inferiore di apprendimento
Tiwari, 1996
Iran
Bender-Gestalt, Raven
Ritardo nello sviluppo psicomotorio
Azizi, 1993
23
Primo autore, data
FRANCESCO VERMIGLIO, ET AL.
Lo sviluppo del SNCf si articola in
tre fasi successive (6). La prima coincide con un momento molto precoce
della gestazione, ancor prima dell’inizio della sintesi degli ormoni tiroidei fetali. In questa fase, che si realizza quindi sotto il controllo esclusivo degli ormoni tiroidei materni, i
neuroni proliferano e migrano nella
corteccia cerebrale, nell’ippocampo e
nell’eminenza mediana. Nella seconda fase, che va dall’inizio della
funzione tiroidea fetale (12a-13a settimana) fino al termine della gravidanza, si completano la neurogenesi
e la migrazione neuronale, lo sviluppo assonale, l’arborizzazione dendritica, la sinaptogenesi, la differenziazione e migrazione della glia e l’inizio della mielinizzazione. Tali eventi
si realizzano sotto il controllo degli
ormoni tiroidei materni e degli
ormoni tiroidei del feto. La terza
fase, infine, quella che si compie
dopo la nascita e termina intorno al
primo anno di vita, è sotto il controllo esclusivo degli ormoni di origine neonatale (Figura 1).
Numerosi studi sperimentali sul
ratto hanno dimostrato come l’insufficienza funzionale tiroidea materna
e fetale provochi profonde alterazioni della proliferazione, migrazione e
maturazione neuronale, e dei meccanismi di mielinogenesi, sinaptogenesi e di regolazione della neurotrasmissione (4).
La T4 attraversa la barriera ematoencefalica grazie allo specifico trasportatore degli ormoni tiroidei
OATP1c1, ampiamente espresso dalle
cellule endoteliali di tutto il SNCf. La
T4, inoltre, raggiunge il liquido cerebrospinale attraverso il plesso corioideo, che esprime, oltre all’OATP1c1,
anche l’MCT8, che promuove il trasporto dell’ormone nei taniciti ependimali che rivestono il terzo ventricolo. Una volta all’interno del SNCf, la
T4 viene trasferita negli astrociti,
dove viene successivamente convertita
in T3 dalla desiodasi di tipo 2 (D2), il
cui pattern di espressione è quantitativamente e cronologicamente differente nelle varie aree cerebrali. La T3
generata negli astrociti viene quindi
trasferita con meccanismo non anco-
1
0
©2
ra conosciuto all’esterno della cellula
e trasportata successivamente dall’MCT8 all’interno del neurone, che,
possedendo il corredo recettoriale
nucleare specifico per la T3, costituisce il vero bersaglio dell’azione ormonale (6) (Figura 2). Il neurone rappresenta anche la sede di metabolizzazione della T3 da parte della desiodasi di
tipo 3 (D3), la cui espressione spaziale
e temporale, analogamente a quella
della D2, è ontogeneticamente regolata per modulare la biodisponibilità
locale di ormone in relazione al programma differenziativo delle diverse
aree cerebrali (7).
Differenti isoforme dei recettori per
gli ormoni tiroidei (TRs) sono espresse a livello della corteccia cerebrale
embrionale sin dalla 9a settimana, e la
loro espressione aumenta di circa 10
volte da tale epoca e fino alla 18a settimana. Tali recettori vennero originariamente identificati da Bernal, che
E
,
3
r
t
i
d
dimostrò anche come l’occupazione
recettoriale da parte della T3 fosse
dell’ordine del 25-30% alla 18a-20a
settimana, con ciò dimostrando come
gli effetti biologici dell’ormone si
espletassero già durante il primo trimestre della gravidanza umana (8, 9).
In epoca successiva, il pattern ontogenetico umano di diverse isoforme del
gene del TR è stato delucidato da
altri autori. Iskaros e coll. hanno
descritto l’espressione delle isoforme
TRβ1, TRα1 e c-erbA1α2 in campioni cerebrali umani di sole 8 settimane, con una predominanza dell’isoforma TR1α1, la cui espressione
aumenta molto rapidamente fino alla
14a settimana (10).
Oltre agli effetti genomici della
T3, la T4 e la rT3 regolano la polimerizzazione dell’actina, evento
determinante per la migrazione neuronale. Gli effetti actina-correlati
comprendono lo sviluppo di neuriti
K
e
ic
s
i
t
ur
Figura 2
Trasporto, internalizzazione e metabolismo degli ormoni tiroidei a livello del sistema nervoso centrale
del feto. Si veda il testo per le abbreviazioni. Modificata da (6).
T4
OATP1c1
T4
T3
nel sangue
Endotelio
OATP1c1
?
T4
T4
T3
D2
CP
MCT8
Astrocita
T3
?
T3
TR
Neurone
T4
T4
MCT8
D2
Astrocita
T3
T3
MCT8
T3
D3
T2
CSF
T3
Tanicita
24
Carenza iodica e sviluppo intellettivo
e l’adesione delle cellule a substrati
contenenti laminina. Un’isoforma
troncata del TRα1 media, a livello
citoplasmatico, l’azione dell’ormone
tiroideo sul citoscheletro (11).
Studi sperimentali sistematici condotti negli ultimi 30 anni dal gruppo
di Gabriella Morreale de Escobar
hanno inoltre dimostrato che: a) la
biodisponibilità di T3 per la neuroembriogenesi è funzione delle concentrazioni di T4 di origine materna nel
primo trimestre e materno/fetale a
partire dal secondo trimestre di gravidanza (12); b) le concentrazioni di T4
nei liquidi fetali (liquido amniotico,
extracelomatico, circolazione fetale) in
una fase precedente l’inizio della funzione tiroidea fetale sono tali da risultare biologicamente rilevanti (13); c)
l’ipotiroxinemia materna durante le
prime fasi dello sviluppo cerebrale
(primo trimestre di gravidanza), qualunque ne sia la causa (inadeguato
apporto nutrizionale di iodio o patologia autoimmune), può indurre sovvertimento della citoarchitettura della
corteccia cerebrale per profonde alterazioni dei meccanismi di migrazione
neuronale (14). Analoghe alterazioni
citoarchitetturali della corteccia sono
state descritte nell’uomo, e caratteristicamente associate ad autismo. Quest’ultima condizione è stata recentemente messa in relazione con l’ipotiroxinemia materna severa in epoca
gestazionale precoce (15).
In sintesi, la T3 è necessaria per lo
sviluppo della corteccia cerebrale
durante la prima metà della gravidanza, quando la T4 materna costituisce
il solo substrato disponibile per la
desiodazione ad ormone biologicamente attivo. Altrettanto importante
è il ruolo svolto dalla D2 e dalla D3
nel determinare la biodisponibilità
locale della T3 durante la vita fetale;
nell’insieme, l’attività delle due desiodasi è modulata, nelle varie fasi dello
sviluppo cerebrale, per garantire sufficienti concentrazioni di T3 a partire
dalla T4 ma, al tempo stesso, per proteggere differenti aree cerebrali da
una concentrazione eccessiva (o
intempestiva) di T3, finché l’attività
di tale ormone non sia richiesta per la
differenziazione tissutale.
1
0
©2
25
CONSEGUENZE DELLA
IODOCARENZA SULLO SVILUPPO
NEUROINTELLETTIVO
L’ipotesi che la gravità del danno
neuropsicomotorio sia correlata con
la severità e la durata della carenza
iodica deriva da due principali considerazioni: a) nelle regioni del
mondo in cui sono stati introdotti
programmi di profilassi iodica e laddove l’apporto nutrizionale di iodio
è migliorato a seguito della progressiva urbanizzazione e della implementazione della grande distribuzione alimentare (profilassi iodica
silente), il cretinismo endemico è
completamente scomparso; b) nelle
aree caratterizzate da carenza iodica
moderato-lieve vengono descritti
esclusivamente disordini neurologici
minori, espressione, questi ultimi,
di alterazioni più sottili dello sviluppo del SNCf. L’attenuazione del
fenotipo neurologico correlata con il
miglioramento dello stato di nutrizione iodica è stata documentata dal
nostro gruppo di ricerca in una serie
di studi condotti in un’area della
Sicilia Nord-Orientale. Nell’arco
temporale di circa 30 anni, parallelamente alla progressiva scomparsa
in questi territori del cretinismo
endemico, si è assistito all’individuazione di un fenotipo neurologico
meno severo, ma certamente più
subdolo perché non immediatamente percepibile, diffuso a larghi strati
della popolazione scolare e per questo definito deficit cognitivo endemico (ECD). Tale condizione, caratterizzata da alterazione delle capacità
visive, percettivo-motorie e integrative, veniva riscontrata nel 14% dei
bambini in età scolare residenti nell’area iodocarente contro il 3,5%
della popolazione di controllo. I
bambini affetti, peraltro considerati
assolutamente normali da genitori,
insegnanti e medici di famiglia, presentavano, inoltre, difetti neurosensoriali e muscolari e un quoziente
intellettivo (QI) <90 nel 95% di
essi (16). L’evidenza che questi bambini, tanto alla nascita quanto al
momento della valutazione, fossero
perfettamente eutiroidei suggerì l’ipotesi che il danno neurologico del
E
,
3
r
t
i
d
bambino fosse il risultato di una
insufficienza funzionale della tiroide
materna secondaria alla carenza iodica. Tale ipotesi è stata oggetto di
uno studio prospettico successivo
dal quale emerse come circa il 70%
dei bambini nati da madri iodocarenti (la cui funzione tiroidea era
stata monitorata nella prima metà
della gravidanza) risultasse affetto
da deficit dell’attenzione e iperattività (ADHD) e come esistesse una
correlazione significativa tra livelli
di tiroxinemia materna e QI dei
bambini. Quest’ultimo risultava 11
punti più basso nei bambini con
ADHD rispetto a quelli non affetti
e ben 22 punti più basso rispetto ai
bambini del gruppo di controllo
iodosufficienti. L’evidenza che quasi
il 90% delle madri con ipotiroxinemia isolata avesse generato bambini
affetti da ADHD fornisce per la
prima volta la prova dell’esistenza di
una relazione diretta tra deficit funzionale tiroideo materno (anche
lieve) da iodocarenza lieve-moderata
e danno neurologico nei nati (17).
Gli effetti dell’esposizione a vari
gradi di deficit nutrizionale di iodio
e della iodosupplementazione in
gravidanza sullo sviluppo intellettivo di bambini di età ≤5 anni sono
stati oggetto di una metanalisi di
recentissima pubblicazione, nella
quale sono analizzati i risultati di 10
studi d’intervento e di 14 studi
osservazionali pubblicati tra il 1980
ed il 2011. I risultati di tali studi
dimostrano come il QI nei nati da
madri rese iodosufficienti prima e/o
durante la gravidanza sia più alto,
mediamente, di 7-8 punti rispetto a
quello dei nati da madri persistentemente iodocarenti. Il dato forse più
interessante che emerge da questa
metanalisi è, tuttavia, quello relativo all’efficacia della supplementazione iodica in relazione con l’epoca in
cui la stessa viene intrapresa.
Complessivamente, emerge come la
precocità dell’intervento di iodoprofilassi (pre-gestazionale o gestazionale precoce) sia associata ad un
effetto massimale in termini di
“guadagno” sul QI, laddove l’efficacia non appare significativa quando
K
e
ic
s
i
t
ur
FRANCESCO VERMIGLIO, ET AL.
Figura 3
Outcome neurocognitivo in nati da madri con diverso apporto nutrizionale di iodio nel 1° trimestre di
gravidanza (19).
6.
7.
113
QI totale
QI verbale
110
107
104
p=0,002
<50
50-100
150
Accuratezza nella lettura
108
107
106
105
104
103
102
101
p=0,06
<50
50-100
150
Rapporto iodio/creatinina (µg/g)
materno nel primo trimestre
© 20
,
3
1
la correzione della iodocarenza
venga effettuata in epoca gestazionale più tardiva (18). Tali risultati
appaiono sostanzialmente in linea
con quelli di un ulteriore studio
(19), non compreso nella citata
metanalisi perché di pubblicazione
immediatamente successiva, che, in
aggiunta, dimostra come il rischio
di compromissione dell’outcome
cognitivo non sia confinato ai nati
da madri con più severa iodocarenza
(EUI <50 µg/l) ma sia presente
anche nei nati da madri lievemente/moderatamente iodocarenti (EUI
50-150 µg/l) e come il QI totale dei
bambini sia direttamente correlato
con lo stato di nutrizione iodica
delle loro madri nel primo trimestre
di gravidanza (Figura 3). Quest’ultimo studio, condotto su una popolazione di gravide del Regno Unito,
paese tradizionalmente considerato
iodosufficiente, pone ulteriormente
Comprensione nella lettura
101
110
109
108
107
106
105
104
103
102
101
8.
9.
p=0,04
<50
50-100
150
10.
104
103
102
11.
101
100
K
e
ic
12.
99
98
97
Ed
itr
hypothyroxinemia on the progeny. Thyroid
10:871-887.
Williams GR 2008 Neurodevelopmental and
neurophysiological actions of thyroid hormone.
J Neuroendocrinol 20:784-794.
Bianco AC, Salvatore D, Gereben B, Berry
MJ, Larsen PR 2002 Biochemistry, cellular
and molecular biology, and physiological roles
of the iodothyronine selenodeiodinases Endocr
Rev 23:38-89.
Bernal J, Pekonen F 1984 Ontogenesis of the
nuclear 3,5,3'-triiodothyronine receptor in the
human fetal brain. Endocrinology 114:677679.
Ferreiro B, Bernal J, Goodyer CG,
Branchard CL 1988 Estimation of nuclear
thyroid hormone receptor saturation in human
fetal brain and lung during early gestation. J
Clin Endocrinol Metab 67:853-856.
Iskaros J, Pickard M, Evans I, Sinha A,
Hardiman P, Ekins R 2000 Thyroid hormone
receptor gene expression in first trimester
human fetal brain. J Clin Endocrinol Metab
85:2620-26233.
Cheng SY, Leonard JL, Davis PJ 2010
Molecular aspects of thyroid hormone actions
Endocr Rev 31:139-170.
Contempre B, Jauniaux E, Calvo R, Jurkovic D, Campbell S, de Escobar GM 1993
Detection of thyroid hormones in human
embryonic cavities during the first trimester of
pregnancy. J Clin Endocrinol Metab 77:17191722.
Calvo RM, Jauniaux E, Gulbis B et al 2002
Fetal tissues are exposed to biologically relevant
free thyroxine concentrations during early phases of development. J Clin Endocrinol Metab
87:1768-1777.
Lavado-Autric R, Auso E, Garcia-Velasco
JV et al 2003 Early maternal hypothyroxinemia alters histogenesis and cerebral cortex
cytoarchitecture of the progeny. J Clin Invest
111:1073-1082.
Román GC, Ghassabian A, BongersSchokking JJ et al 2013 Association of gestational maternal hypothyroxinemia and
increased autism risk. Ann Neurol. Aug 13 doi:
10.1002/ana.23976 [Epub ahead of print]
Vermiglio F, Sidoti M, Finocchiaro MD
1990 Defective neutomotor and cognitive ability in iodine-deficient schoolchildren of an
endemic goiter region in Sicily. J Clin
Endocrinol Metab 70:379-384.
Vermiglio F, Lo Presti VP, Moleti M 2004
Attention Deficit and Hyperactivity Disorders
in the offspring of mothers exposed to mildmoderate iodine deficiency: a possible novel
iodine deficiency disorder in developed countries. J Clin Endocrinol Metab 89:6054-6060.
Bougma K, Aboud FE, Harding KB,
Marquis GS 2013 Iodine and mental development of children 5 years old and under: a systematic review and meta-analysis. Nutrients
5:1384-1416.
Bath SC, Steer CD, Golding J, Emmet P,
Rayman MP 2013 Effect of inadequate iodine
status in UK pregnant women on cognitive
outcomes in their children: results from the
Avon Longitudinal Study of Parents and
Children (ALSPAC). Lancet 382:331-337.
p=0,04
<50
50-100
150
Rapporto iodio/creatinina (µg/g)
materno nel primo trimestre
13.
14.
l’accento sulla necessità di attuazione di sistematiche verifiche territoriali dello stato di nutrizione iodica,
con particolare enfasi a quelle fasce
di popolazione maggiormente vulnerabili, come le donne in età fertile
e le gestanti.
15.
16.
BIBLIOGRAFIA
1. Pearce EN, Andersson M, Zimmermann
MB 2013 Global iodine nutrition: where do we
stand in 2013?. Thyroid 23:523-528.
2. Caldwell KL, PanY, Mortensen ME, Makhmudov A , Merrill L, Moye J 2013 Iodine status in pregnant women in the National
Children’s Study and in U.S. women (15-44
years), NHANES 2005-2010. Thyroid 23:927937.
3. Zimmermann MB 2009 Iodine deficiency.
Endocr Rev 30:376-408.
4. Morreale de Escobar G, Obregon MJ,
Escobar del Rey F 2004 Role of thyroid hormone during early brain development. Eur J
Endocrinol 151 (Suppl 3):U25-U37.
5. Glinoer D, Delange F 2000 The potential
repercussions of maternal, fetal, and neonatal
17.
18.
19.
s
i
t
ur
26
Vol. 14, Suppl. al n° 5, ottobre 2013
INTRODUZIONE
Con il termine di gozzo non tossico si indica un aumento di volume
della tiroide non riferibile a processi
flogistici o neoplastici e non associato ad ipertiroidismo o ipotiroidismo. Il gozzo non tossico può essere
endemico, sporadico e familiare.
Queste forme sono indistinguibili
sul piano clinico e anatomo-patologico e differiscono per il diverso
peso svolto da fattori ambientali e
genetici nella loro patogenesi. Il
gozzo si definisce endemico quando
è presente in più del 5% della popolazione giovanile di un’area geografica ed è dovuto ad un insufficiente
apporto alimentare di iodio. Il gozzo
sporadico si manifesta in soggetti
residenti in aree a sufficiente apporto iodico. Il gozzo familiare è causato da mutazioni di geni coinvolti
nel metabolismo degli ormoni tiroidei, trasmesse come carattere autosomico recessivo.
Il gozzo è una patologia cronica
che evolve nel tempo e si presenta
in forme cliniche diverse nelle
diverse fasi della vita. Ha il suo inizio durante l’adolescenza o la
pubertà, quando in molti ragazzi e
ragazze può essere riscontrato un
minimo ingrandimento diffuso
della ghiandola tiroidea, che rappresenta una risposta fisiologica ai
complessi cambiamenti ormonali
che si verificano in questa fase della
vita. Il gozzo adolescenziale di solito regredisce. Con il passare del
tempo il gozzo diventa nodulare e
progressivamente acquisisce la capacità di secernere ormoni tiroidei
indipendentemente dalla regolazione da parte dell’ormone tireotropo
(thyroid stimulating hormone: TSH).
Questa condizione viene definita di
autonomia funzionale ed è caratterizzata dal riscontro di livelli sierici
di TSH ridotto in presenza di normali valori di ormoni tiroidei. La
fase di autonomia funzionale può
persistere in modo asintomatico per
diversi anni, ma alla fine la tiroide
1
0
©2
Carenza iodica
e gozzo nodulare
Massimo Tonacchera1, Fabio Orlandi2, Paolo Vitti1
Dipartimento di Medicina Clinica e Sperimentale, Università degli Studi di Pisa;
2
Dipartimento di Scienze Cliniche e Biologiche, Università degli Studi di Torino
1
diventa francamente iperfunzionante. Questa successione di eventi è
stata ben definita nelle aree di endemia gozzigena, dove la carenza di
iodio nell’alimentazione rappresenta
il principale fattore ambientale
responsabile della comparsa del
gozzo in soggetti geneticamente
predisposti. Sul piano clinico le
forme di tireotossicosi conseguenti
all’evoluzione dell’autonomia tiroidea vengono distinte in gozzo multinodulare tossico (GMT) ed adenoma tossico.
E
,
3
r
t
i
d
nomia funzionale ed alla fine il
GMT. Un modello che spiega complessivamente l’evoluzione verso
l’autonomia funzionale e l’ipertiroidismo è stato proposto da Studer,
che ha dimostrato l’esistenza di
noduli di origine monoclonale e
policlonali nella stessa ghiandola
multinodulare (3-5). Le cellule epiteliali che costituiscono i follicoli
tiroidei sono policlonali e possiedono diverse potenzialità di crescita e
diversa capacità di sintesi degli
ormoni tiroidei. Conseguentemente,
vi è una certa eterogeneità di crescita e di funzione all’interno della
ghiandola tiroidea e anche all’interno di un singolo follicolo. In modelli animali di iperplasia tiroidea
indotta dalla deplezione di iodio (6,
7) è stato dimostrato che durante la
formazione del gozzo si verifica una
notevole proliferazione dei tireociti
oltre che un aumento dell’attività
funzionale. Questi due eventi possono indurre mutazione nel DNA
genomico delle cellule tiroidee. È
infatti noto che la sintesi degli
ormoni tiroidei richiede la produzione di H2O2 (8) con conseguente formazione di radicali liberi che possono danneggiare il DNA e l’alto tasso
di replicazione cellulare riscontrato
nel gozzo impedisce la riparazione
di tali mutazioni. La comparsa di
mutazioni che conferiscono un vantaggio di crescita (ad esempio le
mutazioni del recettore del TSH)
favorisce la crescita focale (Figura 1).
Pertanto, noduli tiroidei funzionalmente autonomi si possono svilup-
K
e
ic
PATOGENESI
La prima teoria completa sullo sviluppo del gozzo multinodulare è
stato proposta da Marine (1) e successivamente confermata da Taylor
(2). La carenza di iodio può portare
ad un aumento della secrezione di
TSH che determina una iperplasia
della tiroide (gozzo). Successivamente la tiroide entra in un fase di
relativa quiescenza, caratterizzata
dall’accumulo di colloide all’interno
dei follicoli, condizione definita sul
piano istologico di gozzo colloide.
Marine ha ipotizzato che la ripetizione di queste due fasi determinerebbe alla fine la formazione di un
gozzo multinodulare (1). Quando il
gozzo si è sviluppato, i livelli sierici
di TSH e di ormoni tiroidei sono
nella norma e in questa fase il gozzo
multinodulare viene definito normofunzionante o non tossico (gozzo
multinodulare non tossico: GMNT).
Successivamente si sviluppa l’auto-
s
i
t
ur
Corrispondenza: Massimo Tonacchera, Dipartimento di Medicina Clinica e Sperimentale, Università degli Studi di Pisa, Via
Paradisa 2, 56124 Pisa. E-mail: [email protected]
27
MASSIMO TONACCHERA, ET AL.
Figura 1
Storia naturale del gozzo in accordo con l’ipotesi di Studer. La comparsa di mutazioni che conferiscono
un vantaggio di crescita [ad esempio le mutazioni del recettore dell’ormone tireotropo (TSH)] favorisce
la proliferazione di cloni cellulari meno sensibili all’azione del TSH sul controllo della capacitá proliferative e funzionali delle cellule tiroidee. Il progressivo aumento di noduli tiroidei funzionalmente autonomi, in grado cioè di secernere ormoni tiroidei indipendentemente dalla regolazione del TSH, determina
la comparsa dell’autonomia funzionale e la successiva evoluzione verso l’ipertiroidismo franco.
TSH
Normale secrezione ormoni tiroidei
Secrezione ormonale autonoma
I
II
III
IV
Eutiroidismo
K
e
ic
V
Ipertiroidismo
E
,
3
pare da cloni cellulari che contengono una mutazione “vantaggiosa”,
come dimostrato dalla presenza di
mutazioni attivanti il recettore del
TSH in microscopiche aree “calde”
nel contesto del GMNT (9, 10).
1
0
©2
r
t
i
d
s
i
t
ur
Figura 2
Prevalenza del gozzo diffuso e nodulare in un paese della Basilicata, caratterizzato da carenza iodica di
lunga durata. Sono stati esaminati 1.411 soggetti residenti, valutati mediante studio ecografico della tiroide ed esami di funzione tiroidea. La prevalenza del gozzo aumenta con il progredire dell’età. Il gozzo
diffuso è presente in circa il 30% dei soggetti giovani adulti e progressivamente aumenta con l’età. I
noduli tiroidei non sono presenti nei bambini, sono rari nei soggetti di età compresa tra 15 e 25 anni, ed
aumentano progressivamente fino all’età di 65 anni.
STORIA NATURALE
60
50
Gozzo diffuso
Gozzo nodulare
40
%
La carenza iodica svolge un ruolo
rilevante nell’evoluzione del gozzo
nodulare verso l’autonomia funzionale e la tireotossicosi. In diversi paesi è
stata infatti dimostrata una riduzione
dell’incidenza di GMT dopo l’istituzione e l’attuazione della profilassi
iodica (11). Il ruolo dell’apporto
iodico è stato anche valutato mettendo a confronto l’incidenza dei diversi
tipi di ipertiroidismo in una regione
con basso apporto iodico (Jutland,
regione della Danimarca) con un
paese con adeguato apporto di iodio
come l’Islanda (12). L’incidenza dell’ipertiroidismo è risultata essere
significativamente più alta nello
Jutland (38,7/100.000 all’anno) che
in Islanda (23,6/100.000 all’anno).
Nella zona di basso apporto di iodio,
il GMT è stata la causa più comune
di ipertiroidismo, mentre tale patologia era infrequente in Islanda, dove il
morbo di Basedow risultava essere la
causa dominante di ipertiroidismo.
Anche la distribuzione dei nuovi casi
di ipertiroidismo in rapporto all’età
dei pazienti è risultata diversa tra le
due regioni. In Islanda, la maggior
parte dei casi di ipertiroidismo è stata
osservata in persone di età 20-60
anni. Il paziente tipico era una giovane donna con morbo di Basedow.
Nello Jutland, invece, il picco di
ipertiroidismo era presente nei soggetti anziani ed il paziente tipico era
una donna anziana con GMT.
Studi condotti in una popolazione
dell’Italia meridionale, con carenza
iodica medio-lieve, hanno confermato un rapporto stretto tra la durata
della carenza iodica e lo sviluppo di
gozzo nodulare, autonomia funzionale e ipertiroidismo (13). In un paese
della Basilicata, caratterizzato da
carenza iodica di lunga durata, sono
30
20
10
0
15-25
26-35
36-45
46-55
Età (anni)
56-65
66-75
>75
28
Carenza iodica e gozzo nodulare
Figura 3
Prevalenza di autonomia funzionale tiroidea in un paese della Basilicata, caratterizzato da carenza iodica
di lunga durata. La prevalenza dell’autonomia funzionale aumenta progressivamente con l’età, passando
dallo 0,7% nei soggetti di età inferore ai 20 anni al 15,4 % nei soggetti di età superiore ai 75 anni.
15
10
%
stati esaminati 1.411 soggetti residenti, valutati mediante studio ecografico della tiroide ed esami di funzione tiroidea. La prevalenza di
gozzo nodulare, autonomia funzionale tiroidea ed ipertiroidismo aumentava con il progredire dell’età. I
noduli tiroidei non erano presenti
nei bambini, erano rari nei soggetti
di età compresa tra 15 e 25 anni, ed
aumentavano progressivamente fino
all’età di 65 anni, per poi diminuire
successivamente (Figura 2). La prevalenza di autonomia funzionale
tiroidea aumentava progressivamente
dallo 0,7% nei soggetti sotto i 20
anni al 15,4 % nei soggetti sopra i
75 anni (Figura 3). Questa prevalenza di ipertiroidismo subclinico è nettamente superiore a quella riscontrata nelle aree iodosufficienti.
L’autonomia funzionale tiroidea era
osservata più frequentemente nel
gozzo nodulare (21,2%) che nel
gozzo diffuso (6,4%). Anche la prevalenza di ipertiroidismo clinicamente manifesto (ormoni tiroidei al
di sopra della norma) era circa il
doppio di quella riscontrata in aree
iodosufficienti (14) e non presentava
una maggior frequenza nel sesso
femminile rispetto a quello maschile, a differenza di quanto si osserva
nel morbo di Basedow.
Questi dati indicano che, nella sua
storia naturale, il gozzo nodulare
evolve gradualmente e lentamente
verso l’autonomia funzionale ed infine verso la tireotossicosi franca.
5
K
e
c
i
r
t
i
d
E
,
3
1
0
©2
0
<14
15-25
26-35
36-45 46-55
Età (anni)
ALTRI FATTORI AMBIENTALI
IMPLICATI NELLA PATOGENESI
DEL GOZZO NODULARE
Altri fattori ambientali proposti
quali fattori di rischio per lo sviluppo
di gozzo nodulare sono la presenza di
sostanze presenti nell’alimentazione
che interferiscono con il metabolismo
dello iodio (sostanze gozzigene, oggi
definite interferenti endocrini), il
fumo di sigaretta, e l’incremento del
peso corporeo.
Tabella 1
Sostanze gozzigene naturali che possono interferire con il corretto meccanismo di sintesi degli
ormoni tiroidei.
Sostanza gozzigena
Miglio, soia
Manioca di patata dolce,
sorgo comune
Noce di cocco
Crucifere
(cavolo, cavolfiore, broccoli, rape)
Alghe marine (fuco)
29
Agente
Azione
Flavonoidi
Inibizione della tireoperossidasi
Glucosidi cianogenici
metabolizzati a tiocianati
Inibizione della captazione
tiroidea dello iodio
Flavonoidi
Inibizione della tireoperossidasi
Glucosinolati
Danneggiamento della captazione
tiroidea dello iodio
Eccesso di iodio
Inibizione del rilascio
degli ormoni tiroidei
s
i
t
ur
56-65
66-75
>75
Alcuni pazienti possono sviluppare
il gozzo per sostanze gozzigene presenti nella dieta o all’assunzione di
farmaci (14). La spiegazione degli
effetti dovuti a tali sostanze è che
interferiscono con il corretto meccanismo di sintesi degli ormoni tiroidei.
Nella Tabella 1 sono indicate diverse
sostanze gozzigene naturali. Anche la
carenza di ferro e selenio dovuta a
malnutrizione, quando associata ad
un basso apporto nutrizionale di
iodio, può alterare la sintesi degli
ormoni tiroidei ed indurre ingrandimento della tiroide. L’impatto del
fumo come concausa di gozzo è dovuto all’aumento della concentrazione
sierica di tiocianati che derivano
dalla combustione del fumo di sigaretta. I tiocianati possono avere un
effetto inibente la captazione dello
iodio a livello della cellula follicolare
tiroidea. Ovviamente in aree dove la
popolazione è esposta ad una grave
carenza iodica una contaminazione di
tiocianati da fumo ha un effetto maggiore sullo sviluppo del gozzo. Studi
recenti hanno mostrato un incremento del volume della tiroide nei soggetti obesi rispetto ai controlli.
MASSIMO TONACCHERA, ET AL.
DIFETTI DI GENI IMPLICATI
NELLA SINTESI ORMONALE
Difetti in geni che giocano un
ruolo importante nella fisiologia
tiroidea e nella sintesi ormonale possono determinare disormonogenesi
con ipotiroidismo e trasformazione
nodulare della tiroide. Nel caso di
difetti gravi in omozigosi dei geni
che codificano per la tireoglobulina,
la tireoperossidasi, il trasportatore
sodio/iodio, la pendrina, la iodotirosina deiodinasi ed il gene dell’ossidasi
tiroidea si può sviluppare gozzo e
ipotiroidismo.
Negli ultimi 50 anni sono stati
descritti numerosi difetti genetici in
ogni tappa della sintesi degli ormoni
tiroidei. Se non diagnosticata alla
nascita, la diminuita sintesi degli
ormoni tiroidei può risultare in un’elevata secrezione di TSH ed un gozzo
dapprima diffuso e poi a carattere
nodulare (Tabella 2). Difetti minori
degli stessi geni coinvolti nell’ormonogenesi con compromissione funzionale meno severa, dovuti a
varianti alleliche, possono essere
canditati per lo sviluppo del gozzo
1
0
©2
nodulare non tossico, specialmente
in casi di apporto iodico al limite
inferiore o insufficiente.
Una forte predisposizione genetica
è stata dimostrata da studi familiari
e sui gemelli (15). Bambini nati da
genitori con gozzo hanno un rischio
significativamente più alto di sviluppare il gozzo rispetto a bambini
nati da genitori senza gozzo. Anche
la più alta concordanza nei gemelli
monozigoti che in quelli dizigoti
suggerisce una forte predisposizione
genetica (16). Il gozzo è più diffuso
nel genere femminile, e questo
potrebbe essere dovuto ad una differente genetica o all’influenza degli
ormoni steroidei femminili. Evidenze sperimentali dimostrano che l’estradiolo può provocare la crescita di
cellule tiroidee in vitro o può amplificare la crescita di cellule tiroidee
indotte da altri fattori di crescita. La
maggior parte dei gozzi familiari
mostra un modello di ereditarietà
autosomico dominante, indicando
difetti genetici predominanti.
Interazioni tra geni o meccanismi
poligenici (ad esempio effetti di
E
,
3
r
t
i
d
varianti alleliche e polimorfismi)
possono aumentare la complessità
patogenetica del gozzo ed offrono
una spiegazione per questa eterogeneità genetica (14).
MUTAZIONI GENETICHE
NEI NODULI FUNZIONANTI
La frequenza delle mutazioni del
gene del recettore del TSH nei
pazienti affetti da adenoma tossico
o gozzo nodulare tossico riportata
in letteratura è variabile soprattutto
in rapporto alla regione geografica
studiata. Uno dei primi studi eseguiti in Italia, ha dimostrato che il
73% degli adenomi tossici aveva
mutazioni attivanti del gene del
recettore del TSH (17). Risultati
analoghi sono stati pubblicati da
vari autori negli adenomi tossici di
pazienti residenti in aree di moderata endemia gozzigena dell’Europa, ed in particolare in Belgio,
Germania, Spagna e Grecia, ed in
Brasile. Studi eseguiti in Giappone
e in USA, aree dove la popolazione
è alimentata con una dieta sufficiente di iodio, non hanno rilevato
mutazioni del recettore del TSH
(18), anche se uno studio recente di
pazienti giapponesi con adenoma
tossico ha mostrato mutazioni del
gene del recettore del TSH nel 40%
dei casi (18%).
Le mutazioni del gene del recettore del TSH sono state caratterizzate
in vitro mediante studi funzionali
(17). Dopo espressione nelle cellule
eucariote tali mutazioni sono capaci
di attivare in maniera costitutiva l’adenosina monofosfato ciclico
(AMPc) e alcuni di questi recettori
mutati determinano attivazione
della via degli inositoli (17).
È tuttavia molto probabile che le
mutazioni del gene del recettore del
TSH non siano sufficienti a spiegare
la patogenesi di tutti gli adenomi
tossici della tiroide. Sappiamo che
altre cause possono essere rappresentate da mutazioni attivanti della
proteina Gs, mentre fino ad oggi
non sono state riscontrate mutazioni
in altre proteine regolatrici la produzione di AMPc.
K
e
ic
Tabella 2
Difetti in geni che giocano un ruolo importante nella fisiologia tiroidea e nella sintesi ormonale, che
possono determinare disormonogenesi con ipotiroidismo e trasformazione nodulare della tiroide.
Difetti del trasporto dello iodio
Alterazioni del NIS. Mutazioni inattivanti (autosomiche recessive)
Difetti nel processo
di iodinazione enzimatica
Assenza parziale o completa dell’attività della TPO. Apporto
insufficiente di H2O2. Mutazioni del gene della TPO e del gene
DUOX 2: inserzioni, slittamento del modulo di lettura, codoni di
stop (autosomiche recessive)
Sindrome di Pendred
Mutazioni inattivanti del gene PDS. Ipotiroidismo conclamato o
subclinico, gozzo e sordità neurosensoriale (autosomiche recessive)
Anomalie del gene della tireoglobulina
Difetti nell’organificazione dello iodio dovuti a difetti della tireoglobulina. Mutazioni nei siti di splicing donatori, stop prematuro
dello splicing, mutazioni nonsenso (autosomiche recessive)
Alterazione del riciclo dello iodio
Eccessiva secrezione renale dello iodio sotto forma di MIT e DIT.
Difetti molecolari (mutazioni del gene DEHAL 1)
Risposta ridotta dei tessuti bersaglio
agli ormoni tiroidei
Resistenza agli ormoni tiroidei. Gozzo, ipo- ed ipertiroidismo di
grado variabile, livelli sierici elevati di FT3, FT4 e TSH. Mutazioni
puntiformi, delezioni slittamenti del modulo di lettura (sporadiche,
di solito autosomiche dominanti) del recettore ormone tiroideo
NIS: trasportatore sodio/iodio; TPO: tireoperossidasi; DUOX: gene che codifica ossidasi tiroidea; PDS: gene che codifica pendrina; DEHAL 1: gene che codifica iodotirosina deiodinasi; MIT: monoiodotirosina; DIT: diiodotirosina; FT3: triiodotironina libera; FT4: tiroxina libera; TSH: ormone tireotropo.
s
i
t
ur
30
Carenza iodica e gozzo nodulare
MANIFESTAZIONI CLINICHE
DEL GOZZO
Le uniche manifestazioni cliniche
del gozzo semplice (o normofunzionante) sono quelle legate all’aumento di volume della tiroide (19).
Raramente il gozzo è causa di sintomatologia locale, e generalmente
è ben tollerato, anche se di grosse
dimensioni.
Gozzi di notevoli dimensioni, che
possono comprimere la trachea, l’esofago, e vasi del collo, possono essere
associati a sintomi e segni tra cui
stridore inspiratorio, disfagia, e sensazione di soffocamento. Questi sintomi ostruttivi possono essere accentuati dalla cosiddetta manovra
Pemberton. Questa consiste nel sollevare entrambe le braccia fino a toccare i bordi del capo. In questo modo si
determina una riduzione dello spazio
cervico-mediastinico ed un aumento
della pressione intratoracica. In presenza di gozzi di grosse dimensioni si
assiste ad una distensione delle vene
giugulari anteriori e laterali per compressione da parte della tiroide sulla
vena cava superiore.
L’interessamento del nervo laringeo ricorrente, con comparsa di raucedine, potrebbe suggerire la presenza di un carcinoma tiroideo, sebbene anche la paralisi delle corde
vocali possa, se pur raramente, risultare da gozzo nodulare benigno.
Le variazioni di dimensioni della
tiroide sono un evento lento e progressivo e solo occasionalmente,
all’interno dei noduli, possono verificarsi fenomeni di tipo emorragico
che si associano a bruschi aumenti
di dimensioni della formazione
nodulare, talora accompagnati da
sintomatologia di tipo doloroso o ad
accentuazione e/o comparsa dei sintomi ostruttivi.
1
0
©2
E
,
3
VALUTAZIONE DEL GOZZO
La valutazione clinica del gozzo si
basa su un’accurata storia clinica, su
un preciso esame obiettivo, con particolare riguardo alla tiroide, al collo
ed alle strutture adiacenti, ed infine
su una valutazione dello stato metabolico del paziente.
31
È importante stabilire da quanto
tempo il gozzo è presente: patologie
di lunga durata indicano un carattere
maggiormente benigno di quelle che
compaiono in modo repentino o che
bruscamente modificano il loro comportamento clinico.
Occorre ottenere informazioni
circa i farmaci eventualmente utilizzati dal paziente, indagando in particolare quelli per i quali è nota
un’azione gozzigena o che contengano iodio.
L’associazione con una ghiandola
dolente può suggerire la presenza di
una tiroidite subacuta, mentre la
comparsa di un’improvvisa tumefazione con eventuale dolore è suggestiva per una emorragia (cisti emorragiche).
La storia familiare è importante: la
comparsa di gozzo in età adulta deve
far propendere per la diagnosi di
gozzo da carenza iodica o per una
tiroidite, mentre se presente dall’infanzia è possibile che il quadro sia
dovuto a grave deficienza iodica o
difetti dell’ormonogenesi.
Lo stato metabolico del paziente
deve essere valutato attraverso precise domande, anche se, nella maggior
parte dei casi, il gozzo si presenta
con eutiroidismo.
I sintomi di ipotiroidismo (sonnolenza, astenia, affaticabilità) sono
vaghi e a lenta insorgenza, tanto che
possono essere confusi con la sintomatologia aspecifica dovuta all’età
del paziente. Analogamente, anche
ansia, nervosismo, palpitazioni, calo
ponderale e sudorazione, che si osservano nell’ipertiroidismo, sono sintomi aspecifici che possono anche essere causati da un concomitante disordine di tipo emotivo.
Alla presenza di gozzo spesso i
pazienti associano una serie di
disturbi generali, che tuttavia, ad
una valutazione attenta, risultano
non legati direttamente alla malattia tiroidea.
Per effettuare un corretto esame
obiettivo del collo, il paziente deve
essere seduto in una stanza ben illuminata, meglio se di fronte ad una
finestra. Il medico deve prestare
attenzione, oltre che alle dimensioni
r
t
i
d
della tiroide, alla sua consistenza,
alla presenza di noduli, ed alle loro
caratteristiche di consistenza e motilità, alla presenza ed alle caratteristiche dei linfonodi laterocervicali. In
condizioni normali la tiroide non è
visibile, neanche invitando il
paziente a distendere il collo.
La motilità durante la deglutizione consente di distinguere la tiroide
dagli altri tessuti del collo, tuttavia
la motilità può essere persa in presenza di gozzi di notevoli dimensioni, o in caso di tiroidite di Riedel e
di carcinomi infiltranti.
Durante la palpazione del collo
l’esaminatore deve valutare il profilo
della ghiandola tiroidea e stabilire i
limiti dei lobi laterali. La tiroide
normale, alla palpazione, si presenta
soffice e gommosa, e le dimensioni
dei lobi non devono superare quelle
della falange terminale del pollice
dell’individuo in esame.
La consistenza della ghiandola
varia in base al tipo di patologia
associata al gozzo. In presenza di
tiroiditi o di recenti emorragie la
ghiandola è di consistenza aumentata, mentre una consistenza notevolmente aumentata o lignea si osserva
in caso di carcinoma infiltrante o
tiroidite di Riedel. Il lobo piramidale è presente in caso di aumenti
di volume diffusi della ghiandola, e
va distinto dai linfonodi paratracheali.
Un soffio e/o un fremito vascolare
si possono apprezzare in caso di ipertiroidismo da morbo di Basedow.
Altre strutture del collo possono
essere coinvolte nella patologia tiroidea. In presenza di gozzo, soprattutto se di grosse dimensioni e con
interessamento mediastinico, si possono avere compressione e deviazione della trachea, con comparsa di
dispnea e stridore inspiratorio. Voce
rauca si osserva in caso di stiramento
del nervo ricorrente, e va confermata
con la laringoscopia. Nei pazienti
con voluminosi gozzi retrosternali,
la compressione dei vasi del collo
può essere causa di fenomeni di stasi
venosa, facilmente evidenziabili con
il segno di Pemberton.
La palpazione evidenzia la presen-
K
e
ic
s
i
t
ur
MASSIMO TONACCHERA, ET AL.
za di noduli, che richiede l’accertamento della natura degli stessi.
Noduli di consistenza aumentata,
aderenti alle strutture circostanti ed
in associazione con linfoadenopatia
devono far sospettare un carcinoma.
Tuttavia, l’introduzione dell’ecografia nella pratica clinica ha profondamente modificato l’approccio al
paziente con malattie della tiroide
(19). L’esame ecografico fornisce un
utilissimo complemento all’esame
clinico. L’ecografia permette una
misura oggettiva delle dimensioni
di un gozzo e definisce i caratteri di
noduli tiroidei palpabili; mette in
evidenza noduli non palpabili e permette di selezionare quelli da sottoporre ad agoaspirazione. La possibilità di disporre di una misura precisa delle dimensioni della tiroide
(volume in ml, piuttosto che classi
di gozzo stimate con la palpazione)
ha permesso di usare i dati ottenuti
con l’ecografia come parametri
essenziali di definizione del grado di
carenza iodica anche lieve e per
valutare gli effetti della iodoprofilassi. Il volume tiroideo nei ragazzi
in età scolare è infatti uno degli
indicatori di carenza. L’ecografia
permette anche di rilevare la presenza di noduli di piccole dimensioni e
non palpabili, e di selezionare quelli
che meritano di essere sottoposti ad
agoaspirazione per la presenza di
caratteri ecografici sospetti di malignità. L’impiego dell’ecografia nell’aspirazione con ago sottile ha contribuito notevolmente a garantire un
prelievo idoneo nel caso di noduli di
piccole dimensioni o posizionati
posteriormente e quindi non palpabili e nei noduli misti consentendo
un campionamento adeguato della
parte solida del nodulo. L’ecografia
riveste un ruolo fondamentale nello
studio dei linfonodi, in quanto è
possibile distinguere un linfonodo
infiammatorio che ha un aspetto
omogeneo, forma ovale, un ilo evidenziabile sotto forma di una stria
iperecogena centrale da un linfonodo sede di metastasi che è rotondeggiante, senza ilo e con struttura
disomogenea. Il riscontro nel siero
di elevati valori di calcitonina deve
©2
01
far pensare alla presenza di un carcinoma midollare della tiroide.
L’esame citologico di materiale ottenuto tramite aspirazione con ago
sottile del nodulo consente di porre
diagnosi di carcinoma papillifero o
anaplastico, mentre in caso di neoplasie follicolari non è possibile
distinguere, con il solo agoaspirato,
tra forme benigne o maligne.
È inoltre opportuno valutare se
l’aumento di volume della tiroide, ed
in particolare del nodulo, causi coinvolgimento delle strutture adiacenti.
A tal fine è utile praticare una radiografia diretta del collo per trachea
per valutarne la compressione o la
dislocazione, mentre immagini
meno penetranti possono indicare la
presenza di calcificazioni intratiroidee. In caso di gozzi di notevoli
dimensioni, soprattutto nelle fasi di
valutazione pre-operatoria, può essere utile eseguire una tomografia
assiale computerizzata o una risonanza magnetica del collo e mediastino.
E
,
3
r
t
i
d
multinodulare. Gli esami di laboratorio rilevano un ipertiroidismo di
solito non particolarmente grave. Gli
anticorpi anti-recettore del TSH
(causa dell’ipertiroidismo nei pazienti con morbo di Basedow) sono negativi, mentre possono essere presenti
anticorpi anti-tireoglobulina e antitireoperossidasi a basso titolo, espressione di una tiroidite focale che spesso accompagna il gozzo di vecchia
data. La scintigrafia mostra una
ghiandola di dimensioni aumentate
e la distribuzione del tracciante
radioattivo appare disomogenea per
la presenza di aree ipocaptanti e ipercaptanti. All’ecografia si rileva un
ingrandimento della ghiandola con
marcata disomogeneità, presenza di
noduli multipli, spesso con margini
non ben definiti, con lacune e calcificazioni grossolane.
Il trattamento con tionamidi non
porta ad una risoluzione permanente
dell’ipertiroidismo. Il loro uso è
indicato per ripristinare le condizioni di eutiroidismo, mentre il trattamento definitivo prevede la somministrazione di radioiodio o l’intervento di tiroidectomia. Il tipo di
trattamento definitivo è legato alle
dimensioni del gozzo, alla presenza
o meno di noduli sospetti per neoplasia maligna, alle condizioni generali ed alla presenza di patologie
associate che controindichino l’intervento di tiroidectomia. In generale il trattamento con radioiodio è
indicato nella maggior parte dei
pazienti che presentano un gozzo
nodulare che non determini fenomeni compressivi, per i quali è necessario l’intervento di tiroidectomia.
Una discussione a parte merita il
trattamento dell’autonomia funzionale che determina un quadro di ipertiroidismo “subclinico” caratterizzato
dal riscontro di valori di TSH indosabili in presenza di normali valori di
ormoni tiroidei. È stata riportata in
letteratura un’aumentata incidenza di
fibrillazione atriale (20) e mortalità
per patologie cardiovascolari (20) nei
soggetti con ipertiroidismo subclinico, soprattutto in quelli di età superiore a 60 anni, e di osteopenia/osteoporosi in donne in post-
K
e
ic
EVOLUZIONE CLINICA
DEL GOZZO NODULARE
Nella maggior parte dei casi il
gozzo nodulare cresce gradualmente
e risulta asintomatico per un lungo
periodo. L’evoluzione verso l’autonomia funzionale avviene gradualmente e l’ipertiroidismo si manifesta
solitamente nelle persone anziane. Il
GMT, infatti, è la forma di ipertiroidismo più frequente nell’età medioavanzata, soprattutto nelle aree
caratterizzate da carenza iodica (12).
L’ipertiroidismo nell’anziano è difficile da diagnosticare, in quanto è
spesso paucisintomatico e le manifestazioni cliniche sono più sfumate di
quelle osservati nel giovane. I
pazienti presentano un gozzo da
molto tempo, che può determinare
sintomi da compressione tracheale o
esofagea. Frequentemente sono presenti disturbi che coinvolgono l’apparato cardiovascolare quali tachicardia, fibrillazione atriale e scompenso cardiaco (20). Spesso i pazienti
riferiscono una progressiva perdita di
peso asintomatica. All’esame obiettivo si rileva presenza di un gozzo
s
i
t
ur
32
Carenza iodica e gozzo nodulare
menopausa (20). Pertanto le forme di
ipertiroidismo subclinico associate a
gozzo richiedono quasi sempre un
trattamento. In effetti nelle zone di
carenza iodica la prevalenza del gozzo
nodulare con autonomia funzionale
raggiunge il 14,5% nei soggetti di
età superiore ai 60 anni (20) ed in
questa fascia di età il rischio di comparsa di fibrillazione atriale è più elevato ed il trattamento dell’ipertiroidismo subclinico deve essere sempre
considerato con attenzione.
BIBLIOGRAFIA
1. Marine D 1924 Etiology and prevention of
simple goiter. Medicine 3:453-479.
2. Taylor S 1953 The evolution of nodular goiter.
J Clin Endocrinol Metab 13:1232-1247.
3. Derwahl M, Studer H 2001 Nodular goiter
and goiter nodules: where iodine deficiency falls
short of explaining the facts. Exp Clin
Endocrinol Diabetes 109:250-260.
4. Studer H, Peter HJ, Gerber H 1989 Natural
heterogeneity of thyroid cells: the basis for
understanding thyroid function and nodular
growth. Endocr Rev 10:125-135.
1
0
©2
33
5. Peter JH, Gerber, Studer H, Smeds S 1985
Pathogenesis of heterogeneity in human
multinodular goiter. J Clin Invest 76:19922002.
6. Many MC, Denef JF, Hamudi S 1986 Effects
of iodide and thyroxine on iodine-deficient
mouse thyroid: a morphological and functional
study J Endocrinol 110:203-210.
7. Samuels MH 2001 Evaluation and treatment
of sporadic nontoxic goiter-some answers and
more questions. J Clin Endocrinol Metab
86:994-997.
8. Raspe E, Dumont JE 1995 Tonic modulation
of dog thyrocyte H2O2 generation and I-uptake
by thyrotropin through the cyclic adenosine
3’,5’-monophosphate cascade. Endocrinology
136:965-973.
9. Krohn K, Wohlgemuth S, Geber H et al 2000
Hot microscopic areas of iodine deficient euthyroid goiter contain constitutively activating TSH
receptor mutations. J Pathol 192:37-42.
10. Krohn K, Paschke R 2001 Progress in understanding the etiology of thyroid autonomy. J
Clin Endocrinol Metab 86:3336-3345.
11. Baltisberger BL, Minder CE, Burgi H 1995
Decrease of incidence of toxic nodular goiter in
a region of Switzerland after full correction of
mild iodine deficiency. Eur J Endocrinol
132:546-549.
12. Lauberg P, Pedersen KM, Hreidarsson A et
al 1998 Iodine intake and the pattern of thyroid disorders: a comparative epidemiological-
E
,
3
r
t
i
d
13.
14.
15.
16.
17.
18.
study of thyroid abnormalities in the elderly in
Iceland and in Jutland, Denmark. J Clin
Endocrinol Metab 83:765-769.
Aghini-Lombardi F, Antonangeli L, Martino
E et al 1999 The spectrum of thyroid disorders in
an iodine-deficient community: the Pescopagano
survey. J Clin Endocrinol Metab 84:561-566.
Medeiros-Neto G, Knobel M 2010 Iodine
deficiency disorders. In: de Groot LJ, Jameson JL
eds. Endocrinology. 6th ed. New York: Elsevier.
Brix TH, Kyvik KO, Hegedus L 1999 Major
role of genes in the etiology of simple goiter in
females: a population-based twin study. J Clin
Endocrinol Metab 84:3071-3075.
Hegedus L, Bonnema SJ, Bennedbek FN
2003 Management of simple nodular goiter:
current status and fature perspectives. Endocr
Rev 24:102-132.
Tonacchera M, Chiovato L, Pinchera A, et al
1998 Hyperfunctioning thyroid nodules in toxic
multinodular goiter share activating thyrotropin
receptor mutations with solitary toxic adenoma.
J Clin Endocrinol Metab 83:492-498.
Krohn K, Führer D, Bayer Y et al 2005
Molecular pathogenesis of euthyroid and toxic
multinodular goiter. Endocr Rev 26:504-524.
Tonacchera M, Pinchera A, Vitti P 2010
Assessment of Nodular Goiter. Best Pract Res
Clin Endocrinol Metab 24:51-61.
Biondi B, Cooper DS 2008 The clinical significance of subclinical thyroid dysfunction.
Endocr Rev 29:76-131
K
e
ic
19.
20.
s
i
t
ur
Vol. 14, Suppl. al n° 5, ottobre 2013
INTRODUZIONE
La regola aurea della Medicina
“prevenire è meglio che curare” vale
anche per il gozzo endemico e le
altre conseguenze della carenza
nutrizionale di iodio. La correzione
della carenza alimentare di iodio è
in grado di prevenire il gozzo endemico e la sua evoluzione nodulare
(1, 2). La prevenzione del gozzo
endemico si basa principalmente
sull’incremento dell’apporto quotidiano di iodio alla popolazione (1,
2). Sfortunatamente, nonostante la
ben dimostrata efficacia dello iodio e
la disponibilità di metodi per la
supplementazione iodica, il gozzo
endemico e gli altri disordini da
carenza iodica – primi su tutti gli
effetti sullo sviluppo cerebrale
durante la vita fetale e nei primi
anni di sviluppo – non sono stati
eradicati non solo nei paesi in via di
sviluppo ma anche nei paesi industrializzati. La causa principale di
questo insuccesso è che la profilassi
iodica non è solo un problema tecnico o medico, ma dipende molto da
fattori sociali, politici, legali e organizzativi.
Diversi sono i metodi utilizzabili
per la correzione della carenza nutrizionale di iodio (Tabella 1). La scelta
del metodo più idoneo dipende in
prima istanza da alcuni fattori logistici:
- orografia dell’area iodocarente;
- fattori socio-economici;
- cooperazione delle autorità sanitarie locali;
- capacità e risorse organizzative
locali;
- livello d’informazione.
Tutti questi fattori devono essere
considerati al momento della scelta
del metodo di iodoprofilassi. D’altra
parte, ogni metodo deve osservare le
seguenti caratteristiche:
- efficacia: il metodo scelto deve
assicurare un’adeguata quantità di
iodio in una forma chimica tale
che, una volta introdotta nell’organismo, possa essere utilizzata dalla
©2
01
Profilassi iodica:
attualità e prospettive
Massimo Tonacchera, Gianfranco Fenzi, Paolo Vitti
Dipartimento di Medicina Clinica e Sperimentale, Università degli Studi di Pisa
tiroide per la sintesi degli ormoni
tiroidei;
- sicurezza: ogni possibile complicanza deve essere minima, facilmente controllabile ed accettabile
alla luce del beneficio sostanziale e
generale;
- praticabilità: il metodo prescelto
deve essere adatto alle caratteristiche socio-economiche della popolazione dell’area endemica;
- basso costo: è necessario che il programma scelto abbia un favorevole
rapporto costo/beneficio.
Qualunque sia il metodo prescelto, la profilassi iodica – per essere
efficace – deve essere estesa a tutta
la popolazione e non a gruppi selezionati.
E
,
3
r
t
i
d
fattori possono condizionare l’effettiva
concentrazione di iodio nel sale: provenienza e qualità del sale, conservazione e modalità di confezionamento.
Numerosi composti iodati, con
caratteristiche chimico-fisiche diverse possono essere utilizzati nella
iodoprofilassi (Tabella 2). Lo ioduro
di potassio (KI) e lo iodato di potassio (KIO3) sono i più comunemente
utilizzati per la iodazione del sale. Il
KI è più economico ma meno stabile. Il KIO3 è molto più stabile e resistente all’evaporazione. La quantità
di iodio da aggiungere al sale dipende dalla quantità media di sale consumata pro capite dalla popolazione.
K
e
ic
METODI DI IODOPROFILASSI
IODOPROFILASSI CON SALE
FORTIFICATO CON IODIO
Il metodo più semplice ed economico per incrementare l’apporto iodico
giornaliero consiste nell’uso di sale
arricchito con iodio nell’alimentazione quotidiana. Il sale, assunto quotidianamente in piccole quantità, rappresenta il veicolo ideale per la somministrazione di iodio ed è il metodo
di iodoprofilassi più utilizzato nei
paesi industrializzati che dispongono
di reti adeguate di distribuzione. Le
tecniche di iodazione del sale sono
semplici, ben standardizzate e di
basso costo. Inoltre, le caratteristiche
organolettiche del sale da cucina e da
tavola arricchito in iodio non sono
alterate ed il prodotto è generalmente
ben accetto dal consumatore. Molti
s
i
t
ur
SICUREZZA DEL SALE
FORTIFICATO CON IODIO
La profilassi con sale arricchito con
iodio si è dimostrata un metodo
Tabella 1
Diversi metodi di profilassi iodica. La scelta del
metodo è in rapporto alle caratteristiche del
paese, alla distribuzione della popolazione e
alle condizioni socio-economiche.
Sale fortificato con iodio (ioduro/iodato)
Olio iodato (orale o parenterale: sottocute,
intramuscolare)
Iodazione delle acque potabili
Aggiunta di iodio al pane (panificazione)
Iodazione delle acque di irrigazione
Arricchimento in iodio dei mangimi animali
Arricchimento in iodio dei vegetali edibili
Corrispondenza: Massimo Tonacchera, Dipartimento di Medicina Clinica e Sperimentale, Università degli Studi di Pisa,
Via Paradisa 2, 56124 Pisa. E-mail: [email protected]
34
Profilassi iodica: attualità e prospettive
Tabella 2
I diversi composti iodati utilizzati per la iodoprofilassi, le rispettive formule ed il loro contenuto di
iodio. Modificata da: Lange’s Handbook of Chemistry. 6a ed. 1944. New York: McGraw-Hill, Inc.
Composto
Formula
Iodio (%)
I2
100
Ioduro di calcio
CaI2
86,5
Iodato di calcio
Ca(IO3)
65
Iodio
Ioduro di potassio
KI
76,5
Iodato di potassio
KIO3
59,5
Ioduro di sodio
NaI
85
Iodato di sodio
NaIO3
64
molto efficace in tutti i paesi nei
quali è stata adottata e si è rivelata,
a regime, priva di effetti collaterali.
Nella fase iniziale e in presenza di
carenza iodica di grave e di lunga
durata, si è registrato un transitorio
incremento di nuovi casi di ipertiroidismo dovuti all’emergere di stati
di ipertiroidismo latente. In realtà, a
lungo termine, la profilassi iodica
riduce la frequenza dell’ipertiroidismo, che nelle aree di carenza iodica
è doppia rispetto a quelle riscontrate
nei paesi con adeguato apporto iodico. Una maggiore suscettibilità allo
sviluppo di autoimmunità tiroidea,
probabilmente conseguente all’azione immunogenica dello iodio, è
stata documentata in molti studi
sperimentali nell’animale ed in
molti studi epidemiologici (3, 4)
condotti dopo l’attuazione di programmi di iodoprofilassi (4).
Quest’ultimo rilievo – osservato
anche nella recente indagine condotta a Pescopagano – non costituisce
un evento particolarmente rilevante
sul piano clinico anche perché limitato all’aumento dei casi di tiroidite
autoimmune (ma non di morbo di
Basedow), a fronte dell’indubbio
vantaggio dell’eradicazione del
gozzo e dell’evoluzione verso l’autonomia funzionale confermata dalla
riduzione dei casi di ipertiroidismo
non autoimmune (3).
Recentemente, al fine di ridurre
l’impatto che l’eccessivo consumo
di sale sull’alimentazione esercita
sulla salute e in particolare sull’i-
1
0
©2
35
pertensione arteriosa e sulle malattie cardiovascolari (5), è stata lanciata una forte campagna per ridurne drasticamente il consumo.
Questo provvedimento non contrasta di per sé con il principio e l’esigenza di iodoprofilassi, ma può
richiedere un adeguamento della
concentrazione di iodio nel sale
arricchito in misura adeguata a
compensare la riduzione del consumo globale di sale per via diretta
(sale aggiunto direttamente al cibo)
o indiretta (sale presente negli alimenti preconfezionati) (6-8).
E
,
3
r
t
i
d
tuata correttamente, non comporta
alcuna complicanza locale.
Una singola somministrazione
orale assicura una quantità adeguata
di iodio per 1-2 anni. La somministrazione orale è molto meno efficace, perché, a differenza dalla somministrazione parenterale, viene meno
l’accumulo intramuscolare o sottocutaneo di iodio.
Il prodotto più utilizzato è il
Lipiodol Ultrafluid (38% di iodio o
480 mg/cc) prodotto dal Laboratorio
Guerbet Aulnay sous Bous Cedex,
France. Una fiala da 10 ml costa
4.400 sterline.
K
e
ic
METODI ALTERNATIVI
DI IODOPROFILASSI
IODOPROFILASSI CON OLIO IODATO
Questo metodo di profilassi iodica
è particolarmente indicato nei paesi
in via di sviluppo e con ampia
dispersione della popolazione sui
territori di grande estensione raggiungibili con difficoltà.
L’olio iodato, disponibile in fiale
da 10 ml, è stabile e non richiede
conservazione in ambiente refrigerato. Può essere somministrato per
via parenterale intramuscolare, sottocutanea od orale. La preparazione
più largamente usato è il Lipiodol®
(1 ml contiene 480 mg di iodio).
Una singola iniezione intramuscolare o sottocutanea di 0,5-1,0 ml
protegge dagli effetti della carenza
iodica per un periodo di tempo che
va da 3 a 5 anni. L’iniezione non è
particolarmente dolorosa e, se effet-
s
i
t
ur
IODAZIONE DELLE ACQUE POTABILI
Lo iodio aggiunto direttamente
all’acqua potabile rappresenta un
metodo efficace di iodoprofilassi ed
è in grado di correggere la carenza
iodica. In questo caso lo iodio è
aggiunto all’acqua sottoforma di I2
KI o KIO 3 , in quantità tali da
garantire un introito giornaliero di
150 µg. Il costo di questa tecnica è
stato stimato in 64 sterline/persona/anno. La iodazione dell’acqua
potabile, come mezzo per assicurare un adeguato apporto di iodio
alla popolazione, è stata sperimentata con successo in zone più o
meno limitate, ma non si è dimostrata vantaggiosa sul piano economico e organizzativo rispetto alla
iodoproflassi con sale arricchito di
iodio (9).
In Europa il sistema di iodazione
dell’acqua è disponibile rivolgendosi
alla ditta Rhone-Poulenc Rorer
(Francia).
AGGIUNTA DI IODIO
NELLA PANIFICAZIONE
L’utilizzo dello iodio come conservante nell’industria alimentare ed in
particolare nella panificazione, introdotta negli Stati Uniti sin dal 1921,
ha prodotto un significativo incremento dell’escrezione urinaria di
iodio. L’aggiunta di iodato o di ioduro di potassio nella panificazione è
stata attuata in Tasmania (1964) ed
in Olanda (1968).
MASSIMO TONACCHERA, ET AL.
In Tasmania, il monitoraggio
della iodoprofilassi mediante pane
iodato ha indicato che questa
modalità di iodoprofilassi, il cui
costo è contenuto, è molto efficace.
Tuttavia, il sempre minor consumo
di pane e la grande diversificazione
di questo prodotto ne hanno ridotto in maniera netta l’efficacia (10).
Un risultato simile è stato osservato in Belgio (11), dove la fortificazione con iodio del pane ha portato
ad un miglioramento dello stato di
nutrizione iodica nella popolazione
scolare.
ALTRI METODI ALTERNATIVI
DI IODOPROFILASSI
ARRICCHIMENTO IN IODIO
DEI MANGIMI ANIMALI
L’arricchimento di iodio del mangime animale è un metodo già sperimentato con successo nei paesi
scandinavi. Il latte e i prodotti
caseari provenienti da bovini, ovini
e caprini nutriti con mangimi arricchiti di iodio hanno un contenuto
di iodio proporzionale al grado di
arricchimento e, se consumati nelle
abituali quantità, possono di per sé
essere sufficienti a coprire buona
parte del fabbisogno giornaliero.
Essi hanno inoltre il vantaggio che
– essendo generalmente assunti
come tali, senza essere sottoposti a
cottura – non sono esposti al rischio
di evaporazione dello iodio che si ha
in varia misura con qualsiasi tipo di
cottura (12, 13).
1
0
©2
IL FUTURO DELLA
IODOPROFILASSI
ARRICCHIMENTO IN IODIO
DEI VEGETALI EDIBILI
Sono in corso programmi di
biofortificazione dei vegetali edibili
per favorire l’accumulo di maggiori
quantità di iodio da parte di alcune
piante quali pomodori, spinaci, carote, patate, lattuga (15). Con il termine di “biofortificazione” si intende la
supplementazione di microelementi
nella catena alimentare sfruttando le
capacità di assorbimento dei vegetali: si tratta di un sistema piuttosto
semplice e poco costoso per migliorare la nutrizione umana senza tuttavia implicare alcun cambiamento nei
regimi dietetici (15).
E
,
3
IODAZIONE DELLE ACQUE
DI IRRIGAZIONE
La iodazione delle acque di irrigazione è una procedura molto complessa, che richiede un impegno
progettuale e finanziario di grande
rilevanza. Questa è stata attuata in
maniera estensiva in Cina, con l’obiettivo di correggere la carenza di
iodio all’origine della catena alimentare, arricchendo il suolo con questo
micronutriente e di conseguenza i
vegetali e gli animali che ne traggono direttamente o indirettamente il
nutrimento (14).
K
e
ic
IODIO E PIANTE SUPERIORI
Numerose indagini hanno dimostrato come la principale fonte di
iodio per gli uomini e gli animali
sia rappresentata dagli alimenti,
principalmente da quelli di origine
vegetale; tuttavia, mentre questo
elemento risulta essere essenziale
per la salute umana ed animale, il
suo ruolo nel metabolismo vegetale, ammesso che esista, non è ancora stato dimostrato. Nonostante gli
studi compiuti fin dagli inizi del
secolo scorso, non è stato infatti
ancora possibile trarre conclusioni
definitive circa gli effetti esercitati
dallo iodio sulla crescita delle piante; sembra invece che, pur essendo
assorbito dal suolo ed esercitando
effetti che, a seconda dei casi, possono essere positivi o negativi sullo
sviluppo e l’accrescimento, esso non
svolga alcuna funzione essenziale
all’interno della pianta.
L’assorbimento dello iodio da
parte delle piante dipende dalla
quantità e dalla forma di iodio che
è presente nel terreno a livello radicale. Nel suolo possono coesistere
entrambe le forme di I- e di IO3-,
con prevalenza del primo in condizioni riducenti, ad esempio in terreni allagati, e del secondo in condizioni ossidanti (16). Entrambe le
forme possono essere assorbite dalle
piante, anche se gli effetti sulla cre-
r
t
i
d
scita sono diversi a seconda delle
quantità, delle modalità di somministrazione, della specie vegetale
considerata e perfino del tessuto
vegetale analizzato. Non si possono
quindi trarre delle conclusioni
generali. Quello che si osserva più
comunemente è che le piante assorbono iodio in funzione di quella
che è la disponibilità nel terreno e
sembrano tollerare meglio maggiori livelli di IO3- che di I-, e che, in
generale, al di là della specie chimica, concentrazioni molto basse di
iodio (0,02-0,2 mg kg-1) stimolano
la crescita, soprattutto in specie
alofite. La maggiore tolleranza nei
confronti dell’IO 3 - può essere in
parte dovuta al fatto che esso viene
assorbito più lentamente dello I-;
con l’aumento della valenza e del
peso molecolare delle diverse specie
di iodio, infatti, diminuirebbe la
capacità della pianta di assorbirle; è
anche possibile che IO 3 - debba
essere ridotto a I- per essere assorbito (16).
All’interno della pianta, lo iodio
si ritrova principalmente a livello
radicale ed il trasporto verso la
parte aerea aumenta con l’aumentare della disponibilità dell’elemento
nel suolo ed avverrebbe prevalentemente per via xilematica, dal
momento che va ad interessare
soprattutto le foglie piuttosto che i
semi (16). È stato infine ipotizzato
che la tossicità dello iodio sia causata dall’inibizione dei processi
fotosintetici dovuta all’ossidazione
intracellulare di I- a I2 (15): da qui
anche la sua utilizzazione come
potente erbicida. I sintomi di fitotossicità da eccesso di iodio sono
rappresentati dall’imbrunimento
delle foglie più giovani e dalla clorosi di quelle più vecchie (15).
Alcuni studi effettuati negli ultimi anni hanno consentito di
aggiungere alcune importanti
informazioni riguardo la fisiologia
dello iodio nelle piante e i suoi
movimenti nel suolo. Sono state ad
esempio analizzate le dinamiche di
questo elemento nel sistema suolopianta utilizzando isotopi marcati:
è stato così messo in evidenza come
s
i
t
ur
36
Profilassi iodica: attualità e prospettive
soprattutto suoli a prevalente componente argillosa ed organica, ma
anche suoli sabbiosi, presentino
un’elevata capacità di ritenzione nei
confronti di I-, il quale viene solo
in piccola parte dilavato o perso per
processi di volatilizzazione, rimanendo invece localizzato principalmente negli strati superficiali del
terreno, dai quali può essere rilasciato in maniera lenta e stabile per
un certo periodo di tempo.
All’interno della pianta (nello studio è stato analizzato il cavolo cinese), le quantità dell’isotopo marcato
seguono la distribuzione: radice >
stelo > picciolo > foglia, e all’interno di quest’ultima l’accumulo di
iodio decresce dalle venature principali verso quelle secondarie fino
ai bordi esterni ed è maggiore in
foglie giovani piuttosto che in
foglie vecchie, suggerendo che il
trasferimento dello iodio all’interno
della pianta sia un processo passivo,
strettamente legato al movimento
dell’acqua e degli altri nutrienti.
Un altro interessante studio realizzato nella stessa specie ha messo in
evidenza come l’assorbimento dello
iodio sia più efficace quando esso
viene somministrato sotto forma di
IO3- piuttosto che nella forma di Ise la concentrazione è bassa (<0,5
mg l-1), mentre per concentrazioni
maggiori l’andamento è opposto. A
bassa concentrazione, inoltre, l’assorbimento dello iodio risulta essere più sensibile agli inibitori metabolici, suggerendo che i meccanismi di assorbimento possano essere
molteplici e passino da attivi a passivi con l’aumentare della concentrazione, soprattutto per la forma
IO3-. Infine, la maggior parte dello
iodio assorbito dalla pianta viene
intercettato e accumulato a livello
radicale, mentre quello trasportato
nella parte aerea sembra essere
accumulato selettivamente all’interno dei cloroplasti.
Sono state anche messe a confronto diverse fonti di iodio ed è stato
evidenziato come i fertilizzanti
inorganici come KI forniscano una
fonte di approvvigionamento più
immediata per la pianta ma anche
1
0
©2
37
più soggetta ad eventuali perdite
dal terreno per volatilizzazione e
più difficilmente gestibile nella
individuazione dei livelli più idonei
che favoriscano un buon accumulo
senza effetti fitotossici. Al contrario, la somministrazione di iodio in
forma organica, rappresentata da
alghe essiccate e mescolate a diatomite (polvere di diatomee + minerali argillosi, con elevata capacità di
adsorbimento), garantisce un rifornimento di iodio più lento, ma
anche più duraturo nel tempo e
meno soggetto a perdite per volatilizzazione e dilavamento.
Un altro aspetto da considerare è
anche la scoperta piuttosto recente
della capacità che hanno le piante, o
alcune piante, di produrre ed emettere nell’atmosfera metil alogenuri,
tra cui ioduro di metile (CH 3 I),
contribuendo sensibilmente al rilascio di composti alogenati volatili,
estremamente reattivi in numerosi
processi chimici che hanno luogo
nella stratosfera e nella troposfera.
Una produzione significativa di
CH3I da parte di piante di riso è
stata riportata per la prima volta in
uno studio del 1995. Nello stesso
anno, un’analisi effettuata su un
totale di 118 specie vegetali erbacee
ha messo in evidenza come sia piuttosto comune la produzione di
metil alogenuri e metantioli da
parte delle piante, mediante una
reazione catalizzata da una metiltransferasi identificata in ben 87
specie tra quelle analizzate.
L’attività dell’enzima è risultata
relativamente bassa in specie considerate tolleranti nei confronti della
salinità; attività molto alte sono
state invece riscontrate in specie
appartenenti alla famiglia delle
Brassicaceae, le quali risultano essere
spesso anche abbastanza resistenti
nei confronti degli erbicidi contenenti ioduro. Al contrario, nessuna
delle specie esaminate tra quelle
note per essere sensibili nei confronti dei cloruri (come soia, cotone e
vite) ha mostrato un’apprezzabile
attività dell’enzima. Queste metiltransferasi degli alogenuri e dei
bisolfuri potrebbero quindi fornire
E
,
3
r
t
i
d
un importante meccanismo per l’eliminazione degli alogenuri e degli
ioni HS - , che sono entrambi in
grado di esercitare effetti fitotossici.
Nella specie modello Arabidopsis
thaliana – il cui genoma, primo tra
quelli di tutte le piante superiori, è
stato interamente sequenziato –
sono stati identificati tre geni codificanti per enzimi appartenenti al
gruppo delle metiltransferasi degli
alogenuri; tali geni sono stati denominati “harmless to ozone layer”
(HOL), in quanto la loro perdita di
funzione renderebbe la pianta incapace di emettere nell’atmosfera
metil alogenuri gassosi e quindi la
renderebbe inoffensiva nei confronti
dello strato di ozono. L’espressione
di questi geni sarebbe ubiquitaria
nella pianta e presente durante l’intero ciclo di sviluppo.
K
e
ic
s
i
t
ur
BIOFORTIFICAZIONE
Dal momento che le piante sono
in grado di assorbire lo iodio presente nel terreno e di accumularlo
(almeno in parte) nei loro diversi
tessuti, e poiché esse costituiscono
una parte rilevante della dieta sia
umana che animale, esse rappresentano sicuramente una delle principali fonti di iodio all’interno della
catena alimentare ed un arricchimento di questo elemento nei vegetali destinati all’alimentazione
sarebbe auspicabile per cercare di
ridurne le notevoli carenze che si
riscontrano a livello mondiale.
In un approccio di biofortificazione, per ottenere risultati significativi in termini di arricchimento in
iodio che non vadano però a scapito
della resa colturale e anche delle
qualità organolettiche dei vegetali
che vengono coltivati, è necessario
studiare in maniera approfondita la
fisiologia dell’elemento all’interno
della pianta, effettuare prove di tolleranza nei confronti delle diverse
forme dell’elemento che possono
essere somministrate e quindi assorbite mediante analisi delle curve di
crescita in funzione delle diverse
dosi, e infine identificare anche
quali sono gli organi o i tessuti in
MASSIMO TONACCHERA, ET AL.
Figura 1
Escrezione urinaria di iodio in 50 volontari sani che hanno consumato per 5 giorni alla settimana e per 2
settimane cibi vegetali arricchiti con iodio; i valori di ioduria pre-trattamento (basal) erano di 98 µg/l, che
incrementavano a 118 µg/l durante l’assunzione dei vegetali iodati (T1) e diminuivano a 85 µg dopo la
interruzione della somministrazione (PT). Modificata da Tonacchera et al, J Clin Endocrinol Metab 2013.
140
120
*
*
100
12
maniera significativa al miglioramento dello stato di nutrizione iodica dei soggetti trattati senza provocare effetti collaterali (Figura 1). In
nessuno dei volontari sottosposti a
tale tipo di dieta alimentare si è
verificato un eccessivo apporto di
iodio (20).
10
BIBLIOGRAFIA
8
80
6
60
4
40
2
20
0
K
e
ic
0
Basal
T1
E
,
3
cui l’elemento viene maggiormente
accumulato. Sperimentazioni effettuate con un approccio di questo
tipo in alcune specie vegetali hanno
portato a risultati anche molto
diversi tra loro. Una delle specie
più coltivate a livello mondiale è il
riso; uno studio pubblicato nel
1999 ha evidenziato come in questa
specie la maggior parte dello iodio
assorbito si accumuli nelle radici,
nello stelo e nelle foglie, e assai
poco riesca a raggiungere la granella (16). Di conseguenza, anche fornendo le concentrazioni di iodio
più alte, la quantità di questo elemento ricavabile dai semi è insufficiente per soddisfare la dose giornaliera raccomandata di 150 µg per
un individuo adulto. Questi risultati hanno indirizzato la ricerca verso
la biofortificazione di piante erbacee, in cui la foglia riesca ad accumulare maggiori quantità di iodio.
Risultati interessanti sono stati
ottenuti con lo spinacio, il quale, in
coltura idroponica ed in presenza di
una soluzione nutritiva contenente
una concentrazione di IO3- di 1 µM
(quantità che non esercita alcun
1
0
©2
PT
r
t
i
d
1. WHO, UNICEF, ICCIDD 1994 Indicators for
assessing iodine deficiency disorders and their
control through salt iodization. Geneva:
WHO/NUT/94.6.1994.
2. Filetti S, Trimarchi F 1995 Epidemiologia del
gozzo endemico in Italia. In:Pinchera A,
Salvatore G, Faglia G, Vigneri R eds Carenza
iodica e gozzo endemico in Italia. Napoli,
Milano: Mediserve; 32-39.
3. Aghini Lombardi F, Fiore E, Tonacchera M
et al 2013 The effect of voluntary iodine prophylaxis in a small rural community: the
Pescopagano survey 15 years later. J Clin
Endocrinol Metab 98:1031-1039.
4. Latrofa F, Fiore E, Rago T et al 2013 Iodine
contributes to thyroid autoimmunity in
humans by unmasking a cryptic epitope on thyroglobulin. J Clin Endocrinol Metab [Epub
ahead of print].
5. Soldin OP, Pearce EN, Stagnaro-Green A
2010 Dietary salt reductions and cardiovascular
disease. N Engl J Med 362:2224-2226.
6. Leclercq C. & Ferro-Luzzi A 1991 Total and
domestic consumption of salt and their determinants in three regions of Italy. Eur. J. Clin.
Nutr 45:151-159.
7. Vanderpas J 2006 Nutritional epidemiology
and thyroid hormone metabolism. Ann Rev
Nutr 26: 293-322
8. Haldimann M, Alt A, Blanc A, Bloundeau
K 2005 Iodine content of food groups. J Food
Comp Anal 8:171-217.
9. Squatrito S, Vigneri R, Runello F, Ermans
AM, Pollery RD, Ingbar SH 1986 Prevention
and treatment of endemic iodine-deficiency
goiter by iodination of a municipal water. J
Clin Endocrinol Metab 63:368-375.
10. Seal JA, Doyle Z, Burgess JR, Taylor R,
Cameron AR 2007 Iodine status of Tasmanian
following voluntary fortification of bread with
iodine. Med J Aust 186: 69-71.
11. Vandevijvere S, Mourri AB, Amsalkhir S,
Avni F, Van Oyen H, Moreno-Reyes R 2012
Fortification of bread with iodized salt corrected iodine deficiency in school-aged children,
but not in their mothers: a national cross-sectional survey in Belgium. Thyroid 22:10461053.
12. Dunn JT 2003 Iodine should be routinely
added to complementary food. J Nutr
133:3008S-3010S.
13. Varo P, Saari E, Paaso A, Koivistoinen P
1982 Iodine in Finish food. Interat J Vit Nutr
Res 52:80-89.
14. Cao XY, Jiang XM, Kareem A et al 1994
Iodination of irrigation water as a method of sup-
effetto negativo sulla crescita della
pianta), riesce ad accumulare circa 3
mg kg -1 di iodio su peso fresco,
quantità che è probabilmente sufficiente per soddisfare i fabbisogni
quotidiani di questo elemento (17).
Tra le varie specie vegetali quali
cavolo cinese, aglio, carota, sedano,
spinacio, quest’ultimo è particolarmente adatto per programmi di
biofortificazione per lo iodio, anche
quando coltivato su suolo (18). In
un recente approccio sperimentale
(19), il gene umano deputato al trasporto dello iodio della cellula follicolare tiroidea è stato introdotto in
una specie modello Arabidopsis thaliana ottenendo delle piante capaci
di accumulare lo iodio nel proprio
interno.
Vegetali arricchiti con iodio sono
attualmente presenti nel nostro mercato agroalimentare (20); in particolare l’industria si è specializzata
nella coltivazione di pomodori, carote, patate ed altri vegetali biofortificati con iodio. In uno studio recente
è stato dimostrato che la assunzione
giornaliera di questi vegetali arricchiti con iodio contribuisce in
s
i
t
ur
38
Profilassi iodica: attualità e prospettive
plying iodine to severely iodine-deficient population in Xinjiang, China. Lancet 344:107-110.
15. Perata P, Pecchioni N, Meriggi P et al 2005
Lo iodio nell’alimentazione umana ed il ruolo
delle colture erbacee. Agronomica 5: 47-53.
16. Mackoviak CL, Grossl PR 1999 Iodate and
iodide effects on iodine uptake and partitioning
in rice (Oryza sativa L.) grown in solution culture. Plant Soil 212: 135-143.
1
0
©2
39
17. Zhu YG, Huang YZ, Hu Y, Liu YX 2003
Iodine uptake by spinach (Spinacia oleracea L.)
plants grown in solution culture: effects of
iodine species and solution concentrations.
Environ Int 29: 33-37.
18. Dai JL, Zhu YG, Huang YZ, Zhang M, Song
JL 2006 Availability of iodide and iodate to
spinach (Spinacia oleracea L.) in relation to total
iodine in soil solution. Plant Soil 289: 301-308.
E
,
3
r
t
i
d
19. Landini M, Gonzali S, Kiferle C et al 2012
Metabolic engineering of the iodine content in
Arabidopsis. Sci Rep 2:338.
20. Tonacchera M, Dimida A, De Servi M et al
2013 Iodine fortification of vegetables improves
human iodine nutrition: in vivo evidence for a
new model of iodine prophylaxis. J Clin
Endocrinol Metab 98:E694-E697.
K
e
ic
s
i
t
ur
Vol. 14, Suppl. al n° 5, ottobre 2013
CONCLUSIONE
La più efficace prevenzione del gozzo e dei noduli tiroidei è la iodoprofilassi, facilmente attuabile mediante l’uso di sale
fortificato con iodio, ovunque ampiamente disponibile. La iodoprofilassi, e in particolare il consumo di sale iodato, ha
permesso di ridurre o cancellare in molti paesi questi problemi. In Italia, mediante la promulgazione di una legge ad
hoc del 2005 è stato incentivato un programma di iodoprofilassi rendendo obbligatoria la disponibilità di sale arricchito di iodio in tutti i punti di vendita. Purtroppo anche dopo l’entrata in vigore di questa legge l’utilizzo di sale iodato
ancora non raggiunge il 50% della popolazione, percentuale ben lontana da quel 95% che è l’obiettivo del programma
ministeriale. In questo campo tutta la comunità medica è chiamata a dare il suo contributo ad un’informazione corretta
sugli effetti benefici dell’uso del sale iodato in tutta la popolazione, senza eccezioni.
Per favorire un’ulteriore diffusione del consumo di sale iodato da parte della popolazione italiana si può agire su
più fronti: rinnovando una campagna mediatica di sensibilizzazione a livello nazionale; attraverso una informazione
capillare da parte di tutti i medici (di base e specialisti endocrinologi) e intervenendo su una riduzione del prezzo del
sale iodato che, seppur lievemente, risulta comunque più alto rispetto al prezzo del sale non iodato; favorendo l’utilizzo
del sale iodato nell’industria alimentare per la conservazione degli alimenti. Inoltre l’introduzione sul mercato di alimenti biofortificati con iodio apre nuove ed interessanti prospettive per il miglioramento dello stato di nutrizione iodica
nel nostro Paese.
1
0
©2
E
,
3
r
t
i
d
K
e
ic
s
i
t
ur
Massimo Tonacchera, Paolo Vitti
40
1
0
©2
L’Endocrinologo è pubblicato
bimestralmente da:
Editrice Kurtis s.r.l.,
Sede legale e amministrativa,
Redazione e Stampa:
Via Arluno 4, 20010 Casorezzo (MI)
Tel. 02 48202740 - Fax 02 48201219
E-mail: [email protected]
Internet: http://www.kurtis.it
Sede commerciale:
Via Luigi Zoja 30, 20153 Milano
Tel. 02 48202740 - Fax 02 48201219
E-mail: [email protected]
Direttore Responsabile
Canzio Fusé
E
,
3
r
t
i
d
K
e
ic
Supplemento al No. 5, Vol. 14 - Ottobre 2013
a l’Endocrinologo.
Reg. Trib. Milano n. 241 del 26/03/1999.
ROC (Registro Operatori Comunicazione) n. 6133.
Copyright 2013
Editrice Kurtis s.r.l.
ISSN Stampa 1590-170X
ISSN Online 1720-8351
s
i
t
ur
I diritti d’autore di quest’opera sono riservati.
Nello specifico sono vietate la riproduzione,
anche parziale e in qualsiasi forma (fotocopie,
microfilm, ecc.), la ristampa, la traduzione, la
trasmissione verbale o radiotelevisiva, la
memorizzazione su mezzi informatici (CDRom, impianti di elaborazione dati, ecc.)
senza il consenso scritto dell’Editore. Inoltre,
anche nel caso di autorizzazione, la riproduzione di quest’opera, o di una qualsiasi sua
parte, è ammessa solo nei limiti stabiliti dalla
legge.
ASSOCIATO A:
A.N.E.S.
ASSOCIAZIONE NAZIONALE
EDITORIA PERIODICA SPECIALIZZATA
Finito di stampare nel mese di
dicembre 2013.
CODICE: 11873