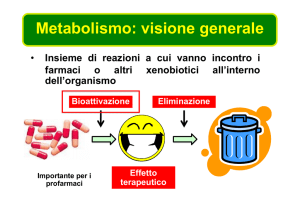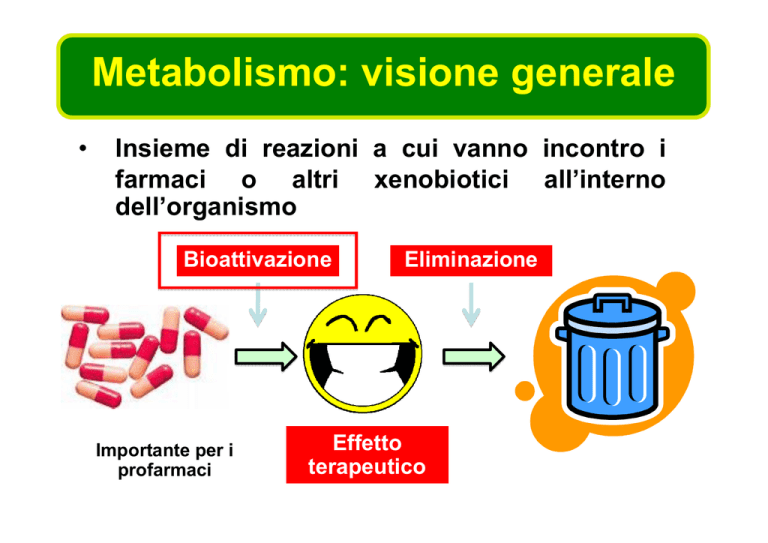
Metabolismo: visione generale
•
Insieme di reazioni a cui vanno incontro i
farmaci o altri xenobiotici all’interno
dell’organismo
Bioattivazione
Importante per i
profarmaci
Eliminazione
Effetto
terapeutico
Profarmaci: valaciclovir
Profarmaci: valaciclovir
Profarmaci: famciclovir
N
N
H2N
N
Aldehyde oxidase
Esterase / hydrolysis
N
O
N
HN
H2N
N
N
HO
AcO
AcO
Famciclovir
Antiviral (Herpes etc)
Pro-drug
HO
Penciclovir
Profarmaci: L-DOPA
H
COOH
NH2
NH2
L-DOPA
decarbossilasi
OH
OH
HO
L-DOPA
HO
dopamina
Profarmaci: L-DOPA
H
COOH
NH2
NH2
L-DOPA
decarbossilasi
OH
OH
HO
L-DOPA
HO
dopamina
Profarmaci: L-DOPA
Profarmaci: clopidogrel
Profarmaci: diacetilmorfina
• >3 volte + potente di morfina (+ liposolubile) – effetti + rapidi se
assunta e.v. o fumata
• Metabolizzata a monoacetilmorfina e morfina
Metabolismo: visione generale
•
Insieme di reazioni a cui vanno incontro i
farmaci o altri xenobiotici all’interno
dell’organismo
Bioattivazione
Es.: paracetamolo
Effetto
Tossico
Metabolismo del paracetamolo
1
1
2
3
4
Metabolismo del paracetamolo
Metabolismo: visione generale
•
Insieme di reazioni a cui vanno incontro i
farmaci o altri xenobiotici all’interno
dell’organismo
Bioattivazione
Polimorfismi,
Interaz. farmacologiche
Effetto
terapeutico
ridotto o assente
Profarmaci: codeina
(Reazione critica per l’effetto analgesico)
Profarmaci: clopidogrel
Individui portatori di alcune varianti del CYP2C19
(CYP2C19*2 e CYP2C19*3) possiedono una ridotta
concentrazione plasmatica del metabolita attivo (hanno
una maggiore reattivita’ piastrinica e vanno incontro piu’
frequentemente a eventi cardiovascolari)
Profarmaci: clopidogrel
Profarmaci: tamoxifene
Il tamoxifene e’ un SERM
(selective estrogen receptor
modulator).
Deve essere attivato nei due
metaboliti
4-idrossitamoxifene ed endoxifen,
attraverso il CYP2D6.
Polimorfismi del CYP2D6
influenzano la risposta al
tamoxifene in donne con
tumore alla mammella
Durante trattamento con
tamoxifene
sarebbe
meglio
evitare
l'uso
prolungato di farmaci
inibitori di CYP2D6, in
particolare
SSRI
(es.
paroxetina, fluoxetina)
Metabolismo: visione generale
•
Insieme di reazioni a cui vanno incontro i
farmaci o altri xenobiotici all’interno
dell’organismo
Eliminazione
Es.: etanolo,
isoniazide
Effetto
Tossico
Metabolismo dell’etanolo
Neurotossico
(neuropatia periferica)
Epatotossico
Metabolismo: visione generale
•
Insieme di reazioni a cui vanno incontro i
farmaci o altri xenobiotici all’interno
dell’organismo
Bioattivazione
Es.: rifampicina,
fenitoina
Eliminazione
Mancato/ridotto
effetto
terapeutico
Metabolismo: visione generale
•
Insieme di reazioni a cui vanno incontro i
farmaci o altri xenobiotici all’interno
dell’organismo
•
Generalmente dopo metabolismo i farmaci
sono piu’ polari e piu’ idrosolubili
•
Le sedi principali per il metabolismo sono
fegato, tratto gastrointestinale, reni, polmoni
(anche altre sedi)
•
La conversione metabolica avviene di solito
per via enzimatica (reazioni di fase I e II)
Reazioni di fase I
•
Hanno la finalita’ di inserire o mettere in
evidenza nel substrato gruppi funzionali di
legami (funzionalizzazione)
Ossidazione
Riduzione
Idrolisi
Citocromo P450-dipendenti
Citocromo P450-indipendenti
Citocromo P450
•
NADPH
NADP
O2
RH
H2O
R-OH
0
5
4
P-
R
tt
u
ed
i
s
a
Superfamiglia di emoproteine
enzimatiche identificate con la
sigla CYP seguita da un
numero
(famiglia),
lettera
(sottofamiglia) e un numero
(singolo gene)
Es. CYP3A4, CYP3A5
•
Localizzato
prevalentemente
nel reticolo endoplasmatico del
fegato (frazione microsomiale)
•
Specificita’, velocita’ e affinita’
diverse per vari substrati a
seconda del sottotipo CYP
Reazioni di fase I
•
Hanno la finalita’ di inserire o mettere in
evidenza nel substrato gruppi funzionali di
legami (funzionalizzazione)
Ossidazione
Riduzione
Idrolisi
Citocromo P450-dipendenti
Citocromo P450-indipendenti
Esempi
Alcol e aldeide deidrogenasi
Xantina + H2O + O2
urato + H2O2
Xantina ossidasi
Monoamminossidasi
Reazioni di fase I
•
Hanno la finalita’ di inserire o mettere in
evidenza nel substrato gruppi funzionali di
legami (funzionalizzazione)
Ossidazione
Riduzione
Idrolisi
Esempio
Acetilcolinoesterasi (AChE)
Reazioni di fase II
•
Usano i gruppi funzionali come “terminale”
per la coniugazione con molecole diverse
Acetilazione
Metilazione
Coniugazione con glutatione
Coniugazione con aminoacidi
Coniugazione con glucuronato
•
Prevedono il consumo di energia, fornita
direttamente o indirettamente dall’ATP
Fasi del metabolismo dei farmaci
Alcuni farmaci subiscono solo
il metabolismo di fase II
Farmaco
FASE I
Ossidazione
Riduzione e/o
idrolisi
FASE II
Prodotti di
coniugazione
(Solitamente Inattivo)
Il farmaco può risultare attivato
o, nella maggior parte dei casi, inattivo
Avvengono prevalentemente nel fegato (poi reni e polmoni)
Entrambi gli stadi (fase I e fase II) sono responsabili
generalmente di una riduzione della liposolubilità del farmaco
e, di conseguenza, ne facilitano l’eliminazione
Fasi del metabolismo dei farmaci
Fasi del metabolismo dei farmaci
Coniugazione con acido
glucuronico
(Fase II)
morfina
(Fase I)
N-demetilazione
Fasi del metabolismo dei farmaci
Metabolismo dei farmaci:
microflora intestinale
• Per farmaci assunti per os la flora microbica imtestinale
puo’ essere rilevante (potenzialita’ biotrasformativa
fegato)
• Biotrasformazioni da flora intestinale essenzialmente di
tipo riduttivo (ambiente anaerobico)
• Flora intestinale potenzialmente coinvolta nel ricircolo
enteroepatico
Fattori che modificano il
metabolismo di xenobiotici
Specie
Differenze tra organismi nell’abilita’ a metabolizzare
particolari sostanze sono alla base di tossicita’ selettiva
(es. Malation)
Età e sesso
In generale feti, neonati e anziani hanno una capacità
limitata per la trasformazione di xenobiotici rispetto agli
adulti. Es. cloranfenicolo, etanolo
Variabilità
genetica
Ad es. reazioni di acetilazione (fase II) e’ influenzata da
fenotipo “lento” o “rapido”. Es. isoniazide.
Nutrizione e Scarsa nutrizione e malattie (es. epatite) influiscono
malattie
negativamente sul metabolismo di xenobiotici.
Esposizione Precedente o simultanea esposizione ad un xenobiotico
ad altre
puo’ portare a inibizione o induzione enzimatica (es. DDT,
sostanze
alcool, fumo di sigaretta)
Dose
Puo’ influire la natura della biotrasformazione (dose
soglia per la tossicità). Es. paracetamolo
Eliminazione: visione generale
• Descrive quella serie di processi che sono alla
base della rimozione di xenobiotici assorbiti
attraverso l’escrezione e/o biotrasformazione
PRINCIPALI
RENALE
FECALE
SECONDARIE
POLMONARE
CUTANEA
SALIVARE
LACRIMALE
MAMMARIA
Escrezione renale
• La funzione principale dei reni e’ l’escrezione di composti
di
scarto
e/o
riassorbimento)
tossici
(filtrazione,
secrezione,
• 130 ml/min vengono filtrati a livello glomerulare (> 150 L
al giorno!!!!) 99% normalmente riassorbito
• Proteine plasmatiche (e farmaci legati ad esse) non
attraversano di norma i filtri glomerulari
• L’eliminazione di farmaci acidi e’ favorita alcalinizzando
le urine (e ostacolata acidificando le urine)
Escrezione renale
Escrezione renale
Escrezione renale
Escrezione fecale
• Il fegato svolge due diverse importanti funzioni sui
farmaci nell’organismo: metabolismo ed escrezione
• Farmaci incapaci di passare la membrana cellulare
vengono trasportati molto efficientemente nella cellula
epatica da vari sistemi di trasporto
• L’escrezione dei farmaci nella bile e’ favorita da due
caratteristiche fisiche: polarita’ e peso molecolare
• L’escrezione biliare puo’ avere particolare importanza
per farmaci assunti per os (effetto di primo passaggio)
Escrezione fecale
• Una volta escreto nella
bile,
viene
un
farmaco
non
necessariamente
eliminato
(ricircolo
enteroepatico)
Cinetiche di eliminazione
Cinetiche di ordine 0
La quantita’ di xenobiotico eliminata
Le cinetiche di ordine 0 indicano che
l’eliminazione dall’organismo si basa
su
processi
metabolici
escrezione saturati.
e/o
di
Al di sotto di concentrazioni saturanti le
cinetiche di eliminazione di ordine 0
possono seguire andamenti di I ordine.
100
% di xenobiotico
da eliminare
per unita’ di tempo e’ costante (flusso
indipendente dalla concentrazione).
0
Tempo
Cinetiche di eliminazione
Cinetiche di I ordine
La quantita’ di xenobiotico eliminata
per unita’ di tempo e’ una percentuale
Le cinetiche di I ordine indicano in
genere
che
l’eliminazione
dall’organismo avviene per lo
tramite meccanismi non saturati.
piu’
L’eliminazione della maggior parte degli
xenobiotici segue una cinetica di I
ordine.
100
% di xenobiotico
da eliminare
costante di quella che rimane da
eliminare.
0
Tempo
Metabolismo dell’etanolo
L’ossidazione di 1 mole di etanolo (46 g) a 1 mole di acido acetico richiede 2
moli di NAD+ (circa 1.3 Kg). Questa quantita’ supera abbondantemente la
disponibilita’ di NAD+ a livello epatico, che ne limita il metabolismo a circa 8
g/ora in un individuo adulto di 70 Kg
Alcol etilico: metabolismo ed
eliminazione
Emivita dipende anche da concentrazione.
Es.:
•
10 mg/100 ml – t½ 15 – 20 min (ordine I)
•
10 mg/100 ml – 0.12 g etanolo/kg di peso
corporeo per ora (per soggetto di 70 kg –
8.4 g/h)
Andamento delle concentrazioni ematiche di etanolo dopo
somministrazione i.v. in cani
Basse dosi
Alte dosi
J Pharmacol Exp ther 109:431, 1953
Comparison
• First Order Elimination
• Zero Order Elimination
– [drug] decreases
exponentially w/ time
– [drug] decreases linearly
with time
– Rate of elimination is
proportional to [drug]
– Rate of elimination is
constant
– Plot of log [drug] or
ln[drug] vs. time are
linear
– Rate of elimination is
independent of [drug]
– t 1/2 is constant
regardless of [drug]
– No true t 1/2
Emivita (t1/2)
• L’intervallo
di
tempo
necessario
affinche’
concentrazione plasmatica si riduca del 50%
la
• E’ indipendente dai valori di concentrazione iniziale di
xenobiotico
• Fornisce una misura dell’efficienza dei processi di
eliminazione dell’organismo nei confronti di un dato
xenobiotico
• Dipende da stato funzionale degli organi o sistemi
dell’individuo
xenobiotico
preposti
all’eliminazione
di
un
dato
Half-Life
• C = Co e - kt
• C/Co = 0.5 for half of the original amount
• 0.5 = e – k t
• ln 0.5 = -k t ½
• -0.693 = -k t ½
• t 1/2 = 0.693 / k
Emivita (t1/2)
• Solitamente farmaci con elevato Vd hanno una emivita
lunga
• Alterazioni dei valori di emivita richiedono correzioni del
regime terapeutico
Emivita (t1/2)
N° di t½
0
1
2
3
4
5
6
7
8
9
10
Frazione di xenobiotico
rimanente
100%
50%
25%
12.5%
6.25%
3.125%
1.56%
0.78%
0.39%
0.195%
0.0975%
*** Sono neccessarie 10 emivite per eliminare il 99,9%***
Clearance
• Puo’ essere definito come il volume di sangue
virtualmente ripulito nell’unita’ di tempo dai processi
di eliminazione
• Clearance d’organo e clearance totale
• Puo’ essere influenzata da vari fattori (es. malattie,
presenza di altre sostanze, legame alle proteine, grado
di ionizzazione, eta’)
• Per farmaci eliminati per via renale, la loro clearance
puo’ essere uguale, maggiore o minore di 130 ml/min
Somministrazioni ripetute e
stato stazionario
La somministrazione di dosi ripetute di un farmaco
(piu’ frequente nella pratica clinica) puo’ determinare
un suo aumento nell’organismo (accumulo) fino al
raggiungimento di un plateau (livello stazionario).
Se la somministrazione di un farmaco viene ripetuta
dopo un tempo pari o superiore a 5 emivite, la nuova
dose semplicemente rimpiazza la precedente
RICORDA: Se un farmaco segue una cinetica di primo
ordine occorre un tempo pari a 4-5 volte l’emivita per la
sua quasi scomparsa dall’organismo
Cp
0
2
4
6
8
10
Time (half time)
12
14
Se la somministrazione di un farmaco viene ripetuta
dopo un tempo pari o superiore a 5 emivite, la nuova
dose semplicemente rimpiazza la precedente
Se invece le nuove somministrazioni vengono fatte a
intervalli piu’ brevi, ciascuna di esse andra’ a sommarsi
a quello che e’ rimasto delle precedenti
Cp
Se somministriamo ripetutamente dosi uguali di
farmaco a intervalli fissi, la concentrazione di farmaco
crescera’ con le successive somministrazioni fino a
stabilizzarsi, oscillando a ridosso di un valore medio
stabile
0
2
4
6
8
10
Time (half time)
12
14
Cp
0
2
4
6
8
10
Time (half time)
12
14
Nell’esempio, l’intervallo
tra una somm. e la
successiva
e’
pari
all’emivita del farmaco
Cp
Dopo una fase iniziale di ascesa (fase di accumulo)
si raggiunge una fase di plateau (fase stazionaria o
di equilibrio)
Uno stato stazionario viene raggiunto dopo circa 4-5
emivite
0
2
4
6
8
10
Time (half time)
12
14
Multiple dosing
At Steady State
amount administered = amount eliminated between doses
Cpss
Cp
Il tempo necessario per raggiungere
(plateau) dipende dall’emivita del farmaco
l’equilibrio
Quando la quantità di farmaco eliminato tra le dosi
eguaglia la dose somministrata, i livelli medi di
farmaco rimarranno costanti e sarà stato raggiunto il
plateau.
time
D = (Cp)eq x 0.693 x Vd x (T/t½)
Si puo’ utilizzare per impostare un
protocollo terapeutico in modo razionale
Esempio
Si vuole somministrare per via e.v. ogni ora ad un uomo di 70
kg la lidocaina, un antiaritmico con Vd= 1.1 l/kg e t1/2 = 1.8 h,
per raggiungere una Cp= 4 mg/l.
D = (Cp)eq x 0.693 x Vd x (T/t½)
D = 4 x 0.693 x 77 x (1/1.8) = 118 mg
La dose cosi’ calcolata sara’ quella necessaria perche’ la Cp
del farmaco sia quella desiderata una volta raggiunto
l’equilibrio, cioe’ dopo circa 4-5 emivite (5 x 1.8 h)
118 mg/h per via e.v. equivalgono a ~ 2 mg/min
somministrati per infusione continua
D = (Cp)eq x 0.693 x Vd x (T/t½)
Si puo’ utilizzare per impostare un
protocollo terapeutico in modo razionale
Si puo’ utilizzare per avere una stima della
Cp in un paziente sottoposto ad un
preciso protocollo terapeutico
Esempio
Si vuole stimare la Cp in un paziente (70 kg) trattato da piu’
di un mese con digossina, somministrata per os (0.2 mg, 2
volte al giorno).
Vd = 7 l/Kg
D = (Cp)eq x 0.693 x Vd x (T/t½)
emivita = 1.7 gg
Biodisp. orale = 0.75
(0.2 x 0.75) = (Cp)eq x 0.693 x 490 x (0.5/1.7)
(Cp)eq = 0.0015 mg/l
Cp
Dopo una fase iniziale di ascesa (fase di accumulo)
si raggiunge una fase di plateau (fase stazionaria o
di equilibrio)
Uno stato stazionario viene raggiunto dopo circa 4-5
emivite
0
2
Uno stato stazionario puo’ essere raggiunto piu’
velocemente
con
4
6
8partendo
10
12 una
14 dose iniziale
maggiore (chiamata dose di carico)
Time (half time)
La dose di carico e’ utile, per esempio, quando si inizia il
trattamento con un farmaco la cui emivita e’ lunga rispetto
all’urgenza della situazione clinica, come nel caso del trattamento
delle aritmie cardiache con amiodarone (emivita 20-100 giorni) o
digossina (emivita 30-40 ore) o quando si avvia un trattamento
anticoagulante con eparina
Loading Dose
Dose = Cp(Target) x Vd
Somministrazioni ripetute e
stato stazionario
Cinetiche di I ordine
Cinetiche di ordine 0
Principali parametri
farmacocinetici
Cmax: concentrazione massima
Tmax: tempo per raggiungere la Cmax
AUC: area sotto la curva
F%: biodisponibilità
T½: tempo necessario perché la concentrazione
plasmatica si riduca della metà
Vd: volume di distribuzione
Cl: clearance