Facoltà di Medicina e Psicologia
Corso di Laurea Magistrale in Psicologia Clinica per la Persona, le
Organizzazioni e la Comunità
Tesi di Laurea
Basi neurobiologiche del ricordo dei
sogni: correlati EEG dei narcolettici
Relatore
Candidata
Prof. Luigi De Gennaro
Cinzia Schiappa
N° matricola 1409063
Correlatore
Prof. Carlo Lai
Anno Accademico 2014/2015
Indice
Introduzione……………………………………….……….pag. 3
Capitolo 1 L'APPROCCIO PSICO-FISIOLOGICO ALLO
STUDIO DEI SOGNI
1.1.
1.2.
1.3.
1.4.
Lo sviluppo dell'approccio psico-fisiologico nella ricerca del sogno e i
problemi metodologici………………………………………….pag. 5
Dicotomia tra REM e NREM e revisione del paradigma
dicotomico…………………………………………………….…pag. 9
L'approccio neuropsicologico nella ricerca sul sogno…………pag. 15
Correlati elettroencefalografici del richiamo dell'attività mentale nel
sonno……………………………………………………....…..pag. 20
Capitolo 2 BASI ANATOMO-FUNZIONALI DELLA
NARCOLESSIA
2.1. Aspetti clinici e fisiopatologia della narcolessia……………….pag. 27
2.2. Il sistema ipocretinergico e ruolo dell’orexina: implicazioni per la
patologia……………………………………………………………...pag. 32
2.3. Alterazioni anatomo-funzionali………………………………..pag. 35
2.4. Il ricordo dei sogni nella narcolessia…………………………..pag. 38
Capitolo 3 LO STUDIO EMPIRICO
3.1
3.2
Introduzione...................................................................................pag. 42
Metodo...........................................................................................pag. 44
3.2.1 Soggetti
3.2.2 Procedura
3.2.3 Strumenti
3.2.4 Analisi dei dati
3.3 Risultati......................................................................................pag. 47
3.4 Discussione................................................................................pag. 51
3.5 Conclusioni generali..................................................................pag. 52
Riferimenti bibliografici…………………………………………….pag. 55
2
Introduzione
La narcolessia è un disturbo neurologico il cui quadro sintomatologico può manifestarsi
con cataplessia, eccessiva sonnolenza diurna (EDS), paralisi del sonno e allucinazioni
ipnagogiche e ipnopompiche. La cataplessia e l’EDS sono i sintomi “peggiori” a cui può
andare incontro un paziente affetto da questa patologia, dal momento in cui questi sintomi
intrudono violentemente durante la veglia. Un attacco cataplettico, che può durare al
massimo alcuni minuti, può essere causato da forti emozioni che provocano la totale o
parziale perdita del tono muscolare; invece, l’EDS sperimentata quotidianamente da questi
pazienti li può portare ad appisolarsi nei momenti meno opportuni, come quando si è alla
guida di un’autovettura. È evidente come un disturbo di questo tipo vada a compromettere
le attività quotidiane del paziente, impedendogli di svolgere una vita normale. Quel che
preoccupa di più è che non esiste un vero e proprio trattamento per la narcolessia, ma solo
alcune regole comportamentali, una buona igiene del sonno e alcuni farmaci stimolanti che
possono aiutare il paziente a combattere l’EDS e la cataplessia eventualmente associata.
Nel presente lavoro di tesi saranno trattati gli aspetti clinici e fisiopatologici della
narcolessia, con particolare attenzione sui sintomi e sul loro andamento nel corso del
tempo, sulla diagnosi, sulle ipotetiche “somiglianze” con le caratteristiche del sonno REM,
sulle aree cerebrali e le sostanze neurochimiche coinvolte nella patologia e sulle alterazioni
anatomo-funzionali che presentano questi pazienti.
L’obiettivo centrale dell’elaborato sono i correlati elettroencefalografici del ricordo dei
sogni nella narcolessia, per cui sarà discusso anche lo sviluppo della ricerca sui sogni nel
corso del tempo e i relativi problemi metodologici a cui i ricercatori sono andati incontro,
con particolare attenzione all’approccio psico-fisiologico e a quello neuropsicologico.
Inoltre, saranno esposti i dati a sostegno della revisione del paradigma dicotomico sonno
REM-NREM, spostando poi l’attenzione sulla mental sleep activity, sulle sue
caratteristiche e su come questa resti in memoria.
Al termine, saranno presentati i risultati preliminari di un progetto di ricerca sui correlati
elettroencefalografici dell’attività onirica nei narcolettici, che è da considerarsi come
un’estensione e un tentativo di replica dei risultati sulle attività oscillatorie cerebrali
predittive del ricordo dei sogni ottenuti da Marzano et al. (2011). Si tratta di uno studio il
cui obiettivo primario è comprendere, attraverso un progetto di ricerca “within-subjects”,
3
se i pattern EEG riscontrati predittivi del successivo ricordo dei sogni siano riconducibili
ad un fenomeno di “tratto” o di “stato”. A questo primario obiettivo di carattere generale se
ne affianca uno secondario più specifico: descrivere, per la prima volta, la relazione
predittiva tra correlati EEG al risveglio e il ricordo dei sogni in un gruppo di pazienti
narcolettici.
4
Capitolo 1
L'approccio psico-fisiologico allo studio dei sogni
1.1 Lo sviluppo dell'approccio psico-fisiologico nella ricerca del sogno e i problemi
metodologici
L’attenzione e la curiosità per i sogni non sono affatto recenti, anzi già l’uomo occidentale
pre-scientifico mostrava interesse per la questione, dilettandosi in interpretazioni
culturalmente orientate e ormai quasi anacronistiche. Inizialmente si pensava al sogno
come facente parte della vita reale, poi lo si è ritenuto un privilegiato canale di
comunicazione con divinità e defunti o, ancora, il risultato del viaggio dell’anima durante
il sonno, fino a considerarlo come racconto profetico al limite del misticismo e della
superstizione (Fagioli, 2002).
Oggi sappiamo che il sogno è una produzione psichica che ciascuno di noi esperisce più
volte durante il sonno; nella mente del dormiente si presentano trame immaginarie di
eventi e azioni che ci conducono a definire il sogno come uno stato di coscienza
caratterizzato da diverse categorie di esperienza. Il sognatore, infatti, è sottoposto ad
esperienze sensoriali (soprattutto sul piano visivo ed uditivo), motorie, verbali, cognitive
ed emotive (il più delle volte piuttosto intense) (Desseilles et al., 2011). Sebbene le
categorie di esperienze da sogno sopracitate si presentino in modo alterato e distorto,
rendendo di fatto improbabile la possibilità che vengano così esperite nello stato di veglia
(Hobson, Stickgold, & Pace-Schott, 1998; Schwartz & Maquet, 2002), il sognatore, di
solito, non è consapevole che si tratti di una visione onirica e vive il tutto come una
rappresentazione analogica (Johnson, Kahan & Raye, 1984).
Nel linguaggio comune si usa la parola “sogno” come sinonimo di storia bizzarra, con
aspetti allucinatori ed emotivamente coinvolgenti, ma ricerche psicofisiologiche già da
tempo hanno mostrato come durante il sonno ci siano anche esperienze simili al pensiero
(e.g., Foulkes, 1962). Consapevoli, quindi, dell’inadeguatezza del termine “sogno” nel
descrivere tutte le possibili attività svolte e vissute durante il sonno, occorre una
precisazione terminologica. In ambito scientifico, infatti, è più opportuno utilizzare termini
quali “sleep mentation”, “mental sleep activity” (MSA) o “mental sleep experience” (MSE)
per riferirsi ai prodotti dell’elaborazione mentale che si riscontrano durante il sonno e che
5
sono riportati al risveglio (Fagioli, 2002). Il termine “sleep mentation” è stato utilizzato fin
dalle prime ricerche psicofisiologiche; il termine MSA sottolinea come la mente non
smetta di lavorare durante il sonno ma sia sempre attiva, anche quando la percezione degli
eventi esterni e dell’interazione con l'ambiente è ridotta; il termine MSE sottolinea, invece,
come il soggetto sperimenti qualcosa che vive privatamente solo lui. Questi termini, che
possono essere considerati equivalenti, sottolineano, dunque, la ormai indubbia natura del
sogno: quest’ultimo è una forma di attività mentale che si manifesta durante il sonno.
Attualmente vengono utilizzati tre approcci metodologici per lo studio della MSA:
l’approccio fenomenologico, l’approccio neuropsicologico e l’approccio psicofisiologico
(Fagioli, 2002).
Il più antico è l’approccio fenomenologico o naturalistico che analizza i racconti dei sogni
dopo i risvegli spontanei utilizzando il metodo psicoanalitico, i questionari e le interviste
(Fagioli, 2002). Si tratta di un metodo di analisi dei sogni proposto da Freud in “Die
Traumdeutung” (1900), in cui i sogni, essendo la via regia per l’inconscio, vanno
interpretati nei loro contenuti latenti.
L’approccio neuropsicologico sarà trattato in dettaglio successivamente (cfr., par. 1.3).
L’approccio più utilizzato nella seconda metà del ‘900 è quello psicofisiologico, il quale
studia l’influenza della variabile indipendente fisiologica sulla variabile dipendente
psicologica, ovvero le caratteristiche della MSA in funzione dell’attività fisiologica. Tale
approccio analizza i resoconti ottenuti dopo aver svegliato il soggetto in specifici stadi del
sonno o dopo un sonno naturale e indisturbato (sia in soggetti normali che in soggetti
affetti da disturbi neurologici, psichiatrici o patologie interne) o in seguito a manipolazioni
sperimentali dell’MSA tramite la somministrazione di stimoli prima o durante il sonno
(Fagioli, 2002). Di fatti, nello specifico, all’interno di questo paradigma sono ravvisabili
diversi metodi e procedure:
-
Diversi studi sono stati condotti confrontando i resoconti ottenuti in seguito a
risvegli sperimentali da specifici stadi o in diversi momenti della notte (Cipolli &
Salzarulo, 1996); in questi casi le variabili indipendenti sono lo stadio o il momento
del sonno e le variabili dipendenti le caratteristiche della MSA.
-
Studi più strettamente sperimentali, invece, hanno valutato quanto gli stimoli
6
erogati prima o durante il sonno influenzassero la MSA1 (Cipolli, 1995); in questi
casi le variabili indipendenti sono le caratteristiche degli stimoli e/o il periodo
precedente al sonno/stadio del sonno in cui gli stimoli vengono somministrati,
mentre le variabili dipendenti sono le caratteristiche della MSA.
-
Altre ricerche sono state condotte integrando metodi della ricerca clinica con quelli
della ricerca umana di base, consentendo di indagare la relazione tra le misure
dell’attività cerebrale o le lesioni neurologiche (variabili indipendenti) e le
caratteristiche della MSA (variabili dipendenti) (cfr., par. 1.3). Queste procedure
vengono sempre più integrate con quelle sviluppate dalla psicologia cognitiva, con
possibili notevoli sviluppi di ricerca soprattutto sulla memoria (cfr., par. 1.2).
Quindi, si è andati alla ricerca delle diverse variabili indipendenti che potessero influenzare
la MSA, in primis il cervello, poi il ciclo REM-NREM, l’ambiente di sonno, le procedure
date ai soggetti sperimentali, le caratteristiche del risveglio, il tempo di sonno, le
caratteristiche di stato o di tratto del soggetto (Fagioli, 2002). In ogni caso, la disputa sul
fatto che siano gli stati fisiologici oppure i fattori psicologici le principali variabili che
influenzano le caratteristiche della MSA ha, di fatto, impedito ai ricercatori di attingere a
teorie di grande, o forse presunto, valore euristico ed esplicative di ogni situazione,
eludendo il rischio di generalizzare ogni risultato.
Storicamente, l’inizio del cammino verso la psicofisiologia del sonno è riscontrabile negli
studi, risalenti al 1862, di E. Kohlschutter sui rapporti tra la profondità del sonno e il
momento in cui inizia il sonno. L’autore dimostrò che la soglia del risveglio va
aumentando nel corso del sonno fino a raggiungere un picco, per poi diminuire dopo le
prime tre ore, attestandosi ad un livello stabile fino al risveglio mattutino. Uno studio sullo
stesso tema fu fatto anche da E. Michelson, ma i risultati furono trascurati a causa delle
scarse conoscenze della fisiologia del sonno del tempo (Kugler, 1996). Un secondo passo
fu la scoperta, nel 1920, dell’elettroencefalografia (EEG), che ha consentito di identificare
1
Un primo ingenuo tentativo che va in questa direzione può essere quello del sinologo e letterato francese
Hervey de Saint-Denys. Questi portò con sé, da un viaggio, una boccetta di profumo e chiese ad un suo servo
di lasciarne cedere qualche goccia sul suo cuscino, ma senza che quest’ultimo gli riferisse in quale notte
l’avrebbe fatto. Dopo dieci giorni, il servo mise del profumo sul cuscino del suo padrone, il quale sognò di
essere ritornato nei luoghi che aveva visitato durante il suo viaggio. La stessa esperienza fu ripetuta con
fragranze, luoghi e tempi diversi, ottenendo i medesimi risultati. L’autore poté, dunque, confermare la sua
ipotesi circa l’esistenza di associazioni, o di quelle che lui definì “affinità psicologiche”, che guidano il flusso
dei sogni, influenzandone la formazione (Hervey de Saint-Denys, 1867/1977). Nonostante le evidenti
problematiche anzitutto metodologiche, si tratta comunque di un primo tentativo sistematico di valutare
quanto e quali fattori potessero influenzare lo scenario dei sogni.
7
che l’attività cerebrale durante il sonno non è omogenea, ma che ci sono dei precisi pattern
elettroencefalografici che si presentano ciclicamente (Fagioli, 2002). Grazie a questo
strumento si è potuta scoprire, ad esempio, l’attività ad onde lente (delta), e di qui come
questa variabile indipendente fisiologica sia correlata alla profondità del sonno (variabile
dipendente psicologica) (Loomis et al., 1937); inoltre, la scoperta della ciclicità di questa
attività lenta fornisce una spiegazione dell’innalzamento e dell’abbassamento della soglia
del risveglio nel corso del sonno, ricollegandosi ai risultati di Kohlschutter sopracitati.
Questi primi movimenti verso uno studio scientifico dei sogni furono oggettivamente
ostacolati agli inizi del Novecento, quando, in seguito alla divulgazione degli studi di
Freud sul contenuto latente dei sogni (Freud, 1955/1900), l’interesse sul contenuto
manifesto di quest’ultimi andò scemando (Desseilles et al., 2011). Infatti, l’approccio
psicoanalitico per l’analisi dei sogni non ha subito un declino in seguito all’introduzione di
tecniche psicofisiologiche, anzi la psicoanalisi si è mostrata molto influente nella codifica
del dato fenomenologico (Salzarullo et al., 1973). Di quei tempi, anche il “neonato”
comportamentismo, negando l’esistenza di esperienze mentali quali il sogno, placò
l’entusiasmo scientifico per questi studi (Desseilles et al., 2011).
Un ultimo passaggio importante per lo sviluppo della psicofisiologia del sonno è stato la
scoperta della fase REM del sonno, avvenuta tra il 1953 e il 1957, da parte di Kleitman,
Aserinsky e Dement. Con questa scoperta si ritenne di aver finalmente trovato il marker
neurofisiologico dei sogni, per cui i ricercatori potevano svegliare il soggetto nel preciso
istante in cui stava sognando e, quindi, raccoglierne il racconto (cfr., par. 1.2).
Sebbene il paradigma di ricerca psicofisiologico abbia contribuito molto allo studio
dell’attività mentale durante il sonno, permangono comunque delle problematiche
metodologiche legate proprio alla natura intrinseca della MSA. L’esperienza onirica,
infatti, è strettamente personale e soggettiva, per cui si “sottrae” all’osservazione
scientifica diretta. Si tratta, dunque, di un’attività mentale che non può essere studiata
direttamente: l’unica porta d’accesso a quest’ultima è rappresentata dal racconto del sogno
fatto al risveglio. De Gennaro et al. (2012), per spiegare la difficoltà che si incontra nello
studio dei sogni, ricorrono all’esempio del “Gatto di Schrodinger”. Di fatti, il sogno può
essere indagato solo interrompendolo, ma questo può alterare lo scenario fisiologico in cui
è prodotto.
Quindi, uno dei problemi metodologici più importanti nell’ambito di questi studi è proprio
l’impossibilità di monitorare e osservare direttamente la MSA durante il sonno, per cui ci si
può affidare solo al ricordo del soggetto appena svegliato. Bisogna, inoltre, considerare che
8
gli eventi fisiologici e le esperienze mentali che intercorrono tra il momento del risveglio e
quello del ricordo possono influenzare proprio quest’ultimo (Fagioli, 2002).
A questo primo problema ne è collegato un altro che riguarda l’analisi dei resoconti dei
sogni. In un primo momento, le procedure di analisi dei contenuti venivano sviluppate in
base alle caratteristiche, prevalentemente qualitative, dei resoconti stessi. Tale analisi
qualitativa ha da subito suggerito una dicotomia tra sogno e pensiero (Foulkes, 1962), che
corrispondono rispettivamente al REM e NREM (cfr., par. 1.2). Infatti, parallelamente agli
studi di Aserinsky e Kleitman, Hall nel suo scritto “The meaning of dreams'' (1953)
descrive e classifica le caratteristiche fenomenologiche di migliaia di sogni di studenti
universitari. Sulla base di questa prima indagine, l’autore, insieme a Van De Castle,
sviluppa un sistema di codifica dettagliato per quantificare il contenuto manifesto dei
sogni, tenendo conto ad esempio, dei personaggi, dei settings, degli oggetti, delle
emozioni, delle interazioni sociali (Hall & Van De Castle, 1966); questo sistema è stato poi
aggiornato grazie a studi più recenti (e.g., Schneider & Domhoff, 2009). Quindi, da allora
in poi, il contenuto fenomenologico dei sogni è stato nuovamente considerato utile per
descrivere i processi cognitivi in gioco durante il sonno, fino ad arrivare a strumenti di
analisi più formali per cui la produzione dell’MSA è stata esplorata esclusivamente da un
punto di vista cognitivo (cfr., par. 1.2).
1.2 Dicotomia tra REM e NREM e revisione del paradigma dicotomico
Tra il 1953 e il 1957, in un laboratorio dell’Università di Chicago, Nathaniel Kleitman e i
suoi allievi, Eugene Aserinsky e William Dement, utilizzando il paradigma di ricerca
psicofisiologico, scoprirono che il sogno si presenta durante specifici periodi del sonno. La
fase in questione è caratterizzata da un’elevata attività corticale (riconoscibile dall’alta
frequenza e dalla bassa ampiezza dell’attività elettroencefalografica e, quindi, paragonabile
a quella della veglia a riposo), da un aumento della frequenza cardiaca e dell’attività
respiratoria e da rapidi movimenti oculari (REMs) (Aserinsky & Kleitman 1953; Dement
& Kleitman, 1957). Furono proprio questi rapid eye movements a dare il nome “fase REM”
a questo particolare stadio del sonno. Questo stadio si presenta ciclicamente ogni 90-100
minuti circa, alternandosi ai 4 stadi del sonno NREM; quindi, l’uomo trascorre circa il 25%
di ore di sonno in un stato di paradossale attivazione cerebrale, con raffiche di rapidi
movimenti oculari e altri cambiamenti fisiologici caratteristici (Aserinsky & Kleitman
9
1953; 1955).
Gli studiosi appena citati, però, non furono né i soli né i primi a notare questo legame tra
sogno e movimenti oculari. Infatti, sul finire dell’Ottocento, già Ladd, professore di
filosofia mentale e morale all'Università di Yale, tramite l’introspezione, notò che quando
non sognava gli occhi non si muovevano (Fagioli, 2002). Dopo circa 40 anni, anche
Jacobson scrisse che, se si svegliava un soggetto mentre i suoi occhi si muovevano sotto le
palpebre chiuse, con molta probabilità questi avrebbe riferito un sogno (Fagioli, 2002).
Ritornando al sonno REM, questo si caratterizza anche per una certa atonia muscolare che
impedisce ai sogni di essere agiti (Jouvet, 1994). Al risveglio da questa fase, i resoconti dei
sogni erano molto più lunghi, bizzarri e carichi di emozioni rispetto ai resoconti NREM
(Aserinsky, Kleitman 1953; Hobson, Pace-Schott, Stickgold, 2000). Gli autori, dunque,
ritennero di aver trovato il marker neurofisiologico del sogno, un dato fisiologico oggettivo
con cui localizzare il momento del sogno: uno stato di alta attivazione cerebrale e bassa
attivazione fisica.
Da questi primi studi psicofisiologici emerse, dunque, l’equazione “sonno REM = sogno”
(Aserinsky & Kleitman 1953; Dement & Kleitman, 1957), per cui si riteneva che l’attività
onirica fosse prerogativa esclusiva di questo stadio del sonno desincronizzato: il 70-95%
dei soggetti svegliati in fase REM riferirono di aver sognato, contro il 5-10% di coloro che
sono stati svegliati durante il sonno NREM (Dement et al., 1957), e questi pochi casi di
resoconti onirici in seguito a risveglio NREM sono stati interpretati come residui di MSA
della fase REM precedente. Questa scoperta fu molto importante ed inaugurò nuove
prospettive nell’ambito della ricerca; innanzitutto si è potuto dimostrare che il sonno non è
uno stato quiescente mentale e cerebrale, ma che episodi di elevata attività neurofisiologica
sono distribuiti lungo tutta il periodo di sonno (Aserinsky & Kleitman, 1953). Inoltre, la
scoperta del sonno REM ha messo la parola fine al quasi cinquantennale dominio della
psicoanalisi nella ricerca sul sogno (Fagioli, 2002).
Quindi, la psicofisiologia ha individuato quella fase del sonno in cui è più probabile che un
soggetto, se svegliato, racconti un sogno e ciò ha permesso di incrementare la quantità di
materiale onirico a disposizione. Tuttavia, quest’ipotesi circa il contesto generativo
dell’attività onirica appare riduttiva (Salzarulo et al., 1973), in quanto si propone
all’interno di una prospettiva di isomorfismo tra cervello e mente, presupponendo
un’identità strutturale tra l’esperienza fenomenologica del dormiente e i processi fisiologici
sottostanti. In questo modo, come già accennato (cfr., par. 1.1), si rischia di operare un
determinismo per cui lo stato fisiologico del sonno viene considerata l’unica variabile che
10
incide sulle caratteristiche della MSA (Fagioli, 2002). Sganciandosi da questa logica
riduzionista di causa-effetto è possibile cogliere anche le funzioni dell’attività onirica,
indipendentemente dal quadro fisiologico in cui si presentano. Per citare alcuni modelli:
sogno con funzione di riattivazione e consolidamento di elementi incontrati in precedenti
esperienze di veglia (e.g. Cipolli et al., 2004; Schwartz, 2010; Wamsley & Antrobus, 2009;
Wamsley et al., 2010); sogno con funzione di regolazione emozionale, nei termini in cui le
emozioni negative realisticamente rappresentate nei sogni forniscono una simulazione
della minaccia e, dunque, una prova generale delle situazioni stressanti (Revonsuo, 2000;
Valli et al., 2005).
Ritornando alla revisione del paradigma dicotomico REM-NREM, il primo a fornire
risultati che misero in discussione l’equazione “sonno REM = sogno” fu Foulkes (Foulkes,
1962). L’intenzione dell’autore era quella di indagare l’origine dei sogni, pertanto, in linea
con l’approccio psicofisiologico classico, provocò risvegli sperimentali nelle fasi di
transizione tra sonno NREM e REM e in tempi diversi dall’inizio di quest’ultimo.
Diversamente da quanto riscontrato negli studi precedenti, Foulkes raccolse resoconti della
MSA anche in seguito a risvegli NREM e l’unica differenza tra le diverse ricerche
consisteva nella formulazione della domanda posta ai soggetti sperimentali dopo il
risveglio. Il gruppo di lavoro di Kleitman, infatti, era solito domandare “hai sognato?”,
domanda che Foulkes ha sostituito con “stavi pensando qualcosa?”. I risultati ottenuti
confermarono l’intuizione: alla domanda formulata nel secondo modo seguirono più
frequentemente risposte affermative in seguito a risvegli NREM (Foulkes, 1962). La
dicotomia tra REM e NREM iniziò, dunque, a vacillare e molti autori concordarono sul
fatto che tra la MSA riportata nella fase REM e quella raccolta negli altri stadi del sonno vi
siano solo differenze qualitative: la prima, infatti, rispetto alla seconda, è più ricca di
contenuti visivi irreali e vivaci, e quindi più vicina al concetto comune di sogno (Foulkes,
1962; Foulkes & Schmidt, 1983; Aserinsky & Kleitman 1953; Hobson, Pace-Schott &
Stickgold, 2000).
Anche Lairy et al. (1967) contestarono il paradigma dicotomico, segnalando come, nelle
fasi di transizione tra sonno REM e NREM, si manifestano simultaneamente pattern
elettroencefalografici di entrambi gli stati e definirono tali fasi di transizione sonno
intermedio. Inoltre, studi successivi hanno mostrato come non solo i REMs sono associati
alla MSA, ma anche i complessi K, le onde PGO, la soppressione fasica dell’EMG e
l’attività muscolare dell’orecchio medio accompagnano quest’esperienza mentale (Hobson,
1998; Horne, 1988; Nielsen, 2000; Hobson et al., 2000).
11
L’attività onirica la si potrebbe descrivere meglio come un continuum che va dalle attività
mentali “simil-pensiero” tipiche del NREM ai sogni vividi e floridi tipici della fase REM
(Cavallero, Cicogna, Natale, Occhionero et al., 1992; Stickgold, Malia, Fosse, Propper &
Hobson, 2001).
Inoltre, studi relativamente recenti hanno indagato hanno monitorato la presenza di
pensieri e allucinazioni sia durante la veglia che durante il sonno ed è emerso che l’attività
del pensiero va diminuendo man mano che si passa dallo stato di veglia, allo stato di sonno
NREM, fino a giungere al suo nadir durante il sonno REM. Viceversa, le allucinazioni
oniriche sembrano aumentare passando dalla veglia, al sonno NREM, fino a giungere al
punto massimo della loro frequenza durante il sonno REM (Fosse, Stickgold & Hobson,
2001, 2004, Nielsen, 2004; Stickgold, Malia et al., 2001). Queste evidenze empiriche
sembrano suggerire che il sonno REM sia uno stato neurofisiologico solo di facilitazione
per il verificarsi del sogno.
Come già accennato, anche l’approccio cognitivo trovò, a partire dal 1970, il suo spazio
nello studio sperimentale sulla MSA, indagando l’influenza della memoria su quest’ultima
(Fagioli, 2002). Tali studi hanno dimostrato che i due tipi di resoconto non sono diversi
nella produzione dei contenuti o nella difficoltà della codifica verbale, piuttosto sono le
immagini oniriche del sonno NREM ad essere meno accessibili alla memoria. Il loro
recupero al risveglio dal sonno NREM è molto più difficoltoso: il grado di consolidamento
della memoria dei contenuti dell’MSA risulta inferiore nel sonno NREM (Salzarulo et al.,
1979). Di fatti, i resoconti di tali sogni sono più ricchi di espressioni come “credo che…”,
“mi sembrava che…”, “non ricordo se…”, e ciò va a corroborare l’ipotesi che il soggetto,
dopo questo tipo di sonno, incontri più difficoltà nella pianificazione semantica (Salzarulo
et al., 1979).
Antrobus raccolse i resoconti onirici di soggetti svegliati durante lo stadio 2 del sonno
NREM e durante la fase REM e li sottopose ad un’analisi psicolinguistica, ovvero contò la
frequenza delle diverse categorie di parole presenti nel resoconto (Antrobus, 1983). Ne
emerse che la lunghezza del resoconto, in termini di numero di parole, era la miglior
discriminante tra i resoconti rilasciati in seguito ad un risveglio NREM e quelli rilasciati
dopo un risveglio REM. Anche Foulkes e Schmidt (1983) effettuarono studi di
comparazione tra i resoconti REM e NREM e anch’essi notarono delle differenze, quali la
maggiore complessità dei resoconti REM dispetto ai NREM. Però, tenendo conto delle
lunghezze dei resoconti, tali differenze erano assai meno evidenti: pertanto, si è potuto
concludere che le differenze qualitative riscontrate fossero le conseguenze di quelle
12
quantitative. Sia Antrobus che Foulkes e Schmidt concordano nel ritenere che ciò che
rende diversi i resoconti REM e NREM sia il diverso funzionamento della memoria (a
livello quantitativo e non qualitativo) in questi due stati del sonno. In particolare, per
Antrobus la codifica e il recupero dell’originale MSA è meno efficace nel NREM che nel
REM; mentre per Foulkes e Schmidt le differenze tra i resoconti REM e NREM sono
imputabili alle differenze nella quantità di attività mnemonica disponibile al momento della
produzione del sogno. La natura degli elementi che fanno capolino nelle immagini oniriche
è stata ampiamente studiata, chiedendo ai soggetti di identificare le fonti di memoria dei
loro sogni e, quanto ottenuto, viene classificato in base alla distinzione che Tulving ha
proposto tra memoria episodica (autobiografica) e semantica (che contiene le conoscenze
generali acquisite nel tempo). Coerentemente con i risultati di Salzarulo e collaboratori
prima citati, le conoscenze semantiche sono state maggiormente individuate nei resoconti
REM che NREM, mentre la memoria episodica è emersa maggiormente nei resoconti
NREM (Baylor et al., 2001). Ma anche il tempo della notte influenza il contenuto dei
sogni: è stato riscontrato un aumento degli elementi semantici nei resoconti delle ultime
fasi REM rispetto alle prime (Cavallero et al., 1990). Uno studio, comparando i resoconti
ottenuti in seguito a risvegli mattutini spontanei con quelli ottenuti dopo risvegli
sperimentali, ha constatato la medesima disponibilità delle fonti della memoria in entrambe
le situazioni (Cicogna et al., 1998). Questi risultati ci conducono a sostenere l’ipotesi per
cui nella produzione dei sogni sono attivi gli stessi meccanismi cognitivi, a prescindere
dallo stato del sonno (Cicogna et al., 1991; Cavallero et al., 1992).
Tali evidenze empiriche appoggiano il “one-generator model”, in base al quale la MSA è
generata da un singolo insieme di processi indipendentemente dalle differenze fisiologiche
tra REM e NREM. Al contrario, il “two-generator model”, appoggiato soprattutto dalla
stampa popolare e dai neuroscienziati, sostiene che l’attività cognitiva del sonno REM è
prodotta da generatori qualitativamente differenti da quelli che producono l’attività
cognitiva durante il sonno NREM. Un tentativo di conciliazione di questi due modelli
perviene da Nielsen, il quale ha definito “fasi di sonno REM nascosto” tutti quei periodi di
sonno NREM che presentano alcuni pattern elettroencefalografici tipici del sonno REM (si
tratta soprattutto di quei periodi NREM che precedono o seguono fasi di sonno REM)
(Nielsen, 2000). Forse è proprio quest’attività “sotto copertura”, secondo l’autore, a
causare la gran parte della MSA durante il sonno NREM (Nielsen, 2000). In realtà, tale
modello sembra essere solo un tentativo di riproporre, modificando alcuni criteri,
l’equazione “sonno REM = sogno”.
13
Anche le ricerche svolte nell’ambito della neuropsicologia del sogno (per approfondimenti
sull’approccio cfr., par. 1.3.) hanno ulteriormente confermato l’infondatezza di tale
equazione, grazie agli studi di Solms sui pazienti cerebrolesi. Per comprendere il
contributo dell’autore si deve partire dagli studi di Jouvet (1962) e da come questi abbiano
influenzato i principali e contemporanei modelli di controllo del ciclo del sonno. Jouvet ha
indagato il rapporto tra prosencefalo e tronco encefalico nella generazione del sonno REM
e, quindi, anche dell’attività onirica (muovendosi ancora in un paradigma di inscindibilità
dei due fenomeni), ottenendo i seguenti risultati: quando il prosencefalo viene separato dal
tronco encefalico vi è una soppressione del sonno REM, che non si registra quando ad
essere isolato è il tronco encefalico. L’interpretazione che si dà di questi dati è che non solo
il prosencefalo da solo non può generare il sonno REM, ma questo risulta anche accessorio
rispetto alla comprovata funzione del tronco encefalico.
Un modello, considerato per molto tempo valido ed autorevole, che riprende questi risultati
è quello di attivazione-sintesi di McCarley e Hobson (1975). Questi autori portano avanti
l’ipotesi che sia l’attività colinergica del tronco encefalico pontino ad innescare il sonno
REM e l’attività onirica (Hobson et al., 1977; 1986; 1998b); nello specifico, i sogni (e
quindi anche il sonno REM) sono attivamente generati dal tronco encefalico e
passivamente sintetizzati dal prosencefalo, per cui le immagini oniriche non sono il
prodotto delle aree cognitive del cervello. Nel frattempo, si diffusero una serie di evidenze
empiriche (di cui prima) che indebolirono l’ipotesi per cui l’attività onirica è generata solo
dal meccanismo fisiologico della fase REM, richiedendo, dunque, necessaria una revisione
del modello di attivazione-sintesi alla luce di tali scoperte. Le modificazioni di questo
modello (Activation-Input-Mode [AIM] model, Hobson, 1992; 1994) sono passate quasi
inosservate, in quanto sostanzialmente non è stata mai abbandonata l’ipotesi sul primato
del tronco encefalico pontino sulla MSA, virando soltanto dall’ipotesi di un legame tra
sonno REM e sogno a quella di un collegamento anatomico tra tronco cerebrale pontino e
attività onirica.
Per indagare la validità di queste ipotesi sono stati effettuati studi su 26 soggetti con tronco
encefalico lesionato (Adey et al., 1968; Chase et al., 1968; Cummings & Greenberg, 1977;
Feldman, 1971; Lavie et al., 1984; Markand & Dyken, 1976; Osorio & Daroff, 1980) ed
effettivamente queste lesioni sono accompagnate dalla soppressione del sonno REM, ma
solo in un caso (Feldman, 1971) è stato riscontrato il pattern “lesione tronco encefalicosoppressione sonno REM-cessazione dell’attività onirica”. Tuttavia, non è stato possibile
affermare nemmeno il contrario, cioè che questa lesione non interferisce con l’attività
14
onirica, in quanto le lesioni in questione erano talmente ampie da compromettere la
coscienza, per cui non si è potuta indagare la relazione sonno REM-sogno (Hobson et al.,
1998b). Quindi, se da un lato è stata riconfermata l’ipotesi per cui sono i neuroni
colinergici del tronco encefalico (nello specifico dell’area peripeduncolare) ad innescare il
sonno REM, non si poteva dire lo stesso per l’attività onirica. Per individuare i meccanismi
sottesi alla MSA, Solms analizzò 111 casi disponibili nella letteratura neurologica umana,
trovandone 110 in cui era riscontrabile una lesione al prosencefalo, l’assenza di attività
onirica e la presenza di sonno REM (Solms, 2000). Questo perché il sistema
dopaminergico di questa area cerebrale, la cui attività in questi casi specifici risulta
compromessa, potrebbe essere coinvolto nella generazione dei sogni (e.g., Frank, 1946;
Partridge, 1950).
In conclusione, l’attività onirica sarebbe il risultato di un’attivazione dopaminergica a
livello prosencefalico, mentre la fase REM è legata all’attività colinergica del tronco
encefalico pontino. Quindi, questi risultati confermano l’ipotesi che il sogno non è una
funzione intrinseca del sonno REM o semplicemente un suo epifenomeno, in quanto
risponde a diversi meccanismi fisiologici. Nello specifico, l’attività onirica e il sonno
REM, sebbene abbiano un legame, sono stati doppiamente scindibili: il sonno REM può
non essere accompagnato da attività onirica e viceversa (Solms, 2000).
In estrema sintesi, i riscontri ottenuti dagli anni ’60 fino ad oggi hanno scardinato il
paradigma dicotomico tra REM e NREM, dimostrando come il sonno REM non abbia
“l’esclusiva” sull’attività onirica.
1.3 L'approccio neuropsicologico nella ricerca sul sogno
L’ipotesi suggestiva di un isomorfismo tra sonno REM e sogno, nonché l’intrinseca
difficoltà di un accesso diretto a quest’ultimo, hanno di fatto ostacolato e rallentato la
ricerca in questo ambito. Un contributo in questa direzione proviene dalle neuroscienze le
quali hanno fornito delle tecniche che hanno permesso di indagare le basi neurali del
ricordo dei sogni. Infatti, un approccio metodologico attualmente in uso nella ricerca sui
sogni è quello neuropsicologico che analizza i resoconti della MSA raccolti in seguito a
risvegli sperimentali in particolari stadi del sonno, sia su soggetti normali che su pazienti
affetti da patologie interne, neurologiche o psichiatriche. Tale approccio, rispetto a quello
psicofisiologico, prende in considerazione anche altre variabili fisiologiche e patologiche,
15
soprattutto mediante l’utilizzo delle nuove tecniche di imaging sul cervello (Fagioli, 2002).
Fa parte di questo approccio la cosiddetta “neuropsychology of dreaming”, a cui si deve la
scoperta che i neuroni dopaminergici del prosencefalo sono responsabili della MSA,
sganciando definitivamente quest’ultima dal sonno REM (cfr., par. 1.2). Nello specifico,
Solms (2000), analizzando i 110 casi disponibili in letteratura di cui prima, notò che quanti
presentavano il pattern “prosencefalo lesionato-soppressione dei sogni-sonno REM
inalterato” potevano essere divisi in due gruppi: 94 casi presentavano una lesione nella
giunzione temporo-parietale-occipitale (PTO), di cui 83 unilaterali e 11 bilaterali; nei
restanti 16 la lesione, sempre bilaterale, riguardava tratti di sostanza bianca che circondano
le corna anteriori dei ventricoli laterali (corteccia prefrontale ventromediale). L’autore nota
come le stesse fibre dopaminergiche della corteccia prefrontale siano recise nella
leucotomia prefrontale e che il 70-90% dei soggetti sottoposti a questo intervento
neurochirurgico non presenta attività onirica (Frank, 1946; 1950; Jus et al., 1973;
Panksepp, 1985; Partridge, 1950; Piehler, 1950; Schindler, 1953). Al contrario, gli agonisti
dopaminergici, come la L-dopa, sembrano aumentare i sogni vividi e gli incubi (Nausieda
et al., 1982;. Scharf et al., 1978) senza agire sull’intensità, la durata o la frequenza del
sonno REM (Hartmann et al., 1980). La coerenza complessiva di questi riscontri
rappresenta un’ulteriore riprova del ruolo del sistema dopaminergico nella generazione dei
sogni.
L’ipotesi che la giunzione temporo-parietale-occipitale e la corteccia prefrontale
ventromediale siano implicate nella generazione dei sogni è coerente con le pregresse
conoscenze sulle funzioni e i meccanismi che queste aree sovrintendono. Infatti, la
giunzione
temporo-parietale-occipitale
nell’immaginazione
mentale
(Kosslyn,
supporta
1994),
i
processi
mentre
la
cognitivi
corteccia
implicati
prefrontale
ventromediale sovrintende ai processi di volere e ricerca (Panksepp, 1985; 1998a), essendo
il sito primario delle azioni più stimolanti (non a caso, un’iperattività di questo sistema
causa i sintomi positivi della schizofrenia).
Anche recenti evidenze clinico-anatomiche (Solms, 1997a) e di imaging funzionale (Braun
et al., 1997; 1998) confermano il coinvolgimento delle aree cerebrali sopracitate,
individuando anche aree non implicate nell’attività onirica, come la corteccia prefrontale
dorsolaterale e quella visiva primaria (Braun et al., 1998).
Rispetto alla corteccia visiva è stata riscontrata un’interessante dissociazione: lesioni della
corteccia visiva associativa provocano anomalie nella visualizzazione delle immagini
oniriche (Solms, 1997a), mentre lesioni della corteccia primaria non hanno alcun effetto
16
sulla possibilità di “vedere” le immagini oniriche. Anche studi di neuroimaging
confermano questo dato, fornendo anche una possibile spiegazione: durante il sonno REM
vi è un’attivazione della corteccia visiva associativa e una disattivazione di quella primaria
(Braun et al., 1998), ma questa dissociazione non si riscontra durante la veglia in quanto
sono entrambe attive (Braun et al., 1997). Probabilmente, durante il sonno REM, le
informazioni visive vengono elaborate dalla corteccia associativa, rendendo di fatto inutile
l’attivazione sia della corteccia visiva primaria che di quella prefrontale.
Invece, rispetto alla disattivazione della corteccia prefrontale dorsolaterale durante
l’attività onirica viene proposta la seguente spiegazione: essendo quest’area cerebrale
importante per le funzioni di attenzioni, la sua disattivazione durante il sonno REM è
coerente con il fatto che i sognatori hanno uno scarso controllo su quello che accade nel
sogno, accettando in modo acritico tutte le sue bizzarrie ed incongruenze (Desseilles et al.,
2011). Inoltre, la quiescenza attentiva che consegue a questa disattivazione cerebrale,
spiegherebbe come mai gli stimoli esterni non interrompono o influenzano la trama onirica
(Burton et al., 1988; Foulkes, 1966).
Quando le lesioni cerebrali compromettono la cognizione in veglia, ci sono anche dei
deficit corrispondenti nei sogni (Nir & Tononi, 2010). Diversi studi, quindi, dimostrano
che le lesioni cerebrali, quali quelle della corteccia visiva associativa, che comportano dei
danni durante la veglia, causano anche disfunzioni parallele nell’attività onirica. Ad
esempio, soggetti che hanno una percezione dei volti alterata, riporteranno questa stessa
alterata percezione anche nei sogni (Solms, 1997; Solms, 2000); oppure lesioni in
specifiche regioni che sottendono la percezione visiva del colore o movimento
provocheranno deficit corrispondenti nei sogni (Solms, 2000; Kerr et al., 1981). Con la
stessa ipotesi di fondo, lo studio di Cipolli e collaboratori (1992) su pazienti affetti dal
morbo di Parkinson ha dimostrato la correlazione tra il funzionamento cognitivo di questi
soggetti e le caratteristiche strutturali dei resoconti della MSA del sonno REM. Nello
specifico, questa patologia neurologica influenza soprattutto le caratteristiche sequenziali e
strutturali dei sogni, ostacolando ad esempio l’elaborazione delle informazioni. Quindi, è
possibile affermare che la pianificazione sogno riflette il grado di funzionamento cognitivo
non solo durante il sonno, ma anche durante la veglia.
Anche Doricchi e Violani (1992) hanno valutato i siti delle lesioni che interferiscono con
l’attività del sognare, trovando che i danni nei lobi frontali non sono necessariamente
associati con la perdita del sogno, mentre le lesioni nei lobi parietali e quelle associate a
sindromi disconnettive potrebbero causare una perdita dell’attività onirica, ma senza una
17
notevole asimmetria emisferica. Inoltre, hanno chiarito che la cessazione del sogno dopo
un danno unilaterale a destra o a sinistra era frequente tanto quanto lo era dopo un danno
bilaterale. Quindi, poiché lesioni cerebrali anche solo unilaterali bastano a far perdere
l’attività onirica, gli autori sono giunti alla conclusione che entrambi gli emisferi sono
necessari per quest’attività, e nello specifico l’emisfero destro fornisce il materiale per i
sogni, mentre quello sinistro i mezzi per la sua decodifica. Infatti, per molto tempo si era
ipotizzato che il sogno fosse una funzione del solo emisfero destro, fino a quando la
neuropsicologia non ha dato il suo contributo all’interno di questa polemica sulla
lateralizzazione emisferica2 delle strutture che producono i sogni. Studi su pazienti splitbrain hanno dimostrato l’infondatezza di tale credenza: paragonando i resoconti e i
contenuti dei sogni di questi pazienti con quelli di un gruppo di controllo, si è potuto
constatare che i pazienti split-brain mostravano la stessa capacità degli altri di riferire i
sogni (McCormick et al., 1997).
Quindi, attraverso l’approccio neuropsicologico sono state individuate lesioni cerebrali
specifiche che possono essere la causa della perdita o dell’alterazione del sogno; pertanto
Solms (1997), basandosi sull’osservazione di 332 casi clinici con confermata lesione
cerebrale, propose una nosologia di disturbi del sognare correlati a lesioni cerebrali:
-
Anoneria visiva, perdita totale o parziale delle immagini visive del sogno causata
da una lesione bilaterale mediale occipito-temporale;
-
Anoneria globale, cessazione totale dell’attività onirica, pur in presenza di una vista
inalterata, a causa di lesioni bilaterali posteriori frontali corticali o sottocorticali;
-
Anoneroagnosia, difficoltà a distinguere tra esperienze oniriche ed elementi di
realtà, a causa di lesioni frontali limbiche;
-
Sindrome da incubi ricorrenti, a causa di un’attività convulsiva nell’area frontale
limbica.
Come già accennato, la neuropsicologia si è servita delle tecniche di neuroimaging per i
suoi studi, anche se in questo campo ci sono ancora delle carenze. Ad esempio, la
neuroanatomia funzionale dei sogni rischia di rimanere su un piano puramente speculativo,
in quanto carente di sistematicità. Nello specifico, mancano le misure di imaging
funzionale prima dei risvegli da qualsiasi stadio del sonno, a prescindere se questo sia
accompagnato o meno dal ricordo onirico. Tra l’altro, queste ricerche si dimostrano
2
Per lateralizzazione emisferica si intende l’asimmetria nella distribuzione delle funzioni cerebrali tra i due
emisferi, ovvero il fatto che uno dei due “domini” sull’altro per alcune funzioni.
18
limitate a causa della loro scarsa risoluzione temporale, rendendo difficile la valutazione di
cambiamenti su un lasso temporale più ampio (De Gennaro et al., 2012). Le tecniche di
neuroimaging più utilizzate sono la PET (Positron Emission Tomography) e la fMRI
(Risonanza Magnetica Funzionale); la fMRI, rispetto alla PET, non è invasiva per cui può
essere ripetuta più volte e fornisce misure dei cambiamenti funzionali del cervello ad alta
risoluzione. Nonostante questi vantaggi, la fMRI è di difficile impiego negli studi sui
sogni, in quanto produce forti rumori e necessita dell’immobilizzazione della testa. Quindi
è stata utilizzata soprattutto la PET, riuscendo a descrivere la neuroanatomia funzionale del
sonno e le eventuali correlazioni con le caratteristiche dei sogni, soprattutto rispetto al
sonno REM. Infatti, uno dei limiti degli studi di neuroimaging è che sono andati alla
ricerca di prove per rafforzare la connessione sonno REM-sogni, nonostante numerosi
studi avessero già mostrato la debolezza di questo legame (cfr., par. 1.2).
Comunque, tramite la PET è stato possibile individuare alcune aree cerebrali responsabili
della modulazione di specifiche caratteristiche dei sogni: gli aspetti percettivi dei sogni
sembrerebbero legati all’attivazione delle cortecce occipitale e temporale durante il sonno
REM, infatti l’elevata attivazione della corteccia visiva occipito-temporale spiega le vivaci
immagini tipiche dei sogni (e.g., Braun et al., 1997); le caratteristiche emotive
sembrerebbero legate all’attivazione dell’amigdala, della corteccia orbito-frontale e della
corteccia cingolata anteriore (e.g., Maquet et al., 1996; Maquet et al., 1997; Hobson et al.,
1998); le alterazioni del ragionamento logico, la memoria di lavoro, la memoria episodica
e le funzioni esecutive che caratterizzano i resoconti REM sembrerebbero causate
dall’ipoattivazione della corteccia prefrontale (e.g., Maquet et al., 1996).
Altri studi hanno avanzato l’ipotesi di una differente attività metabolica tra i due stati del
sonno: il sonno NREM, rispetto al REM, presenta un’evidente riduzione dei livelli di
attivazione di talamo, tronco encefalico pontino, corteccia orbitofrontale, corteccia
cingolata anteriore e corteccia prefrontale laterale (e.g., Braun et al., 1997; Maquet et al.,
1997). Rispetto a questo modello di progressiva disattivazione regionale è possibile fare
due constatazioni: in primis, questo declino è coerente con il sopraggiungere del sonno
“profondo” (ad onde lente) del NREM; in secundis, questo modello evidenzia il contrasto
tra i due stati del sonno, laddove le stesse aree che vanno incontro a disattivazione durante
il NREM si attivano, invece, durante il REM. Infatti, studi di neuroimaging hanno
confermato un modello di attivazione regionale durante il REM già ipotizzabile grazie alle
registrazioni EEG (Jones, 1991; Steriade & McCarley, 1990), evidenziando un elevato
fabbisogno energetico cerebrale (Maquet et al., 1990) e un aumento del flusso sanguigno
19
cerebrale (Madsen, Holm et al., 1991; Madsen, Schmidt et al., 1991; Madsen & Vorstrup,
1991). Nello specifico, le regioni cerebrali in cui è riscontrabile tale attivazione sono: il
tegmento pontino, il talamo, il prosencefalo basale, l’amigdala, l’ippocampo e la corteccia
cingolata anteriore (Braun et al., 1997; Maquet et al., 1996; Nofzinger et al., 1997).
Inoltre, durante il sonno REM si attivano le aree cerebrali deputate al movimento, tra cui le
cortecce motorie e premotorie primarie, il cervelletto e i gangli della base (Braun et al.,
1997; Maquet et al., 2000). Questi dati sembrano essere coerenti con i contenuti motori dei
sogni e con la necessaria atonia muscolare che accompagna il REM, impedendo ai sogni di
essere agiti.
Alcuni studi di neuroimaging e registrazioni intracraniche suggeriscono come l’ippocampo
e l’amigdala abbiano un ruolo centrale nel sogno. Nello specifico, l’ippocampo media la
riproduzione parziale nei sogni dei ricordi degli eventi di veglia (Fell et al., 2001; Fell et
al., 2006), mentre l’amigdala è coinvolta nell’elaborazione di ricordi emotivamente
significativi durante il sonno, per cui il carico emotivo dei sogni potrebbe essere correlato
al suo livello di attivazione (Misane et al., 2005; Maquet, 2000; Nofzinger et al., 2002).
Studi recenti indicano come le caratteristiche strutturali di amigdala e ippocampo siano
associate all’elaborazione cognitiva ed emotiva nei compiti durante la veglia (Maguire et
al., 2000; Iaria et al., 2008); allo stesso modo, altre analisi microstrutturali hanno reso
evidente come le caratteristiche strutturali di queste aree sottocorticali siano correlate ad
aspetti qualitativi della MSA riportate dopo il risveglio (cfr., par. 1.4). Queste misurazioni
morfo-anatomiche di aree sottocorticali fanno parte di approcci “strutturali” che potrebbero
superare alcuni ostacoli degli approcci “funzionali”, mostrandosi utili per fornire
informazioni sui correlati neurali dell’attività onirica (De Gennaro et al., 2012).
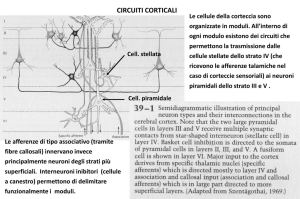
Fanno parte dell’approccio neuropsicologico anche quegli studi che hanno indagato
l’elettrofisiologia corticale locale del sonno e del sogno per valutarne i correlati neurali,
dimostrando che l’attività cerebrale durante il sonno non è omogenea e trovando anche un
importante link tra l’attività onirica e la veglia (e.g., Marzano et al., 2011) (cfr., par. 1.4).
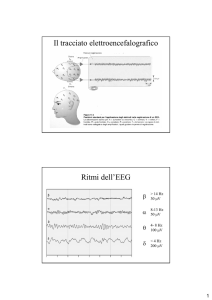
1.4 Correlati elettroencefalografici del richiamo dell'attività mentale nel sonno
Avendo ormai appreso che il sogno è una costante delle ore di sonno (cfr., par. 1.2), è
possibile comprendere come il cervello e la mente “non dormano mai”, presentando
sempre un certo livello di attivazione (Wittmann et al., 2004). Si tratta però di
20
un’attivazione tutt’altro che omogenea, in quanto si susseguono ciclicamente specifici
pattern elettroencefalografici, più o meno sincronizzati, in specifiche aree cerebrali,
considerati dei veri e propri correlati neurali o elettroencefalografici del sonno.
Come già accennato, le prime evidenze empiriche in termini di correlati neurali del sonno
sono state possibili grazie all’introduzione, nel 1920, dell’elettroencefalografia (cfr., par.
1.1), poi a seguire, nel 1953, si è potuto dividere il sonno in REM e NREM, quest’ultimo a
sua volta scomposto in quattro fasi. Invece, rispetto alle diverse aree cerebrali, alcuni studi
di neuroimaging hanno trovato che le stesse aree corticali (ad esempio, la corteccia
cingolata anteriore, il talamo, il tronco encefalico pontino, ecc.) che presentano un’elevata
attività metabolica durante il sonno REM, vanno poi incontro ad una brusca disattivazione
durante il NREM (e.g., Braun et al., 1997; Maquet et al., 1997) (cfr., par. 1.3).
Questa disomogeneità del sonno non si riscontra solo rispetto all’attività elettrica neurale,
ma anche nei termini di diverse aree cerebrali (quindi, anche a livello spaziale), e ciò è
supportato anche da altre prove. Ad esempio, l’utilizzo di nuove tecnologie quali la
presenza di più canali EEG ha consentito lo studio delle dinamiche spazio-temporali EEG
durante il sonno, dimostrando che le dinamiche omeostatiche del processo di recupero
sono locali e che non coinvolgono l’intera corteccia nella stessa misura (Ferrara et al.,
2011). Questo fenomeno può essere spiegato con la teoria del sonno locale: il sonno è un
processo uso-dipendente, in quanto l’attività corticale locale durante il sonno dipende
dall’attività cerebrale locale passata durante la veglia. L’attività corticale locale durante il
sonno è valutata in base alla quantità dell’attività ad onde lente (SWA) ed è stato notato
come questa si presenti in misura maggiore soprattutto nella corteccia frontale (Werth et
al., 1996; Marzano et al., 2010). Coerentemente con la teoria uso-dipendente locale, questo
fenomeno dipenderebbe da un bisogno maggiore di sonno ad onde lente della corteccia
frontale, a sua volta causato dai suoi maggiori livelli di attivazione durante la veglia.
Invece, rispetto alla MSA si è cercato di capire quanto i resoconti fossero delle fedeli
restituzioni dell’attività onirica. A tal proposito, combinando approcci fisiologici con
l’analisi dei contenuti dei sogni, si è potuto dimostrare che i resoconti dei sogni altro non
sono che le restituzioni della MSA durante il sonno, dal momento che le misure
fisiologiche registrate in fase REM sono, almeno in parte, coerenti con i contenuti dei
sogni riferiti al risveglio (Erlacher et al., 2008). Tale corrispondenza potrebbe essere
spiegata dalla teoria della simulazione neurale dell’azione, in base alla quale le azioni
immaginate e quelle eseguite condividono lo stesso substrato neurale, attivando le
medesime regioni cerebrali (Decety, 1996). Pertanto, l’unica differenza che intercorre tra
21
un’azione sognata ed una eseguita consiste proprio nella mancata esecuzione motoria della
prima, infatti, durante la fase REM, il dormiente è colto da una totale atonia muscolare che
gli impedisce di agire i suoi sogni.
Dal loro canto, anche gli studi sulla percezione visiva sono andati nella direzione di una
condivisione di alcuni meccanismi neurali tra veglia e sogno: ad esempio, pazienti con
lesione in V4 non generano l’immagine di colori e di volti né durante la veglia né durante i
sogni (Solms, 2000; Adler, 1944; Adler, 1950; Botez et al., 1985; Brain, 1950; Brain, 1954;
Charcot, 1983; Kerr et al., 1978; Macrae & Trolle, 1956). In alcuni casi, infatti, è stato
dimostrato che lesioni cerebrali che compromettono le funzioni cognitive in veglia causano
deficit corrispondenti anche nei sogni (Nir & Tononi, 2010) (cfr., par. 1.3). In realtà, non
sempre vi è la corrispondenza attesa tra le anomalie della MSA e le cortecce lesionate. Ad
esempio: le immagini oniriche sembrano essere influenzate da lesioni della corteccia
primaria unimodale sensomotoria (Solms, 2000); pazienti emiplegici3 mantengono nei loro
sogni le immagini somatosensoriali e motorie (Solms, 1997; Brown, 1989; Mach, 1959);
pazienti afasici4 nei loro sogni riescono ad avere un’immagine dei discorsi audioverbali
(Solms, 1997; Cathala et al., 1983; Schanfald et al., 1985). Questi dati sostengono l’ipotesi
che gli aspetti somatosensoriali, motori e audioverbali dei sogni non sono modulati dalle
rispettive cortecce unimodali, ma probabilmente da cortecce eteromodali paralimbiche o
temporo-parietali-occipitali (Solms, 2000).
Per quanto riguarda i più specifici correlati neurali della MSA, l’approccio
neuropsicologico ha fornito un importante contributo, nonostante delle volte abbia tentato
di riproporre l’ormai superata equazione “sogno=sonno REM”. Uno dei contributi più
importanti in questa direzione è quello di Solms, che ha dimostrato il ruolo del
prosencefalo (nello specifico della giunzione temporo-parietale-occipitale e della corteccia
prefrontale ventromediale) nella generazione dei sogni (Solms, 1997; 2000) (cfr., par.1.3).
Un altro riscontro importante nell’ambito delle neuroscienze è quello per cui anche
l’ippocampo ed l’amigdala giocano un ruolo importante nel sogno: il primo media la
riproduzione parziale dei ricordi di veglia nei sogni, mentre la seconda gioca un ruolo
3
L’emiplegia è una condizione patologica caratterizzata da una perdita completa dell’attività motoria
volontaria di una metà del corpo. Essa è determinata da lesioni dei fasci nervosi piramidali che conducono gli
impulsi nervosi della motilità volontaria.
4
L’afasia è un disturbo del linguaggio consistente nell’incapacità di comprensione delle parole,
nell’incapacità di formulare le parole o nella compromissione di entrambe le funzioni, pur essendo del tutto
integri gli strumenti periferici di ricezione e di emissione dei suoni. Essa è determinata da lesioni delle aree
del cervello deputate all’elaborazione del linguaggio.
22
nell’elaborazione dei ricordi emotivamente significativi durante il sonno.
Rispetto all’ippocampo, il primo indizio circa il suo coinvolgimento nella memoria
proviene da registrazioni intracraniche su pazienti epilettici che dimostrano il ruolo della
connettività5 rino-ippocampale nella formazione della memoria esplicita durante la veglia
(Fell et al., 2001). Il collegamento con il sonno è ravvisabile dai risultati di un secondo
studio che trova una relazione tra il ricordo dei sogni in seguito a risvegli REM e
l’aumentata connettività rino-ippocampale ed intraippocampale durante questo stadio del
sonno (Fell et al., 2006). Si evince, dunque, come la capacità di accedere ai contenuti
mnestici dei sogni possa essere correlata all’attività coordinata di queste due aree corticali,
laddove una migliore connettività funzionale aumenta la probabilità di ricordare i sogni.
Rispetto all’amigdala, è stato dimostrato il suo ruolo sia nel recupero e nella codifica della
memoria emozionale sia nell’espressione delle emozioni durante la veglia (Misane et al.,
2005). Parallelamente, è stata riscontrata una maggiore attivazione di quest’area durante il
sonno rispetto alla veglia e, nello specifico, quest’attivazione sembra essere maggiore in
quei soggetti che riferiscono un sogno in seguito ad un risveglio REM (Maquet, 2000;
Nofzinger et al., 2002). Questi risultati sostengono, dunque, l’ipotesi di un coinvolgimento
dell’amigdala nell’elaborazione dei ricordi emotivamente significativi durante il sonno, per
cui il carico emotivo dei sogni potrebbe essere correlato al suo livello di attivazione.
Le informazioni sui correlati neurali dell’attività onirica provengono anche da approcci
“strutturali”, come quelli che hanno individuato inizialmente un’associazione tra le
caratteristiche strutturali di amigdala e ippocampo e l’elaborazione cognitiva ed emotiva
nei compiti durante la veglia (Maguire et al., 2000; Iaria et al., 2008). Di seguito, altre
analisi microstrutturali (De Gennaro et al., 2011) hanno reso evidente come le
caratteristiche strutturali di queste aree sottocorticali siano correlate anche ad aspetti
qualitativi della MSA, quali il carico emotivo, la vivacità e la bizzarria del sogno. Nello
specifico, la bizzarria dei sogni correla negativamente con il volume dell’amigdala sinistra
e positivamente con l’integrità microstrutturale dell’amigdala destra, mentre il carico
emotivo è direttamente proporzionale all’integrità microstrutturale dell’amigdala sinistra;
deboli relazioni sono state individuate tra la bizzarria e la misura dell’ippocampo. Rispetto,
invece, agli aspetti quantitativi della MSA (ad esempio, il numero medio dei sogni ricordati
al giorno) non risultano correlazioni con le misure strutturali di amigdala e ippocampo.
Inizia, quindi, a delinearsi un quadro abbastanza coerente che evidenzia la continuità tra i
5
Con il termine “connettività” ci si riferisce al collegamento e alla comunicazione tra due regioni cerebrali.
23
meccanismi corticali e sottocorticali della veglia e l’attività cognitiva durante il sonno,
nello specifico sembra esserci un rapporto tra memoria episodica, attività corticale e
attività onirica. L’ipotesi è la seguente: dal momento in cui i sogni accedono ai contenuti
della memoria episodica, codificata poi in memoria dichiarativa (o esplicita) durante il
sonno, il processo di recupero dei contenuti onirici potrebbe avere dei meccanismi
elettrofisiologici in comune con i processi di codifica dei ricordi episodici attivi durante la
veglia; in altri termini, veglia e sonno condividerebbero alcuni meccanismi neurofisiologici
per la codifica della memoria episodica.
Per quanto riguarda la codifica della memoria episodica durante la veglia, alcuni studi
hanno evidenziato come oscillazioni theta servano ad ordinare temporaneamente le
rappresentazioni della memoria episodica (Nyhus et al., 2010). Anche studi di registrazioni
intracraniche hanno dimostrato che gli aumenti delle oscillazioni theta, nella corteccia
frontale, durante la fase di codifica sono predittivi di successivi periodi di ricordo
(Sederberg et al., 2003). Nello specifico, l’aumento dell’attività oscillatoria theta nella
corteccia frontale renderebbe possibile da parte di quest’ultima un controllo
sull’ippocampo (e.g., Nyhus et al., 2010), implicato nella codifica e nel recupero dei
ricordi episodici in veglia. Infatti, l’attività coordinata tra ippocampo e corteccia rinale
(connettività rino-ippocampale) media la formazione della memoria episodica (Fell et al.,
2001).
Altri meccanismi neurali ed altre aree cerebrali sembrano essere coinvolte nel processo di
codifica della memoria episodica in veglia: alcune evidenze sostengono che la diminuita
attività alpha a livello temporo-parietale rende attive le informazioni immagazzinate
(Khader et al., 2011) e che l’amigdala è coinvolta sia nel controllo della codifica e del
recupero delle memorie emozionali che nell’espressione delle emozioni (Misane et al.,
2005).
Coerentemente con questo quadro di conoscenze in veglia, è stato proposto un ruolo
dell’ippocampo e dell’amigdala nell’attività onirica, nei termini in cui il primo media la
riproduzione parziale dei ricordi di veglia nei sogni e la seconda gioca un ruolo
nell’elaborazione dei ricordi emotivamente significativi durante il sonno. Si evince,
dunque, come queste aree cerebrali possano mediare lo stesso tipo di funzione sia durante
il sonno che durante la veglia.
Il secondo collegamento tra sonno e veglia, che supporta l’ipotesi di una condivisione di
alcuni meccanismi neurofisiologici tra questi due stati, è evidente se si analizzano i dati
elettrofisiologici forniti da Marzano et al. (2011). Questo studio ha trovato che oscillazioni
24
cerebrali in specifici stadi, nei 5 minuti di sonno che precedono il risveglio mattutino sono
predittive del successivo ricordo dei sogni. Nello specifico, una maggiore attività frontale
theta durante il sonno predice il successivo ricordo dei sogni in seguito a risvegli dalla fase
REM, mentre una minore attività oscillatoria alpha nell’area temporo-parietale destra
predice il successivo ricordo dei sogni in seguito a risvegli dallo stadio 2 del sonno. Si
tratta, dunque, delle stesse attività (theta e alpha) e delle stesse aree cerebrali (frontale e
temporo-parietale) coinvolte nei processi di memoria in veglia. Quindi, è possibile
confermare l’ipotesi per cui sonno e veglia hanno gli stessi meccanismi di codifica dei
ricordi episodici.
Attività onirica e veglia sembrano condividere l’attivazione anche di altre aree cerebrali, in
quanto in entrambi i casi sono coinvolte la giunzione temporo-parietale e la corteccia
prefrontale ventromediale (cfr., par. 1.3). Solms non è stato l’unico che ha dimostrato il
ruolo di queste due aree prosencefaliche nella generazione dei sogni, in quanto anche
recenti studi di neuroimaging sono giunti alle stesse conclusioni. Ad esempio, Eichenlaub
et al. (2014) ha trovato che i soggetti con una più alta frequenza nel ricordo dei sogni
rispetto a quelli con una frequenza più bassa mostrano, durante il sonno, un più elevato
flusso ematico sia nella giunzione temporo-parietale che nella corteccia prefrontale
mediale. Un altro studio ha dimostrato che una lesione della giunzione temporo-parietaleoccipitale compromette l’attività onirica, nei termini in cui i resoconti della MSA sono solo
in forma sequenziale e narrativa, mancando dunque della componente visiva (Kerr et al.,
1981). Inoltre, questa stessa lesione compromette anche le abilità visuo-spaziali in veglia,
infatti, Kosslyn (1994) ha trovato che la giunzione temporo-parietale-occipitale supporta i
processi cognitivi implicati nell’immaginazione mentale. Invece, rispetto alla corteccia
prefrontale ventromediale, Panksepp (1985; 1998a) ha dimostrato come questa sovrintenda
ai processi di volere e ricerca. Nella stessa direzione, uno studio di neuroimaging ha
valutato il “self” e ha dimostrato come la valutazione del “self-relatedness” preveda anche
il coinvolgimento della corteccia prefrontale mediale e della giunzione temporo-parietale;
nello specifico, un’alta attività nelle suddette aree cerebrali sembra essere associata con un
aumentato vagare della mente e con un maggior coinvolgimento della memoria episodica e
dei processi di valutazione (Legrand & Ruby, 2009).
Interessante è il fatto che mentre una lesione della giunzione temporo-parietale-occipitale
(sistema posteriore) comporta sempre la perdita della MSA, la stessa stretta correlazione
non è stata individuata per la corteccia prefrontale ventromediale (sistema anteriore), in
quanto una lesione di quest’ultima non è invariabilmente associata alla cessazione dei
25
sogni. Ad esempio, alla leucotomia prefrontale consegue una cessazione totale dei sogni
nel 70-90% dei casi, quindi non in tutti i casi osservati (Solms, 2000). Inoltre, lesioni della
corteccia prefrontale dorsolaterale che causano problemi nell’automonitoraggio e nella
capacità di prendere decisioni durante la veglia, non incidono sui sogni (Nir & Tononi,
2010). D’altro canto, nella nosologia dei disturbi del sognare di Solms (cfr., par. 1.3) ne
rientrano due, l’anoneroagnosia e la sindrome da incubi ricorrenti, che dipenderebbero da
lesioni nell’area della corteccia prefrontale ventromediale (Solms, 1997).
In conclusione, tutte le evidenze elettrofisiologiche e neuropsicologiche riportate sono in
linea con un modello di continuità tra i substrati cerebrali della veglia e quelli dell’attività
onirica, anche se lasciano irrisolta una questione: i correlati neurali riscontrati sono
riconducibili a fattori di tratto o di stato? (cfr., par. 3.1)
26
Capitolo 2
Basi anatomo-funzionali della narcolessia
2.1 Aspetti clinici e fisiopatologia della narcolessia
La narcolessia è un disturbo neurologico che clinicamente si manifesta come un disturbo
del sonno, presentando sintomi quali eccessiva sonnolenza diurna, cataplessia, paralisi del
sonno e allucinazioni ipnopompiche e ipnagogiche. Si tratta di un disturbo che è stato
descritto per la prima volta più di cento anni fa, con Westphal (1877) e Gelineau (1880), e
che continua a suscitare molto interesse fra gli studiosi, nonostante la sua bassa incidenza
sulla popolazione generale. Infatti, la narcolessia è presente in circa un soggetto ogni 2000
(Silber et al., 2002) e uno degli studi epidemiologici più sofisticato ha trovato che su un
campione di 11354 gemelli singoli finlandesi solo lo 0,026% era affetto da narcolessia
(Hublin et al., 1994). Inoltre, la narcolessia sembra essere più frequente in Giappone, con
percentuali che si aggirano tra lo 0.16% e lo 0.18% (Tashiro et al., 1994; Honda, 1979), e
meno in Israele, con una percentuale dello 0.002% (Lavie & Pedel, 1987).
Rispetto all’età di esordio, da un’indagine di Dauvilliers et al. (2001a) sulla popolazione
francese e canadese emerge una distribuzione bimodale della quale non si conoscono le
ragione: sono stati, infatti individuati due picchi nell’età di insorgenza, il più alto è quello
dei 15 anni, l’altro dei 36. Quindi, solitamente la narcolessia esordisce in età
adolescenziale, anche se non mancano casi di esordi precoci o tardivi (dopo i 40 anni)
(Okun et al., 2002; Silber et al., 2002).
Il quadro sintomatologico della narcolessia può variare da caso a caso, ma, generalmente, i
suoi sintomi principali sono l’eccessiva sonnolenza diurna (EDS) e la cataplessia, mentre
quelli secondari sono le paralisi del sonno e le allucinazioni ipnopompiche e ipnagogiche.
L’EDS si presenta ogni giorno, ad intervalli regolari che possono variare da paziente a
paziente, ma, generalmente, si manifesta ogni 2 ore. Alcune volte il paziente riesce a
vincere l’EDS, ma il più delle volte questa prende il sopravvento e il soggetto non riesce a
resistere al sonnellino; questo fenomeno è più probabile che si presenti quando il paziente è
fisicamente inattivo, ad esempio quando è seduto in macchina o davanti la televisione.
Questi episodi di sonno sono caratterizzati da un esordio precoce della fase REM (Vogel,
1960; Dement et al., 1966) e hanno una durata che varia in base ai fattori ambientali; questi
27
sonnellini ripristinano il normale livello di vigilanza per un’ora o più e sono proprio il
numero di ore che intercorre tra un episodio e un altro ad informare della gravità della
patologia (Dauvilliers et al., 2003). Questa eccessiva sonnolenza diurna può causare anche
disattenzione, discorsi confusi, visione offuscata, diplopia e comportamenti automatici
come mettere gli oggetti in luoghi strani o guidare verso mete non prestabilite. Nello
specifico, in almeno la metà di questi pazienti sono stati segnalati problemi di memoria
(Aguirre et al., 1985), anche se i loro test neuropsicologici sono generalmente normali.
Solitamente, i narcolettici si addormentano non appena si coricano, ma il loro sonno è
interrotto da numerosi risvegli (Montplaisir et al., 1978), motivo per cui, in un primo
momento, l’EDS è stata ritenuta la diretta conseguenza di questa cattiva qualità del sonno
notturno. Andando a monitorare i livelli di sonnolenza diurna in quei narcolettici che
mantenevano una buona qualità del sonno notturno, ci si rese conto che questi mostrano
ugualmente un’EDS (Harsh et al., 2000), pertanto, la qualità del sonno notturno dà solo un
minimo contributo alla cronica sonnolenza del paziente (Harsh et al., 2000; Broughton et
al., 1994); quindi, un rapporto significativo tra scarsa qualità del sonno notturno e
sonnolenza diurna non è mai stato trovato.
Mentre l’EDS può presentarsi anche nel quadro sintomatologico di altri disturbi o essere
esso stesso un disturbo secondario ad un altro, la cataplessia è patognomica della
narcolessia, ovvero è associata solo ed esclusivamente a questa patologia. Il 60% dei
pazienti narcolettici manifesta cataplessia, che, solitamente, esordisce poco dopo l’EDS,
ma talvolta può seguirla di 3-5 anni (Okun et al., 2002; Silber et al., 2002); è raro che la
cataplessia sia la prima manifestazione clinica della narcolessia, infatti solitamente il primo
sintomo accusato da questi pazienti è l’eccessiva sonnolenza diurna. La cataplessia
consiste in un improvviso calo del tono muscolare causato da fattori emotivi, soprattutto da
emozioni positive (Okun et al., 2002; Guilleminault et al., 1995; Anic-Labat et al., 1999),
e questi sintomi peggiorano se il soggetto è stanco e in debito di sonno. Molto
probabilmente, si tratta di un’intrusione dell’atonia muscolare del sonno REM durante la
veglia. Un attacco cataplettico può portare ad un totale collasso del soggetto, in cui tutti i
muscoli striati cedono e il soggetto cade di peso a terra, oppure può interessare solo un
numero limitato di muscoli, come quelli facciali, degli arti superiori o degli arti inferiori. Il
medico deve prestare attenzione soprattutto a queste forme incomplete di attacchi
cataplettici, perché il paziente, non ritenendoli sintomi patologici, potrebbe trascurarli. La
durata dell’attacco cataplettico può variare da qualche secondo a qualche minuto, lasso
temporale durante il quale il paziente rimane totalmente cosciente; anche la frequenza con
28
cui si manifesta varia da soggetto a soggetto, andando da un minimo di un attacco all’anno
ad un massimo di più attacchi al giorno. Alcuni pazienti possono sperimentare lo “stato
cataplettico”, una rara manifestazione della narcolessia che può essere esacerbata dalla
sospensione dei farmaci anticataplettici (Passouant et al., 1970; Parkes, 1985; Hishikawa &
Shimizu, 1995) e che è caratterizzata da attacchi cataplettici che possono durare anche
alcune ore al giorno, costringendo il soggetto a stare a letto.
Nel quadro sintomatologico della narcolessia possono essere presenti anche altri sintomi,
definiti ausiliari perché non sono necessari per diagnosticare questa patologia. I sintomi in
questione sono le allucinazioni ipnopompiche e ipnagogiche e le paralisi del sonno, che
possono manifestarsi anche in condizioni diverse dalla narcolessia, come ad esempio nel
caso di deprivazione cronica di sonno, apnee ostruttive e, occasionalmente, in soggetti sani
(Aldrich, 1996; Dahlitz et al., 1993).
Le allucinazioni ipnopompiche sono allucinazioni oniriche, spesso spaventose, che il
soggetto sperimenta nella fase di transizione tra sonno e veglia (quindi, al momento del
risveglio), mentre le allucinazioni ipnagogiche sono sperimentate nel passaggio dalla
veglia al sonno (momento dell’addormentamento). Tali allucinazioni possono essere
visive, tattili, uditive e, a volte, addirittura vestibolari (come quando si ha l’improvvisa
sensazione di cadere); i soggetti durante queste “visioni” non si rendono conto della loro
natura allucinatoria e, spaventati, possono ricorrere a comportamenti rassicuranti prima di
addormentarsi, come tenere un’arma o un cane in camera da letto.
Spesso associate alle allucinazioni ipnagogiche, le paralisi del sonno colpiscono il soggetto
in fase di addormentamento o al risveglio dal sonno REM (Hishikawa, 1976) e consistono
nella totale incapacità di muoversi e, a volte, di respirare normalmente. Si tratta di un
fenomeno che solitamente dura alcuni istanti, ma che può durare anche alcuni minuti; per
far uscire il soggetto da questa spiacevole e spaventosa condizione è sufficiente che questi
venga toccato, infatti, molte delle persone che sperimentano questi sintomi stabiliscono un
codice con il loro compagno di letto, in modo tale da poter essere aiutati.
La narcolessia è una malattia cronica fortemente invalidante e i diversi quadri
sintomatologici appena descritti danno un’idea di quanto sia difficile la vita per questi
pazienti. Esempi del suo impatto sociale negativo sono le menomazioni alla guida e l’alta
prevalenza di incidenti in questa popolazione, ma la narcolessia interferisce anche con le
normali prestazioni lavorative, aumentando il tasso di disoccupazione e il pensionamento
anticipato tra questi pazienti (Broughton et al., 1981; Aldrich, 1989; Alaila, 1992). In molti
casi, con il passare del tempo, alcuni sintomi della narcolessia (ad esempio, EDS e
29
cataplessia) sembrano migliorare, ma, con molta probabilità, questo dato dipende da una
migliore gestione della malattia stessa che si acquisisce solo con il trascorrere del tempo; al
contrario, i disturbi del sonno notturno sembrano acuirsi con l’avanzare dell’età.
Complessivamente, nella maggior parte dei pazienti la gravità della narcolessia rimane
stabile per un certo numero di anni, in alcuni pazienti migliora progressivamente e in rari
casi peggiora lentamente (Billiard et al., 1983; Sonka et al., 1991).
Considerando il quadro sintomatologico di questo disturbo appare evidente che questo
abbia qualcosa in comune con il sonno REM, in quanto sembra quasi che alcune
caratteristiche di questo stadio del sonno intrudano spaventosamente e violentemente
durante la veglia di questi soggetti. Infatti, la cataplessia è molto simile all’atonia
muscolare che caratterizza la fase REM del sonno, così come le allucinazioni oniriche e le
paralisi del sonno ricordano questo particolare stadio del sonno; tutte queste similitudini,
associate alla propensione dei narcolettici ad addormentarsi ed entrare subito in fase REM,
hanno dato adito all’idea che la narcolessia fosse un disturbo del sonno REM (Dement et
al., 1966). Tuttavia, tale ipotesi è stata accantonata in quanto non spiega né l’eccessiva
sonnolenza diurna sperimentata da questi pazienti, né la breve latenza del sonno NREM e
REM e nemmeno l’anomala distribuzione delle fasi 3 e 4 durante la notte di sonno
(Billiard et al., 1992).
Secondo Broughton et al. (1986), invece, la narcolessia sarebbe il risultato della
perturbazione dei meccanismi di controllo del sonno e della veglia, per cui un attacco
cataplettico rappresenterebbe un'intrusione dell’atonia del sonno REM durante la veglia,
mentre le allucinazioni ipnagogiche sarebbero delle immagini oniriche che si svolgono
nello stato di veglia. Inoltre, quest’ipotesi spiegherebbe anche la presenza di brevi episodi
di atonia muscolare e di REM durante il sonno NREM (Montplaisir et al., 1978), e,
viceversa, la presenza di fusi del sonno (caratteristica del sonno NREM) nel sonno REM
(Barros-Ferreira & Lairy, 1976).
Una terza ipotesi sulla fisiopatologia della narcolessia propone che quest’ultima sia il
risultato di una disregolazione dei due processi del sonno, quello omeostatico e quello
circadiano (Kripke, 1976; Billiard et al., 1992;. Dantz et al., 1994), che sono responsabili
dell’alternarsi armonioso di sonno e veglia nell’arco delle 24 ore (Borbely, 1982;. Daan et
al., 1984). In particolare, la presenza di sonno diurno e di risvegli notturni fa pensare ad un
maggior squilibrio del ritmo circadiano (Nobili et al., 1995).
Per quanto riguarda la fisiopatologia specifica della cataplessia, questa sembra essere
causata dall’attivazione delle vie neurali discendenti che promuovono l'atonia, molto
30
probabilmente attraverso meccanismi simili a quelli che producono l’atonia muscolare
durante il sonno REM. Nel sonno REM l’atonia muscolare dipende da un’inibizione
postsinaptica dei motoneuroni alpha: i neuroni del midollo mediale, attivati a loro volta dai
neuroni colinergici pontini, innervano i motoneuroni spinali alpha, rilasciandovi glicina, un
neurotrasmettitore inibitore (Curtis et al., 1968). Durante la veglia e il sonno NREM,
questi meccanismi non entrano in azione, perché le afferenze noradrenergiche e
serotoninergiche provenienti rispettivamente dal locus coeruleus (LC) e dai nuclei del rafe
inibiscono le cellule colinergiche pontine che, attivando il talamo, avrebbero provocato la
desincronizzazione corticale tipica del sonno REM (Nitz et al., 1997; Gervasoni et al.,
1998). Però, i meccanismi che provocano l’atonia muscolare durante la cataplessia sono
leggermente diversi da quelli appena descritti: mentre i neuroni del LC sono inattivi sia
durante il sonno REM che durante gli attacchi cataplettici, i neuroni dei nuclei del rafe
sono silenti durante il sonno REM, ma attivi durante la cataplessia (Wu et al., 2003). Forse,
è proprio l’attivazione dei neuroni serotoninergici dei nuclei del rafe a far sì che il soggetto
mantenga un certo livello di consapevolezza durante gli attacchi. Resta, invece, avvolto nel
mistero il fatto che la cataplessia sia innescata da emozioni come la risata o la rabbia.
Probabilmente nella questione è coinvolta l’amigdala: questa regione cerebrale è attiva
durante le forti emozioni e, proiettando alle regioni pontine coinvolte nel sonno
desincronizzato, la sua stimolazione può aumentare il sonno REM (Simon-Arceo et al.,
2003). Registrazioni su cani narcolettici hanno riportato come l’amigdala di questi animali
sia attiva poco prima e durante l’attacco cataplettico, dimostrando come i neuroni
dell’amigdala abbiano un ruolo nello scatenare questo sintomo (Gulyani et al., 2002).
L’attivazione di questo “circuito emozionale” potrebbe essere ravvisabile, sebbene in
misura nettamente inferiore, anche in individui sani e ne è un esempio il fatto che il riflesso
H, che è un riflesso spinale monosinaptico semplice, sia soppresso durante la risata, dando
al soggetto quella sensazione di mancanza di forze (Overeem et al., 1999). Infatti, questo
riflesso è soppresso anche durante gli attacchi cataplettici (Guilleminault et al., 1974).
Inoltre, la narcolessia con cataplessia sembra essere causata dalla perdita del neuropeptide
ipocretinergico eccitatorio (Mignot et al., 2002) ed è proprio l’ipocretina che, agendo a
diversi livelli, sopprimere l’atonia (cfr., par. 2.2).
31
2.2 Il sistema ipocretinergico e ruolo dell’orexina: implicazioni per la patologia
Circa 15 anni fa, due gruppi di ricerca diversi scoprirono, contemporaneamente, un nuovo
peptide a cui diedero nomi diversi, in quanto non immaginavano si trattasse della stessa
sostanza (per una rassegna completa, vedi Willie et al., 2001). Infatti, un gruppo di ricerca
chiamò questo peptide “orexina” per il suo ipotetico ruolo nei meccanismi regolatori
dell’alimentazione (Sakurai et al., 1998), mentre l’altro gruppo lo chiamò “ipocretina” per
la sua somiglianza con la secretina (De Lecea et al., 1998). Quindi, ipocretina e orexina
altro non sono che due modi diversi per indicare lo stesso peptide che esiste in due forme,
ipocretina-1 e ipocretina-2 o orexina-A e orexina-B. Entrambe derivano dallo stesso
processo proteolitico e si trovano nei neuroni dell’ipotalamo posteriore e laterale (Sakurai
et al., 1998; Elias et al., 1998), i quali hanno terminazioni nervose in tutto il SNC, in
particolare nelle regioni aminergiche e colinergiche che promuovono la veglia (Peyron et
al., 1998; Chemelli et al., 1999).
L’orexina ha un ruolo cruciale nella neurobiologia della narcolessia ma, prima di passare
brevemente in rassegna alcuni studi che sostengono tale ipotesi, è bene comprendere
anzitutto il ruolo di questo peptide nel controllo dei comportamenti sonno/veglia. Saper et
al. (2001) hanno ipotizzato che l’ipocretina influenzi quei meccanismi che, innescando un
circuito elettrico noto come flip-flop, sono alla base del ciclo sonno/veglia. Durante il
sonno il flip-flop è off: i neuroni GABAergici dell’area preottica ventrolaterale (APVL)
dell’ipotalamo inibiscono i neuroni aminergici che promuovono l’attivazione corticale e
l’arousal comportamentale, ovvero i neuroni noradrenergici del locus coeruleus (LC), i
neuroni serotoninergici dei nuclei dorsali del rafe (DR) e i neuroni istaminergici del nucleo
tubero-mammillare (NTM) (Sherin et al., 1996; Szymusiak et al., 1998; Sherin et al.,
1998). L’APVL è però a sua volta inibita dalle stesse aree che inibisce (Gallopin et al.,
2000), portando il flip-flop sull’on (veglia): i neuroni ipocretinergici dell’ipotalamo laterale
stimolano i neuroni aminergici che promuovono la veglia e che, a loro volta, inibiscono
l’APVL. Quindi, vieni confermata l’ipotesi iniziale per cui i neuroni ipocretinergici
contribuiscono a stabilizzare il flip-flop neurale sonno/veglia, nei termini in cui
promuovono la veglia e inibiscono il sonno. Infatti, sono stati riscontrati elevati livelli di
ipocretina durante la veglia attiva e il sonno REM e livelli più bassi durante la veglia quieta
e il sonno ad onde lente (Estabrooke et al., 2001; Yoshida et al., 2001; Kiyashchenko et
al., 2002).
32
Diversi anni fa, due laboratori di ricerca riuscirono a dimostrare il ruolo del sistema
istaminergico nella narcolessia. Lin et al. (1999) effettuarono degli studi su cani con
narcolessia autosomica recessiva e trovarono una mutazione exon-skipping del gene del
recettore ox2, la quale mutazione, probabilmente, esita in un recettore non funzionale.
Nello stesso periodo, il gruppo di ricerca di Yanagisawa notò come nei topi privi dei
recettori per l’orexina o privi dell’orexina stessa fossero presenti caratteristiche molto
simili a quelle della narcolessia umana, come ad esempio brevi periodi di veglia, frequenti
transizioni nel sonno REM e comportamenti simili alla cataplessia (Chemelli et al., 1999;
Tokita et al., 2001; Kisanuki et al., 2001). I topi privi del recettore ox2 mostravano un
fenotipo più grave di coloro che non possedevano il recettore ox1; pertanto, fu dimostrato
che il recettore ox2 svolge un ruolo più importante nel controllo del comportamento
sonno/veglia. Altri studi poi confermano queste intuizioni, infatti, in cani narcolettici sono
state riscontrate basse concentrazioni corticali di istamina (Nishino et al., 2001) e
un’antagonista dell’istamina blocca parzialmente l’effetto di promozione della veglia
dell’orexina (Yamanaka et al., 2002).
Mentre negli animali la causa della narcolessia sembra essere l’assenza ereditaria del
recettore ox2, nell’uomo la causa sembra essere la degenerazione dei neuroni
ipocretinergici. Infatti, gli studi effettuati sul sistema ipocretinergico di soggetti umani con
narcolessia conducono alla conclusione che disfunzioni nella produzione di ipocretina
possono produrre i sintomi di questo disturbo. Ad esempio, Nishino et al. (2000; 2001)
hanno trovato nel liquor cerebro-spinale (CSF) di soggetti narcolettici una marcata
riduzione di orexina-A: in 32 narcolettici su 38 l’orexina-A era inosservabile e ciò ha
suggerito una perdita di questi peptidi nel cervello di soggetti narcolettici. In particolare, è
stato dimostrato che un malfunzionamento del sistema ipocretinergico si associa
soprattutto alla narcolessia con cataplessia: in circa il 90% dei soggetti narcolettici con
cataplessia, già dopo pochi mesi dall’esordio sintomatologico, manca l’orexina-A nel CSF
(Nishino et al., 2000; Mignot et al., 2002). Al contrario, in quasi tutti i soggetti narcolettici
che non manifestano i sintomi della cataplessia sono ravvisabili normali concentrazioni di
orexina nel CSF (Kanbayashi et al., 2002; Mignot et al., 2002). Infatti, secondo Siegel
(2004) è proprio l’ipocretina di cui i narcolettici sono carenti che fa sì che alle reazioni
emotive intense o agli sforzi improvvisi segua quella debolezza muscolare che mette questi
pazienti nella sgradevole situazione di paralisi motoria. Non a caso, iniezioni di ipocretina
nel locus coeruleus e nel bulbo mediale aumentano il tono muscolare (Kiyashchenko et al.,
2001; Mileykovskiy et al., 2002). Alla luce di queste nuove scoperte, la terza edizione
33
dell’International Classification of Sleep Disorders (2014) ha proposto un cambiamento
terminologico per la diagnosi di narcolessia che riflette proprio la maggiore attenzione
prestata all’ipocretina. Infatti, si è passati da “narcolessia con cataplessia” e “narcolessia
senza cataplessia” a “narcolessia di tipo 1 (deficit di ipocretina)6” e “narcolessia di tipo 2
(senza deficit di ipocretina)7”, la cui diagnosi, appunto, si basa anche sulla misurazione
della concentrazione di ipocretina-1 nel CSF.
Comunque, il processo che causa questa perdita di orexina è sconosciuto. Molti ricercatori
hanno avanzato l’ipotesi che una perdita selettiva dei neuroni orexina potrebbe essere
causata da un processo autoimmune o neurodegenerativo. E’ stato ipotizzato che la
narcolessia fosse una malattia autoimmune, a causa della sua associazione con l’HLA DR2
e l’HLA DQ1 (antigeni leucocitari umani di seconda classe). Infatti, alcuni studi hanno
trovato che il 100% dei narcolettici giapponesi con cataplessia sono positivi per entrambi
gli antigeni (Honda et al., 1983; Juji et al., 1984; Matsuki et al., 1985); l’associazione con
l’HLA DR2 è stata successivamente confermata anche nel 90-95% dei bianchi (Langdon et
al., 1984; Billiard & Seignalet, 1985; Poirier et al., 1986; Mueller-Eckhardt et al., 1986;
Guilleminault et al., 1989; Aldrich, 1990) e nel 60% degli afro-americani (Neely et al.,
1987). Tuttavia, sono stati segnalati anche casi negativi per l’HLA DR2, che suggeriscono
la presenza di altri geni predisponenti alla malattia (Andreas-Zietz et al., 1986;
Guilleminault & Grumet, 1986a; Mueller-Eckhardt et al., 1986). Infatti, la più bassa
percentuale di associazione tra gli afro-americani ha lasciato pensare a differenze interetniche: Matsuki et al. (1992) confermarono quest’intuizione, riscontrando come negli
afro-americani l’associazione fosse più stretta con l’HLA DQB1*0602 che con l’HLADRB1*15. Studi di associazione con l’HLA sono stati condotti anche in soggetti
narcolettici senza cataplessia, ma un'associazione con DQB1*0602 è stata trovata solo nel
6
La diagnosi di narcolessia di tipo 1 viene fatta quando il soggetto presenta, per almeno 3 mesi, un’EDS o
improvvisi attacchi di sonno associati ad una od entrambi le seguenti condizioni: cataplessia, latenza media
del sonno < 8 minuti durante il Multiple Sleep Latency Test (MSLT), almeno 2 addormentamenti in fase
REM (SOREMPs) durante il MSLT oppure almeno un SOREMPs durante il MSLT e un SOREMPs durante
la precedente notte di sonno; la concentrazione di orexina-A nel CSF, misurata con l’immunoreattività, < 110
picogrammi/ml oppure < 1/3 del valore medio dei soggetti normali.
7
Per una diagnosi di narcolessia di tipo 2 devono essere soddisfatti tutti i seguenti criteri: per almeno 3 mesi
è presente un’EDS o improvvisi attacchi di sonno; latenza media del sonno < 8 minuti, almeno 2 SOREMPs
durante il MSLT oppure almeno un SOREMPs durante il MSLT e un SOREMPs durante la precedente notte
di sonno; nessuna manifestazione di cataplessia; la concentrazione di orexina-A nel CSF, misurata con
l’immunoreattività, > 110 picogrammi/ml o > 1/3 del valore medio dei soggetti normali; l’EDS o i risultati
ottenuti al MSLT non sono spiegati da altre cause come sonno insufficiente, apnee notturne, sindrome da
sonno ritardato, effetti da farmaci o effetti da sospensione di farmaci.
34
40.9% dei casi. Tale risultato mostra chiaramente la stretta associazione tra DQB1*0602 e
la presenza di cataplessia (Mignot et al., 1997a); tra l’altro questi risultati sono in linea con
quelli ottenuti negli studi di cui sopra che hanno dimostrato una correlazione tra il
malfunzionamento del sistema ipocretinergico e la narcolessia con cataplessia (Nishino et
al., 2000; Mignot et al., 2002).
L’eziologia genetica della narcolessia è indubbia, difatti un parente di primo grado di un
narcolettico ha una possibilità dalle 10 alle 40 volte superiore rispetto alla popolazione
generale di presentare narcolessia con cataplessia (Billiard et al., 1994; Mignot, 1998), ma
la relativamente bassa concordanza di narcolessia nei gemelli monozigoti (Mignot, 1998)
fa pensare ad un ruolo anche dei fattori ambientali. Alcuni studi (Billiard et al., 1983;
Orellana et al., 1994; Lankford et al., 1994; Roth, 1980) hanno trovato che, nella metà dei
casi, i primi sintomi della narcolessia sono preceduti da diversi fattori ambientali, quali
grave stress psicologico, brusco cambiamento dei propri orari di sonno, traumi, gravidanze,
infezioni varie, ecc., che probabilmente fungono da fattori precipitanti rispetto ai
predisponenti fattori genetici. Comunque le conoscenze sul ruolo dei fattori ambientali
sono ancora scarse.
2.3 Alterazioni anatomo-funzionali
Tra le alterazioni neurochimiche associate alla narcolessia, in primis, il già citato deficit
ipocretinergico (soprattutto nei casi di narcolessia con cataplessia), probabilmente causato
da un processo autoimmune (cfr., par. 2.2).
La narcolessia sembra essere associata anche ad alterazioni del sistema monoaminergico e
colinergico e studi farmacologici lo confermano. Ad esempio, le anfetamine usate per
trattare l’EDS vanno a bloccare la ricaptazione delle monoamine e ne aumentano il
rilascio, senza interferire con il sistema colinergico. Allo stesso modo, gli anticataplettici
quali gli antidepressivi triciclici e gli inibitori selettivi della ricaptazione della serotonina,
oltre al loro effetto anticolinergico, bloccano la ricaptazione delle monoamine. Al
contrario, la prazosina, un’antagonista dei recettori noradrenergici alpha-1, aggrava i
sintomi della narcolessia, in particolare la cataplessia (Aldrich & Rogers, 1989). Anche gli
studi biochimici confermano un difetto del sistema monoaminergico: i narcolettici
presentano una bassa concentrazione di dopamina e del suo metabolita nel CSF
(Montplaisir et al., 1982) ed un elevato turnover dopaminergico nel SNC (Faull et al.,
35
1983). Gli studi farmacologici condotti sui cani confermano il coinvolgimento nella
patologia del sistema colinergico e di quello monoaminergico mostrato dagli studi sugli
esseri umani. Infatti, la somministrazione di farmaci colinomimetici esacerba la cataplessia
nei cani narcolettici, mentre la somministrazione di sostanze anticolinergiche diminuiscono
tali sintomi (Delashaw et al., 1979). Rispetto al sistema monoaminergico, invece, gli
antagonisti dei recettori noradrenergici alpha-1 facilitano la cataplessia, mentre gli agonisti
la sopprimono (Mignot et al., 1988a,b). L’evidenza che le stesse sostanze che agiscono
sulla cataplessia, esacerbandola o sopprimendola, hanno il medesimo effetto sul sonno
REM (Nishino & Mignot, 1997) sembra confermare l’ipotesi per cui l’atonia muscolare
durante l’attacco cataplettico e quella durante il sonno REM condividano un simile
equilibrio neurochimico. Infatti, in entrambi i casi è ravvisabile il coinvolgimento del
sistema monoaminergico e di quello colinergico (cfr., par. 2.1). Rispetto al sistema
monoaminergico va, però, fatta una specificazione: i sistemi noradrenergici sono
primariamente coinvolti nella fisiopatologia della cataplessia, più discutibile è, invece, il
ruolo dei neuroni serotoninergici, mentre il sistema dopaminergico sembra essere meno
coinvolto nella fisiopatologia della cataplessia è maggiormente per la sonnolenza
(Dauvilliers et al., 2003). Infatti, gli inibitori selettivi della ricaptazione della serotonina
hanno effetto sulla cataplessia solo ad alte dosi (Nishino et al., 1993a), mentre sul sonno
REM hanno effetti sempre inibitori; invece, gli inibitori selettivi della ricaptazione della
dopamina non influiscono né sui sintomi della cataplessia (Nishino et al., 1994; 1996) né
sulla comparsa del sonno REM.
In linea con quanto già sostenuto, le misurazioni delle concentrazioni di monoamine e dei
loro metaboliti nelle diverse regioni cerebrali di cani narcolettici hanno dato i seguenti
risultati. E’ stato riscontrato un aumento significativo delle concentrazioni di dopamina e
del suo metabolita DOPAC nell'amigdala e alte concentrazioni di DOPAC nel nucleo
reticolare parvocellulare (Bowersox et al., 1987). Nel nucleo reticolare orale pontino sono
stati registrati alti livelli di concentrazione di noradrenalina, che, invece, è presente in
quantità minore nella regione ipotalamica preottica (Mefford et al., 1983; Miller et al.,
1990). Alcuni studi hanno riportato un aumento dei recettori adrenergici alpha 1-b
nell’amigdala (Mignot et al., 1989a) e dei recettori alpha 2 nel LC (Fruhstorfer et al.,
1989). Invece, i recettori colinergici muscarinici M2 si presentano in quantità elevata nella
formazione reticolare pontina (Boehme et al., 1984; Kilduff et al., 1986); infatti, iniettando
piccole dosi di agonisti colinergici in questa struttura si innescano attacchi cataplettici in
cani narcolettici (Reid et al., 1994 a, b). Se si iniettano dosi più alte della stessa sostanza in
36
cani normali, si verificherà, ugualmente, un attacco cataplettico (Reid et al., 1994a). Questi
risultati, presi insieme, suggeriscono la presenza di un’ipersensibilità dei cani narcolettici
alla stimolazione colinergica nella regione pontina.
A livello anatomico, invece, nel tessuto cerebrale dei cani narcolettici non è stato
riscontrato alcun cambiamento, fatta eccezione della degenerazione degli assoni del setto e
dell’amigdala. Tali modifiche hanno raggiunto il loro massimo a circa 2 mesi di età, che
corrisponde all'età di insorgenza dei sintomi nei cani narcolettici (Siegel et al., 1995;
1996).
Oltre alle modificazioni neurochimiche appena discusse, la narcolessia può accompagnarsi
anche a compromissioni nelle funzioni cognitive. Infatti, a causa della scarsa qualità del
sonno notturno e della, almeno in parte, conseguente eccessiva sonnolenza diurna, questi
pazienti potrebbero manifestare delle compromissioni nelle funzioni esecutive. Infatti,
anche in soggetti sani è stato dimostrato che a deprivazioni da sonno segue un alterato
controllo esecutivo, ravvisabile nell’aumento del tasso delle dimenticanze, nella lentezza
delle risposte a semplici calcoli matematici e nei risultati scadenti nei compiti di vigilanza
(Van Dongen et al., 2003; Harrison et al., 2000). Ci sono studi che provano la vulnerabilità
dei meccanismi della corteccia prefrontale in condizioni di sonno insufficiente o disturbato
(Muzur et al., 2002; Harrison et al., 2000); in realtà, la corteccia prefrontale non ha
l’esclusiva sui processi esecutivi, in quanto contribuiscono a queste funzioni anche la
corteccia parietale posteriore e la corteccia cingolata anteriore (Elliott, 2003).
Coerentemente con quanto sopra, alcuni studi hanno riscontrato, in condizioni di
deprivazione da sonno, un ipometabolismo delle aree prefrontali e parietali posteriori
(Braun et al., 1997) e un basso tasso metabolico di glucosio, misurato con la PET, nel
talamo, nella corteccia prefrontale e parietale posteriore (Thomas et al., 2000).
In accordo con i risultati appena esposti, non stupisce la probabilità che i soggetti affetti da
narcolessia abbiano dei problemi con le funzioni cognitive che fanno capo alla corteccia
prefrontale ed è plausibile l’ipotesi per cui i narcolettici possano manifestare un
peggioramento in alcune performance mnestiche. Thomas (2005), tramite la risonanza
magnetica funzionale, ha monitorato i cambiamenti dinamici nell’attivazione cerebrale
durante un compito di memoria di lavoro in uno stato di grave sonnolenza diurna in
soggetti narcolettici. I risultati ottenuti da questo studio sono coerenti con le ipotesi degli
autori e con quanto esposto precedentemente: innanzitutto è stata confermata l’attivazione
bilaterale di quelle aree cerebrali che la letteratura già annoverava nella rete delle funzioni
esecutive (corteccia prefrontale, corteccia parietale posteriore e corteccia cingolata
37
anteriore); in un secondo momento, in concomitanza con il rallentamento delle prestazioni,
è stata registrata una riduzione dell'attivazione cerebrale, soprattutto nella corteccia
prefrontale.
Considerando la forte associazione tra cataplessia ed emozioni, sono stati indagati i
processi di elaborazione cerebrale di stimoli visivi emotivi in soggetti narcolettici,
misurandone l’attività fisiologica. Per suscitare queste emozioni alcuni studi hanno
utilizzato l’International Affective Picture System (IAPS4), un sistema che comprende una
serie di diapositive a colori che suscitano una gamma di stati affettivi positivi, neutri e
negativi (Lang et al., 1988 a, b). Durante quest’esposizione emotiva vengono misurate tutte
le risposte fisiologiche, come la frequenza cardiaca, la conduttanza cutanea,
l’elettromiografia facciale, la pressione arteriosa, ecc. (per una rassegna completa, vedi
Bradley, 2000). Tucci et al. (2003), ad esempio, studiarono gli effetti psicofisiologici
dell’elaborazione di stimoli visivi che suscitano emozioni utilizzando proprio l’IAPS. Ne è
emerso che le reazioni a questi stimoli da parte dei sistemi autonomici, muscolari e
cognitivi dei soggetti narcolettici sono molto più attenuate rispetto a quelle del gruppo di
controllo, soprattutto quando gli stimoli visivi sono sgradevoli. Questi risultati conducono
alla conclusione che i soggetti narcolettici presentano una difficoltà nella trasformazione
ed elaborazione degli input, soprattutto di quelli negativi, che in realtà potrebbe celare una
risposta adattiva per esorcizzare la comparsa dell’attacco cataplettico.
2.4 Il ricordo dei sogni nella narcolessia
Dal momento che la frequenza del ricordo dei sogni è stata collegata ad alcuni parametri
del sonno, come la frequenza dei risvegli notturni e la durata del sonno (Schredl, 2007),
alcuni studiosi si sono domandati se un disturbo del sonno, che inevitabilmente
compromette alcuni dei suoi parametri, possa influenzare il ricordo e il processo onirico.
Sulla base di quest’ipotesi, sono stati avviati una serie di studi sui contenuti e sul ricordo
dei sogni in pazienti con disturbi del sonno. I dati ottenuti hanno offerto utili indicazioni su
come i processi fisiologici e psicologici interagiscono nella generazione del sogno, ma,
nonostante i promettenti risultati di questi studi, l’influenza dell’alterata organizzazione del
sonno sul sogno è stata poco studiata (Cipolli et al., 2008). Per comprendere i risultati di
questi studi è opportuno spiegare brevemente due ipotesi che danno conto dell’intero
38
percorso del sogno, dalla sua generazione al suo richiamo: l’ipotesi della continuità tra
contenuto del sogno e veglia e il modello attivazione-recupero del ricordo del sogno.
Secondo l’ipotesi della continuità (Hall & Nordby, 1972), i sogni esprimono le
preoccupazioni e le emozioni della veglia. Anche Schredl (2003) ha effettuato delle
indagini per verificare tale ipotesi ed ha individuato 5 fattori che potrebbero modulare la
probabilità che frammenti della veglia possano essere incorporati nei sogni: diminuzione
esponenziale, con il tempo trascorso, del tasso di incorporazione delle esperienze della
veglia nei sogni; coinvolgimento; esperienze di tipo emozionale durante la veglia; tratti di
personalità; tempo della notte. L’ipotesi della continuità può essere verificata con due
approcci
metodologici:
la
manipolazione
sperimentale,
che
consiste
nella
somministrazione di stimoli prima che il soggetto si addormenti, e gli studi sul campo, ad
esempio raccogliendo resoconti di sogni in periodi particolari della vita del soggetto.
Secondo il modello di attivazione-recupero (Koulack & Goodenough, 1976) sono necessari
due passaggi per poter ricordare un sogno: il primo passaggio necessita di un’eccitazione
corticale per poter trasferire il contenuto del sogno dalla memoria a breve termine a quella
a lungo termine, dopodiché segue il processo di recupero. Considerando che il primo
processo di immagazzinamento non avviene durante il sonno, è necessario che la MSA sia
seguita da un periodo di veglia. Anche i risultati di alcuni studi su soggetti sani sostengono
questo modello, mostrando come i risvegli notturni (Cory et al., 1975; Schredl et al., 2003)
e la bassa qualità del sonno (Lugaresi et al., 1983; Schredl et al., 1997) aumentino la
frequenza dei ricordi dei sogni. Questo modello è sostenuto anche dall’accresciuta
frequenza del ricordo dei sogni in soggetti con insonnia (Schredl et al., 1998). Invece, il
processo di recupero può essere integrato con altre tre ipotesi: secondo l’ipotesi della
salienza (Cohen et al., 1974) più è saliente l’esperienza del sogno, maggiore sarà la
probabilità di ricordarlo; secondo l’ipotesi dell’interferenza (Cohen et al., 1973) minore
saranno le interferenze durante il processo di recupero, maggiore sarà la probabilità di
ricordare il sogno; secondo l’ipotesi della rimozione (Freud, 1900) emozioni molto intese
fanno diminuire le probabilità di ricordare il sogno.
Comunque, ritornando agli studi su pazienti con disturbi del sonno (per una rassegna
completa, vedi Schredl, 2008), questi dimostrano che un’alterata fisiologia del sonno ha
degli effetti sul ricordo e sui contenuti dei sogni di questi particolari pazienti.
Tra i vari disturbi del sonno, quello che sembra essere più utile per indagare i processi di
generazione dei sogni durante la fase REM è la narcolessia con cataplessia (NC),
soprattutto per alcuni aspetti del suo quadro sintomatologico che sembrano essere
39
un’intrusione delle caratteristiche del sonno REM durante la veglia. Inoltre, Fosse et al.
(2002), indagando sull’esperienza emozionale di soggetti narcolettici durante il sonno
REM, hanno compreso come le ricerche su questi pazienti offrano la possibilità unica di
studiare le emozioni ed analizzarne i correlati psicofisiologici. Infatti, i risultati da loro
ottenuti hanno dimostrato che la narcolessia intensifica le emozioni sperimentate durante i
sogni-REM, soprattutto ansia/paura e gioia/euforia, e questo è più chiaramente visibile
durante i SOREMs, sia per la frequenza che per l’intensità delle emozioni. I ricercatori
hanno ipotizzato che questo dato potrebbe dipendere dal fatto che la patologia
compromette i sistemi neurobiologici che supportano le funzioni cognitive-emozionali.
Rispetto agli studi sui contenuti dei sogni dei narcolettici, alcuni autori hanno descritto
questi sogni come più vivaci e spesso inquietanti (Nixon et al., 1964; Lee et al., 1993),
mentre Vogel (1960; 1976) ha trovato uguali quantità di emozioni negative e positive nei
sogni di questi pazienti. Vogel ha, inoltre, riferito che questi pazienti sono più spesso
consapevoli del loro stato di coscienza durante il sogno, cioè sanno che l’esperienza che
stanno vivendo non è reale.
Per quanto riguarda la frequenza del richiamo onirico, Schredl (1998) ha condotto uno
studio pilota su un gruppo di 23 narcolettici, da cui è emersa una maggiore frequenza del
ricordo dei sogni e resoconti più bizzarri e negativi rispetto al gruppo di controllo. Uno
studio sui sogni in seguito a risvegli REM è stato effettuato su 15 narcolettici ed è stato
constatato che la percentuale dei ricordi di questi sogni, attestandosi attorno al 90%, è
molto più alta in questi pazienti (Fosse, 2000; Fosse et al., 2002). Inoltre, i sogni degli
ultimi cicli di sonno dei narcolettici erano più brevi di quelli ottenuti dal gruppo di
controllo, ma non sono state trovate correlazioni tra la frammentazione del sonno e la
lunghezza dei sogni o altre caratteristiche dei sogni (Fosse, 2000). Anche in questo studio,
come in quelli di Vogel, i narcolettici, rispetto al gruppo di controllo, sono maggiormente
consapevoli che si tratta di un’attività onirica e non della realtà. Gli studi di Fosse, però,
non rispondono ad alcune questioni: l’effetto dell’età sul contenuto dei sogni (i soggetti del
campione utilizzato avevano tra i 17 e i 70 anni), l’effetto delle strategie di coping usate
per fare fronte al disturbo (la maggior parte dei soggetti sperimentali erano membri ben
adattati della Norwegian Narcolepsy Association) e l’effetto della condizione drug-naïve
sul contenuto dei sogni (la maggior parte avevano interrotto il loro trattamento).
In generale, studi di laboratorio hanno dimostrato che le esperienze oniriche dei pazienti
narcolettici durante il sonno REM sono più lunghe, complesse e bizzarre di quelle dei
soggetti sani. Ma il fatto che i sogni di questi pazienti siano più lunghi e complessi
40
potrebbe dipendere da due fattori: un ottimale funzionamento dei processi cognitivi
coinvolti nella generazione del sogno oppure un più accurato ricordo di quest’ultimo.
Mazzetti et al. (2010), per stabile da quale dei due fattori dipendessero le caratteristiche dei
sogni dei narcolettici, hanno comparato gli indicatori di lunghezza e l’organizzazione
strutturale dei resoconti dei sogni della fase REM di 14 pazienti con NC con quelli di un
gruppo di controllo. Dopo una notte sperimentale, i ricercatori hanno provocato nei
soggetti due risvegli dopo 8 minuti dall’inizio del primo e del terzo sonno REM e hanno
chiesto loro sia un resoconto spontaneo del sogno, chiedendo di riferire la loro esperienza
onirica, che un resoconto guidato, domandando di ricordare ulteriori particolari
dell’esperienza. Tutti i resoconti sono stati analizzati usando le regole story-grammar di
Mandler e Johnson (1977; 1980), al fine di identificare le macro unità dei singoli contenuti
e descrivere l’organizzazione strutturale della storia. Mentre il ricordo dei sogni, attestabile
a circa il 90%, è comparabile tra il gruppo sperimentale e quello di controllo, i resoconti
spontanei dei primi sonni REM sono più lunghi e complessi nel primo gruppo che nel
secondo. Dopo il terzo sonno REM, più di un terzo dei pazienti con NC e dei soggetti sani
ha rilasciato resoconti guidati, la cui lunghezza e complessità era paragonabile con quella
dei resoconti spontanei. Da questi risultati si evince che i pazienti con NC raggiungono il
funzionamento ottimale dei processi cognitivi sottostanti la generazione dei sogni prima,
durante la notte, dei soggetti del gruppo di controllo. Questo studio ha confermato, dunque,
i risultati ottenuti qualche anno prima dal gruppo di ricerca di Cipolli (2008).
41
Capitolo 3
Lo studio empirico
3.1
Introduzione
Numerose evidenze elettrofisiologiche e neuropsicologiche sono coerenti con l’ipotesi di
una continuità tra i meccanismi corticali e sottocorticali della veglia e l’attività cognitiva
durante il sonno (cfr., par. 1.4). Nello specifico, sembra esserci un rapporto tra memoria
episodica, attività corticale e ricordo dell’attività onirica, nei termini in cui veglia e sonno
sembrano condividere alcuni meccanismi neurofisiologici per la codifica della memoria
episodica.
Rispetto ai correlati neurali del ricordo dei sogni, lo studio di Marzano et al. (2011) ha
trovato come specifiche oscillazioni corticali, in specifici stadi del sonno, nei 5 minuti che
precedono il risveglio mattutino, siano predittive del successivo ricordo dei sogni. In
particolare, è emerso che una maggiore attività frontale theta durante il sonno predice il
successivo ricordo dei sogni in seguito a risvegli dalla fase REM, mentre una minore
attività oscillatoria alpha nell’area temporo-parietale destra predice il successivo ricordo
dei sogni in seguito a risvegli dallo stadio 2 del sonno. Questo studio, però, ha lasciato
irrisolta una questione: i correlati EEG riscontrati, predittivi del ricordo del sogno, sono
riconducibili a fattori di “stato”, ovvero alla specifica fisiologia del sonno al momento del
risveglio, oppure a fattori di “tratto”, ovvero a specifici pattern EEG che caratterizzavano
stabilmente i soggetti sperimentali? Questo limite dipende dal fatto che lo studio in
questione ha effettuato una sola sessione sperimentale per ciascun soggetto, in cui le
combinazioni delle diverse condizioni che si potevano presentare, ricordo o non ricordo del
sogno associato al risveglio REM o NREM, erano del tutto casuali ed uniche per ogni
soggetto (in considerazione del fatto che si disponeva solo del risveglio finale dopo
un’intera notte di sonno).
Per sciogliere la questione bisogna passare da un disegno di ricerca che confronti soggetti
diversi ad un disegno di ricerca “within-subjects” che confronti le condizioni di più risvegli
all’interno dello stesso soggetto. Pertanto, sono risultati necessari nuovi studi che
effettuassero più registrazioni sullo stesso soggetto al fine di incrementare la probabilità di
registrare le seguenti combinazioni:
42
•
risveglio da una fase REM associato al ricordo del sogno (REM-SI);
•
risveglio da una fase REM associato al non ricordo del sogno (REM-NO);
•
risveglio da una fase NREM associato al ricordo del sogno (NREM-SI);
•
risveglio da una fase NREM associato al non ricordo del sogno (NREM-NO).
Infatti, solo effettuando registrazioni polisonnografiche multiple intra-soggetto, oltre che
inter-soggetto, sarà possibile comprendere se le oscillazioni cerebrali trovate sono
riconducibili a fattori di “tratto” o di “stato”.
Il progetto di ricerca che sarà esposto, per il metodo e i particolari soggetti sperimentali
coinvolti, mira a rispondere proprio a tale questione, proponendosi come una naturale
prosecuzione e completamento di quello di Marzano e collaboratori. Infatti, se da un lato si
ipotizza di replicare in pazienti narcolettici i risultati ottenuti nel 2011, dall’altro si vuole
condurre un passo in avanti nella ricerca sui correlati EEG del ricordo dei sogni, ponendo
come scopo principale della ricerca proprio quello di comprendere se le oscillazioni
cerebrali trovate in associazione con il ricordo dei sogni siano da considerarsi fenomeni di
“stato” o di “tratto”. A questo primario obiettivo di carattere generale se ne affianca uno
secondario più specifico: descrivere, per la prima volta, la relazione predittiva tra correlati
EEG al risveglio e il ricordo dei sogni in un gruppo di pazienti narcolettici.
Quindi, nel laboratorio di Psicofisiologia del Sonno del Dipartimento di Psicologia
dell’Università degli studi di Roma “La Sapienza”, in collaborazione con il Dipartimento
di Medicina Specialistica, Diagnostica e Sperimentale di Bologna, è stato avviato un
protocollo di ricerca sui correlati EEG dell’attività onirica in soggetti con diagnosi di
narcolessia con cataplessia.
Il vantaggio di questo progetto è che il Multiple Sleep Latency Test (MSLT) a cui sono stati
sottoposti i soggetti sperimentali, per la sua particolare procedura (cfr., par. 3.2.2),
consente di avere più nap per lo stesso paziente, aumentando dunque il numero delle
combinazioni possibili per ciascun soggetto. Inoltre, le peculiarità della narcolessia, ovvero
i SOREMs e la ormai dimostrata più alta frequenza del ricordo dei sogni in questi pazienti
piuttosto che in soggetti sani (cfr., par. 2.4), incrementa, rispettivamente, la possibilità di
disporre di risvegli in fase REM e di numerosi resoconti dei sogni.
43
3.2 Metodo
3.2.1 Soggetti
Lo studio ha coinvolto un gruppo di 16 pazienti (10M e 6F) con diagnosi di narcolessia con
cataplessia, sottoposti a trattamento farmacologico e con un’età media di 32.75 anni
(d.s.=12.0). I pazienti sono stati selezionati anche in base ai risultati dell’Epworth
Sleepiness Scale (ESS), un breve questionario che serve a valutare l’EDS, e della Beck
Depression Inventory-II (BDI-II), questionario per valutare il tono dell’umore.
3.2.2 Procedura
Per controllare la qualità e quantità del sonno nel corso della settimana precedente
all’esperimento, è stato chiesto ai partecipanti di compilare, ogni mattina, entro i 15 minuti
dal risveglio, un diario del sonno nel quale riferire le stime soggettive relative alla durata
del sonno, la modalità di addormentamento e di risveglio, eventuali fattori di disturbo
percepiti durante la notte ed eventuali sogni ricordati. Infine, sempre per evitare che i
risultati dell’esperimento dipendessero dalla precedente notte di sonno, i soggetti hanno
trascorso questa notte in laboratorio, durante la quale sono stati sottoposti a registrazione
polisonnografica.
Questo protocollo di ricerca ha previsto che ciascun soggetto sperimentale fosse sottoposto
al Multiple Sleep Latency Test (MSLT), gold standard nella valutazione dell’EDS, con la
seguente procedura: ai soggetti viene data la possibilità di fare, nell’arco dell’intera
giornata, 5 sonnellini a distanza di due ore l’uno dall’altro; il paziente ha 20 minuti per
addormentarsi e, nel caso in cui si addormenti, lo si lascia dormire per altri 15.
Ovviamente, per determinare lo stato di sonno o lo stato di veglia ed, eventualmente, la
fase REM si tiene conto della registrazione polisonnografica a cui il soggetto è sottoposto
durante il test. Tra un’occasione di sonno e l’altra, il ricercatore o il tecnico che eseguono il
test si assicurano che il paziente non si addormenti. L’utilizzo di questa particolare
procedura rende potenzialmente disponibili 5 nap per lo stesso paziente. Al risveglio da
ogni nap del MSLT, ovviamente qualora si presentasse un addormentamento, è stato
richiesto ai partecipanti di descrivere verbalmente l’eventuale esperienza onirica ricordata,
che è stata audioregistrata. I ricercatori, seguendo la ormai confermata procedura di
Foulkes (cfr., par. 1.2), hanno chiesto a ciascun soggetto di descrivere dettagliatamente
44
“tutto ciò che gli era passato per la mente nel periodo di sonno”. A tal proposito, i soggetti
sono stati preliminarmente istruiti a considerare come sogno qualsiasi tipologia di attività
mentale avvenuta durante il periodo di sonno.
Dopo ogni risveglio, a prescindere se questo sia stato o meno accompagnato dal ricordo
della MSA, è stato chiesto ai soggetti di compilare un diario per raccogliere le
caratteristiche del sonno valutate soggettivamente (latenza del sonno, numero di risvegli,
tempo totale e qualità del sonno), la sensazione di aver sognato o meno, il numero di sogni
ricordati al momento del risveglio e le caratteristiche qualitative dell’eventuale attività
onirica ricordata (bizzarria, connotato emotivo, vividezza e lunghezza) mediante scala
visuo-analogica.
3.2.3 Strumenti
I dati relativi all’attività corticale (EEG) sono stati acquisiti con elettrodi di scalpo
sinterizzati Ag-AgCl montati su cuffia elastica per 19 derivazioni corticali (C3, C4, Cz, F3,
F4, F7, F8, Fp1, Fp2, Fz, O1, O2, P3, P4, Pz, T3, T4, T5, T6) del sistema internazionale
10-20, con referenze mediate A1 e A2 sui mastoidi giuntati. Per i segnali EEG è stata usata
una costante di tempo di 0.5 secondi e un filtro notch a 50 Hz.
Invece, i dati relativi all'attività oculare e muscolare sono stati acquisiti attraverso elettrodi
bipolari per registrazione EOG ed EMG. Rispetto alle rilevazioni EOG, è stato posizionato
un elettrodo circa un centimetro sopra e lateralmente al canto esterno dell'occhio destro ed
uno circa un centimetro sotto e lateralmente al canto esterno dell’occhio sinistro. Il segnale
EMG è stato rilevato attraverso due elettrodi sottomentonieri, predisposti uno sul lato
destro ed uno su quello sinistro del muscolo. Quindi, considerando l’intera registrazione
polisonnografica (EEG, EOC, EMG) erano disponibili 23 canali di registrazione.
3.2.4 Analisi dei dati
I tracciati polisonnografici registrati durante il MSLT presso il Dipartimento di Medicina
Specialistica, Diagnostica e Sperimentale di Bologna sono stati poi inviati al laboratorio di
Psicofisiologia del Sonno del Dipartimento di Psicologia di Roma, dove sono stati siglati
secondo i criteri standard di Rechtschaffen e Kales (1968) per epoche di 20 secondi,
45
attraverso un’ispezione visiva offline. Per escludere eventuali artefatti dovuti ad attivazioni
oculari e/o muscolari, i tracciati sono stati ulteriormente siglati per epoche di 4 secondi,
sempre secondo i criteri standard di Rechtschaffen e Kales e attraverso un’ispezione visiva
offline.
A questa fase di scoring è seguita una di classificazione, in cui i tracciati siglati sono stati
divisi in base al risveglio (REM o NREM), selezionando poi i soggetti che hanno
presentato entrambe le condizioni di recall (REC) e no recall (NREC) con lo stesso
risveglio. Sulla base di queste combinazioni, 8 soggetti hanno prodotto le due condizioni
REC e NREC in seguito a risvegli da fase NREM e altri 8 hanno prodotto le medesime
condizioni in seguito a risvegli dalla fase REM.
I dati ottenuti per le 19 derivazioni corticali sono stati poi sottoposti ad analisi spettrale
attraverso il calcolo della FFT-Fast Fourier Transform con risoluzione di frequenza a 0.25
Hz nel range 0.5-29.75 Hz. Le potenze spettrali ottenute per ciascun bin sono state mediate
e suddivise secondo le bande EEG canoniche (non tenendo in considerazione frequenze
superiori a 25 Hz): delta (0.5-4.75 Hz), theta (5.00-7.75 Hz), alpha (8.00-11.75 Hz), sigma
(12.00-15.75 Hz) e beta (16.00-24.75 Hz). Le potenze spettrali medie delle diverse bande,
dopo trasformazione logaritmica, sono state codificate su scala cromatica e riprodotte
graficamente su una proiezione bidimensionale dello scalpo nella posizione corrispondente
alla derivazione in esame e interpolate tra gli elettrodi (Figure 1 e 3).
Per effettuare i confronti statistici tra le due condizioni REC e NREC, separatamente per
REM e NREM, sono stati realizzati test t di Student per campioni appaiati, per ciascuna
derivazione e per ogni banda di frequenza. E' utile ricordare che proprio facendo confronti
within-subjects, entro lo stesso soggetto, tra REC e NREC, è possibile controllare
l'influenza dei fattori di tratto. Queste analisi statistiche sono state eseguite nell’ambiente
di Matlab.
Le mappe topografiche dei confronti statistici sono state ottenute seguendo la stessa
procedura delle mappe topografiche descrittive di cui sopra (Figure 2 e 4).
E’ stata applicata, inoltre, la correzione di Bonferroni al fine di aggiustare il valore di α
critico per l’elevato numero di confronti multipli eseguiti. E’ stato calcolato un indice di
intercorrelazione tra le variabili dipendenti (Perneger, 1998; Sankoh, Huque & Dubey,
1997) separatamente per NREM (r =0.95) e REM (r =0.31). Tenendo conto di queste
correlazioni e del numero di confronti statistici effettuati, il valore di alpha critico è stato
ponderato in tal modo: α ≤ 0.0398 (t ≥ 2.52) per il NREM, α ≤ 0.0022 (t ≥ 4.72) per il
REM.
46
3.3 Risultati
I risultati che verranno ora esposti sono da considerarsi del tutto preliminari e, come già
detto, si riferiscono ai seguenti soggetti:
-
8 che dispongono della condizione REC e NREC in seguito a risvegli in fase
NREM da sonnellini di durata media di 13.87 minuti (d.s.=2.31);
-
8 che dispongono della condizione REC e NREC in seguito a risvegli in fase REM
da sonnellini di una durata media di 13.25 minuti (d.s.=2.74).
I dati sono stati analizzati separatamente per ciascun risveglio, pertanto si riportano due
sezioni di risultati.
NREM
Nella Figura 1 sono presentate le mappe topografiche descrittive delle potenze spettrali
medie relative ai 5 minuti che hanno preceduto il risveglio in fase NREM, per ciascuna
delle bande considerate, per ciascuno degli elettrodi. I dati si riferiscono ad entrambe le
condizioni (REC e NREC) e i colori più caldi esprimono un maggior livello di attivazione
cerebrale rispetto ai colori più freddi. Da queste mappe si evince il tipico andamento
regionale del sonno NREM, con una prevalenza centro-frontale soprattutto dell’attività
delta, a seguire la gamma del theta e dell’alpha, con un gradiente antero-posteriore, ed una
bassa attività beta.
47
Figura 1 Mappe topografiche descrittive delle potenze spettrali medie relative ai 5 minuti che hanno
preceduto il risveglio in fase NREM
Nella Figura 2, invece, sono riportate le mappe topografiche dei confronti statistici, per
campioni appaiati, tra le condizioni REC e NREC nei 5 minuti che hanno preceduto il
risveglio in fase NREM. Anche in questo caso, i colori più caldi esprimono la prevalenza
di quella specifica potenza spettrale per la specifica banda, per lo specifico elettrodo, per la
condizione di REC; i colori più freddi, invece, esprimono la prevalenza di quella specifica
potenza spettrale per la specifica banda, per lo specifico elettrodo, per la condizione di
NREC. Da queste mappe emergono due ordini di fenomeni per la condizione REC:
1. riduzione delle attività delta e theta nelle aree occipitali e in parte in quelle parietali;
2. prevalenza di attività beta a livello della corteccia temporale destra.
In modo del tutto complementare, in concomitanza alla condizione NREC si registrano i
seguenti fenomeni:
1. prevalenza delle attività delta e theta nelle aree occipitali e in parte in quelle
parietali;
2. riduzione dell’attività beta a livello della corteccia temporale destra.
48
Nella Tabella 1 sono riportate i dati delle derivazioni che nei confronti statistici con la t test
di Student sono risultate significative per il risveglio NREM.
Figura 2 Mappe topografiche dei confronti statistici tra le condizioni REC e NREC nei 5 minuti che
hanno preceduto il risveglio in fase NREM
DELTA
THETA
Derivazioni corticali
t test di Student
p
O1
-3.223
0.0146
O2
-3.244
0.0142
P3
-2.907
0.0228
P4
-2.848
0.0248
Pz
-3.53
0.0095
C3
-2.589
0.0360
C4
-2.524
0.0396
Cz
-2.942
0.0216
O1
-3.353
0.0122
O2
-2.560
0.0375
P3
-2.765
0.0279
49
BETA
Pz
-2.939
0.0217
T5
-2.947
0.0215
T6
4.389
0.0032
Tabella 1 Derivazioni corticali significative (con correzione di Bonferroni) per i confronti statistici tra
le condizioni REC e NREC per i risvegli in fase NREM
REM
Nella Figura 3 sono riportate, con la stessa logica precedentemente descritta, le mappe
topografiche descrittive delle potenze spettrali medie relative ai 5 minuti che hanno
preceduto il risveglio in fase REM in entrambe le condizioni di REC e NREC, per ciascuna
delle bande considerate, per ciascuno degli elettrodi. Anche in questo caso i risultati sono
relativamente conformi alle differenze regionali solitamente riscontrate in fase REM,
mostrando una prevalenza centro-frontale delle attività più lente (delta e theta).
Figura 3 Mappe topografiche descrittive delle potenze spettrali medie relative ai 5 minuti che hanno
preceduto il risveglio in fase REM
50
La Figura 4, in coerenza con la Figura 2, riporta l’esito dei confronti statistici, per
campioni appaiati, tra le condizioni REC e NREC nei 5 minuti che hanno preceduto il
risveglio in fase REM. In questo caso, il complesso delle differenze appare meno chiaro
rispetto al NREM, laddove emerge, per la condizione REC, una riduzione dell’attività beta
a livello occipitale, che comunque non raggiunge la significatività statistica.
Figura 4 Mappe topografiche dei confronti statistici tra le condizioni REC e NREC nei 5 minuti che
hanno preceduto il risveglio in fase REM
3.4 Discussione
Il presente elaborato ha riportato i risultati di una fase preliminare dello studio sui correlati
EEG in pazienti narcolettici, che persegue il doppio obiettivo di fornire un contributo alla
questione “stato” o “tratto” e di descrivere la relazione predittiva tra i correlati EEG al
risveglio e i ricordi dei sogni in questo gruppo di pazienti mai studiati prima. Da questa
fase preliminare emerge un pattern di risultati più univoco e significativo per il NREM
rispetto al REM.
51
Infatti, la condizione REC sembra essere predetta, nei 5 minuti che precedono il risveglio
in fase NREM, da un decremento delle attività posteriori lente e da un incremento delle
attività rapide. Si tratta di due fenomeni che, in qualche modo, sembrano essere
complementari, in quanto sembrano suggerire che un livello di maggiore attivazione e
contemporaneamente un parallelo decremento di attivazione siano condizioni permissive al
ricordo dei sogni. Da questi risultati sembrerebbero emergere almeno tre conclusioni,
stante sempre la preliminarietà dello studio e la scarsa numerosità delle condizioni
ricercate:
1. un parziale supporto al modello di arousal-retrievial (Koulack & Goodenough,
1976) (cfr., par. 2.4), secondo il quale il ricordo dei sogni è predetto da una
maggior livello di attivazione e/o da un’attivazione delle aree posteriori temporooccipitali;
2. i presenti risultati in pazienti con diagnosi di narcolessia appaiono diversi da quelli
evidenziati da Marzano et al. (2011) in soggetti normali e al risveglio dal sonno
notturno; infatti quello studio aveva identificato una minore attività oscillatoria
alpha nell’area temporo-parietale destra come predittiva della condizione REC in
seguito a risveglio NREM;
3. i risultati sembrerebbero coerenti con l’ipotesi di un fenomeno di stato, per cui i
correlati EEG riscontrati sarebbero riconducibili ad una caratteristica funzionale
legata al contingente momento in cui viene svegliato il soggetto e in cui si raccoglie
il resoconto onirico.
Per quanto riguarda l’assenza di differenze per i risvegli da sonno REM, le due più
probabili spiegazioni (che non sono alternative) rimandano alla scarsa potenza dello studio
in questa fase preliminare e alla possibilità che il protocollo (i.e., la durata del nap) non
abbia consentito l’acquisizione di un sonno REM consolidato, tale da evidenziare il pattern
neurale eventualmente associato alla presenza/assenza di ricordo di sogni.
3.4 Conclusioni generali
In conclusione, questa preliminare indagine sui correlati neurali del ricordo dei sogni in
pazienti narcolettici sembra delineare un quadro dei risultati diverso da quelli relativi al
sonno notturno di soggetti normali e, di conseguenza, anche non coerente con l’ipotesi di
una condivisione tra veglia e sonno di alcuni meccanismi neurofisiologici per la codifica
52
della memoria episodica; sembra invece emergere una coerenza, seppur parziale, con il
modello di arousal-retrievial. Rispetto, invece, alla questione “tratto” o “stato”, i risultati
sembrerebbero andare nella direzione di un fenomeno di “stato”.
La preliminarità di questo studio è strettamente legata ad almeno tre limitazioni che lo
stesso presenta e che potrebbero essere oggetto di revisione nelle fasi successive dello
studio stesso:
1. Le dimensioni campionarie sono esigue, per cui la robustezza statistica dello studio
è relativamente bassa. Infatti, si dispone solo di 8 soggetti per i risvegli in fase
NREM e altrettanti per i risvegli in fase REM.
2. Lo studio si è necessariamente adattato ad alcune delle necessità del protocollo
clinico previsto per questi pazienti che, prevedendo dei sonnellini della durata
massima di 15 minuti, non fornisce un sonno consolidato e questo è vero
soprattutto per il REM. Infatti, una spiegazione della presenza di risultati
interpretabili solo per il NREM e non per il REM è probabilmente da ascriversi alla
possibilità che mentre il primo abbia avuto tempo per consolidarsi, lo stesso non
vale per il secondo. Si tratta, dunque, di un sonno REM ancora non stabilizzato e
che quindi non presenta ancora alcune delle caratteristiche che altri studi hanno
associato alle condizioni REC e NREC.
3. Il protocollo del MSLT prevede che i 5 nap siano distribuiti lungo tutta la giornata
(ore 9:00, 11:00, 13:00, 15:00 e 17:00), per cui esiste una possibilità di interferenza
delle variabili circadiane con i risultati ottenuti. L’ideale sarebbe, dunque,
considerare tra le variabili non solo la fase del risveglio (REM o NREM), ma anche
la fase circadiana, distinguendo quantomeno tra i nap mattutini e quelli
pomeridiani. Nello studio considerato questo non è stato possibile a causa della
scarsa numerosità dei soggetti e delle condizioni desiderate.
53
54
Riferimenti bibliografici
Adey W., Bors E., Porter R. EEG sleep patterns after high cervical lesions in man.
Archives of Neurology. 1968; 24:377-383.
Adler A. Course and outcome of visual agnosia. J Nerv Ment Dis 1950; 111: 41-51.
Adler A. Course and outcome of visual agnosia. Journal of Nervous and Mental Dis. 1950;
111:41-51.
Adler A. Disintegration and restoration of optic recognition in visual agnosia: Analysis of a
case. Archives of Neurology and Psychiat. 1944; 51: 243-259.
Aguirre M., Broughton R., Stuss D. Does memory impairment exist in narcolepsycataplexy? J. Clin. Exp. Neuropsychol. 1985;7:14-24.
Alaila S.L. Life effects of narcolepsy: measures of negative impact, social support and
psychological well-being. Loss Grief Care 1992; 5:1-22.
Aldrich M. S. Automobile accidents in patients with sleep disorders. Sleep 1989;12:487-94.
Aldrich M. S. The clinical spectrum of narcolepsy and idiopathic hypersomnia. Neurology,
1996; 46: 393-401.
Aldrich M. S., Rogers A. E. Exacerbation of human cataplexy by prazosin. Sleep
1989;12:254-6.
Aldrich M.S. Narcolepsy. N. Engl. J. Med. 1990; 323, 389-394.
Andreas-Zietz A., Keller E., Scholz S., Albert E. D., Roth B., Nevsimalova S. et al. DR2
negative narcolepsy. Lancet 1986; 2:684-5.
Anic-Labat S., Guilleminault C., Kraemer H. C., Meehan J., Arrigoni J., Mignot E.
Validation of a cataplexy questionnaire in 983 sleep-disorders patients. Sleep 1999;22:7787.
antero-posterior shifts of spectral power. Neuroreport 1996;8:123–7.
Antrobus J. REM and NREM sleep reports: Comparison of word frequencies by cognitive
classes. Psychophysiology 1983; 20: 562-568.
Aserinsky E. & Kleitman N. Two types of ocular motility occurring in sleep. Journal of
Applied Physiology 1955; 8:1-10.
Aserinsky E., Kleitman N. Regularly occurring periods of eye motility and concurrent
phenomena during sleep. Science 1953; 118: 273-274.
Barros-Ferreira M., Lairy G. C. Ambiguous sleep in narcolepsy. In: Guilleminault C.,
Dement W.C., Passouant P., editors. Narcolepsy. New York: Spectrum; 1976. p. 57-75.
Baylor G.W., Cavallero C. Sleep 2001; 24, 165.
Billiard M., Besset A., Cadilhac J. The clinical polygraphic development of narcolepsy
epidemiology and long-term evolution.
In: Guilleminault C., Lugaresi E., editors.
55
Sleep/wake disorders: natural history. New York: Raven Press; 1983. p.171-85.
Billiard M., De Koninck J., Coulombe D., Touzery A. Napping behavior in narcoleptic
patients: a four hour cycle in slow wave sleep. In: Stampi C., editor. Why we nap:
evolution, chronobiology and functions of polyphasic and ultrashort sleep. Boston:
Birkhauser; 1992. p. 245-57.
Billiard M., Pasquie-Magnetto V., Heckman M., Carlander B., Besset A., Zachariev Z.,
Eliaou J.F., Malafosse A. Family studies in narcolepsy. Sleep 1994; 17, S54-S59.
Billiard M., Seignalet J. Extraordinary association between HLA-DR2 and narcolepsy.
Lancet 1985 Vol 1 (226-227).
Boehme R.E., Baker T.L., Mefford I.N., Barchas J.D., Dement W.C., Ciaranello R.D.
Narcolepsy: cholinergic receptor changes in animal model. Life Sci. 1984; 34:1825-8.
Borbely A.A. A two process model of sleep regulation. Hum. Neurobiol. 1982; 1:195-204.
Botez M., Olivier M., Vézina J.L. et al. Defective revisualization: Dissociation between
cognitive and imagistic thought. Case report and short review of the literature. Cortex.
1985; 21:375-89.
Bowersox S.S., Kilduff T.S., Faull K.F., Zeller-de-Amicis L., Dement W.C., Ciaranello
R.D. Brain, dopamine receptor levels elevated in canine narcolepsy. Brain Res. 1987;
402:44-8.
Bradley M.M. Emotion and motivation. In: Cacioppo J.T., Tassinary L.G., Bernston G.G.,
eds. Handbook of psychophysiology, 2nd ed. Cambridge: University Press; 2000:602-42.
Brain R. Loss of visualization. Proceedings of the Royal Society of Med. 1954; 47:288290.
Brain R. The cerebral basis of consciousness. Brain. 1950; 73:465-479.
Braun A.R., Balkin T.J., Wesensten N.J., Gwadry F., Carson R.E., Varga M., Baldwin P.,
Belenky G., Herscovitch P. Dissociated pattern of activity in visual cortices and their
projections during human rapid eye movement sleep. Science. 1998; 279(5347):91-5.
Braun A.R., Balkin T.J., Wesenten N.J., Carson R.E., Varga M., Baldwin P., Selbie S.,
Belenky G., Herscovitch P. Regional cerebral blood flow throughout the sleep-wake cycle.
An H2(15)O PET study. Brain 1997; 120:1173-97.
Broughton R., Dunham W., Weisskopf M. et al. Night sleep does not predict day sleep in
narcolepsy. Electroencephalogr. Clin. Neurophysiol. 1994; 91:67-70.
Broughton R., Ghanem Q., Hishikawa Y., Sugita Y., Nevsimalova S., Roth B. Life effects
of narcolepsy in 180 patients from North America, Asia and Europe compared to matched
controls. Can. J. Neurol. Sci. 1981; 8:299-304.
Broughton R., Valley V., Aguirre M., Roberts J., Suwalski W., Dunham W. Excessive
daytime sleepiness and the pathophysiology of narcolepsy-cataplexy: a laboratory
56
perspective. Sleep 1986; 9:205-15.
Brown J. Essay on perception. In: J. Brown (ed.) Neuropsychology of visual perception.
Hillsdale, NJ: L. Erlbaum, 1989.
Cacioppo J.T., Gardner W.L. Emotion. Annu. Rev. Psychol. 1999; 50:191-214.
Carskadon M.A., Dement W.C., Mitler M.M., Roth T., Westbrook P., Keenan S. Guidelines
for the multiple sleep latency test (MSLT): a standard measure of sleepiness. Sleep 1986;
9:519-24.
Cathala H., Laffont F., Siksou M. et al. Sommeil et rêve chez des patients atteints de
lesions pariétales et frontales. Revue Neurologique. 1983; 139:497-508.
Cavallero C., Cicogna P., Natale V., Occhionero N., Zito A. Slow wave sleep dreaming.
Sleep 1992; 15: 562-566.
Cavallero C., Foulkes D., Hollifield M., Terry R. Memory sources of REM and NREM
dreams. Sleep 1990; 13: 449-455.
Charcot J.M. Un cas de suppression brusque et isolée de la vision mentale des signes et des
objets, (formes et couleurs). Progrès Médical. 1983; 11:568-571.
Chase T., Moretti L., Prensky A. Clinical and electroencephalographic manifestations of
vascular lesions of the pons. Neurology. 1968; 18:357-68.
Chemelli R.M. et al. Narcolepsy in orexin knockout mice: molecular genetics of sleep
regulation. Cell 1999; 98: 437-451.
Chervin R.D., Kraemer H.C., Guilleminault C. Correlates of sleep latency on the multiple
sleep latency test in a clinical population.
Electroenceph. Clin. Neurophysiol.
1995;95:147-53.
Cicogna P., Cavallero C., Bosinelli M. Cognitive aspects of mental activity during sleep.
Am. J. Psychol. 1991; 104: 413–425.
Cicogna P., Natale V., Bosinelli M. A comparison of mental activity during sleep onset and
morning awakening. Sleep 1998, 21: 462–470.
Cipolli C. Sleep, dreams and memory. J Sleep Res 1995; 4:1-9.
Cipolli C., Bellucci C., Mattarozzi K., Mazzetti M., Tuozzi G., Plazzi G.
organization of REM-dreams in patients with narcolepsy–cataplexy.
Story-like
Brain Research
Bulletin 2008; 77: 206-213.
Cipolli C., Bolzani R., Massetani R., Murri L., Muratorio A. Dream structure in
Parkinson’s patients. J Nerv Ment Dis 1992; 180:516-523.
Cipolli C., Fagioli I., Mazzetti M. e Tuozzi G. Incorporation of presleep stimuli into dream
contents: Evidence for a consolidation effect on declarative knowledge during REM sleep?
Journal of Sleep Research, 2004; 13(4), 317–326.
57
Cipolli C., Salzarulo P. L’étude expérimentale du reve. Revue Internationale de
Psychopathologie 1996; 23:505-522.
Cohen D.B., MacNeilage P. F. A test of the salience hypothesis of dream recall. J. Consult
Clin. Psychol. 1974; 42:699-703.
Cohen D.B., Wolfe G. Dream recall and repression: evidence for an alternative hypothesis.
J. Consult Clin. Psychol. 1973;41:349–55.
Cory T.L., Orniston D.W., Simmel E., Dainoff M. Predicting the frequency of dream recall.
J. Abnorm. Psychol. 1975; 84: 261–6.
Cummings J.L., Greenberg R. Sleep patterns in the “locked in” syndrome.
Electroencephalography and Clinical Neurophysiol. 1977; 43:270-271.
Curtis D.R., Hosli L., Johnston G.A., Johnston I.H. The hyperpolarization of spinal
motoneurones by glycine and related amino acids. Exp. Brain Res. 1968; 5: 235-258.
Daan S., Beersma D. G. M., Borbely A. A. The timing of human sleep: a recovery process
gated by a circadian pacemaker. Am. J. Physiol. 1984; 246:R161-78.
Dahlitz M., Parkes J.D. Sleep paralysis. Lancet 1993; 341:406-7.
Dantz B., Edgar D. M., Dement W. C. Circadian rhythms in narcolepsy: studies on a 90
minute day. Electroenceph. Clin. Neurophysiol. 1994;90:24-35.
Dauvilliers Y., Billiard M., Montplaisir J. Clinical aspects and pathophysiology of
narcolepsy. Clinical Neurophysiology 2003; 114: 2000-2017.
Dauvilliers Y., Montplaisir J., Molinari N., Carlander B., Ondze B., Besset A. et al. Age of
onset of narcolepsy in two large populations of patients in France and Quebec. Neurology
2001a;57:2029-33.
De Gennaro L., Cipolli C., Cherubini A., Assogna F., Cacciari C., Marzano C. et al.
Amygdala and hippocampus volumetry and diffusivity in relation to dreaming. Hum Brain
Mapp 2011; 32:1458-70.
De Gennaro L., Marzano C., Cipolli C., Ferrara M. How we remember the stuff that
dreams are made of: Neurobiological approaches to the brain mechanisms of dream recall.
Behavioural Brain Research 2012; 226: 592-596.
De Lecea L., Kilduff T.S., Peyron C., Gao X., Foye P.E., Danielson P.E., Fukuhara C.,
Battenberg E. L., Gautvik V.T., Bartlett F.S. 2nd, Frankel W.N., van den Pol A.N., Bloom
F.E., Gautvik K.M., Sutcliffe J.G. The hypocretins: hypothalamus-specific peptides with
neuroexcitatory activity. Proc. Natl. Acad. Sci. USA 1998; 95: 322-327.
Decety J. Do imagined and executed actions share the same neural substrate? Cognitive
Brain Research 3 1996; 87-93.
Delashaw J.B., Foutz A.S., Guilleminault C., Dement W.C. Cholinergic mechanisms and
cataplexy in dogs. Exp Neurol 1979;66:745-57.
58
Dement W.C., Kleitman N. The relation of eye movements during sleep to dream activity:
An objective method for the study of dreaming. J. Exp. Psychol. 1957; 53: 89–97.
Dement W.C., Rechtschaffen A., Gulevich G. The nature of the narcoleptic sleep attack.
Neurology 1966; 16: 18–33.
Desseilles M., Dang-Vu T.T., Sterpenich V., Schwartz S.
Cognitive and emotional
processes during dreaming: A neuroimaging view. Consciousness and Cognition 2011;20:
998–1008.
Doricchi F., Violani C. Dream recall in brain-damaged patients: a contribution to the
neuropsychology of dreaming through a review of the literature. In: John S., Antrobus M.
B., editors. The neuropsychology of sleep and dreaming. Hillsdale, NJ: Erlbaum 1992; 99–
129.
Eichenlaub J.B., Nicolas A., Daltrozzo J. et al. Resting brain activity varies with dream
recall frequency between subjects. Neuropsychopharmacology. 2014; 39:1594-1602.
Elias C. F. et al. Chemically defined projections linking the mediobasal hypothalamus and
the lateral hypothalamic area. J. Comp. Neurol. 1998; 402: 442–459.
Elliott R. Executive functions and their disorders. Br Med Bull 2003; 65:49-59.
Erlacher D., Schredl M. Do REM (lucid) dreamed and executed actions share the same
neural substrate? Int. J. Dream Res. 2008; 1:7-14.
Estabrooke I.V., McCarthy M.T., Ko E. et al. Fos expression in orexin neurons varies with
behavioral state. J. Neurosci. 2001; 21:1656-1662.
Fagioli I. Mental activity during sleep. Sleep Medicine Reviews, 2002; 6: 307–320.
Faull K.F., Guilleminault C., Berger P. A., Barchas J.D. Cerebrospinal fluid monoamine
metabolites in narcolepsy and hypersomnia. Ann. Neurol. 1983; 13: 258-63.
Feldman M.H. Physiological observations in a chronic case of “locked-in” syndrome.
Neurology. 1971; 21:459-478.
Fell J., Fernández G., Lutz M.T., Kockelmann E., Burr W., Schaller C. et al. Rhinalhippocampal
connectivity
determines
memory
formation
during
sleep.
Brain
2006;129:108–14.
Fell J., Klaver P., Lehnertz K., Grunwald T., Schaller C., Elger C.E., Helmstaedter C.
Human memory formation is accompanied by rhinal–hippocampal coupling and
decoupling. Nat. Neurosci. 2001; 4:1259-64.
Ferrara M., De Gennaro L. Going local: insights from EEG and stereo-EEG studies of the
human sleep-wake cycle. Curr Top Med Chem. 2011; 11(19):2423-37.
Fosse R. REM mentation in narcoleptics and normals: an empirical test of two
neurocognitive theories. Conscious. Cogn. 2000;9:488-509.
Fosse R., Stickgold R., Hobson J.A. Brain–mind states: Reciprocal variation in thoughts
59
and hallucinations. Psychological Science, 2001; 12: 30-36.
Fosse R., Stickgold R., Hobson J.A. Emotional Experience During Rapid-eye-movement
Sleep in Narcolepsy. Sleep, 2002; 25(7): 724-732.
Fosse R., Stickgold R., Hobson J.A. Thinking and hallucinating: Reciprocal changes in
sleep. Psychophysiology, 2004; 41(2): 298-305.
Foulkes D. Dream reports from different stages of sleep. J. Abn. Soc. Psychol. 1962; 65:
14–25.
Foulkes D. The psychology of sleep. New York: Scribner 1966.
Foulkes D., Schmidt M. Temporal sequence and unit composition in dream reports from
different stages of sleep. Sleep 1983; 6: 265-280.
Frank J. Clinical survey and results of 200 cases of prefrontal leucotomy. J. Ment. Sci.
1946;92:497-508.
Freud S. Die Traumdeutung. Leipzig, Wien: Franz Deuticke, 1900.
Fruhstorfer B., Mignot E., Bowersox S., Nishino S., Dement W.C., Guilleminault C.
Canine narcolepsy is associated with an elevated number of alpha-2 receptors in the locus
coeruleus. Brain Res. 1989; 500:209-14.
Gallopin T., Fort P., Eggermann E., Cauli B., Luppi P.H., Rossier J., Audinat E.,
Mühlethaler M., Serafin M. Identification of sleep-promoting neurons in vitro. Nature
2000; 404: 992-995.
Gelineau J. De la narcolepsie. Gaz des Hop (Paris) 1880;55:626-8. p.635-7.
Gervasoni D., Darracq L., Fort P., Souliere F., Chouvet G., Luppi P. H.
Electrophysiological evidence that noradrenergic neurons of the rat locus coeruleus are
tonically inhibited by GABA during sleep. Eur J Neurosci 1998; 10: 964-970.
Guilleminault C., Carskadon M., Dement W. C. On the treatment of rapid eye movement
narcolepsy. Arch. Neurol. 1974; 30: 90-93.
Guilleminault C., Gelb M. Clinical aspects and features of cataplexy. Adv. Neurol.
1995;67:65-77.
Guilleminault C., Grumet C. HLA-DR2 and narcolepsy: not all narcoleptic cataplectic
patients are DR2. Hum. Immunol. 1986a;17:1-2.
Guilleminault C., Mignot E., Grumet F.C. Familial patterns of narcolepsy. Lancet
1989;2:1376-1379.
Gulyani S., Wu M.F., Nienhuis R., John J., Siegel J.M. Cataplexyrelated neurons in the
amygdala of the narcoleptic dog. Neuroscience 2002; 112: 355-365.
Hall C.S. e Van De Castle R.L. The content analysis of dreams. New York: AppletonCentury-Crofts; 1966.
Hall C.S. The meaning of dreams. New York: McGraw-Hill; 1953.
60
Hall C.S., Nordby V. The individual and his dreams. New York: New American Library;
1972.
Harrison Y., Horne J.A., Rothwell A. Prefrontal neuropsychological effects of sleep
deprivation in young adults-a model for healthy aging? Sleep 2000; 23:1067-72.
Harsh J., Peszka J., Hartwig G., Mitler M. Night-time sleep and daytime sleepiness in
narcolepsy. J. Sleep Res. 2000;9:309 –316.
Hartmann B., Russ D., Oldfield M., Falke R. & Skoff B. Dream content: effects of LDOPA. Sleep Res. 1980: 9, 153.
Hervey de Saint-Denys M.J.L. Les Rêves et les moyens de les diriger. Paris: Editions
D’Aujourd’hui (1867).
Hishikawa Y. Sleep paralysis. In: Guilleminault C., Dement W.C., Passouant P., editors.
Narcolepsy. New York: Spectrum; 1976. p. 97–125.
Hishikawa Y., Shimizu T. Physiology of REM sleep, cataplexy, and sleep paralysis. Adv.
Neurol. 1995; 67:245-71.
Hobson J.A. The Chemistry of Conscious States: How the Brain Changes Its Mind. Boston:
Little Brown and Co; 1994.
Hobson J.A. The dreaming brain. New York: Basic Books, 1998.
Hobson J.A., Lvdic R. e Baahdovan H.A. Evolvine concepts of sleep cycle generation:
From brain ce&rs t; neurona: populations (with commentaries). Behav. Bram Sci. 1986; Y:
371-448.
Hobson J.A., McCarley R.W. The brain as a dream state generator: an activation-synthesis
hypothesis of the dream process. Am. J. Psychiatry 1977; 134, 1335-1348.
Hobson J.A., Pace-Schott E.F., Stickgold R. Dreaming and the brain: Toward a cognitive
neuroscience of conscious states. Behavioral and Brain Sciences, 2000; 23(6): 793-842,
(discussion 904-1121).
Hobson J.A., Pace-Schott E.F., Stickgold R., Kahn D. To dream or not to dream? Relevant
data from new neuroimaging and electrophysiological studies. Curr Opin Neurobiol
1998;8:239-44.
Hobson J.A., Stickgold R., Pace-Schott E.F. The neuropsychology of REM sleep dreaming.
NeuroReport, 9(3), R1-14, 1998.
Honda Y. Census of narcolepsy, cataplexy and sleep life among teenagers in Fujisawa city.
Sleep Res 1979; 8:191.
Honda Y., Asaka A., Tanimura M. et al. A genetic study of narcolepsy and excessive
daytime sleepiness in 308 families with a narcolepsy or hypersomnia proband. In:
Guilleminault C., Lugaresi E., eds. Sleep/wake disorders: natural history, epidemiology,
and long-term evolution. New York: Raven Press, 1983:187–199.
61
Horne J. Why we sleep. Oxford: Oxford University Press, 1988.
Houghton W. C., Scammell T. E., Thorpy M. Pharmacotherapy for cataplexy. Sleep
Medicine Reviews 2004; 8: 355-366.
Hublin C., Kaprio J., Partinene M., Koskenvuo M., Heikkila K., Koskimies S. et al. The
prevalence of narcolepsy: an epidemiological study of the Finnish twin cohort. Ann Neurol
1994; 35:709-716.
Iaria G., Lanyon L.J., Fox C.J., Giaschi D., Barton J.J. Navigational skills correlate with
hippocampal fraction anisotropy in humans. Hippocampus 2008; 18:335-9.
Johnson M. K., Kahan T. L., Raye C. L. Dreams and reality monitoring. Journal of
Experimental Psychology: General, 1984; 113(3): 329-344,.
Jones B.E. Paradoxical sleep and its chemical/structural substrates in the brain.
Neuroscience 1991; 40(3), 637-656.
Jouvet M. Paradoxical sleep mechanisms. Sleep, 17(Suppl. 8), S77-83, 1994.
Jouvet,
Recherches sur les structures nerveuses et les mécanismes responsables des
différentes phases du sommeil physiologique. Arch. ital. Biol., 1962, 100 (125).
Juji T., Satake M., Honda Y., Doi Y. HLA antigens in Japanese patients with narcolepsy: all
the patients were DR2 positive. Tissue Antigens 1984, 24, 316-319.
Jus K., Bouchard M., Jus A., Villeneuve A. & Lachance R. Sleep EEG studies in untreated,
long-term schizophrenic patients. Archives of General Psychiatry 1973; 29, 386-390.
Kanbayashi T., Inoue Y., Chiba S., Aizawa R., Saito Y., Tsukamoto H., Fujii Y., Nishino S.,
Shimizu T. CSF hypocretin-1 (orexin-A) concentrations in narcolepsy with and without
cataplexy and idiopathic hypersomnia. J. Sleep Res. 2002; 11:91-93.
Kerr N.H., Foulkes D. Right hemispheric mediation of dream visualization: a case study.
Cortex 1981; 17:603-609.
Kerr N.H., Foulkes D., Jurkovic G. Reported absence of visual dream imagery in a
normally sighted subject with Turner’s syndrome. Journal of Mental Imagery. 1978; 2:247264.
Khader P.H., Rösler F. EEG power changes reflect distinct mechanisms during long-term
memory retrieval. Psychophysiology. 2011; 48:362-369.
Kilduff T.S., Bowersox S.S., Kaitin K.I., Baker T.L., Ciaranello R.D., Dement W.C.
Muscarinic cholinergic receptors and the canine model of narcolepsy. Sleep 1986; 9:102-6.
Kisanuki Y., Chemelli R., Tokita S., Willie J.T., Sinton C.M., Yanagisawa M. Behavioral
and polysomnographic characterization of orexin-1 receptor and orexin-2 receptor double
knockout mice. Sleep 2001; 24:A22.
62
Kiyashchenko L.I., Mileykovskiy B.Y., Lai Y.Y., Siegel J.M. Increased and decreased
muscle tone with orexin (hypocretin) microinjections in the locus coeruleus and pontine
inhibitory area. J Neurophysiol. 2001; 85: 2008-2016
Kiyashchenko L.I., Mileykovskiy B.Y., Maidment N., Lam H.A., Wu M.F., John J., Peever
J., Siegel J.M. Release of hypocretin (orexin) during waking and sleep states. J. Neurosci.
2002; 22: 5282-5286.
Klawans H.L., Weber S., Nausieda P.A., Weiner W.J., Kaplan L.R. Sleep disruption in the
course of chronic levodopa therapy: an early feature of the levodopa psychosis. Clin.
Neuropharmacol. 1982; Vol 5 (183-194).
Kosslyn S. Image and Brain. MIT press; 1994.
Koulack D., Goodenough D.R. Dream recall and dream recall failure: an arousal-retrieval
model. Psychol. Bull 1976;83:975–84.
Kripke D. Biological rhythm disturbances might cause narcolepsy. In: Guilleminault C.,
Dement W. C., Passouant P., editors. Narcolepsy. New York: Spectrum; 1976. p. 475–83.
Kugler J. Sleep Research: pictures from the early years. WFSRS Newsletter 1996, 5: 22–
23.
Lairy G. C., de Barros Ferreira M., Goldsteinas L. Les phases intermédiaires du sommeil.
In Gastaut H., Lugaresi E., Berti Ceroni G., Coccagna G. (eds) Abnormalities of sleep in
man: Proceedings of the XVth European Meeting on Electro encephalography. Bologna:
Aula Gaggi, 1967: 275-83.
Lang P.J., Greenwald M.K. The International Affective Picture System standardization
procedure and initial group results for affective judgments: technical report IB. Gainesville,
FL: The Center for Research in Psychophysiology, University of Florida; 1988.
Lang P.J., Ohman A., Vaitl D. The International Affective Picture System [Photographic
slides]. Gainesville, FL: The Center for Research in Psychophysiology, University of
Florida; 1988.
Langdon N., Welch K.I., an Dam M., Vaugham R., Parkes K. Genetic markers in
narcolepsy. Lancet 1984; 2: 1178.
Lankford D.A., Wellman J.J., O’Hara C. Postraumatic narcolepsy in mild to moderate
closed head injury. Sleep 1994; 17:S25-S28.
Lavie P., Peled R. Narcolepsy is a rare disease in Israel. Sleep 1987; 10: 608-609.
Lavie P., Pratt H., Scharf B. et al. Localized pontine lesion: nearly total absence of REM
sleep. Neurology. 1984; 34:118-120.
Lee J.H., Bliwise D.L., Labret-Bories E., Guilleminault C., Dement W.C. Dream-disturbed
sleep in insomnia and narcolepsy. J. Nerv. Ment. Dis. 1993;181:320-4.
63
Legrand D., Ruby P. What is self-specific? Theoretical investigation and critical review of
neuroimaging results. Psychol Rev. 2009; 116:252-282.
Lin L., Faraco J., Li R., Kadotani H., Rogers W., Lin X., Qiu X., de Jong P. J., Nishino S.,
Mignot E. The sleep disorder canine narcolepsy is caused by a mutation in the hypocretin
(orexin) receptor 2 gene. Cell 1999;98:365-376.
Lin L., Hungs M., Mignot E.
Narcolepsy and the HLA region.
Journal of
Neuroimmunology 2001; 117: 9-20.
Loomis A.L., Harvey E.N., Hobart G.A. Cerebral states during sleep, as studied by human
brain potential. J Exp Psychol 1937, 21:127-144.
Lugaresi E., Cirignotta F., Zucconi M., Mondini S., Lenzi P.L., Coccagna G. Good and poor
sleepers: an epidemiological survey of the San Marino population. In: Guilleminault C.,
Lugaresi E., editors. Sleep-wake disorders: natural history, epidemiology and long-term
evolution. New York: Raven Press 1983; p.1-12.
Mach E. The analysis of sensations, and the relation of the physical to the psychical. 5th
edition. Dover; 1959.
Macrae D., Trolle E. The defect of function in visual agnosia. Brain. 1956; 79:94-110.
Madsen P.L. & Vorstrup S. Cerebral blood flow and metabolism during sleep.
Cerebrovascular and Brain Metabolism Reviews 1991; 3(4), 281-296.
Madsen P.L., Holm S., Vorstrup S., Friberg L., Lassen N.A. & Wildschiodtz G. Human
regional cerebral blood flow during rapid-eye-movement sleep. Journal of Cerebral Blood
Flow and Metabolism 1991; 11(3), 502-507.
Madsen P.L., Schmidt J.F., Wildschiodtz G., Friberg L., Holm S., Vorstrup S. et al.
Cerebral O2 metabolism and cerebral blood flow in humans during deep and rapid-eyemovement sleep. Journal of Applied Physiology 1991; 70(6), 2597-2601.
Maguire E.A., Gadian D.G., Johnsrude I.S., Good C.D., Ashburner J., Frackowiak R.S.,
Frith C.D. Navigation-related structural change in the hippocampi of taxi drivers. Proc.
Natl. Acad. Sci. USA 2000; 97: 4398-403.
Mandler J. M., Johnson N. S. A tale of two structures: underlying and surface forms in
stories. Poetics 1980; 9: 51-86.
Mandler J. M., Johnson N. S. Remembrance of things parsed: story structure and recall.
Cognit. Psychol. 1977; 9: 111-151.
Maquet P.
Functional neuroimaging of normal human sleep by positron emission
tomography. J. Sleep Res. 2000;9:207-31.
Maquet P., Dive D., Salmon E., Sadzot B., Franco G., Poirrier R., et al. Cerebral glucose
utilization during sleep-wake cycle in man determined by positron emission tomography
and [18F]2-fluoro-2-deoxy-D-glucose method. Brain Research 1990; 513(1), 136-143.
64
Maquet P., Franck G. REM sleep and amygdala. Mol. Psychiatr. 1997;2:195-6.
Maquet P., Laureys S., Peigneux P., Fuchs S., Petiau C., Phillips C. et al. Experiencedependent changes in cerebral activation during human REM sleep. Nature Neuroscience
2000; 3(8), 831–836.
Maquet P., Peters J., Aerts J., Delfiore G., Degueldre C., Luxen A., Franck G. Functional
neuroanatomy of human rapid-eye-movement sleep and dreaming. Nature 1996;383:163-6.
Markand O., Dyken M. Sleep abnormalities in patients with brain stem lesions. Neurology.
1976; 26: 769-76.
Marzano C., Ferrara M., Curcio G., De Gennaro L. The effects of sleep deprivation in
humans: topographical electroencephalogram changes in non-rapid eye movement
(NREM) sleep versus REM sleep. J. Sleep Res. 2010;19:260-8.
Marzano C., Ferrara M., Mauro F., Moroni F., Gorgoni M., Tempesta D., Cipolli C., De
Gennaro L. Recalling and Forgetting Dreams: Theta and Alpha Oscillations during Sleep
Predict Subsequent Dream Recall. The Journal of Neuroscience, 2011; 31(18): 6674-6683.
Matsuki K., Grumet F.C., Lin X., Gelb M., Guilleminault C., Dement W.C., Mignot E.
HLA DQB1-0602, rather than HLA DRw15 (DR2), is the disease susceptibility gene in
Black narcolepsy. Lancet 1992; 339, 1052.
Matsuki K., Juji T., Tokunaga K., Naohara T., Satake M., Honda Y. Human
histocompatibility leukocyte antigen (HLA). Haplotype frequencies estimated from the
data HLA class I, II, and III antigens in 111 Japanese narcoleptics. J. Clin. Invest. 1985;
76, 2078-2083.
Mazzetti M., Bellucci C., Mattarozzi K., Plazzi G., Tuozzi G., Cipolli C. REM-dreams
recall in patients with narcolepsy-cataplexy. Brain Research Bulletin 2010;81: 133-140.
McCarley R. W., Hobson J. A. Neuronal excitability modulation over the sleep cycle: a
structural and mathematical model. Science 1975;189:58-60.
McCormick J., Nielsen T., Ptito M., Hassainia F., Ptito A., Villemure J-C., Vera C.,
Montplaisir J.
REM sleep dream mentation in right hemispherectomized patients.
Neuropsychologia 1997; 35: 695-701.
Mefford I.N., Baker T.L., Boehme R., Foutz A.S., Ciaranello R.D., Barchas J.D. et al.
Narcolepsy: biogenic amine deficits in an animal model. Science 1983; 220:629-32.
Mignot E. Genetic and familial aspects of narcolepsy. Neurology 1998; 50, S16-S22.
Mignot E., Bowersox S. S., Maddaluno J., Dement W. C., Ciaranello R. D. Evidence for
multiple (3 H)-Prazosin binding sites in canine brain membranes. Brain Res. 1989a;
486:56-66.
Mignot E., Guilleminault C., Bowersox S.S., Rappaport A., Dement W.C. Effects of alpha1-adrenoceptors blockade with prazosin in canine narcolepsy. Brain Res 1988a ;444:184-8.
65
Mignot E., Guilleminault C., Bowersox S.S., Rappaport A., Dement W.C. Role of central
alpha-1-adrenoceptors in canine narcolepsy. J Clin Invest 1988b; 82:885-94.
Mignot E., Hayduk R., Black J., Grumet F. C., Guilleminault C. HLA class II studies in
509 narcoleptic patients. Sleep 1997a; 20:1012-20.
Mignot E., Lammers G.J., Ripley B., Okun M., Nevsimalova S., Overeem S., Vankova J.,
Black J., Harsh J., Bassetti C., Schrader H., Nishino S. The role of cerebrospinal fluid
hypocretin measurement in the diagnosis of narcolepsy and other hypersomnias. Arch.
Neurol. 2002; 59:1553-62.
Mileykovskiy B.Y., Kiyashchenko L.I., Siegel J.M. Muscle tone facilitation and inhibition
after orexin-a (hypocretin-1) microinjections into the medial medulla. J Neurophysiol
2002; 87: 2480-9.
Miller J.D., Faull K.F., Bowersox S.S., Dement W.C. CNS monoamines and their
metabolites in canine narcolepsy: a replication study. Brain Res. 1990;509:169-71.
Misane I., Tovote P., Meyer M., Spiess J., Ogren S.O., Stiedl O. Time-dependent
involvement of the dorsal hippocampus in trace fear conditioning in mice. Hippocampus
2005; 15:418-26.
Montplaisir J., Billiard M., Takahashi S., Bell I.R., Guilleminault C., Dement W.C. Twentyfour-hour recording in REM narcoleptics with special reference to nocturnal sleep
disruption. Biol Psychiatry 1978;13:73-89.
Montplaisir J., de Champlain J., Young S.N., Missala K., Sourkes T.L., Walsh J. et al.
Narcolepsy and idiopathic hypersomnia: biogenic amines and related compounds in CSF.
Neurology 1982; 32:1299-302.
Mueller-Eckhardt G., Meier-Ewert K., Schendel D.J., Reinecker F.B., Muthoff G., MuellerEckhardt C.C. HLA and narcolepsy in a German population. Tissue Antigens 1986;
28:163-9.
Muzur A., Pace-Schott E.F., Hobson J.A. The prefrontal cortex in sleep. Trends Cog. Sci.
2002; 6:475-81.
Neely S., Rosenberg R., Spire J.P. et al. HLA antigens in narcolepsy. Neurology
1987;37:1858-1860.
Nielsen A., Stenstrom P. What are the memory sources of dreaming? Nature Vol. 437,
2005.
Nielsen T. A. A review of mentation in REM and NREM sleep: “Covert” REM sleep as a
possible reconciliation of two opposing models. Behavioral and Brain Sciences 2000; 23:
851-866.
Nielsen T. A. Chronobiological features of dream production. Sleep Medicine Reviews,
2004; 8(5): 403-424.
66
Nir Y. & Tononi G. Dreaming and the brain: from phenomenology to neurophysiology.
Trends in Cognitive Sciences Vol.14 No.2, 2010.
Nishino S. & Mignot E. Pharmacological aspects of human and canine narcolepsy. Prog
Neurobiol 1997; 52:27-78.
Nishino S., Arrigoni J., Shelton J., Dement W.C., Mignot E. Desmethyl metabolites of
serotonergic uptake inhibitors are more potent for suppressing canine cataplexy than their
parent compounds. Sleep 1993a; 16:706-12.
Nishino S., Fujiki N., Ripley B., Sakurai E., Kato M., Watanabe T., Mignot E., Yanai K.
Decreased brain histamine content in hypocretin/orexin receptor-2 mutated narcoleptic
dogs. Neurosci. Lett. 2001; 313:125-128.
Nishino S., Mao J., Sampathkumaran R., Honda K., Dement W.C., Mignot E. Differential
effects of dopaminergic and noradrenergic uptake inhibitors on EEG arousal and cataplexy
of narcoleptic canines. Sleep Res 1996; 25:317.
Nishino S., Mao J., Sampathkumaran R., Shelton J., Mignot E. Increased dopaminergic
transmission mediates the wake-promoting effects of CNS stimulants. Sleep Res Online
1994;17:436-7.
Nishino
S.,
Okura
M.,
Mignot
E.
Narcolepsy:
genetic
predisposition
and
neuropharmacological mechanisms. Sleep Medicine Reviews, 2000; 4(1):57-99.
Nitz D., Siegel J. GABA release in the dorsal raphe nucleus: role in the control of REM
sleep. Am J Physiol 1997; 273(1 Pt 2): R451-R455.
Nixon O. L., Pierce C. M., Lester B. K., Matthis J. L. Narcolepsy: nocturnal dream
frequency in adolescents. J. Neuropsychiatry 1964;5:150-2.
Nobili L., Besset A., Ferrillo F., Rosadini G., Schiavi G., Billiard M. Dynamics of slow
wave activity in narcoleptic patients under bed rest condition. Electroenceph. Clin.
Neurophysiol. 1995;95:414-25.
Nofzinger E.A., Buysse D.J., Miewald J.M., Meltzer C.C., Price J.C., Sembrat R.C. et al.
Human regional cerebral glucose metabolism during non-rapid eye movement sleep in
relation to waking. Brain 2002;125:1105-15.
Nofzinger E.A., Mintun M.A., Wiseman M., Kupfer D.J. & Moore R.Y. Forebrain
activation in REM sleep: An FDG PET study. Brain Research 1997; 770(1-2), 192-201.
Nyhus E., Curran T. Functional role of gamma and theta oscillations in episodic memory.
Neurosci. Biobehav. Rev. 2010;34:1023-35.
of the human sleep-wake cycle. Curr Top Med Chem 2011;11:2423-37.
Okun M.L., Lin L., Pelin Z., Hong S., Mignot E. Clinical aspects of narcolepsy-cataplexy
across ethnic groups. Sleep 2002; 25:27-35.
67
Orellana C., Villemin E., Tafti M., Carlander B., Beset A., Billiard M. Life events in the
year preceding the onset of narcolepsy. Sleep 1994; 17:S50-S53.
Osorio I., Daroff R.B. Absence of REM and altered NREM sleep in patients with
spinocerebellar degeneration and slow saccades. Ann Neurol. 1980 Mar;7(3):277-80.
Overeem S., Lammers G. J., van Dijk J. G. Weak with laughter. Lancet 1999; 354: 838.
Panksepp J. Affective Neuroscience. Oxford: OUP 1998.
Panksepp J. Mood changes. In Handbook of Clinical Neurology (45) (Vinken P. et al., eds),
In pp. 271–285, Elsevier, 1985.
Parkes J.D. Sleep, its disorders. Philadelphia: WB Saunders; 1985.
Partridge M. Pre-frontal leucotomy: a survey of 300 cases personally followed for 1–3
years. Oxford: Blackwell; 1950.
Passouant P., Baldy-Moulinier M. Données actuelles sur le traitement de la narcolepsie.
Action des imipraminiques. Concours Med. (Paris) 1970;92:835–8.
Perneger T.V. What's wrong with Bonferroni adjustments. BMJ. 1998; 316(7139):1236-8.
Peyron C., Tighe D. K., van den Pol A. N., de Lecea L., Heller H. C., Sutcliffe J. G.,
Kilduff T. S. Neurons containing hypocretin (orexin) project to multiple neuronal systems.
J. Neurosci. 1998; 18: 9996–10015.
Piehler R. Uber das Traumleben leukotomierter (Vorlaufige Mitteilung) [On the dream-life
of the leucotomized (preliminary communication)]. Nervenartz 1950; 21: 517-521.
Poirier G., Monplaisir J., Decary F., Momege D., Lebrun A. HLA antigens in narcolepsy
and idiopathic central nervous hypersomnolence. Sleep 1986; 9: 153-158.
Rechtschaffen A., Kales A. A manual of standardized terminology, techniques and scoring
system for sleep stages of human subjects. Los Angeles: UCLA Brain Information Service
(1968).
Reid M.S., Siegel J.M., Dement W.C., Mignot E. Cholinergic mechanisms in canine
narcolepsy. II. Acetylcholine release in the pontine reticular formation is enhanced during
cataplexy. Neuroscience 1994b;59:523-30.
Reid M.S., Tafti M., Geary J., Nishino S., Siegel J.M., Dement W.C., Mignot E.
Cholinergic mechanisms in canine narcolepsy: I. Modulation of cataplexy via local drug
administration into the pontine reticular formation. Neuroscience 1994a;59:511-22.
Revonsuo A. The reinterpretation of dreams: An evolutionary hypothesis of the function of
dreaming. Behavioral and Brain Sciences, 2000; 23(6), 877–901(discussion 904–1121).
Richardson G. S., Carskadon M. A., Flagg W., VanDenHoed J., Dement W. C., Mitler M.
Excessive daytime sleepiness in man: multiple sleep latency measurement in narcoleptic
and control subjects. Electroenceph. Clin. Neurophysiol. 1978;45:621–7.
Ripley B., Overeem S., Fujiki N., Nevsimalova S., Uchino M., Yesavage J., Di Monte D.,
68
Dohi K., Melberg A., Lammers G. J., Nishida Y., Roelandse F. W., Hungs M., Mignot E.,
Nishino S. CSF hypocretin/orexin levels in narcolepsy and other neurological conditions.
Neurology 2001b;57:2253–8.
Roth B. Narcolepsy and Hypersomnia. Basel: Karger, 1980.
Sakurai T., Amemiya A., Ishii M., Matsuzaki I., Chemelli R. M., Tanaka H., Williams S. C.,
Richardson J. A., Kozlowski G. P., Wilson S., Arch J. R., Buckingham R. E., Haynes A. C.,
Carr S. A., Annan R. S., McNulty D. E., Liu W. S., Terrett J. A., Elshourbagy N. A.,
Bergsma D. J., Yanagisawa M. Orexins and orexin receptors: a family of hypothalamic
neuropeptides and G protein-coupled receptors that regulate feeding behavior. Cell 1998;
92: 573–585.
Salzarulo P., Cipolli C. Linguistic organization and cognitive implications of REM and
NREM sleep related reports. Percept Mot Skills 1979; 49: 767-777.
Salzarulo P., Cipolli C., Lairy G.C., Pecheux M. L’étude psychologique de l’activité
mentale du sommeil: analyse critique des méthodes et théories. L’évolution psychiatrique.
1973; 1:33-70.
Salzarulo P., Pecheux M.G., Lairy G.C. A vecto-oculographic approach to fast sleep eye
movements in man. Electroenceph. Clin. Neurophysiol 1973; 34: pp. 539-542
Sankoh A.J., Huque M.F., Dubey S.D. Some comments on frequently used multiple
endpoint adjustment methods in clinical trials. Stat Med. 1997; 16(22):2529-42.
Saper C.B., Chou T.C., Scammell T.E. The sleep switch: hypothalamic control of sleep and
wakefulness. Trends Neurosci. 2001; 24:726-731.
Sateia M.J. International classification of sleep disorders-third edition: highlights and
modifications. Chest. 2014 Nov; 146(5):1387-94.
Scammell T. E. The Neurobiology, Diagnosis, and Treatment of Narcolepsy. Annals of
Neurology, 2003; 53 (2).
Schanfald D., Pearlman C., Greenberg R. The capacity of stroke patients to report dreams.
Cortex. 1985; 21:237-247.
Scharf B., Moscovitz C., Lupton C. & Klawans H. Dream phenomena induced by chronic
levodopa therapy. J. Neural Transmission. 1978; 43, 143.
Schindler R. Das Traumleben der Leukomierten [The dream-life of leucotomized]. Wiener
Zeitschrift fur die Nervenheilkunde 1953; 6:330
Schneider A. e Domhoff G.W. The quantitative study of dreams; 2009.
Schredl M. Dream recall: models and empirical data. In: Barrett D., McNamara P., editors.
The new science of dreaming – volume 2: content, recall, and personality correlates.
Westport: Praeger; 2007. p. 79–114.
Schredl M. Dreams in patients with sleep disorders. Sleep Med. Rev. 2008;13: 215-221.
69
Schredl M. Continuity between waking and dreaming: a proposal for a mathematical
model. Sleep Hypn. 2003;5:26–40.
Schredl M. Die nachtliche Traumwelt: Einfuhrung in die psychologische Traumforschung.
Stuttgart: Kohlhammer; 1999.
Schredl
M.
Traume
und
Schlafstorungen:
Empirische
Studie
zur
Traumerinnerungshaufigkeit und zum Trauminhalt von schlafgestorten Patientinnen.
Marburg: Tectum; 1998.
Schredl M., Bozzer A., Morlock M. Traumerinnerung und Schlafstorungen. Psychother.
Psychosom. Med. Psychol. 1997;47:108–16.
Schredl M., Schafer G., Weber B., Heuser I. Dreaming and insomnia: dream recall and
dream content of patients with insomnia. J. Sleep Res. 1998;7:191–8.
Schredl M., Wittmann L., Ciric P., Gotz S. Factors of home dream recall: a structural
equation model. J. Sleep Res. 2003;12:133–41.
Schwartz S. Life goes on in dreams. Sleep, 2010; 33(1), 15–16.
Schwartz S., Maquet P. Sleep imaging and the neuro-psychological assessment of dreams.
Trends in Cognitive Sciences, 2002; 6(1): 23–30.
Sederberg P.B., Kahana M.J., Howard M.W., Donner E.J., Madsen J.R. Theta and gamma
oscillations during encoding predict subsequent recall. J. Neurosci. 2003; 23:10809-14.
Seignalet J., Billiard M. Possible association between HLA B7 and narcolepsy. Tissue
Antigens 1984; 23: 188–189.
Sherin J.E., Elmquist J.K., Torrealba F., Clifford B. Saper C.B. Innervation of histaminergic
tuberomammillary neurons by GABAergic and galaninergic neurons in the ventrolateral
preoptic nucleus of the rat. J. Neurosci. 1998; 18:4705-4721.
Sherin J.E., Shiromani P.J., McCarley R.W., Saper C.B. Activation of ventrolateral preoptic
neurons during sleep. Science 1996; 271:216-219.
Siegel J.M. Hypocretin (OREXIN): Role in Normal Behavior and Neuropathology. Annual
Review of Psychology 2004; Vol. 55: 125-148.
Siegel J.M., Fahringer H.M., Anderson L., Nienhuis R., Gulyani S., Nassiri J., Mignot E.,
Switzer R. C. Evidence for localized neuronal degeneration in narcolepsy: studies in the
narcoleptic dog. Sleep Res. 1995; 24:354.
Siegel J.M., Nienhuis R., Mignot E., Fahringer H.M., Jamgochian G.M. Neuronal
degeneration in the amygdala of the narcoleptic dog. Sleep Res. 1996; 25:370.
Silber M.H., Krahn L.E., Olson E.J., Pankratz V.S. The epidemiology of narcolepsy in
Olmsted County, Minnesota: a population based study. Sleep 2002; 25:197-202.
Simon-Arceo K., Ramirez-Salado I., Calvo J.M. Long-lasting enhancement of rapid eye
movement sleep and pontogeniculooccipital waves by vasoactive intestinal peptide
70
microinjection into the amygdala temporal lobe. Sleep 2003; 26: 259-264.
Slotnick S.D., Thompson W.L., Kosslyn S.M. Visual memory and visual mental imagery
recruit common control and sensory regions of the brain. Cogn Neurosci. 2012; 3: 14-20.
Solms M. Dreaming and rem sleep are controlled by different brain mechanisms. Behav.
Brain Sci. 2000; 2:843-50.
Solms M. The neuropsychology of dreaming: a clinico-anatomical study. Mahwah, NJ,
US: Lawrence Erlbaum Associates; 1997.
Sonka K., Tafti M., Billiard M. Narcolepsy and ageing. In: Smirne S., Franceschi M.,
Ferini-Strambi L., editors. Sleep and ageing. Milan: Masson; 1991. p. 181–6.
Steriade M. & McCarley R.W. Brainstem control of wakefulness and sleep. New York:
Plenum Press, 1990.
Stickgold R., Hobson J. A., Fosse R., Fosse M. Sleep, Learning, and Dreams: Off-line
Memory Reprocessing. Science, 2001; 294.
Stickgold R., Malia A., Fosse R., Propper R., Hobson J. A.
Brain–mind states: I.
Longitudinal field study of sleep/wake factors influencing mentation report length. Sleep,
2001; 24(2): 171-179.
Strauch I., Meier B. In search of dreams: results of experimental dream research.
study. Cortex 1981;17:603-9.
Sutcliffe J. G., de Lecea L. The Hypocretins: Setting the arousal threshold. Nature
Publishing Group, 2002; 3.
Szymusiak R., Alam N., Steininger T.L., McGinty D. Sleep-waking discharge patterns of
ventrolateral preoptic/anterior hypothalamic neurons in rats. Brain Res. 1998; 803:178-188.
Tashiro T., Kambayashi T., Hishikawa Y. An epidemiological study of narcolepsy in
Japanese. In: The 4th International Symposium on Narcolepsy; 1994; Tokyo, Japan, 1994:
13.
Thomas M., Sing H., Belenky G., Holcomb H., Mayberg H., Dannals R., Wagner H.J.R.,
Thorne1 D., Popp K., Rowland L., Welsh A., Balwinski S., Redmond D. Neural basis of
alertness and cognitive performance impairments during sleepiness I. Effects of 24 h of
sleep deprivation on waking human regional brain activity. J. Sleep Res. 2000;9:335-52.
Thomas R.J. Fatigue in the executive cortical network demonstrated in narcoleptics using
functional magnetic resonance imaging-a preliminary study. Sleep Medicine 2005; 6: 399406.
Tokita S., Chemelli R., Willie J., Yanagisawa M. Behavioral characterization of orexin-2
receptor (OX2R) knockout mice. Sleep 2001; 24:A20-A21.
Tucci V., Stegagno L., Vandi S., Ferrillo F., Palomba D., Vignatelli L., Ferini-Strambi L.,
Montagna P., Plazzi G. Emotional Information Processing in Patients with Narcolepsy: A
71
Psychophysiologic Investigation. Sleep, Vol. 26, No. 5, 2003.
Valli K., Revonsuo A., Palkas O., Ismail K.H., Ali K.J., Punamaki R.L. The threat
simulation theory of the evolutionary function of dreaming: Evidence from dreams of
traumatized children. Consciousness and Cognition 2005; 14(1), 188-218.
Van Dongen H.P., Maislin G., Mullington J.M., Dinges D.F. The cumulative cost of
additional wakefulness: dose–response effects on neurobehavioral functions and sleep
physiology from chronic sleep restriction and total sleep deprivation. Sleep 2003; 26:11726.
Vogel G.W. Mentation reported from naps of narcoleptics. Adv. Sleep Res. 1976;3:161-8.
Vogel G.W. Studies in the psychophysiology of dreams III. The dream of narcolepsy. Arch
Gen Psychiatry 1960;3:421-5.
Wagner A.D., Shannon B.J., Kahn I. e Buckner R.L. 2005. Parietal lobe contributions to
episodic memory retrieval. Trends in Cognitive Sciences, 9:445-453.
Wamsley E.J. e Antrobus J.S. The expression of trace conditioning during non-REM sleep
and its relation to subjective experience. Neurobiology of Learning and Memory, 2009.
Wamsley E.J., Perry K., Djonlagic I., Reaven L.B. e Stickgold R. Cognitive replay of
visuomotor learning at sleep onset: Temporal dynamics and relationship to task
performance. Sleep, 2010; 33(1), 59-68.
Werth E., Achermann P., Borbely A.A. Brain topography of the human sleep EEG: anteroposterior shifts of spectral power. Neuroreport. 1996 Dec 20; 8(1):123-7.
Westphal C. Eigentumliche mit Einschlafen verbundene Anfalle. Arch. Psychiatr. Nervenkr.
1877;7:631-5.
Willie J.T., Chemelli R.M., Sinton C.M., Yanagisawa M. To eat or to sleep? Orexin in the
regulation of feeding and wakefulness. Annu. Rev. Neurosci. 2001; 24: 429-458.
Wittmann L., Schredl M. Does the mind sleep? An answer to ‘‘What is a dream
generator?’’. Sleep Hypn. 2004; 6:177-8.
Wu M.F., John J., Boehmer L.N., Yao D., Nguyen G.B., Siegel J.M. Activity of dorsal
raphe cells across the sleep-waking cycle and during cataplexy in narcoleptic dogs. J.
Physiol. 2003.
Yamanaka A., Tsujino N., Funahashi H., Honda K., Guan J.L., Wang Q.P., Tominaga M.,
Goto K., Shioda S., Sakurai T. Orexins activate histaminergic neurons via the orexin 2
receptor. Biochem. Biophys. Res. Commun. 2002;290:1237-1245.
Yoshida Y., Fujiki N., Nakajima T., Ripley B., Matsumura H., Yoneda H., Mignot E.,
Nishino S. Fluctuation of extracellular hypocretin-1 (orexin A) levels in the rat in relation
to the light-dark cycle and sleep-wake activities. Eur. J. Neurosci. 2001;14:1075-1081.
72