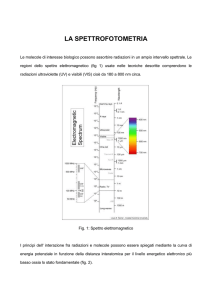
SPETTROSCOPIA
1) Quale delle seguenti radiazioni presenta energia piu’elevata?
- ultravioletto
- microonde
- infrarosso
- onde radio
- raggi X
2) Quale delle seguenti radiazioni presenta frequenza più bassa?
- ultravioletto
- microonde
- infrarosso
- onde radio
- raggi X
3) Un’onda elettromagnetica consiste di:
a) un campo magnetico variabile un campo elettrico costante
b) un campo elettrico ed un campo magnetico costante
c) un campo elettrico variabile ed il campo magnetico costante
d) un campo elettrico ed un campo magnetico variabili
4) Il campo elettrico ed il campo magnetico;
a) sono sullo stesso piano
b) sono su due piani paralleli
c) sono su due piani perpendicolari
d) sono su due piani a 180°
5) L`energia associata ad una radiazione elettromagnetica è data da:
a) E= h
b) E=c.c)E= h d) E= h.c/
6) Nella rifrazione il raggio rifratto ha:
a) la stessa velocità, ma diversa
à e la stessa
c) la stessa , ma diversa
d) stessa , ma diversa
7) La è:
a- la distanza fra due massimi in un’onda
b- la distanza fra un massimo e un minimo in un’onda
c- la massima distanza percorsa
d- il numero di onde che transitano in un punto in un secondo
8) La è:
b. il numero di oscillazioni al secondo
c. la distanza fra un massimo e un minimo in un’onda
d. la distanza fra due minimi in un’onda
e. la distanza percorsa dall’onda in un secondo
9) La frequenza di una radiazione elettromagnetica è:
a) numero di oscillazioni al secondo
b) numero di fotoni al secondo
c) distanza tra due massimi successivi
d) la velocità dell`onda
10) La è:
a)la distanza tra due punti successivi in fase tra loro di un onda
b)la distanza tra un massimo ed un minimo successivi di un onda
c)la spazio percorso da un`onda in 1 secondo
d) la massima distanza percorsa
11) Una radiazione infrarossa:
f. provoca la transizione energetica degli elettroni più vicini al nucleo
g. induce rotazione nelle molecole
h. amplifica le naturali oscillazioni dei legami molecolari
i. riesce ad eccitare gli elettroni di valenza
12) Una radiazione nelle microonde:
j. provoca la transizione energetica degli elettroni più vicini al nucleo
k. induce rotazione nelle molecole
l. amplifica le naturali oscillazioni dei legami molecolari
m. riesce ad eccitare gli elettroni di valenza
13) La luce bianca è:
n. una radiazione caratterizzata da una sola lunghezza d’onda
o. una radiazione policromatica
p. una radiazione con velocità nel vuoto di 300 Km/s
q. una radiazione caratterizzata da una sola frequenza
14) Per radiazione policromatica si intende:
r. una radiazione caratterizzata da una sola lunghezza d’onda
s. una radiazione con velocità nel vuoto di 300 Km/s
t. una radiazione caratterizzata da una sola frequenza
u. la luce bianca
15) Un oggetto appare colorato in rosso quando è illuminato dalla luce solare perché:
a) assorbe tutte le radiazioni
b) assorbe le radiazioni rosse
c) assorbe le radiazioni gialle complementari al rosso
d) assorbe le radiazioni blu-verdi complementari al rosso
16) Come apparirà un oggetto giallo alla luce del sole, se posto in una stanza blu e illuminato da
luce blu (giallo e blu sono colori complementari):
v. nero
w. bianco
x. blu
y. giallo
17) Come apparirà un oggetto rosso alla luce del sole, se posto in una stanza verde e illuminato
da luce verde (verde e rosso sono colori complementari):
z. verde
aa. rosso
bb. bianco
cc. nero
17b) Una mela rossa, in una stanza rossa illuminata da luce rossa appare:
bianca
nera
rossa
blu
Motivare la risposta
18) Associa i diversi tipi di transizioni energetiche di una molecola alle corrispondenti
radiazioni:
-
rotazionali
elettroniche interne
elettroniche esterne
vibrazionali
nucleari
19) Una sostanza organica assorbe radiazioni visibili. Posso dedurre che...
-
non assorbe radiazioni UV
non assorbe radiazioni IR
presenta doppi legami coniugati
presenta legami ionici
20) Secondo la legge di Lambert-Beer...
-
trasmittanza e concentrazione sono direttamente proporzionali
assorbanza e concentrazione sono direttamente proporzionali
frequenza e concentrazione sono direttamente proporzionali.
lunghezza d'onda e concentrazione sono direttamente proporzionali
21) Segna l’unica affermazione errata:
dd. Per la legge di Lambert e Beer se raddoppio la concentrazione del campione,
raddoppia l’assorbanza
ee. Per la legge di Lambert e Beer se raddoppio il cammino ottico, raddoppia
l’assorbanza
ff. Per la legge di Lambert e Beer se raddoppio la lunghezza d’onda alla quale eseguo
l’analisi, raddoppia l’assorbanza
gg. Per la legge di Lambert e Beer se raddoppio la temperatura del campione, raddoppia
l’assorbanza
22) Segna l’unica affermazione errata:
a- Per la legge di Lambert e Beer assorbanza e concentrazione sono
direttamente proporzionali
b- La trasmittanza può assumere valori da 0 a 1
c- L’assorbanza può assumere valori da 0 a 1
d- Assorbanza e cammino ottico sono direttamente proporzionali
23) La legge di Lambert-Beer e' valida per...
-
soluzioni diluite
V F
soluzioni concentrate
V F
radiazioni policromatiche
V
F
-
radiazioni monocromatiche
V
F
24) Su quale fenomeno ottico si basa l'azione disperdente di un prisma?
-
interferenza
rifrazione
effetto fotoelettrico
legge di Lambert-Beer
25) Su quale fenomeno si basa il funzionamento di un fototubo?
-
interferenza
rifrazione
effetto fotoelettrico
legge di Lambert-Beer
26) Due radiazioni elettromagnetiche monocromatiche percorrono lo stesso mezzo nella stessa
direzione e verso, se i loro massimi coincidono si ha;
a) interferenza costruttiva e aumento dell`ampiezza dell`onda
b) interferenza costruttiva e diminuzione dell`ampiezza dell`onda
a) interferenza distruttiva e aumento dell`ampiezza dell`onda
b) interferenza distruttiva e diminuzione dell`ampiezza delle onde
27) Le regioni spettrali generalmente interessate nella spettrofotometria UV-visibile sono:
a) 20-700 nm
b)200-780 nm
c)100-980 nm
d) 200-380 nm
28) la spettrofotometria di assorbimento UV-visibile è originata da transizioni, dal livello
fondamentale a quello eccitato, di tipo
a) elettronico
b) rotazionale
c) elettroniche, vibrazionali e rotazionali
d) vibrazionale
29) la spettrofotometria di assorbimento UV-visibile è originata da transizioni, dal livello
fondamentale a quello eccitato, di tipo
a) elettronico
b) rotazionale
c) elettroniche, vibrazionali e rotazionali
d) vibrazionale
30) La diffrazione si ha:
hh. quando un fascio di radiazioni viene mandato contro una fenditura di dimensioni
paragonabili alla della radiazione
ii. quando un fascio di radiazioni viene mandato contro una fenditura di dimensioni
molto più grandi della della radiazione
jj. quando un fascio di radiazioni viene mandato contro un sistema di particelle di
dimensioni paragonabili alla della radiazione
kk. quando un fascio di radiazioni viene mandato contro un sistema di particelle di
dimensioni molto più grandi alla della radiazione
31) Per diffusione si intende:
a- la riemissione in molte direzioni della radiazione incidente su un sistema di
particelle molto più grandi della della radiazione
b- l’interazione costruttiva fra due radiazioni che escono in fase da un filtro a
interferenza
c- l’interazione distruttiva fra due radiazioni che escono fuori fase da un filtro
a interferenza
d- la riemissione in molte direzioni della radiazione incidente su un sistema di
particelle di grandezza paragonabile alla della radiazione
32) l`elettrone che acquista energia è:
a) un elettrone esterno
b) un elettrone di legame
c)un elettrone del secondo strato d) un elettrone vicino al nucleo
33) Sapendo che h = 6,62. 10-34 J.s e c = 3 . 108 m/s, calcolare l’energia di una radiazione
avente = 120 nm
a- 2,38 10-23 J
b- 7,944 10-32 J
c- 1,655 10-27 J
d- 1,655 10-18 J
34) Quali fra le seguenti transizioni avverranno con radiazioni avente lunghezza d’onda minore?
efgh-
n
n
34b) Associa ad ogni radiazione il tipo di transizione:
microonde……………………………………………………………………………
raggi X………………………………………………………………………………..
UV-Vis…………………………………………………………………………………
Infrarosso……………………………………………………………………………..
35) Nel seguente diagramma rappresenta le transizioni elettroniche che avvengono in una
molecola, specificando se sono permesse o proibite, e in che zona dello spettro avvengono
n
36) Osservate la transizione energetica A e rispondete alle domande
a) La specie chimica interessata è un atomo o una
molecola? Motivare la risposta
A
B
b) La radiazione assorbita cade nel campo dell’infrarosso? Perché?
c) La transizione energetica B avviene a una frequenza maggiore di quella di A?
Perche?
37) Perché l`assorbimento molecolare, in UV-visibile, origina uno spettro a bande ?
38) Su che cosa si basa la spettrofotometria?
39) L`energia assorbita da una molecola sotto quale forma viene riemessa ?
40) Da cosa è causato l`assorbimento nell`UV-visibile.
41) Quali sono le differenze fra lo spettro di assorbimento di un atomo e lo spettro di
assorbimento di una molecola? Spiega a cosa sono dovute tali differenze
42) Come si interpreta il legame fra gli atomi secondo la teoria degli orbitali molecolari?
43) Perché la spettroscopia IR è più adatta ad analisi qualitative, mentre la spettroscopia UV ad
analisi quantitative?
44) Descrivi l'energia di una molecola poliatomica gassosa (o in soluzione diluita) come somma
dei suoi diversi contributi e associa a ciascuno di essi il tipo di radiazione interessato. Fai la
stessa cosa per un atomo gassoso.
45) L’energia totale di una molecola è data da vari contributi. Elencali e associa a ciascuno di
essi (se possibile) il tipo di radiazione interessato
46) Per quale motivo i composti dei metalli di transizione appaiono intensamente colorati?
47) Sapendo che il campo spettrale dell’UV-VIS è 200-780 nm calcola il corrispondente
intervallo di frequenza (c = 3 105 Km/sec)
48) Perché una soluzione torbida può determinare errori significativi nelle misure di assorbanza?
49) Perché l’assorbimento molecolare, in UV-visibile, origina uno spettro a bande?
50) Il rilassamento mediante fluorescenza: come si realizza e come può essere sfruttato ai fini
analitici
51) Gli spettri UV-visibile sono adatti per l’analisi qualitativa? Spiega perché
52) Descrivi le principali transizioni energetiche dei composti organici e inorganici che
interessano l’UV-visibile
53) Da che cosa dipende il colore di un corpo.
54) Un corpo appare nero quando......................
55) Qual è la relazione tra assorbanza e trasmittanza?
56) Scrivi la legge di Lambert e Beer e indica le unità di misura dell’assorbanza e del
coefficiente di assorbimento quando il cammino ottico è espresso in cm e la concentrazione
in moli/litro
57) Definire l`assorbanza e la trasmittanza.
58) Schema a blocchi di uno spettrofotometro UV-Vis mono raggio e doppio raggio
59) Disegna lo schema a blocchi di uno spettrofotometro doppio raggio
UV-visibile
mettendone in evidenza: le caratteristiche costruttive, il funzionamento e paragonalo al
monoraggio.
60) Descrivi la struttura generale (a blocchi) di uno spettrofotometro UV o IR. a raggio singolo e
a doppio raggio. Elenca i vantaggi del secondo rispetto al primo
61) Per quale motivo, sia in uno spettrofotometro a raggio singolo, sia in uno spettrofotometro a
doppio raggio, si effettua l’azzeramento contro il bianco
62) Quali tipi di lampade conosci nel campo spettrale dell’UV e del Visibile?
63) Su quali principi si basano i monocromatori ,prismi e reticoli, e quali sono i parametri che
individuano le loro qualità?
64) Come si valuta la qualità del monocromatore?
65) Descrivi come i reticoli funzionano da monocromatori
66) Su quale principio si basa il funzionamento del prisma come monocromatore
67) Quali tipi di cuvette si trovano nella spettroscopia UV VIS? Quali criteri si usano nella
scelta?
68) Principio di funzionamento dei tubi fotomoltiplicatori.
69) Che criteri si segue nella scelta della lunghezza d’onda per le misure di assorbanza?
70) I nitrati possono essere determinati tal quale (senza bisogno di trattamenti preventivi)
nell’UV. I nitriti invece devono esser fatti reagire con il reayyivo di Griess per poterli
determinare nel visibile. Invece i solfati non possono essere determinati per assorbimento nè
all’UV, nè al visibile, in nessun modo (si ricorre allora a misure torbidimetriche). Sulla base
di queste considerazioni descrivi quali sono i requisiti che una sostanza deve avere per poter
essere determinata quantitativamente all’UV-VIS.
71) Disegna lo schema a blocchi di uno spettrofotometro di emissione
72) Disegna lo schema a blocchi di uno spettrofotometro di assorbimento atomico (o
molecolare)
73) Elenca almeno tre cause che provocano il discostamento dalla legge di Lambert e Beer
74) Quali sono le principali cause di deviazione dalla legge di Beer nell`analisi quantitativa
UV/visibile?
75) Da quali fattori dipende la qualità di uno spettro?
76) Come si esegue un’analisi quantitativa in spettroscopia?
77) Reattivo di Griess, reattivo di Nessler, ninidrina ecc. sono tutti reattivi cromogeni. Cosa
significa questo termine?
78) Come viene scelta la lunghezza d`onda per misure di assorbanza ?
79) metodo della retta di taratura
80) metodo delle aggiunte
81) Per quale tipo di analisi viene generalmente utilizzata la spettrofotometria IR?
82) Qual è la regola di selezione generale e quali sono le transizioni permesse in IR?
83) Un cromoforo X assorbe a λ = 450 nm
Due soluzioni del cromoforo hanno dato i valori riportati nella tabella:
Concentrazione di X
1 ppm
Cx
Assorbanza
0,234
0,157
Calcolare il valore incognito nella tabella
84) Un composto di P.M 292,6 è stato solubilizzato in un matraccio tarato da 5 ml. Se ne è
prelevata un`aliquota di 1,00 ml, che è stata posta e diluita con acqua in un matraccio tarato
da 10 ml. L`assorbanza misurata a 340 nm è stata 0,427 in una cella da 1cm. L`assorbività
molare di tale composto a 340 nm è 6130 M-1 cm-1.
a) Calcolare la concentrazione del composto nella cuvetta
b) qual era la concentrazione del composto nel matraccio da 5 ml
c) quanti milligrammi di composto sono contenuti nella soluzione iniziale ?
85) Il coefficiente di assorbimento molare di un dato cromoforo in soluzione è 9,32.103
l/cm.mol a 470 nm. Calcolare l`intervallo delle concentrazioni permesse se l`assorbanza,
misurata con celle da 1 cm, deve essere non inferiore a 0,15 nèsuperiore a 0,8.
86) Completa la tabella con i valori mancanti (PM analita= 200u). Le misure sono state eseguite
a diversa .
A
B
C
A
0,172
%T
5,23
ε (1/mol cm)
4,23.103
3,73.103
9,78.103
cm
1
0,1
M
ppm
0,0489
5,24
87) L`assorbanza di una soluzione 2,30.10-5 M è0,822 a 260 nm in una cella da 1,00 cm.
a) Calcolare il coefficiente di assorbimento molare.
b)Quale valore avrà l`assorbanza se si raddoppia la concentrazione della soluzione e se ne
dimezza il cammino ottico?
88) Un campione di 15,0 mg di un composto di PM= 384,63 u è stato sciolto in un matraccio
tarato da 5 ml.
Se ne è prelevato 1 ml , che è stato posto in un matraccio tarato da 10 ml e diluito fino alla
tacca.
a) Calcolare la concentrazione mol/l del campioni nel matraccio da 5 ml
b) Calcolare la concentrazione mol/l del campioni nel matraccio da 10 ml
c) Se il campione da 10 ml è stato posto in una cuvetta da 0,5 cm ed il coefficiente di
assorbimento molare è, a 495 nm, 1,5.103, qual è il valore dell`assorbanza?
89) Per la determinazione spettrofotometrica dei nitriti nelle acque, con il reattivo di Griess,
viene usato il metodo della retta di taratura. Il procedimento consiste nel preparare le
seguenti soluzioni:
- Soluzione Standard concentrata: 0,2500 g di NaNO2 (PM = 68,999 u) esattamente pesati
vengono trasferiti in un matraccio da un litro e portati a volume con acqua distillata
- Soluzione standard diluita: 5 ml della soluzione standard concentrata soluzione vengono
diluiti in un matraccio da 500 ml con acqua distillata.
- Retta di taratura: in 5 matracci tarati da 50 ml vengono posti volumi di soluzione standard
diluita compresi fra 1 e 40 ml, a cui vengono aggiunti 2,5 ml di reattivo e infine portati a
volume con acqua.
Completa la seguente tabella :
matraccio No
1
2
3
4
5
Ml di sol. stand .
diluita
5
10
20
30
40
NaNO2 (mg/l)
A
0,089
0,117
0,358
0,505
0,701
Successivamente 50 ml di un campione di acqua di pozzo vennero posti in un matraccio da
100 ml, addizionati al reattivo e portati a volume. L’assorbanza letta risultò essere di
0,413. Calcolare i mg/l di nitriti nell’acqua
90) Una soluzione 1,0.10-3 M di un colorante X ha un`assorbanza di 0,2 a 450 nm e
un`assorbanza 0,05 a 625 nm.
Una soluzione 1,0.10-4 M di un colorante Y ha un`assorbanza 0,00 a 450 nm e
un`assorbanza di 0,42 a 625 nm.
Calcolare la concentrazione di ciascuno dei due coloranti in una soluzione che ha
un`assorbanza di 0,38 a 450nm e un`assorbanza di 0,71 a 625 nm.In tutte le misure èstata
usata la stessa cella.
91) Abbiamo una soluzione a 200 ppm di Cu++. Vogliamo preparare 5 matracci da 100 ml
rispettivamente a 2 – 4 – 8 – 10 – 15 ppm. Calcolare i ml di soluzione madre che bisogna
prelevare per ottenere i cinque standard.
92) Dai seguenti dati calcolare la concentrazione di P e R nella miscela :
soluzione
assorbanza assorbanza concentrazione
365 nm
470 nm
P
0,15
0,642
10-4M
R
0,684
0,088
2.10-4M
miscela incognita
0,721
0,604
?
Tutte le misure sono state effettuate usando la stessa cella.
93) Un campione di 15 mg di un composto di PM=384,63 è stato sciolto in un matraccio tarato
da 5 ml. Se ne è prelevato un ml che è stato posto in un matraccio tarato da 10 ml e diluito
fino alla tacca.
a- calcolare la concentrazione molare del campione nel matraccio da 5 ml
b- calcolare la concentrazione molare del campione nel matraccio da 10 ml
c-
Se il campione da 10 ml è stato posto in una cuvetta da 0,5 cm ed il coefficiente di
assorbimento molare è, a 495 nm, 1500, qual è il valore dell’assorbanza?
94) Un campione di 10 mg di un composto di PM=231,87 u è stato sciolto in un matraccio tarato
da 10 ml. Se ne è prelevato un ml che è stato posto in un matraccio tarato da 25 ml e diluito
fino alla tacca.
d- calcolare la concentrazione molare del campione nel matraccio da 10 ml
e- calcolare la concentrazione molare del campione nel matraccio da 25 ml
f- Se il campione da 25 ml è stato posto in una cuvetta da 0,5 cm ed il coefficiente di
assorbimento molare è, a 530 nm, 950, qual è il valore dell’assorbanza?
95) Vogliamo costruire due rette di taratura per il permanganato, una lavorando a 1, l’altra
lavorando a 2.
1
2
Rappresentare le due rette di taratura sullo stesso grafico. Dire a quale lunghezza d’onda è
meglio lavorare e perché.
96) Una soluzione di un composto AB (PM=187 uma) contiene 10-3 g/l di soluto. In 5 matracci
da 100 ml vengono poste le seguenti aliquote di soluzione:
4 - 8 - 12 - 16 - 20 ml
successivamente i matracci vengono portati a volume e viene misurata l’assorbanza. Si
ottennero i seguenti valori:
0,124 - 0,250 - 0,367 - 0,509 - 0,610
In seguito venne misurata l’assorbanza di una soluzione a concentrazione incognita di AB,
che risultò essere 0,319. Calcolare la concentrazione dell’analita nel campione.
97) Sono state preparate 4 soluzioni a titolo noto di una sostanza colorata e ne è stata misurata
l’assorbanza ad una opportuna lunghezza d’onda. I dati sono riportati in tabella:
C (mg/l)
2,5
5,0
10,0
15,0
A
0,23
0,40
0,91
1,26
Misurando nelle stesse condizioni l’assorbanza di una soluzione a concentrazione incognita
è stato ottenuto un valore di A = 0,64. Qual è la concentrazione della soluzione esaminata?
96b) La fenolftaleina è incolore a pH inferiori a 9 mentre assume colore fucsia a pH superiori.
Sotto è riportata la struttura della fenolftaleina nei due casi. Giustificare l’assenza di colore e la
presenza di colore
98) L’astaxantina è la sostanza responsabile del colore rosso dei gamberi:
Cosa è responsabile del
colore del composto?
L’unione dell’astaxantina con una proteina porta alla
formazione di un composto responsabile del colore azzurro
di alcune aragoste. Possiamo allora affermare che tale
proteina ha sull’astaxantina un effetto………………..
99) Si devono preparare 4 soluzioni (di volume 100 ml) contenenti ioni calcio con
concentrazioni:
-
C1= 4,0 mg/l di Ca++ C2= 8,0 mg/l di Ca++
C3= 12 mg/l di Ca++ C4= 16 mg/l di Ca++
Per ottenerle si prepara prima una soluzione standard contenente 100 mg/l di Ca++, introducendo
l’opportuna quantità di carbonato di calcio in un matraccio da 500 ml, attaccandolo con HCl
fino a ottenimento di una soluzione e portando a volume.
Quanto carbonato deve essere introdotto nel matraccio?
Come si deve procedere nei prelievi di soluzione madre per ottenere le 4 soluzioni
finali?
Soluzione madre:
500 ml di soluzione 100 mg/l Ca++
……………g di CaCO3
Prelievo…………..ml
soluzione madre
Prelievo…………..ml
soluzione madre
Prelievo…………..ml
soluzione madre
Prelievo…………..ml
soluzione madre
100 ml soluzione
4,0 mg/l Ca++
100 ml soluzione
8,0 mg/l Ca++
100 ml soluzione
12 mg/l Ca++
100 ml soluzione
16 mg/l Ca++
100)
Vogliamo determinare i componenti di una miscela estratta dalle foglie di spinaci:
clorofilla a, clorofilla b e carotenoidi.
Nella figura sono riportati gli spettri UV-VIS dei tre composti:
Scegliere la più opportuna per eseguire l’analisi quantitativa dei tre composti separati
motivando la risposta.
Che tipi di cuvette è opportuno utilizzare?