MODULI ANALISI IV CH
a.s. 2006/2007 prof. Alfredo Tifi
1. STATISTICA DELL’ERRORE; ELABORAZIONE ED ESPRESSIONE DEI DATI
ANALITICI
Concetti: errore relativo e assoluto; precisione;
accuratezza; errore casuale; errore sistematico;
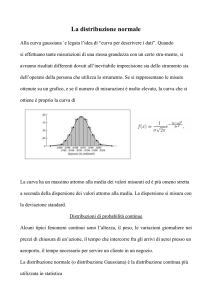
dispersione; distribuzione statistica gaussiana ;
scarto quadratico medio; deviazione standard
e stima s; intervallo di fiducia; valori aberranti;
propagazione dell’errore. Segnale analitico;
curva di calibrazione; linearità; sensibilità;
rumore; limite di rivelabilità; limite di
quantificabilità;
intervallo
di
linearità;
pendenza; intercetta; linea di tendenza; minimi
quadrati;
coefficiente
di
correlazione;
interpolazione; estrapolazione; modello non
lineare; linearizzazione.
Concepts: absolute - relative error; precision;
accuracy; random error; systematic error;
dispersion; Gaussian statistical distribution;
mean square deviation; population ( and
sampled (s) standard deviation; confidence
limits; discordant values; propagation of errors.
Analytical signal; calibration curve; linearity;
sensitivity;
noise;
detectability
limit;
quantification limit; linearity range; slope;
intercept; tendency line; least squares;
correlation
coefficient;
interpolation;
extrapolation; non-linear model; linearization.
Modelli e Teorie: teoria degli errori
Obiettivi:
1. tradurre l’errore assoluto in errore relativo;
2. riconoscere errori casuali ed errori sistematici;
3. calcolare la media e la deviazione standard di una serie di misure come indice di
dispersione;
4. determinare l’intervallo di fiducia centrato sulla media di una serie di misure ripetute, ed
esprimere il dato medio completo di incertezza tramite “T di Student”;
5. individuare i dati aberranti in una serie di prove, tramite test con Q di Dixon;
6. quantificare l’incertezza complessiva di un valore ottenuto da una serie di misure
indipendenti ciascuna affetta da un dato errore casuale.
7. utilizzare strumenti dotati di sensibilità e limite di rilevabilità adeguati alla precisione
richiesta o adeguare la procedura sperimentale in modo da rientrare nell’intervallo di validità
degli strumenti disponibili.
8. Determinare sperimentalmente l’intervallo di linearità e di attendibilità in una curva di
calibrazione;
9. determinare la retta “best fitting” tramite metodo dei minimi quadrati, valutando la
significatività della costante;
10. ricavare un parametro analitico dal segnale analitico per interpolazione dalla retta di
calibrazione ed esprimere tale dato con il limite fiduciale basato sull’incertezza nella
costante;
11. ricavare un’espressione lineare da una relazione di dipendenza logaritmica, iperbolica o
ambedue.
Tempi 1° periodo: settembre – 2° periodo: marzo-aprile-maggio 2006
SISTEMA DI GESTIONE QUALITA’ (vedi programmazione triennale: Sviluppo di metodiche
interne, Istruzioni Operative Strumento; Procedure Operative Standard (es. Procedure di taratura
bilance); procedura di assegnazione dei campioni d’analisi)
Tempi: durante l’intero anno scolastico
OSSIDIMETRIA, POTENZIOMETRIA, ARGENTOMETRIA
Concetti: equivalenza; punto di viraggio; quantitatività; legge degli equivalenti; normalità; peso
equivalente; curva di titolazione; indicatore redox; retrotitolazione; potenziale di riduzione;
potenziometro; prodotto di solubilità;
Modelli e Teorie: equazione di Nernst; principio dell’equilibrio mobile applicato agli equilibri di
solubilità
Obiettivi:
12. Determinare la massa equivalente del titolante e della specie titolata in una redox;
13. Effettuare la standardizzazione dei titolanti tipici (tiosolfato, permanganato)
14. Effettuare un’analisi ossidimetrica completa su campioni commerciali
15. Disegnare una curva di titolazione redox completa e determinare la costante d’equilibrio
16. Effettuare una titolazione ossidimetrica con individuazione potenziometrica del punto di
equivalenza.
17. Disegnare una curva argentometrica
18. Effettuare una determinazione argentometrica di un acqua contenente cloruro secondo il
metodo di Mohr.
Tempi: ottobre –dicembre 2006
ANALISI QUALITATIVA
Concetti: precipitazione selettiva; complessazione; diagramma di flusso; prodotto di solubilità;
effetto ione comune.
Obiettivi:
19. progettare una procedura di separazione e riconoscimento di un gruppo di cationi e anioni
incolori in soluzione (ammonio, magnesio, bario, alluminio, zinco, cadmio, nitrato,
carbonato, fosfato, cloruro, bromuro, ioduro), basata sulle diverse solubilità in reattivi
precipitanti e capacità di complessarsi di questi.
20. applicare un diagramma di flusso dato alla procedura di identificazione di uno o più cationi
in soluzione acquosa.
Tempi: gennaio 2007
SPETTROFOTOMETRIA E APPLICAZIONI ANALITICHE
Concetti: intensità luminosa; lunghezza d’onda; monocromaticità; assorbimento molecolare della
luce; trasmittanza; assorbanza; monocromatore; spettro di assorbimento; massimo di assorbimento;
assorbanza molare; curva di calibrazione.
Modelli e teorie: legge di assorbimento esponenziale di Lambert & Beer.
Obiettivi:
21. calcolare l’assorbanza sulla base dell’intensità luminosa entrante e uscente;
22. calcolare l’assorbanza dalla concentrazione e dall’assorbanza molare.
23. costruire lo spettro di assorbimento punto a punto.
24. determinare sperimentalmente l’intervallo di linearità dell’assorbimento di una specie
assorbente e preparare standard a concentrazione adeguata
25. costruire la retta di calibrazione col metodo dei minimi quadrati
26. effettuare un’analisi spettrofotometrica vis./UV e determinare il valore con il metodo a un
punto o con la retta di regressione lineare (applicata alla determinazione del nitrato,
ammonio met. Nessler, nitrito, met. difenilammina).
Tempi: febbraio – maggio 2006