Re
v
i vpeorrtag
e con
e nl a s m
Trapianto autologo di
cellule staminali
emopoietiche (aHSCT) in
caso di sclerosi multipla
Il trattamento di pazienti con forme gravi di SM continua a essere difficile. In questi casi il
trapianto autologo di cellule staminali emopoietiche (aHSCT) consente di arrestare del tutto
o quasi la malattia. In questa terapia le cellule staminali vengono impiegate con successo da
molto tempo, ma in generale essa non si è ancora imposta come metodo. Di seguito vengono
descritti gli aspetti più importanti del trattamento, le possibilità e le sfide che presenta.
Una versione breve di questa relazione è riportata sul numero 3 2013 di FORTE.
Introduzione
Malgrado i grandi progressi nel trattamento della sclerosi multipla e l’introduzione di molti nuovi medicamenti negli ultimi
anni, per una ridotta percentuale di persone con SM il decorso
della malattia è così grave che anche le terapie più efficaci come
natalizumab, citostatico, mitoxantrone o ciclofosfamide non si
dimostrano del tutto efficaci. La procedura da adottare in questo caso, dopo aver aumentato l’intensità del trattamento e spesso
dopo l’uso di medicamenti non ancora autorizzati per la SM, resta un problema importante nella terapia contro questa malattia.
Le alternative sono l’adozione della terapia causale limitandosi al
trattamento dei maggiori sintomi, come ad esempio la spasticità
o l’affaticamento, oppure il ricorso al trattamento aHSCT, che da
1 | N° 3 | Agosto 2013
tempo viene impiegato con successo nel trattamento della leucemia. Da oltre 20 anni il metodo aHSCT è sperimentato in Europa
e in Nord America su pazienti con forme gravi di SM e ulteriormente sviluppato. Finora oltre 1000 pazienti sono stati trattati
con l’aHSCT. Sulla base dei risultati di molteplici studi clinici
e dell’analisi dei dati relativi alle diverse procedure, ora si è in
grado di valutare l’aHSCT in modo sufficientemente ponderato
da poterlo prevedere come buona terapia alternativa nei suddetti
casi di SM grave, in presenza di determinate condizioni. L’obiettivo di questo articolo è quello di illustrare l’esecuzione pratica
dell’aHSCT, il suo effetto e i possibili effetti collaterali, i pazienti
più adatti al trattamento e le fasi pratiche da adottare se si sceglie
l’aHSCT come possibile trattamento.
v i v e r e au
con
s klla
an
sm
g
SM – una malattia autoimmune
La SM è una tipica malattia autoimmune
organo-specifica: in altre parole, il sistema
immunitario del paziente attacca i tessuti
corporei. Nel caso della SM vengono attaccate le strutture proteiche o gli antigeni
nel cervello e nel midollo osseo (sistema
nervoso centrale o SNC). Normalmente la
funzione del sistema immunitario è quella
di proteggerci dagli agenti patogeni come
virus e batteri. In presenza di condizioni
non ancora accertate, che comprendono infezioni virali e fattori genetici, può avvenire che le cellule immunitarie non tollerino
più le strutture del corpo, ma le attacchino.
In questo caso gli immunologi parlano di
possibilità di malattia autoimmune dovuta
alla compromissione dell’immunotolleranza. Processi simili si hanno nei casi delle allergie, con la differenza che in questo caso
le iperimmunizzazioni che provocano la
malattia si rivolgono contro le proteine dei
peli dei gatti, gli acari della polvere, i semi
di determinate piante o strutture simili.
Nel caso della SM l’iperimmunizzazione è
rivolta contro il tessuto dell’SNC, e viene
trasmessa principalmente dai cosiddetti
linfociti T helper, una particolare tipologia
di globuli bianchi. La reazione determina
a sua volta altri meccanismi infiammatori e cellule infiammatorie. Si ritiene che
il processo sia innescato da una infezione virale, provocata da determinati virus
come ad esempio il virus di Epstein-Barr,
che provoca la mononucleosi infettiva.
Probabilmente però tra i fattori scatenanti
possono rientrare molti altri virus che provocano infezioni delle vie aeree superiori
o influenza. Inoltre il soggetto deve avere
una determinata predisposizione genetica.
Come tutti i disturbi ricorrenti, la SM rientra nelle malattie genetiche complesse: in
altre parole, la combinazione di molti geni,
probabilmente varie centinaia, può provocare un maggiore rischio di sviluppare la
SM. Una situazione simile si osserva con
altre malattie autoimmuni come il diabete
di tipo 1, l’artrite reumatoide o le patologie intestinali infettive, anche se in questo
caso la combinazione di geni a rischio e
FORTE
fattori ambientali è leggermente diversa, e
pertanto la reazione immunitaria si rivolge
contro il pancreas o le articolazioni. Se la
SM si è manifestata con un primo attacco, o come accade di solito, era già presente in precedenza senza che il paziente
o il medico se ne accorgessero, le cellule T
helper si sono attivate e anziché rivolgersi
contro il virus scatenante, aggrediscono le
strutture proteiche o determinate sostanze
dell’SNC, danneggiandone i tessuti. Con
l’andare del tempo queste cellule T autoreattive si moltiplicano e si attivano sempre
più facilmente, ogni volta che vengono attivate da una nuova infezione virale o dalla
liberazione di autoantigeni dell’SNC. Si
verifica così una reazione a cascata, che di
solito non è più in grado di arrestarsi da
sola e provoca la distruzione di una parte
di tessuto sempre maggiore dell’SNC. Di
conseguenza i pazienti soffrono di attacchi
e disfunzioni neurologiche. L’obiettivo del
trattamento di una malattia di questo tipo
dovrebbe essere quello di impedire quanto
prima il circolo di attivazione crescente di
cellule immunitarie autoreattive, disattivare o eliminare queste cellule e ripristinare
la condizione normale del sistema immunitario, in modo che non attacchi i tessuti
del corpo: in altre parole, ripristinare la
tolleranza immunitaria.
In che cosa consiste il trattamento
aHSCT?
Proprio questo ultimo punto è l’obiettivo
del trattamento aHSCT. Per comprendere
come funziona, è necessario citare alcune informazioni generali sullo sviluppo
dell’aHSCT. Nell’ambito deIle affezioni
cancerogene a carico del sistema ematico (leucemie, linfomi), ma anche di altre
patologie tumorali, si cerca di eliminare
completamente le cellule tumorali attraverso una chemioterapia il più possibile aggressiva, per eliminare il cancro. Il
grande problema di questa procedura era
che i medicamenti utilizzati non uccidono
soltanto le cellule tumorali, ma anche altre
cellule che si dividono molto rapidamente,
come ad esempio le cellule dell’intestino
o del sistema ematico. Pertanto la terapia
contro il tumore elimina anche cellule
sane e vitali, e in particolare le cellule immunitarie. Queste ci difendono dagli agenti patogeni con i quali siamo confrontati
quotidianamente dall’esterno o che sono
persino presenti sia all’interno (intestino,
vie respiratorie e altri organi) sia all’esterno del nostro corpo (cute). Ne consegue che il risultato della chemioterapia è
quello di esporre il paziente alle infezioni,
il che provoca infezioni pericolose, a volte letali, nel giro di pochi giorni. Se oltre
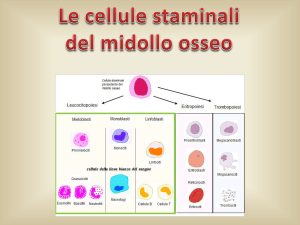
alle cellule immunitarie mature si eliminano anche le cellule staminali, ovvero le
cellule presenti nel nostro midollo osseo,
che compongono il sistema immunitario,
la morte è inevitabile, in quanto prima o
poi si verificherà una grave infezione. Più
di 30 anni fa medici e studiosi hanno sviluppato una soluzione che consente di aggirare elegantemente questi problemi, che
nel 1990 è valsa a E. Donnall Thomas il
premio Nobel per la medicina: il trapianto
di cellule staminali emopoietiche. Se prima della chemioterapia si prelevano al paziente le sue cellule staminali (autologhe)
dal midollo osseo, e le si congela, dopo la
chemioterapia aggressiva, che distrugge
cellule tumorali, ematiche e immunitarie,
è possibile scongelarle e risomministrarle
attraverso una semplice infusione. In poche settimane/mesi da queste cellule progenitrici si ricostruirà la maggior parte
della popolazione di cellule immunitarie,
creando un «nuovo» sistema immunitario.
Il paziente tornerà così a essere immunocompetente, ovvero a essere nuovamente
in grado di controllare o evitare le infezioni in modo del tutto normale.
Per tornare al problema iniziale: come
trattare i pazienti affetti da SM aggressiva, il cui sistema immunitario per così dire
«non segue le regole», ma attacca il cervello e il midollo spinale? Sulla base della
premessa che abbiamo appena delineato
relativamente allo sviluppo del trattamento HSCT, quasi 20 anni fa alcuni ematologi come Riccardo Saccardi e Athanassios
Fassas, specialisti in trapianto di cellule
N° 3 | Agosto 2013 | 2
vivere con la sm
staminali come Richard Burt e neurologi
come Gianluigi Mancardi, per citare solo
pochi pionieri, hanno deciso di adottare
una soluzione tanto semplice quanto logica: sostituire il sistema immunitario difettoso. A tal fine si adotta il metodo aHSCT
che comprende la «raccolta» delle cellule
staminali del corpo, l’eliminazione del sistema immunitario che non funziona correttamente e successivamente la ricostruzione di un nuovo sistema immunitario
completamente tollerante.
Nelle diverse forme di trapianto di cellule staminali ematopoietiche è importante
fare la distinzione tra HSCT autologo (di
cui stiamo scrivendo ora) e HSCT allogenico. Nel trattamento HSCT autologo al
paziente vengono infuse le sue stesse cellule staminali, che hanno una buona compatibilità a lungo termine, ma comportano
il rischio dovuto al fatto che si tratta delle
proprie cellule, quindi potenzialmente a rischio SM dal punto di vista genetico. Nel
trattamento HSCT allogenico si utilizzano
cellule staminali di un’altra persona, ad
esempio un fratello o altri familiari, che
devono essere il più possibile istocompatibili con le cellule del ricevente. Dal
momento che una tale istocompatibilità
completa è rarissima, spesso si verificano le cosiddette reazioni immunologiche
del trapianto contro l’ospite (Graft versus
host), che possono avere diversa gravità.
In questo caso il nuovo sistema immunitario generato presso il ricevente delle cellule immunitarie si rivolge contro l’ospite
(Host) e ne attacca gli organi che percepisce come estranei. Per evitarlo, il ricevente
di un trattamento HSCT allogenico deve
essere sottoposto a terapia immunosoppressiva, che a sua volta causa una serie di
problemi. Per i pazienti è importante sapere che il trattamento aHSCT presenta una
mortalità, ovvero un rischio di morire in
seguito al trattamento, pari a circa l’1,2%,
mentre nell’allo-HSCT la percentuale sale
al 7–10% o superiore. Pertanto in caso di
SM o malattie autoimmuni l’allo-HSCT è
fuori discussione. Il rischio di morte legato
all’aHSCT è limitato al tempo immediata3 | N° 3 | Agosto 2013
mente precedente e successivo al trapianto,
in cui il paziente si trova a essere completamente privo di protezione immunologica
ed esposto a qualsiasi infezione. Se questo
periodo viene superato, non sono necessari
altri trattamenti. Il paziente viene riportato a uno stato simile a quello precedente
alla malattia e inizia a ricostruire un nuovo
sistema immunitario, come avviene in età
infantile o giovanile.
Infine si dovrebbe accertare, come nel frattempo è stato dimostrato in modo convincente anche dal nostro laboratorio, che nella maggior parte dei pazienti il trattamento
aHSCT consente di ottenere veramente i
risultati sperati, ovvero una sostituzione
completa e un rinnovamento del sistema
immunitario. In precedenza si erano eseguiti degli esperimenti su cavie animali
che avevano dimostrato l’efficacia della terapia in diversi modelli, tuttavia per quanto
riguarda la SM gli effetti positivi sono stati
dimostrati solo nel 2005, una tappa fondamentale per la comprensione del meccanismo d’azione.
Quali pazienti possono essere trattati
con il metodo aHSCT?
Il primo passo, nonché il più importante, è
costituito dall’identificazione del paziente
con SM dal decorso grave. In questo modo
è possibile ponderare correttamente rischi
e possibilità del trattamento aHSCT sulla
base delle conoscenze scientifiche attuali.
Senza citare tutti i dettagli degli intensi
dibattiti tra gli esperti in Europa e Nord
America, si possono elencare i seguenti
aspetti: nel caso ideale i pazienti dovrebbero trovarsi nella fase di attacco della
malattia (RRMS), o – se si prevede di trattare un paziente con decorso secondario
progressivo (SPMS) o primario cronico
progressivo (PPMS) – manifestare lesioni
croniche all’SNC. Inoltre la percentuale di
attacchi, la loro gravità e regressione incompleta, la sintomatologia della malattia
(deficit motori gravi, disfunzioni del cervelletto o delle funzioni autonome) e i risultati dell’imaging a risonanza magnetica
dovrebbero far presagire un decorso attivo/
aggressivo della SM. Tra gli altri fattori si
considera anche l’età del paziente. Nei pazienti di età superiore ai 40–45 anni, per
motivi non ancora chiariti si innesca un
invecchiamento precoce delle cellule immunitarie, che riduce l’efficacia della generazione di un nuovo sistema immunitario
e comporta maggiori rischi. Inoltre, come
per tutti i trattamenti rivolti al sistema immunitario, è importante che l’aHSCT venga effettuato prima che venga danneggiata
una quantità eccessiva di tessuti dell’SNC,
e nel caso ideale fintantoché il paziente
abbia una disabilità contenuta, ovvero pari
a 4–5 punti nella scala EDSS. Pertanto il
paziente dovrebbe essere trattato nei primi
cinque, massimo 10 anni dalla diagnosi.
I criteri elencati presentano un grave dilemma. Il gruppo di pazienti appena delineato è proprio quello per cui l’assunzione
di sostanze già omologate ed efficaci come
il natalizumab, e in futuro anche altre, darebbero risultati più promettenti. Pertanto
la sfida è quella di sperimentare in un tempo accettabile e prima che il paziente raggiunga un grado considerevole di disabilità
non soltanto le terapie iniziali standard (p.
es. Interferon-beta, glatiramer-acetato, fingolimod o acido fumarico), bensì, qualora queste non dessero risultati, di passare
a una sostanza più efficace, ad esempio il
natalizumab, prima di optare per la terapia
dimostratasi di gran lunga più efficace, il
trattamento aHSCT, o perlomeno di prenderla in considerazione. Di solito questo
processo dura troppo tempo e non viene
portato avanti in modo sufficientemente
deciso, e pertanto si perde la «window of
opportunity» ottimale. Nel frattempo è
stato chiaramente dimostrato che l’aHSCT
è comunque in grado di attenuare il decorso della malattia negli stadi successivi
dell’SPMS o PPMS, ma probabilmente in
questo caso il rischio del trattamento non
è compensato dai suoi possibili vantaggi.
Per molti anni sono state trattate principalmente queste ultime categorie di pazienti,
motivo per cui è anche stato necessario
così tanto tempo per delineare il grande
potenziale del trattamento.
vivere con la sm
In pratica, come viene eseguito
l’aHSCT?
Negli ultimi 20 anni sono stati analizzati
nel dettaglio tutti i parametri dell’aHSCT,
ad esempio il modo migliore per ottenere
le cellule staminali (oggi si attingono dal
sangue periferico attraverso una procedura
simile alla donazione di sangue, chiamata
leucaferesi), i medicamenti da utilizzare
per eliminare il sistema immunitario e le
modalità con cui proteggere i pazienti con
antibiotici da infezioni dovute a virus e funghi durante la fase successiva al trapianto.
Senza scendere troppo nel dettaglio, dopo
molte discussioni tra esperti attualmente si
è consolidata le seguente procedura, considerata il migliore compromesso tra elevata
efficacia e buona tollerabilità:
una volta identificato un paziente affetto
da una forma grave di SM e discusso con
lui in modo approfondito le altre terapie
possibili, il trattamento aHSCT dovrebbe
essere effettuato da un team interdisciplinare di specialisti in trapianti (solitamente
ematologi o oncologi), specialisti in SM e
personale infermieristico con formazione e preparazione ad hoc. L’indicazione e
gli esami preliminari vengono effettuati
da neurologi con esperienza nel settore.
Successivamente il paziente viene visitato
dall’ematologo al fine di escludere la presenza di patologie internistiche preesistenti, in particolare ematologiche/immunologiche. In caso di conformità di indicazione
ed esclusione dei rischi, la fase successiva è
il ricovero nel reparto ematologia/trapianti, dove per prima cosa si effettua la mobilizzazione delle cellule staminali con la
somministrazione di un fattore di crescita
e di un prodotto chemioterapico (ciclofosfamide). In seguito a questo trattamento,
le cellule staminali ematopoietiche vengono immesse dal midollo osseo al sangue
periferico, dove possono essere «raccolte»
attraverso la suddetta leucaferesi, per poi
essere congelate. Segue il trattamento con
un cocktail di quattro citostatici, abbreviati con la sigla BEAM. Il risultato è la
quasi totale eliminazione di tutte le cellule
ematiche e immunitarie. Questa fase viene
FORTE
chiamata anche condizionamento. Successivamente vengono reinfuse le cellule
ematiche scongelate del paziente e vengono somministrati una tantum degli anticorpi contro i linfociti T (globulina antitimociti, ATG), che eliminano le eventuali
cellule immunitarie rimaste. Nelle 2–4
settimane successive, il paziente ricoverato
viene trattato con antibiotici contro batteri,
virus e funghi per superare lo stadio della
fase iniziale successiva al trattamento in
cui il paziente è privo di protezioni immunologiche e quindi esposto alle infezioni.
La formazione di un nuovo sistema immunitario funzionante a partire dalle cellule
staminali richiede da poche settimane ad
alcuni mesi. Il solo ripristino delle cellule
T helper CD4+ è molto più lungo e si conclude in 1–2 anni.
Possibilità e rischi del trattamento
aHSCT
Negli ultimi anni ci sono stati grandi dibattiti, meta-analisi, studi di casi, piccoli studi clinici, uno studio clinico della fase IIb
(ASTIMS) e la valutazione sistematica dei
dati del registro dell’European Blood and
Marrow Transplantation Group (EBMT)
in Europa e del Center for International
Blood and Marrow Transplant Research
(CIBMTR) in Nord America. Tutto ciò
ha portato a dimostrare che la procedura
BEAM-ATG aHSCT ha un’elevata efficacia nei pazienti con forme gravi di malattia
e decorso RRMS, nella maggior parte dei
casi arresta in modo completo e duraturo la
malattia senza richiedere un ulteriore trattamento permanente, e spesso fa regredire
parzialmente le disfunzioni cliniche. Tutto
ciò di fronte a un rischio di mortalità acuta
nei primi 3 mesi dall’aHSCT pari a circa
l’1,2%. La mortalità dei pazienti che hanno
subito il trapianto prima del 2000 si attestava attorno al 7%, un valore da imputarsi
a determinati fattori di rischio come l’età
avanzata del paziente, lo stato avanzato
della SM e gli schemi di trapianto che prevedevano l’irradiazione corporale totale o
il citostatico busulfan per via orale. A posteriori la motivazione di gran lunga pre-
valente era però l’esperienza insufficiente
dei centri e la mancanza di una stretta cooperazione tra specialisti di trapianti e neurologi specializzati in SM. Ora tali fattori
di rischio sono noti, è stato identificato lo
schema aHSCT che costituisce il migliore
compromesso tra elevata efficacia e buon
profilo di effetti collaterali (BEAM-ATG)
e almeno in alcuni centri esiste una solida
cooperazione tra ematologi/specialisti di
trapianti e neurologi. Inoltre, se si confronta il tasso di leucemie secondarie, effetti
collaterali gravi per il cuore, e il tempo
relativamente breve in cui è possibile somministrare il mitoxantrone, nonché la sua
efficacia molto più bassa rispetto al trattamento aHSCT, la mortalità acuta sopra
riportata dell’aHSCT assume un valore
molto più relativo, e dal mio punto di vista
accettabile per un paziente affetto da SM.
Naturalmente è opportuno mirare a contenere ulteriormente il rischio di mortalità.
Qual è la differenza tra il trattamento
aHSCT e le terapie immunomodulatorie/
immunosoppressive disponibili
attualmente o nel prossimo futuro
per il trattamento della SM?
I trattamenti immunomodulatori/immunosoppressivi contro la SM attualmente
autorizzati hanno un’efficacia contenuta
(interferone beta, glatiramer acetato), o in
presenza di un’elevata efficacia possono
avere effetti collaterali gravi (natalizumab
e PML; Fingolimod con effetti collaterali
cardiaci e oftalmologici e raramente riattivazione di infezioni da virus Herpes
pericolose per la vita). Essi sono accomunati dal fatto di dover essere costantemente somministrati e di esercitare tutta una
serie di effetti relativamente aspecifici sul
sistema immunitario e su altri organi. A
questa seconda caratteristica fa eccezione il natalizumab: tuttavia la possibilità
di somministrarlo in modo permanente è
notevolmente limitata dal rischio di PML
crescente col protrarsi del trattamento. Al
contrario, il trattamento aHSCT viene effettuato una sola volta, e successivamente
non sono necessarie terapie permanenti.
N° 3 | Agosto 2013 | 4
vivere con la sm
La maggior differenza rispetto ai trattamenti omologati è però costituita dal meccanismo completamente diverso con cui
agisce l’aHSCT. Quest’ultimo agisce sulla
causa della SM eliminando completamente il sistema immunitario aberrante e ricostruendo un sistema immunitario completamente nuovo e di nuovo tollerante nei
confronti del tessuto dell’SNC. Si tratta del
metodo che si avvicina maggiormente alla
guarigione, anche se in seguito all’aHSCT
in una ridotta percentuale di pazienti si verifica una nuova insorgenza della malattia.
Al momento non è ancora chiaro se in questo caso la SM si sia sviluppata una seconda volta o se il precedente danneggiamento del tessuto dell’SNC e la liberazione di
proteine/antigeni dall’SNC abbia stimolato
nuove cellule immunitarie, ragion per cui
la SM continua a progredire. In linea di
massima esiste il rischio che la SM si ripresenti, in quanto nel trattamento aHSCT
ai pazienti vengono risomministrate le loro
cellule staminali ematopoietiche che hanno la predisposizione genetica alla SM.
L’aHSCT è disponibile in Svizzera?
L’aHSCT viene applicato con routine in
diversi centri ematologici/oncologici in
Svizzera nella terapia delle malattie del
sangue e dei tumori e può essere utilizzato per le persone con SM. Attualmente,
il trattamento non viene però rimborsato dalle casse malati. Affinché in futuro
i costi possano essere assunti, dev’essere
almeno avviato uno studio internazionale sul trattamento della SM con l’aHSCT,
per garantire che le esperienze relative al
trattamento vengano raccolte in maniera
sistematica e che le suddette esperienze
vengano tenute in considerazione. Uno
studio di questo genere è attualmente in
preparazione a Zurigo, a opera della Clinica di Ematologia in collaborazione don
il reparto di Neuroimmunologia e Ricerca SM presso la Clinica di Neurologia, e a
breve dovrebbe essere presentato al Comitato etico cantonale. Ci auguriamo che nei
casi di SM grave nei quali le terapie omologate si dimostrino inefficaci, in presenza
5 | N° 3 | Agosto 2013
di una documentazione esaustiva vengano
accolte le richieste di assunzione delle
spese. Finanziando autonomamente i trattamenti, dopo l’introduzione degli importi
forfettari per singolo caso i costi stabiliti
presso l’Ospedale universitario di Zurigo
si attestano attorno ai 160’000–180’000
franchi. Questo prezzo può essere considerato abbordabile se confrontato alle terapie
permanenti da somministrarsi per anni o
decenni, ma nel confronto internazionale
con i Paesi confinanti (Germania, Regno
Unito, Italia) è decisamente troppo elevato,
in quanto in questi Paesi i costi si attestano tra i 30’000 e i 50’000 euro. Per questo
motivo, il trattamento aHSCT a pagamento viene eseguito all’estero.
Prospettive
Nei prossimi anni dovrebbero essere effettuate ulteriori ricerche sul meccanismo
con cui agisce il trattamento aHSCT nella
SM. Inoltre si auspica che ai medici e agli
studiosi, che da anni si occupano di questo
tema, vengano messi a disposizione i mezzi finanziari per uno «studio della fase III»,
per confrontare l’efficacia dell’aHSCT con
i migliori trattamenti omologati in uno studio clinico di ampia portata. Nonostante il
lungo lavoro a monte, non sarà facile trovare questi fondi, poiché il procedimento
in questione fa concorrenza ai prodotti
dell’industria farmaceutica e la sua adozione non avvantaggerebbe nessuna azienda.
Pertanto dovrà essere richiesto il sostegno finanziario delle pubbliche istituzioni,
come ad esempio l’UE o i National Institutes of Health. Confidiamo nel sostegno
delle organizzazioni dei pazienti e delle
società SM dei rispettivi Paesi e a livello
internazionale, affinché questa terapia così
promettente e già ben analizzata possa essere messa quanto prima al servizio dei
pazienti con SM dal decorso grave.
Testo: Prof. Dr.med. Roland Martin
Per maggiori
informazioni
Gli interessati possono rivolgere le
loro richieste al Prof. Dr.med. Martin,
reparto di Neuroimmunologia
e Ricerca SM, Clinica di Neurologia,
Ospedale universitario di Zurigo
([email protected]).