11
Il metabolismo: una visione d'insieme
L'insieme delle trasformazioni che avvengono in un organismo vivente si chiama metabolismo. Il
metabolismo si divide in catabolismo che comprende tutte le reazioni degradative che trasformano
composti complessi, con una certa quota di energia di legame, in sostanze sempre più semplici estraendo
intermedi importanti o, nel catabolismo energetico, l'energia necessaria per le varie attività biologiche
quali il movimento, il trasferimento dell'informazione genetica, il passaggio selettivo attraverso le
membrane, il mantenimento dell'omeostasi termica, l'eliminazione di sostanze tossiche (come l'NH 3).
Una parte importante della trasduzione dell'energia chimica di legame in energia libera, e che è
fondamentale nello nostro studio successivo, sarà destinata a rendere possibili tutte le sintesi di
molecole indispensabili per un corretto funzionamento delle cellule che nel loro insieme sono l'altra
parte del metabolismo: l'anabolismo. L'anabolismo è costituito da tutte le reazioni endoergoniche che
partendo da relativamente pochi composti semplici, attraverso reazioni riduttive, permette alle cellule
di sintetizzare numerose e complesse biologiche di fondamentale interesse. Si pensi alla sintesi delle
proteine e della loro importanza biologica.
Nelle cellule le reazioni cataboliche e quelle anaboliche non sono accoppiate temporalmente per cui
esse devono disporre di un “serbatoio di raccolta” dell’energia: un composto intermedio secondo lo
schema:
AH2 + I—redox————→ A + IH2
A viene ossidato da un composto che assume elettroni e H + e che quindi si riduce.
Questo intermedio deve essere comune ad altre reazioni e cioè entrare in altre redox e, col suo potere
riducente acquisito, riossidarsi per ridurre un nuovo composto B sul quale verrà trasferita l'energia
(potere riducente).
IH2 + B—redox————→ I + BH2.
Osservare che l'intermedio in una classica ossidoriduzione funziona da deidrogenasi. In questa reazione
l’intermedio si riduce ossidando A. Ma il suo “potere riducente” deve essere ripristinato e questo
avviene permettendo una reazione riduttiva “accoppiata” a quella ossidativa. Alla fine delle due reazioni
I esce inalterato. Gli enzimi che contengono coenzimi che operano le deidrogenazioni sono accettori di
H2. L’ossidazione di AH2 ha liberato energia che si è trasferita nell’intermedio che porta il potere di
ridurre altre molecole e quindi di innescare le vie biosintetiche. Vedremo la struttura e il meccanismo
d'azione di due coenzimi delle deidrogenasi, il FAD e il NAD+ , fondamentali nel metabolismo come
intermedi capace di accettare elettroni e quindi di ridursi e di cederli in altre reazioni, riossidandosi,
per ricominciare di nuovo. E' naturale che il metabolismo energetico sarà alimentato e dipenderà da
questi coenzimi ossidati. Vedremo anche che, alla fine della glicolisi, Il NAD si riduce a NADH....ma non
viene ripristinato dalla via metabolica. La cellula dovrà trovare una soluzione, pena il blocco della
glicolisi e quindi di tutto il catabolismo del glucosio.
Una cellula ha bisogno di una riserva di energia autonoma e capace di essere ceduta in una molteplicità
di reazioni. Una specie di accumulatore che immagazzina energia, capace di essere sintetizzato in
molte reazioni esoergoniche e utilizzabile in molte
reazioni endoergoniche.
La molecola, non la sola, ma la più importante, che svolge
queste funzioni è l’ATP.
L'ATP è un nucleotide in cui l'adenina, una base azotata
presente anche nel DNA si lega ad una molecola di
ribosio, con un legame
12
N-glicosidico, il quale a sua volta lega, con legame estere forte, un fosfato. I legami del primo fosfato
col secondo e quello del secondo col terzo sono legami fosfoanidridici, abbastanza forti, ma idrolizzabili
enzimaticamente.
Come si vede in figura l'ATP, in acqua, presenta quattro cariche elettriche negative che rendono
instabile la molecola. L'acqua si addiziona al legame fosfoanidridico terminale provocandone la rottura.
Questa rottura è catalizzata dall'enzima ATPasi che nel sito attivo espone uno ione bivalente positivo
Mg+2 che destabilizza, avvicinandole tra loro, le cariche negative. L'allontanamento successivo degli ioni
Mg provoca una violenta repulsione elettrostatica che determina la rottura del legame fosfoanidridico.
ATP + H2O
——→ ADP + Pi
La reazione ha un ∆G°' di -7.3 Kcal/mole (-30.5 KJ/mole)
ed è quindi fortemente esoergonica.
L'idrolisi dell'ATP è spostata a destra perché i prodotti presentano una maggiore stabilità complessiva
dovuta sia allo ione fosfato, stabilizzato per risonanza, che all'ADP che si ionizza liberando H + in
ambiente pressoché
neutro.
La funzione dell'ATP è
quella di mettere a
disposizione energia
libera immediatamente
e non quella di
conservarla.
Il turnover dell'ATP è
elevatissimo. Un uomo a
riposo consuma circa 40
Kg di ATP in 24 ore.
Durante uno sforzo
considerevole la
velocità di utilizzazione
dell'ATP è di circa 1/2
Kg al minuto! E' del
tutto evidente che
questo è possibile solo
se la cellula è in grado
di rigenerare ATP dall'ADP secondo la reazione: ADP + Pi ——→ ATP.
Come vedremo sarà, per i chemiotrofi, l'ossidazione dei nutrienti la strada che porterà alla produzione
di ATP.
Come abbiamo visto, l'ATP cede Pi (fosfato inorganico) all'acqua con una certa facilità e allora
definiamo il suo potenziale di trasferimento di gruppi fosfato uguale all'energia liberata da questo
processo: ∆G°' = -7.3 Kcal/mole.
Nella cellula ci sono composti estremamente importanti, con un potenziale di trasferimento superiore a
quello dell'ATP e li incontreremo nel corso di studio. Uno di questi è la fosfocreatina.
Questi composti possono trasferire un gruppo fosfato all'ADP per rigenerare ATP. Nel muscolo la
quantità di ATP presente può sostenere l'attività contrattile per meno di un secondo. L'abbondanza di
fosfocreatina, con il suo elevato potenziale di trasferimento, permette una generazione immediata di
ATP secondo la reazione:
Fosfocreatina + ADP —→ ATP + Creatina.
Quindi durante l'esercizio muscolare è la fosfocreatina che mantiene elevata la concentrazione di ATP.
L'ATP è un ottimo trasportatore di gruppi fosfato anche per il fatto che ha un potenziale di
trasferimento intermedio rispetto ai principali composti fosforilati che ci sono nella cellula.
13
Abbiamo capito così perché l'esochinasi può trasferire un Pi dall'ATP al glucosio. Infatti il glucosio-6-P
ha un potenziale di trasferimento inferiore a quello dell'ATP.
Vedremo, nella glicolisi, che si genererà ATP per un trasferimento di Pi dal fosfoenolpiruvato all'ADP.
Si tratta di generazione di ATP a livello del substrato
I coenzimi delle deidrogenasi: NADH e FADH2
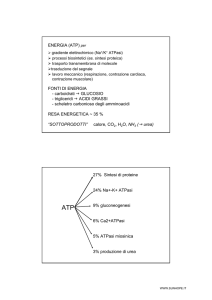
Generare ATP è quindi lo scopo principale di tutto il metabolismo energetico. Abbiamo visto come
questo avvenga alla fine di un lungo processo di demolizione dei nutrienti che è caratterizzato da una
serie di ossidoriduzioni in cui, partendo da un substrato ridotto (un carboidrato, un acido grasso e
anche un aminoacido) con una determinata energia potenziale di legame, gli elettroni e i protoni vengono
trasferiti da intermedi specifici. Questi trasportatori di "potere riducente" sono i coenzimi delle
deidrogenasi: il flavin-adenin-dinucleotide (FAD) e il nicotinammide-adenin-dinucleotide (NAD+).
Sarà bene abituarsi, e lo capiremo presto, a distinguere i quattro modi in cui questi coenzimi si trovano
scritti che sono le seguenti:
NAD+ che si legge NAD ossidato, NADH che si legge NAD ridotto; FAD che si legge FAD ossidato e
FADH2 che si legge FAD ridotto.
Incontreremo anche il NADP+ che si legge NAD fosfato ossidato e il NADPH, NAD fosfato ridotto.
Questi coenzimi sono complessi molecolari che, per la loro struttura, possono addizionare protoni ed
elettroni di atomi di idrogeno rimossi dalle deidrogenasi. E precisamente:
Il NAD+ è in grado di accettare uno ione idruro e quindi un protone e due elettroni : H:(ione idruro) ——
→ H+ + un doppietto elettronico.
Il FAD è in grado di accettare due atomi di H e cioè due protoni (2 H+) + un doppietto elettronico.
Evidentemente il NAD ossidato che addiziona due elettroni e un protone si riduce e passa nella forma
NADH (ridotto).
Il FAD passa da FAD a FADH2. Ma vediamo meglio le loro strutture.
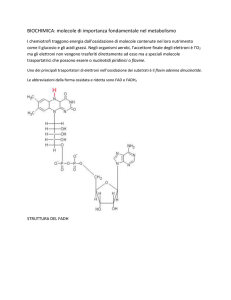
Il nicotinammide-adenin-dinucleotide (NAD+; NADH)
La figura ci mostra la sua forma ossidata (NAD+).
Come si può vedere all'anello eterociclico dell'adenina è legato
un ribosio. Il ribosio lega due gruppi fosfato che, tramite un
nuovo ribosio, legano l'anello nicotinammidico (parte grigia
chiara) che è la parte reattiva della molecola, cioè quella che
accetta il doppietto elettronico e un protone. (ricordate: lo ione
idruro)
La nicotinammide è la vit. PP.
Poiché le deidrogenasi rimuovono nel complesso due atomi di
idrogeno, la reazione
globale libererà un
protone H+
NAD+ + H2 ——→
NADH + H+
Come si vede nel dettaglio protoni ed elettroni attaccano il sito
reattivo. Un idrogeno si addiziona al sito reattivo mentre l'arrivo del doppietto elettronico, attratto
dall'azoto positivo genera un riarrangiamento della distribuzione, nell'anello, che porta all'annullamento
della carica sull'azoto che passa da valenza 4 alla valenza 3.
14
Nota importante: osservando la struttura del NAD, sul ribosio legato all'adenina, in posizione 2'
troviamo il gruppo OH. Se al posto di H sostituiamo un gruppo fosfato, allora si parla di NADP+ che,
come detto si chiama NAD fosfato ossidato. La presenza di un gruppo fosfato, ad alta energia,
conferisce al NADP+, nello stato ridotto, NADPH, la proprietà di essere il principale donatore di
elettroni nelle biosintesi riduttive. Il meccanismo di trasferimento degli elettroni è lo stesso sia nel
NADH che nel NADPH. E' importante comunque saperli distinguere perché se studiamo una reazione in
cui è presente il NADPH allora siamo all'interno di riduzioni anaboliche mentre se è presente il NADH
allora ci troviamo in tappe cataboliche per la produzione di ATP. Il NADPH viene generato nella via del
pentoso fosfato, che vedremo in seguito.
Il flavin-adenin-dinucleotide (FAD FADH2)
Nella struttura del FAD troviamo
ancora un adenina che si lega ad un
ribosio che a sua volta lega due gruppi
fosfato. La parte centrale è il
derivato da una vitamina idrosolubile
la riboflavina, la vt. B12. La parte
reattiva sta nell'anello isoallossazinico
che può accettare due protoni e due
elettroni sugli atomi di N, come si vede in figura.
Mentre i coenzimi NAD possono essere legati a diverse deidrogenasi e
sono mobili, i FAD sono legati covalentemente alle loro proteine
enzimatiche che per questo prendono il nome di flavoproteine.
Come si può facilmente osservare, sia ATP che NAD che FAD sono
derivati da nucleotidi (l'ATP è un nucleotide).