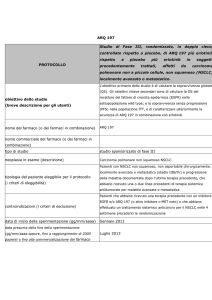
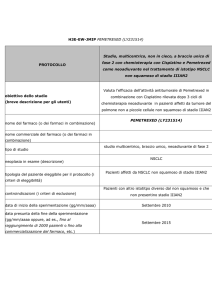
TUMORI DEL POLMONE
Dr Antonio Frassoldati
Distinzione
1. NSCLC: tumore del polmone non a
piccole cellule (85-90% diu tutti i tumori
del polmone)
2. SCLC: tumore del polmone a piccole
cellule (10-15% diu tutti i tumori del
polmone)
NSLC: Incidenza e Mortalità
Il cancro al polmone è la neoplasia più
comune al mondo
Negli uomini è il più comune, un caso su
cinque casi di tumore.
Nelle donne è il quarto tipo di tumore più
comune, dopo quelli al seno, al colon-retto
e allo stomaco.
NSLC: Incidenza e Mortalità
L’incidenza negli uomini nel Regno Unito è
diminuita di 7-10% ogni 5 anni dalla metà
degli anni ’70.
L’incidenza tra le donne del Regno Unito è
incrementata del 10% ogni cinque anni sino
agli anni ’90 e nel 1990 il cancro al polmone
ha superato il cancro al seno nella cittadina
di Glasgow come causa più comune di
cancro tra le donne
NSLC: Incidenza e Mortalità
In Italia una progressiva diminuzione
dell’incidenza tra gli uomini con una
diminuzione percentuale annua stimata del
1.4% e una riduzione di mortalità legata al
tumore del polmone. Questa diminuzione è
presente nei gruppi di età più giovane, in cui
l’abbandono dell’abitudine al fumo è
maggiore.
Tra le donne sia l’incidenza (+ 1.2%
all’anno) che la mortalità (+ 0.9% all’anno)
sono in aumento.
NSLC: Incidenza e Mortalità in Emilia
Romagna
www.registro-tumori.it, dati aggiornati al 2007
NSLC: Incidenza e Mortalità in Emilia
Romagna
www.registro-tumori.it, dati aggiornati al 2007
NSLC: Incidenza e Mortalità in Emilia
Romagna
www.registro-tumori.it, dati aggiornati al 2007
NSLC: Incidenza e Mortalità in Emilia
Romagna
www.registro-tumori.it, dati aggiornati al 2007
NSLC: Incidenza e Mortalità in Emilia
Romagna
www.registro-tumori.it, dati aggiornati al 2007
NSLC: Sopravvivenza
Sopravvivenze a cinque
differenze tra i sessi.
anni
del
10%,
senza
La sopravvivenza relativa al cancro al polmone è
fortemente dipendente dall’età alla diagnosi, essendo
maggiore nei giovani rispetto ai pazienti anziani.
Nei gruppi di giovane età (15-44 anni) la sopravvivenza
relativa a cinque anni è del 18% rispetto al solo 6% nei
pazienti con età superiore ai 75 anni.
Negli stadi avanzati sopravvivenza a 5 anni del 1-2% ,
Negli stadi localizzati sopravvivenza a cinque anni
dalla diagnosi di circa il 30%
Fattori di Rischio
Il fumo di tabacco costituisce il più importante fattore di rischio e si
ritiene sia responsabile dell'85% dei casi osservati.
Il rischio relativo è in stretta relazione con il numero di sigarette/die
fumate, con la durata (in anni) dell'abitudine e con il contenuto di
catrame. Il rischio relativo dei fumatori rispetto ai non fumatori è
pari a 14 mentre quello dei forti fumatori (oltre le 20 sigarette al di')
è di 20 volte.
Sostanze di origine lavorativa
(Asbesto, Cromo, Arsenico, Berillio, Cloruro di Vinile, Idrocarburi
Aromatici Policiclici, Clorometiletere, Radon e altri) sono
riconosciute come carcinogeni polmonari che spesso, come nel
caso dell’amianto, potenziano il loro effetto in presenza di fumo di
tabacco.
Il ruolo dell'inquinamento atmosferico è oggi riconosciuto come un
importante fattore ma è ancora oggetto di studio e discussione.
NSCLC: Prevenzione
Alcuni studi epidemiologici hanno evidenziato che una
maggiore assunzione di vitamina E e beta-carotene
con verdure a foglie gialle e verdi, potrebbe giocare un
ruolo protettivo contro gli effetti dei fattori cancerogeni.
Nessuno dei grandi esperimenti randomizzati
chemiopreventivi
per valutare il ruolo di
un’integrazione
dietetica
con
micronutrienti
antiossidanti come la vitamina A, E, carotenoidi, Naceticistina o 4-HPR ha mostrato una diminuzione
nell’incidenza del tumore al polmone.
Al contrario, il beta-carotene potrebbe avere un effetto
nocivo, principalmente sui fumatori
NSCLC: Screening
Presupposti: elevata incidenza, la diagnosi precoce
migliora la sopravvivenza e il tasso di resecabilità
Svantaggi: elevato costo, elevato tasso di falsi positivi
(chirurgia inutile) e falsi negative (diagnosi ritardata),
elevata esposizioni a radiazioni ionizzanti
Sono in corso studi randomizzati per misurare
l’efficacia della TC spirale a basse dosi nel ridurre la
mortalità per cancro al polmone.
L’utilizzo di una TC spirale a basse dosi è da
considerarsi investigazionale con un’evidenza di livello
di tipo 3 per gli individui ad alto rischio
NSCLC: Diagnosi
Approssimativamente il 95% di pazienti che
presentano un tumore al polmone hanno dei sintomi
che frequentemente sono attribuiti ad effetti collaterali
del fumo.
Sintomi principali:
üTosse
üDispnea
üCalo ponderale
üEmottisi
üSindromi paraneoplastiche
üL’osteoarteropatia ipertrofica polmonare (clubbing
delle dita e l’ asimmetria dei periosti delle ossa lunghe
distali)
üIpercalcemia maligna
üDolore
Iter Diagnostico
La prima formulazione di una sospetto di una
carcinoma polmonare avviene solitamente sulla base
di un radiogramma toracico:
Le più comuni modalità di presentazione in un
radiogramma standard:
üLesione periferica solitaria
üAtelettasia polmonare (con senza versamento
pleurico)
üLesione addensante ilare con/senza infiltrazione del
mediastino senza segni di metastasi a distanza o di
versamento pleurico
üLesione metastatica singola o multiple a distanza
üVersamento pleurico.
Iter Diagnostico
ü
ü
ü
ü
ü
ü
ü
ü
ü
ü
E.O.
RX torace: esami di I istanza
Esame citologico dell'escreato (sensibilità del 66%, specificità 99%)
TC con MDC (valuta TNM, sensibilità complessiva del 57%, una
specificità dell’82% per N mediastino)
Fibrobronscopia con biopsia o agoaspirato transbronchiale
PET (sensibilità del 98.0% e di specificità dell’83.3%)
Agobiopsia transtoracica (sotto guida TC, per
lesioni periferiche)
Mediastinoscopia (per valutare N del mediastino
in pazienti candidabili all’intervento con TC/PET
+ o dubbia)
Mediastinotomia
VATS (per biopsia delle stazioni linfonodali,
particolarmente utile nei casi di tumore N3 e T4
(Stadio IIIB)
Stadiazione Clinica di Neoplasia
Accertata
ü
ü
ü
ü
ü
La definizione di estensione del fattore T la si ottiene mediante
radiografia del torace, TC toracica e fibrobroncoscopia.
RM trova giustificazioni in casi estremamente selezionati al fine
di valutare le strutture di confine (parete toracica, diaframma,
apice polmonare, mediastino )
La valutazione di N richiede TC e/o RM e/o PET, agoaspirato
transbronchiale e mediastinoscopia, mediastinotomia e
videotoracoscopia.
L'accurata determinazione dell'estensione dell'interessamento
linfonodale costituisce il più importante
fattore per la scelta terapeutica e per la
sopravvivenza a lungo termine dopo
chirurgia radicale.
Scintigrafia ossea, TC o ecografia
addome per la valutazione del M, TC
encefalo su indicazione clinica
Classificazione TNM
Classificazione TNM
Lung Cancer Survival by Pathologic
Stage: Iaslc New Classification
Goldstraw et al. JTO: 2: 706-714. 2007
The New Who/International Association
for the Study of Lung Cancer
Histologic Classification of Non-small Cell Lung Carcinomas (Nsclc)
Squamous cell carcinoma (30%)
ü
Papillary
ü
Clear cell
ü
Small cell
ü
Basaloid
Adenocarcinoma (40%)
üAcinar
üPapillary
üBronchioloalveolar carcinoma
•Nonmucinous.
•Mucinous.
•Mixed mucinous and nonmucinous or
indeterminate cell type
üSolid adenocarcinoma with mucin
üAdenocarcinoma with mixed subtypes
üVariants
Large cell carcinoma (10-15%)
üVariants
Adenosquamous carcinoma
Carcinomas with pleomorphic, sarcomatoid or
sarcomatous elements
üCarcinomas with spindle and/or giant cells
üSpindle cell carcinoma
üGiant cell carcinoma
üCarcinosarcoma
üPulmonary blastoma
Carcinoid tumor
üTypical carcinoid
üAtypical carcinoid
Carcinomas of salivary-gland type
üMucoepidermoid carcinoma
üAdenoid cystic carcinoma
üOthers
Unclassified carcinoma
Lung Cancer Histotypes
NSCLC ~80%
Informazione da Chiedere all’Anatomopatologo:
diagnosi differenziale tra SCLC e NSCLC,
e quali sottogruppi di NSCLC
G Rossi et al, IJSP 2009
Informazione da Chiedere all’Anatomopatologo:
fattori prognostici e predittivi di risposta al trattamento
ISTOLOGIA
KRAS mut
EGFR mut
ERCC1 (ihc, rt-pcr)
ALK (fish)
BRCA1 (fish)
P53 (ihc)
Gene profiling?
T790 mut
cMET (fish)
The Need of a Right Sample Tissue
Biopsy Techniques in Lung Cancer Diagnosis
ü
Sputum cytology
ü
Bronchial brushings and washings
ü
Fluids
ü
FNA – cytology – primary or mets
ü
Transbronchial biopsy
ü
Bronchial Biopsy
ü
Core biopsy – primary or mets
ü
Liver biopsy
ü
Mediastinoscopy
ü
Lymph node excision
ü
VATS biopsy / resection
ü
Thoracotomy & tumour excision
Kerr K., 2008
Fattori Prognostici e Predittivi
Prognostic
Predictive
Baseline patient or
tumour characteristic
that provides
information on
outcome regardless
of treatment
Baseline patient or
tumour characteristic
that provides
information on
outcome from
treatment
Many biomarkers may have both predictive and prognostic value
Fattori Prognostici in NSCLC
Clinical factors
Biologic factors
üAge
üEGFR
üSex
üPS
üKRAS
üBRCA1
ü…
Tumour factors
Pharmacogenetic factors
üHistology
üERCC1
üStage
üRRM1
üTS
Gene profiling ?
Fattori Prognostici in NSCLC
Fattori Prognostici in NSCLC
Sex, Age, Histology & PS
Sculier et al, JTO, 2008
Fattore Prognostico in NSCLC:
Estensioni di Malattia
cTNM
MS (m)
pTNM
MS (m)
cIA
60
pIA
119
cIB
43
pIB
61
cIIA
34
pIIA
49
cIIB
18
pIIB
31
cIIIA
14
pIIIA
22
cIIIB
10
pIIIB
13
cIV
6
pIV
17
Sobin et al, 2009
The Prognostic and Predictive Role of
Histology in Advanced Non-Small Cell
Lung Cancer
Historically, histologic subtype has not reliably been shown
to have prognostic importance in advanced NSCLC.
Although histologic subtypes are often described for patients
with NSCLC enrolled in clinical trials, analyses that examine
a potential association between histology and efficacy
outcomes are often not reported.
FR Hirsch et al, JTO 2009
Histology and Pemetrexed
Table 1. Phase III Randomized Trials in Non-small Cell Lung
Cancer Showing a Superior Activity of Pemetrexed in Nonsquamous Histology
GV Scagliotti , ED ASCO 2009
TS mRNA Expression in Lung Cancer Cells
Scagliotti G, ASCO 2009
Potential oncogenic “drivers” in nonsmall cella lung cancer (NSCLC)
Bang Y, PASCO 2010
Potential EGFR TKI’s Predictive Markers
Clinical Predictive
Markers
Biological Predictive
Markers
Habits: never smoker
EGFR protein (IHC)
Histology: adeno and BAC
EGFR gene copy (FISH)
Gender: female
EGFR mutation
Race: Asian
K-RAS mutation
Opzioni Terapeutiche
Stage
%
IA
IB
II
III A
III A
N2
20-25
5y-S%
Surgery
55-70
Surgery ±
Adjuvant Treatment
30-35
III B
IV
Terapeutical
Strategy
50-40
25-40
Neoadjuvant Treatment +
Surgery ± Adjuvant Treatment
10-25
Chemotherapy + Radiotherapy
10-20
Chemotherapy ± Biologics +
BSC
<10
Correlazione fra Stadio TNM e Scelta
Terapeutica
Stadio I, II e IIIA “non bulky”
ü
Lobectomia per lesioni periferiche.
ü
Exeresi sublobare per
funzionale respiratorio
ü
Pneumonectomia o lobectomia con broncoplastica
per le lesioni centrali
ü
Nei pazienti anziani ( > 71 anni) la lobectomia non
da nessun vantaggio rispetto alla resezione
limitata. ( Mery, Chest 2005)
pazienti
con
deficit
Stadio I A e B
T1-2a N0 M0
La chirurgia è il trattamento di scelta
(mortalità è postoperatoria 3-5%)
% recidiva locale < lobectomia vs
resezione
Pazienti inoperabili o con insufficiente
riserva
polmonare
o
con
controindicazioni
mediche
all’intervento sono candidati a RT con
intento curativo (Noordijk Radiother
Oncol 1988; Dosoretz, Int J Radiat
Oncol Biol Phys 1992)
Stadio II
T1-2, N1, M0
T2b-T3 N0 M0
La chirurgia è il trattamento di scelta (mortalità
postoperatoria 3-5%)
è
Pazienti inoperabili o con insufficiente riserva polmonare o
con controindicazioni mediche all’intervento sono candidati a
RT con intento curativo (Noordijk Radiother Oncol 1988;
Dosoretz, Int J Radiat Oncol Biol Phys 1992)
Chemioterapia adiuvante con schemi contenenti platino
Stadio III A
T1-2 N2 M0
T3 N1-2 M0
T4 N0-1 M0
Terapia chirurgica (se possibile) + CT adiuvante o RT
adiuvante
RT + Chemioterapia (definitiva)
RT adiuvante: dati controversi su OS ma miglior controllo
locale (Emami Am J Clin Oncol 1997, Sawyer Ann Thorac
Surg 1997, Keller NEJM 2000)
Trattamento neoadiuvante (CT + RT) Rosell NEJM 1994,
Roth J Natl Cancer Inst 1994, Albain J Clin Oncol 1995
Stadio III A
Le possibilità della terapia chirurgica in questo stadio devono
tener conto dell' entitá dell'estensione del tumore primario e del
grado di interessamento linfonodale
Se il linfonodo metastatico è singolo e sono tecnicamente
resecabili sia il linfonodo, sia il tumore primitivo, si esegue
resezione insieme ad una linfoadenectomia mediastinica
Nel caso di invasione neoplastica della parete toracica o
diaframma o pleura mediastinica o pericardio si esegue una
lobectomia con resezione "en bloc" della struttura interessata.
Qualora il tumore giunga ad interessare i bronchi principali si
può eseguire un intervento di sleeve lobectomy o di sleeve
pneumonectomy
Non esistono evidenze cliniche conclusive che dimostrino la
superiorità della linfoadenectomia ilomediastinica sistematica
rispetto al semplice campionamento (sampling) linfonodale.
Stadio III A (N2)
POTENZIALMENTE RESECABILE à Terapia di
induzione o neo – adiuvante: chemioterapia o
chemioterapia + radioterapia.
NON RESECABILE à no chirurgia; radioterapia
+ chemioterapia
Tumore di Pancoast
T3, N0 or N1, M0
Interessano l’apice polmonare e le ultime radici del plesso
brachiale.
Tendenza precoce all’invasione locale
Tardiva diffusione linfatica ed ematica
Se N0-1 chemioradioterapia neoadiuvante + chirurgia
(Rusch J Thorac Cardiovasc Surg 2001)
RT
Stadio III B
any T, N3, M0
T4, any N, M0
Chemioterapia + Radioterapia (Le Chevalier, J Natl Cancer
Inst 1991) (Dillman, NEJM 1990) (Pfister, J Clin Oncol
2004
Chemioterapia + radioterapia concomitante à chirurgia
(Rusch J Thorac Cardiovasc Surg 1993) (Albain J Clin
Oncol 1995)
Chemioterapia
Radioterapia palliativa (Langendijk, Int J Radiat Oncol Biol
Phys 2000) (Sundstrøm J Clin Oncol 2004)
RUOLO DELLA
CHEMIOTERAPIA
POSTOPERATORIA
Perche’ la Chemioterapia Adiuvante?
1.
Poor survival after surgery
2.
Positive results from clinical trials
3.
Positive results from meta-analysis
4.
Follow-up confirmation
5.
NVB-CDDP reverses the trend of poor outcome of ADK
6.
Positive comparison with other adjuvant setting
7.
Easy patients selection
8.
Well established treatment strategy
9.
Cheaper treatment in lung cancer
10. Strongly recommended by international guidelines
Adjuvant CT Trials in NSLCL
Synopsis of Results by Stage
Trial/Stage
IA
IB
II
IALT
JBR.10
4 cm ?
ANITA
LACE MA
Positive
Negative
IIIA
Lung Adjuvant Cisplatin Evaluation
A pooled analysis by the LACE collaborative group
Adjuvant Setting
20 year historical perspective
HR 0.87 (0.74-1.02) p=0.08
N = 1394
BMJ 1995; 311:899-909
HR 0.89 (0.82-0.96) p=0.005
N = 4584
JCO 2008; 26:3552-3559
All cisplatin based
HR 0.80 (0.70-0.91) p<0.001
N = 1888
JTO 2010; 5:220-228
Clinical Recommendations
Non – small – cell lung cancer: ESMO clinical
recommendations for diagnosis, treatment and follow-up
G. D’Addario1 & E. Felip2
On behalf of the ESMO Guidelines Working Group
1
Onkologie Schaffhausen, Schaffhausen, Switzerland;
Medical Oncology Service, Vall d’Hebron University Hospital, Barcelona, Spain
2
Treatment of localized disease
üSurgical resection in functionally fit patients (lobectomy/
pneumonectomy plus systematic mediastinal lymph node
sampling or lymphadenectomy).
üCisplatin – based adjuvant combination chemotherapy is
recommended in stage II and IIIA [I, A], and can be
considered in selected stage IB patients (T > 4cm).
Annals of Oncology 20 (Supplement 4): iv68 – iv70, 2009
doi:10, 1093/annonc/mdp 132
Risultati
Le linee guida internazionali convergono nel suggerire una
chemioterapia contenente platino.
Durata trattamento 4 cicli se:
üPazienti in buone condizioni generali
üP.S. di 0-1
üNo comorbidità
üBuona ripresa fisica dopo l’intervento chirurgico.
Risultati
Metanalisi dei dati individuali raccolti dai 5 più grandi studi
di chemioterapia adiuvante : ALPI, ANITA, BLT, IALT,
JBR10 (Pignon, ASCO 2006)
Sopravvivenza a 5 anni 4,2%
Beneficio > stadio II e III (HR 0.83, C.I. 0.730.73-0.95)
Nessun beneficio stadio IA (HR 1.41, C.I. 0.960.96-2.09)
e IB (HR 0.93, C.I. 0.780.78-1.10)
Risultati
Chemioterapia adiuvante nel paziente anziano (> 70 aa)
Analisi retrospettiva di 5 studi di adiuvante (IALT, ALPI,
BLT, ANITA,BR10)
Dei 4564 pz. 9% > 70 aa
Follow up mediano 5.1 aa
Non correlazione tra chemioterapia ed età
Algoritmo Clinico per CT Adiuvante
Stadio II-IIIA
üEtà
< 70-75 anni
üEtà
> 70-75
üPS
0-1
üPS
>1
üNo
comorbidità
üComorbidità
üIntervallo
< 40 giorni
üCompleto
recupero
üEsiti
üCompleta
informazione
üScarsa
informazione
üERCC1
positivo (?)
üERCC1
Negativo (?)
CT adiuvante
üIntervallo
(cardiovascolare)
> 40 giorni
post-chirurgici o com.
Follow-up
RUOLO DELLA
RADIOTERAPIA
POSTOPERATORIA
(PORT)
Post-Operative Radiotherapy in Stage II
or IIIA Completely Resected NSCLC
Stage and nodal status subgroup analysis for
survival
Post - Operative Radio Therapy
Overview (Lancet 1998)
2128 pts including 808 stage III pts
in 9 randomized studies
Surgery alone (1072 pts)
(1056 pts)
2-year Survival: 55%
Surgery + PORT
2-year Survival: 48%
PORT Group, Lancet 1998
ANITA: a Randomised Controlled Trial
Adjuvant vinorelbine plus cisplatin versus observation in patients with
completely resected stage IB – IIIA non-small cell lung cancer (Adjuvant
Navelbine International Trialist Association [ANITA]): a randomised
controlled trial.
1.00
CT
RT47.4%
CT/RT
CT
34.4%
CT
RT
21.3%
RT
OBS 16.6%
OBS
5y-S in N2
0.75
0.50
0.25
# 224 N2 pts
0.00
0
20
40
60
80
DURATION OF SURVIVAL (MONTHS)
100
120
IASLC 2005
R Rosell et al, WCLC 2005
Clinical Recommendations
Non – small – cell lung cancer: ESMO clinical
recommendations for diagnosis, treatment and follow-up
G. D’Addario1 & E. Felip2
On behalf of the ESMO Guidelines Working Group
1
Onkologie Schaffhausen, Schaffhausen, Switzerland;
Medical Oncology Service, Vall d’Hebron University Hospital, Barcelona, Spain
2
Treatment of local disease
üPostoperative radiotherapy ca be considered in patients
not radically resected
üPostoperative radiotherapy is not recommended for
patients with radically resected stage I and II disease [I, A]
and should only be considered for patients with resected
stage IIIA disease/mediastinal node involvement
Annals of Oncology 19 (Supplement 2): ii39– ii40, 2008
doi:10, 1093/annonc/mdn 081
RUOLO DELLA TERAPIA
BIOLOGIA IN ADIUVANTE
BR. 19 - Schema
Pts with completely resected
stage IB, II, and IIIA NSCLC
Gefitinib 250 mg po
daily x 2 yrs
Stratified by
üStage
üHistology
üPost
Randomized 1:1
– op RO
üSex
üAdjuvant
üChemotherapy*
Placebo 0 mg po
daily x 2 yrs
* Protocol amended January 2003 to allow adjuvant chemotherapy which
which
became a stratification factor
Goss, PASCO 2010
BR. 19 - Results
BR. 19 – Overall Survival
BR. 19 – Disease Free Survival
Goss, PASCO 2010
QUALE TRATTAMENTO
LOCOREGIONALE PER MALATTIA
LOCALMENTE AVANZATA?
LA COMBINAZIONE DI CHEMIO E
RADIOTERAPIA RAPPRESENTA
IL TRATTAMENTO STANDARD
DEL NSCLC INOPERABILE/NON
RESECABILE
ü
ü
ü
ü
ü
ASCO Guidelines
ONTARIO Lung Cancer Guidelines
START Guidelines
ESMO Guidelines
Linee guida AIOM
CT-RT nel’NSCLC
Concomitante?
RT
Sequenziale?
Entrambe?
CT
Trattamento CT-RT dell’NSCLC Stadio III
Conclusioni
Il trattamento con chemioterapia e radioterapia toracica
concomitante rimane il “gold standard” per pz giovani, senza
comorbidità, fit e con volumi ridotti (V20<35%)
La CT-RT sequenziale costituisce una valida alternativa per pz
fragili o in presenza di grossi volumi
L’aggiunta di un trattamento adiuvante non migliora i risultati ed
incrementa la tossicità
Il beneficio aggiuntivo di una chemioterapia di induzione preCT/RT rimane da dimostrare
Importanza di RT ottimale: dose > 60
conformazionale 3-4 D, involded field senza ENI
Gy,
tecnica
Algoritmo Terapeutico del NSCLC III
Stadio Inoperabile
Stadio III inoperabile
Discussione
multidisciplinare
Caso
all’operabilità
alcuni T4)
riconducibile
(N2
limitato,
Caso
non
riconducibile
all’operabilità (N3, N2 bulky e/o
pluristazionale, alcuni T4)
CT di induzione
CT/RT Concomitante
Chirurgia +/RT adiuvante
LA TERAPIA DELLA MALATTIA
METASTATICA
Malattia Metastatica
Le opzioni terapeutiche includono chemioterapia e terapia di
supporto (RT)
Fattori prognostici di risposta alla terapia:
üPS
üSesso femminile
üLDH
üPerdita di peso < 5% nei 6 mesi precedenti
üPresenza di un solo sito di metastasi normali
üAssenza di M+ ossee o epatiche
üAssenza di precedente trattamento
Fattori biologi predittivi di risposta
The Treatment Goals for Advanced Nsclc
ü
Increase overall survival
ü
Maintain and improve quality of life
ü
Improve symptom control
ü
Develop treatment options that limit
adverse events
Results of a Phase III Randomized Trial
Effect of early palliative care (PC) on quality of life (QoL),
aggressive care at the end-of-life (EOL), and survival in stage IV
NSCLC patients: Results of a phase III randomized trial
Quality of EOL Care and Resource Utilization
Survival Analysis
J Temel, PASCO 2010
A-NSCLC Therapy Significant Milestones
in 1st-Line
Median survival (months)
12 ----------------------------------------------------------------------------10 -------------------------------------8
P
6–8 ms
6
P-based
doublets
8–10 ms
Cb-PAC
+
Cis-VNB
BEVA 12.5
+
ms in
CTXB 11.3
selected
ms in
NSQ
EGFR +
PEM /cis
12.6 ms in
ADC
4
2
BSC
2–4 ms
0
1970
1980
1990
2007
2008
2009
The Need of Customized CT in NSCLC
In advanced NSCLC
ü
Response rates 20-40% (70% in EGFR mut+ with TKIs)
ü
Median survival 8-10 months (12 months with new
drugs, 28 months in EGFR mut+ with TKIs)
ü
Median time to progression 5-6 months (14
months in EGFR mut+ with TKIs)
ü
1-year survival 30-40% (>50% with new drugs)
ü
2-year survival 15-20%
ü
Response rate in 2nd line 10%
CT Registered in First Line Treatment of
Advanced NSCLC in Italy
Cisplatin + Docetaxel or Gemcitabine
Carboplatin + Paclitaxel
Gemcitabine
Vinorelbine
Platinum based CT + Bevacizumab#
Cisplatin + Pemetrexed*
# Non squamous and selected patients
* Non squamous
CT Registered in Second Line Treatment
of Advanced NSCLC in Italy
Docetaxel
Pemetrexed (EMEA approved also for
maintenance)
Erlotinib
CT Registered in Third Line Treatment of
Advanced NSCLC in Italy
Erlotinib
A-NSCLC Clinical Practice in 2012
EGFR Mut+
PTS
ü
Gefitinib
ü
P-based Doublets:
Cis+Gemcitabine
Cis+Docetaxel better
than Cis+Vin or
Cb+Pac
•
SQUAMOUS
& NOS PTS
•
P-based Doublets:
•
Cis+Pemetrexed
better than
Cis+
Gemcitabine
ü
NON
SQUAMOUS
LC PTS
ü
ü
P-based
CT+Cetuximab (*)
(*) According to registration for
EGFR status and CT
P-based CT (**)+
Bevacizumab in
selected patients
ü
(**) Cb+Pac > Cis+Gem
P-based CT+Cetuximab (*)
(*) According to registration for EGFR status and CT
CHEMIOTERAPIA DI I LINEA
Clinical Recommendations
Non – small – cell lung cancer: ESMO clinical
recommendations for diagnosis, treatment and follow-up
G. D’Addario1 & E. Felip2
On behalf of the ESMO Guidelines Working Group
1
Onkologie Schaffhausen, Schaffhausen, Switzerland;
Medical Oncology Service, Vall d’Hebron University Hospital, Barcelona, Spain
2
Treatment of stage IV disease
üTwo-drug, platinum-based chemotherapy combined with
vinorelbine, gemcitabine or a taxane prolongs survival, improves
quality of life and controls symptoms in patients with good
performance status [I, A]. Non – platinum combination
chemotherapy can be considered in patients who are fit to
receive platinum agents. In first – line metastatic EGFR –
mutated patients EGFR TKIs treatment may be contemplated.
Annals of Oncology 19 (Supplement 2): ii39– ii40, 2008
doi:10, 1093/annonc/mdn 081
Treatment Decision
Age
üYoung vs Elderly
Biology
üEGFR mut, ERCC1
PS
ü0-1 vs 2
Toxicities of previous regimen*
üMild vs moderate vs severe
Comorbidities
üNone/mild vs Moderate/severe
Response to previous treatment*
üPR/CR vs SD vs PD
Strategies
üContinuous therapy vs holidays
w/o CT
Time to progression*
üShort vs long
Costs
üCheap vs expensive
* Only for second line and subsequent lines
Cis Vs Carbo: Subgroup Analysis
Survival - test of interaction positive for histology (p = 0.098)
and for type of chemotherapy (p = 0.093)
Subgroups
HR
95% CI
p
Non-Squam Histology
1.12
1.01-1.23
0.026
Squam Histology
0.97
0.85-1.10
0.586
II generation CT
0.94
0.80-1.11
0.467
III generation CT
1.11
1.01-1.21
0.026
Ardizzoni A, JNCI 2007
Gem/Platinum is Statistically Superior in
PFS Over Other Platinum Regimens
Le Chevalier T, Lung Cancer 2005
Old CT: Conclusions from Meta-Analyses
Cisplatin + gemcitabine
&
Cisplatin + docetaxel
Are slightly better than
Carboplatin + paclitaxel
&
Cisplatin + vinorelbine
JMDB: Cis/Pem Vs Cis/Gem - Study
Design
Randomization factors:
üStage
üPS
üGender
üHysto vs cyto dx
üBrain mets
Vitamin B12 folate and
dexamethasone given in
both arm
R
A
N
D
O
M
I
S
E
Cisplatin 75 mg/m2
Pemetrexed 500 mg/m2
d1 q 3 weeks up to 6 cycles
Cisplatin 75 mg/m2
Gemcitabine 1250 mg/m2
D1,8 q 3 weeks up to 6
cycles
Scagliotti G, JCO 2008
Survival Time (months) in Non Squamous Patients
Probability Without Event
Probability Without Event
JMDB: OS in Non-Squamous & Squamous
Patients
Survival Time (months) in Squamous Patients
Scagliotti G, JCO 2008
TS mRNA Expression in Lung Cancer Cells
Scagliotti G, JCO 2008
ECOG 4599 VS AVAIL
Study
# Pts
CT
RR%
PFS
HR
ECOG
750
Carbo+Pac
Carbo+Pac+Beva
15
35
4.5
6.2
0.66
AVAiL
656
Cis+Gem
Cis+Gem+Beva
20
30
6.1
6.5
0.85
ECOG - Sandler A, NEJM 2006
AVAiL - Manegold C, ESMO 2008
Efficacy of Bevacizumab Based Therapy
Locally advanced
metastatic or
recurrent nonsquamous NSCLC
(n=2,166)
Medium, months
95% CI
Chemotherapy +
bevacizumab 7.5
mg/kg or 15 mg/kg
every 3 weeks
Bevacizumab
Ma ..................
Therapy
OS
TTP
15,3
7,8
14,5-16,5
7,4-8,1
PD
Crinò L, ASCO 2009
Integrating Anti-VEGF Therapy Into
Clinical Practice: Where We Are Now
Which patients are eligible for Avastin?
Tumour cavitation – on therapy
ü
Central tumour location
ü
Concomitant anticoagulation therapy
ü
Controlled hypertension
ü
Brain metastasis
ü
Conclusioni
ü
Gemcitabina e Taxani: stessa efficacia, miglior tollerabilità
(D’Addario JCO 2005)
ü
CDDP meglio di CBDCA (Ardizzoni ASCO 2006) ma
<maneggevolezza e tollerabilità
ü
CisPem I opzioni nei adk
EGF-R WT
ü
Durata ottimale 4-6 cicli ma
non esistono raccomandazioni
(Smit JCO 2001)
ü
TC dopo 2-4 cicli per continuare
o no
Old as the Hills VS Elderly/Young & “Fit”
Hefner Hugh et al, Playboy 2009
Malattia Metastatica
Se PS basso, calo ponderale o età
avanzata
à
monochemioterapia
oppure combinazione poco tossica
oppure trattamento sintomatico
TERAPIA DI II LINEA
Docetaxel VS Pemetrexed: Survival
Hanna F, JCO 2004
Gefitinib and Erlotinib:
Similar Drugs, Different Histories
Overall Survival
Overall population
Probability of survival
Thatcher N, Lancet 2005
Shepherd F, NEJM 2005
Gefitinib vs Docetaxel: OS
Shepherd F, ASCO 2009
TK-INHIBITORS
EGFR Background
Epidermal growth factor receptor (EGFR):
ü
ü
ü
ü
ü
ü
HER/ErbB family of transmembrane receptors
Dimerizes on ligand binding
Intracellular tyrosine kinase (TK) domain
Activation leads to downstream effector
pathways, cellular proliferation, etc.
EGFR TK mutations present in
~10-50% of NSCLC
NSCLC: Activating mutations in TK
domain
•
90%
•
in-frame deletions in exon 19
single amino acid substitutions in
exon 21 (L858R)
Lynch, NEJM 2004; 350:2129-39
EGFR TK Domain Mutations in NSCLC
EGFR mutations are
over-represented in responders
to EGFR inhibitors
Mutations that confer Sensitivity
to EGFR-TKIs include:
ü exon 19 small in-frame
deletions (50%)
ü exon 21 point mutations
EGFR L858R (40%)
Mutations known to cause Resistance
to first-generation EGFR-TKIs include:
ü exon 20 point mutations (e.g. T790M)
ü Role of cMET amplification
Deletions
(vIII) ~ 1%
Extracellular
ligand-binding
domain
TM
Exon 18
19
20
21
Tyrosine
kinase
domain
22
23
24
Sharma et al. Nature Rev Cancer 2007;7;169; Ji et al. Proc Natl Acad Sci USA 2006;103;7817
Stephens et al. Nature 2004;431:525
PREDICTIVE Factors for EGFR-TKI
Sensitivity
Predictive for Response
ü
ü
Clinical
ü
ü
Gender
Histology
Smoking history
Ethnicity
Predictive for Survival
ü
ü
ü
ü
ü
ü
ü
Biological
ü
ü
ü
EGFR Gene mutation
EGFR high copy number
HER2 high copy number
AKT activation
Primary Resistance
Acquired Resistance
ü
ü
Smoking history
Ethnicity
Histology
PS
Response to prior therapy
Skin rash
EGFR gene mutation
EGFR high copy number
• K-RAS mutation
• EGFR exon 20 insertion
• EGFR T790M
• cMET amplification
PREDICTIVE Factors for EGFR-TKI
Sensitivity
Predictive for RESISTANCE
Primary Resistance
ü
ü
K-RAS mutation
EGFR exon 20 insertion
Acquired Resistance
ü
ü
EGFR T790M
cMET amplification
EGFR TKIs Erlotinib e Gefitinib
ü Dopo fallimento di ≥1 linea chemioterapica
ü Nel mantenimento
ü In Prima Linea
Iressa Pan ASia Study
IPASS Phase III Study design
Patients
1217
≥18 years
üLife expectancy
≥ 12 weeks
üAdenocarcinoma
histology
üNever smokers or light
ex-smokers*
üPS 0-2
üStage IIIB/IV
üMeasurable disease
üAge
Endpoints
Gefitinib
250 mg/day
1:1 randomization
Carboplatin AUC
5 or 6 and
Paclitaxel
200mg/m2 3 wkly
Primary
üProgression free survival (noninferiority)
Secondary
üObjective response rate
üQuality of life
üDisease related symptoms
üOverall survival
üSafety and tolerability
Exploratory
üBiomarkers
• EGFR mutation
• EGFR gene copy number
• EGFR protein expression
*Never smokers:<100 cigarettes in lifetime; light ex-smokers: stopped ≥15 years ago and smoked
≤10 pack yrs Carboplatin/paclitaxel was offered to gefitinib patients upon progression
T Mok et all, NEJM Sept 2009
IPASS PFS
Gefitinib
Probability 1.0
of PFS
N
Events
Carboplatin /
609
453 (74.4%)
paclitaxel
608
497 (81.7%)
HR (95% CI) = 0.741 (0.651, 0.845) p<0.0001
0.8
5.8
74%
48%
7%
5.7
61%
48%
25%
0.6
Median PFS (months)
4 months progression-free
6 months progression-free
12 months progression-free
0.4
Gefitinib demonstrated non-inderiority relative to
carboplatin / paclitaxel in terms of PFS
0.2
0.0
At risk :
Gefitinib
Carboplatin /
paclitaxel
0
4
8
12
16
20
24 Months
609
608
363
412
212
118
76
22
24
3
5
1
0
0
T Mok et all, NEJM Sept 2009
Ipass Study Orr in EGFR Mutation ±
71.2%
Gefitinib
Carboplatin / paclitaxel
47.3%
Overall
response
rate (%)
23.5%
1.1%
(n=132)
(n=129)
(n=91)
(n=85)
Odds ratio >1 implies greater chance of response on gefitinib
T Mok et all, NEJM Sept 2009
OPTIMAL : Study Design
ü Chemonaїve advanced
NSCLC
152 pts
ü EGFR Act Mut+
(exon 19 deletion or exon 21
L858R mutation)
R
Erlotinib 150mg/day
1:1
ü ECOG PS 0–2
ü
ü
ü
Stratified by mutation type, histology, smoking status
Primary endpoint: PFS
Secondary endpoints: OS, ORR
Gemcitabine
1,000mg/m2 (d1, 8) plus
Carboplatin AUC=5
(day 1); i.v., every 3
weeks, up to 4 cycles
MPFS 13,1 months T vs 4,6 months CT
HR=0,16 (0,10-0,26 p<0,0001)
Toxicity profile in favour to Erlotinib
EGFR mut+ del19: MPFS 15,3 m à > benefit
EGFR mut+ L585R: MPFS 12,5 m
PI: C. Zhou (Shangai, China) - ESMO 2010
EURTARC: Spanish Lung Cancer Group
Phase III, Open-Label, Randomized study
(Spain, France, Italy)
Population
EGFR mutation
R
A
N
D
O
M
I
Z
A
T
I
O
N
N=130
Benefit TTP 7 m
ARM A
Erlotinib 150 mg/d/vo
N=65
Cis 75/Gem 1250
ARM B
N=65
C
R
O
S
S
O
V
E
R
Cis 75/ Doc 75
Carbo5/Gem 1000
at
Carbo6/Doc 75
Benefit TTP 4 m
α=0.05 (two-tailed comparison)
β=0.2 (80% power)
On June 9 2010 145 CAUCASIAN patients randomized
P
D
EGFR TKIs Erlotinib e Gefitinib
ü Dopo fallimento di ≥1 linea chemioterapica
ü Nel mantenimento
ü In Prima Linea
Maintenance Erlotinib in A-nsclc
SATURN Design & Results
+ 1.0 ms
F Cappuzzo et al, P ASCO 2009
EGFR TKIs Erlotinib e Gefitinib
ü Dopo fallimento di ≥1 linea chemioterapica
ü Nel mantenimento
ü In Prima Linea
Erlotinib in Previously Treated Non-Small
Cell Lung Cancer
BR.21 Study Design
NSCLC unsuitable to
receive CT stratified by:
üCentre
üPerformance
status
0/1 vs 2/3
üResponse
731 pts
to prior Rx
(CR/PR:SD:PD)
üPrior
regimens (1 vs 2)
üPrior
platinum
(yes vs no)
R
A
N
D
O
M
I
S
E
ERLOTINIB*
150 mg daily
* 2:1
randomisation
Placebo
“150 mg” daily
Primary endpoint: OS
F Shepherd et al, N Eng J Med 2005
BR.21 Survival
Overall Survival
Progression-free Survival
MOS = + 2.0 ms (6.7 vs 4.7 ms)
1-yS = + 9 % (31 vs 22%)
MPFS= + 0.4 ms (2.2 vs 1.8 ms)
F Shepherd et al, N Eng J Med 2005
Effect of Early Palliative Care on Quality of Life
Effect of early palliative care (PC) on quality of life (QoL),
aggressive care at the end-of-life (EOL), and survival in stage IV
NSCLC patients: Results of a phase III randomized trial.
Quality of EOL Care and Resource Utilization
Survival Analysis
J Temel, PASCO 2010
Conclusioni
Trattare il paziente non la malattia ( terapia personalizzata in
base al PS, età, comorbidità etc)
Terapia Tailored ( basata su alcuni fattori prognostici e predittivi
di risposta al trattamento)
Nei EGF-R mut indicati TK-i in I linea
Negli adenocarcinomi indicato Platino/Pemetrexed
II o III linea se buon PS
Early palliative support
SCLC
SLC: Incidenza e Mortalità
La sopravvivenza mediana senza trattamento è di 3 mesi per
la malattia limitata e di un mese e mezzo per quella estesa
Nella popolazione maschile europea il tasso di incidenza
annuale di tumore a piccole a cellule (standardizzato per l’età)
varia da piu’ di 15 (Olanda, Slovenia, Estonia, Sud della
Spagna, Croazia, Germania) a meno di 2 (a Ragusa e Lat
via);nelle donne il tasso varia da piu’ di 5 a meno di 1 .
Fattori di Rischio
1. Il fumo di tabacco.
2. Sostanze di origine lavorativa
(Asbesto, Cromo, Arsenico, Berillio, Cloruro di Vinile, Idrocarburi
Aromatici Policiclici, Clorometiletere, Radon e altri) sono
riconosciute come carcinogeni polmonari che spesso, come nel
caso dell’amianto, potenziano il loro effetto in presenza di fumo
di tabacco.
3. Il ruolo dell'inquinamento atmosferico è oggi riconosciuto come
un importante fattore
ma è ancora oggetto di studio e
discussione.
Istologia
ü
Il SCLC è caratterizzato da piccole cellule rotonde di
piccole dimensioni, con nuclei colorati e scarso citoplasma
ü
Alto tasso di mitosi
ü
Ampia necrosi tumorale
ü
Immuoistochimica: differenziazione neuroendocrina
ü
Diagnosi differenziale dai tumori neuroendocrini del
polmone (carcinoidi, carcinoidi atipici etc)
SCLC: Diagnosi
Piu’ dell’80% dei pazienti con SCLC riferiscono che I sintomi
sono comparsi da 3 mesi o meno
Sintomi principali:
üTosse
üDispnea
üCalo ponderale
üDolore toracico
üSindromi paraneoplastiche (sindrome da inappropriata
secrezione di ADH (11%), la sindrome di Cushing (2.4%) e la
sindrome di Eaton Lambert ).
üSindrome mediastinica
üDisfagia
üRaucvedine
üDolore
SCLC: Diagnosi
Al momento della diagnosi 2/3 dei pazienti hanno malattia
metastatica, all’osso (30%), al fegato (25%),al midollo osseo
(25%) o al SNC (10%). I sintomi legati alle metastasi a
distanza possono o meno essere presenti.
Il SCLC solitamente si presenta come una lesione di grandi
dimensioni, a rapido accrescimento, a partenza dal parter
centrale dei grossi bronchi e con invasione rapida del
mediastino.
Iter Diagnostico
La prima formulazione di una sospetto di una carcinoma
polmonare avviene solitamente sulla base di un radiogramma
toracico.
Le più comuni modalità di presentazione in un radiogramma
standard:
üSi presenta una grossa massa centrale,
üSegni di invasione mediastinica.
üCome screening la lastra del torace ha una sensibilità del 4550%
Iter Diagnostico
La citologia su espettorato ha una sensibilità del 25-30%,
Rx Torace e citologia su espettorato ha una sensibilità del 6070%
Marker Tumorali (NSE e Cromogranina): non sono utili nell’iter
diagnostico a causa della loro scarsa sensibilità e specificità.
sono elevati nel 60-65 % dei casi.
Iter Diagnostico
Fibrobroncoscopia: permette di eseguire una biopsia ed il
lavaggio bronchiale (sensibilità è piu’ dell’80 %).
L’aggiunta di un agoaspirato con ago fine (EBNA) alla biopsia
ed al lavaggio bronchiale può incrementare la sensibilità fino al
90%.
Difficile agobiopsia TC-guidato: lesioni centrali difficilmente
raggiungibili per via transtoracica.
Iter Diagnostico
II Opzioni
Video-toracoscopia à per lesioni periferiche o linfonodi
mediastinici
Mediastinoscopia
à biopsia escissionale dei linfonodi del
mediastino anteriore o
lesione perilari
Stadiazione Clinica di Neoplasia
Accertata
La definizione di estensione del fattore T (la si ottiene mediante
radiografia del torace, TC toracica e fibrobroncoscopia.
La valutazione di N richiede TC torace
La valutazione di M richiede TC addome e torace
Scintigrafia ossea,
TC encefalo o RMN encefalo
Classificazione TNM
Il sistema di stadiazione convenzionale
Il SCLC è tradizionalmente classificato in limitato o esteso.
La definizione di malattia limitata è basata sulla fattibilità di
trattare completamente il tumore con un trattamento
radioterapico.
Classificazione TNM
Malattia limitata
La definizione di malattia limitata include pazienti con
malattia localizzata all’emitorace con metastasi linfonodali
regionali (includendo i linfonodi ipsilaterali e controlaterali,
mediastinici e sopraclaveari) e senza versamento pleurico.
L’interessamento del nervo ricorrente e della vena cava
superiore sono considerate malattia limitata. Recentemente,
pazienti con interessamento mediastinico controlaterale e/o
sopraclaveare e/o versamento pleurico omolaterale sono
stati inclusi in questo gruppo in quanto hanno una prognosi
migliore dei pazienti con metastasi a distanza.
Classificazione TNM
Malattia estesa
La malattia estesa rappresenta qualsiasi tumore oltre i limiti
definiti sopra
Fattori Prognostici e Predittivi
Una malattia in stadio limitato è il più importante fattore
prognostico positivo.
Il Performace status
Metastasi epatiche, ossee ,midollari e/o encefaliche
Un’elevato livello di LDH e ALP, bassi livelli di sodio o
albumina o emoglobina sono associati ad una cattiva
prognosi.
Trattamento del SCLC Limitato
ü
Chemioterapia e radioterapia sequenziale
ü
Chemioterapia e radioterapia concomitante
ü
Radioterapia esclusiva nei pazienti unfit
ü
Chirurgia in casi molto selezionati ( stadio I con N0 e
buon PS)
ü
WBRT ( radioterapia panencefalica ) profilattica in tutti i
pazienti in risposta completa, gli ultimi studi clinici
suggeriscono un beneficio anche nei pazienti in risposta
parziale e buon performance status
Trattamento del SCLC Limitato
ü
Chemioterapia e radioterapia concomitante più efficace
della Chemioterapia e radioterapia sequenziale ma con
un peggior profilo di tossicità ( da preferire quindi nei
pazienti in buon performance status )
ü
Chemioterapia di riferimento: Cisplatino ed Etoposide
ü
Valida opzione : carboplatino ed Etoposide nei pazienti
con Insufficienza renale o ridotto PS
ü
Monoterapia nei pazienti unfit : preferire platino
Trattamento del SCLC Avanzato
La probabilità di essere curativi per i pazienti con tumore a
piccole cellule metastatico è bassa con meno del 5% di
sopravvivenza a 5
anni. Il trattamento dev’essere
considerato palliativo nella maggior parte degli individui. La
chemioterapia combinata migliora la sopravvivenza media
ed è anche in grado di migliorare i sintomi nel 50% dei
pazienti con versamenti pleurici, nell’80% dei pazienti con
sindrome della vena cava superiore e nel 70% dei pazienti
con polmone atelattasico.
La radioterapia associata alla chemioterapia è in grado di
ridurre la progressione di malattia in sede toracica senza
alterare pero né la sopravvivenza libera da malattia né la
sopravvivenza globale.
Trattamento del SCLC Avanzato
ü
Chemioterapia di riferimento: Cisplatino ed Etoposide
ü
4-6 cicli totali
ü
Valida opzione : carboplatino ed Etoposide nei pazienti
con Insufficienza renale o ridotto PS
ü
Monoterapia nei pazienti unfit : preferire platino
ü
Radioterapia WBRT o sul torace utili per il controllo dei
sintomi
Trattamento del SCLC Avanzato in
Recidiva o Progressione Dopo I Linea
ü
II linea in caso di Platino refrattari o platinoresistenti
(recidiva entro 3 mesi dal termine della chemioterapia
con platino)
•
CAV (cisplatino/adriamicina/alcaloidi
Elevata tossicità
•
Topotecan : elevata mielotossicità
ü
Rintrodurre platino nei tumori con un lungo intervallo
libero da progressione
ü
Radioterapia a scopo palliativo
della
vinca):
MESOTELIOMA
Mesotelioma Pleurico
Tumore raro, a lungo disconosciuto fino al ‘60 quando
descritto in 33 soggetti in Sud Africa.
Prime indicazioni negli anni ’40, ma il riconoscimento
avviene nei primi anni ’60. (fino ad allora si credeva che
fosse una metastasi di un adenocarcinoma primitivo situato
altrove)
Incidenza
Tumore molto raro.
ü15 casi x milione negli uomini negli USA.
ü20 uomini 3 donne x milione in GB con rapporto 10:1
maschi e 5:1 femmine verso pleura/peritoneo
Solo negli uomini si è registrato un aumento, che conferma la
natura professionale.
E’ un tumore della pleura fortemente associato in studi
epidemiologici con storia di esposizione ad asbesto che è
dimostrabile nel 70-80% dei casi. Nei restanti casi (25%) non
è dimostrabile la causa professionale.
üIl 20% ha una asbestosi che è presente nel 50% dei mesot.
del peritoneo.
Periodo di Latenza
Incubazione 15-40 anni (mediamente 35-40); una volta
esposto …se sensibile, à tumore. La latenza minore è stata
di 14 anni!!
Nei tumori con lunga latenza, non vi è reazione del soggetto
in quanto non vi è sviluppo antigenico associato al tumore
Amianto
Definizione:
Definizione
Con il termine “AMIANTO” o “ASBESTO” si indica un gruppo
diversificato di minerali (silicati) caratterizzati da struttura
fibrosa.
I principali gruppi mineralogici-morfologici sono:
üSerpentino (crisotilo o amianto bianco)
üAnfiboli (crocidolite o amianto blu; amosite o amianto
bruno; tremolite; actinolite; antofillite).
Il primo è costituito da fibre circonvolute, di lunghezza
variabile fino a 5 cm e diametro compreso tra 0,7 e 1,5
micron; i secondi sono costituiti da fibre rigide, rettilinee di
lunghezza fino a 8 cm e diametro di 3,5-4 micron.
Amianto
Caratteristiche :
L’amianto è un materiale indistruttibile, resistente al calore, al
fuoco, all’azione di agenti chimici, allo stiramento ed
all’attrito, molto flessibile, filabile, dotato di proprietà
fonoassorbenti e termoisolanti.
Queste caratteristiche, insieme al basso costo di lavorazione,
ne hanno favorito l’impiego in diversi campi.
Amianto
Effetti Patogeni:
Patogeni
Le principali manifestazioni si presentano soprattutto a carico
dell’apparato respiratorio, e sono dovuti alla inalazione delle
fibre aerodisperse.
L’inalazione di fibre di asbesto determina, sull’apparato
respiratorio,
una
serie
di
patologie
riconducibili
principalmente a reazioni fibrose diffuse e irreversibili a
carico dell’interstizio polmonare e/o delle pleure e a
degenerazioni tumorali maligne del polmone e delle stesse
pleure.
Amianto
Effetti Patogeni:
Patogeni
Nell’ambito delle patologie amianto-correlate si riconoscono
üQuadri eziologici certi:
•
•
•
Pleuropatie
Pneumopatie
Neoplasie (Mesotelioma,Carcinoma Polmonare, e
Carcinoma Laringeo)
üQuadri eziologici per i quali la correlazione è in corso di
approfondimento:
•Carcinomi dell’apparato digerente
•Tumori del tratto urinario, dell’ovaio, cerebrali
Amianto
Genesi delle diverse patologie :
Manifestazioni dose indipendente
üPleuropatie (placche pleuriche,
ispessimenti diffusi,
versamenti recidivanti, atelettasie rotonde)
üMesotelioma
Manifestazioni dose dipendente
üPneumopatie (asbestosi)
üCarcinoma Polmonare
üCarcinoma Laringeo
Amianto
Genesi delle diverse patologie :
l’amianto, quando manipolato o sollecitato meccanicamente,
disperde nell’atmosfera una miscela di fibre, tra loro in
proporzioni non costanti, suddivisibili in grandi, medie e
ultrafini ( diametro molto inferiore a 1 micron e lunghezza
inferiore a 5 micron). Quando le fibre medie e ultrafini inalate
raggiungono gli alveoli polmonari provocano l’asbestosi ed il
carcinoma polmonare, ma soltanto le ultrafini riescono a
passare dal polmone alla pleura, ove provocano
manifestazioni benigne o, nei soggetti suscettibili, il
mesotelioma maligno.
Tali conclusioni, non
sono tuttavia state
universalmente condivise nel mondo scientifico.
ancora
Amianto
Meccanismo D’Azione
L’azione cancerogenetica sarebbe da ricondursi ad uno
stimolo della crescita del tessuto, mediato dal ruolo dei
macrofagi e del FGN, che, portando ad uno stimolo di
crescita continua, agisce da cancerogeno (mitogenesi porta
alla mutagenesi) facilitando l’insorgenza di errori di
trascrizione. L’infiammazione è un prerequisito per
l’induzione tumorale.
Amianto
Prevenzione Primaria :
Un’efficace riduzione del rischio si ottiene evitando
l’esposizione a fibre di amianto, indipendentemente dalle
dimensioni.
Già il D.P.R. 303/56 all’articolo 21 disponeva una serie di
azioni, a carico dei datori di lavoro, al fine di impedire o
ridurre lo sviluppo e la diffusione delle polveri di qualunque
specie nell’ambiente di lavoro, adottando procedimenti
lavorativi in macchinari chiusi, muniti di sistemi di aspirazione
e di raccolta delle polveri, atti ad impedirne la dispersione.
Amianto
Legge 27 marzo 1992 n.257 “Norme relative alla cessazione
dell’impiego dell’amianto”
Art.12 comma 5 “… i proprietari degli immobili devono
comunicare alle unità sanitarie locali i dati relativi alla
presenza di amianto floccato o in matrice friabile …”
(presente in intonaci, controsoffitti, guarnizioni, isolamenti
termici di tubazioni, caldaie, ecc.)
Clinica
Dolore toracico prima transitorio quindi continuo, esacerbato
da tosse.
Dispnea progressiva con ingrossamento della massa che
comprime il polmone, i vasi dell’ilo, devia il mediastino.
Frequenti metastasi a
generalmente subcliniche.
distanza
Sopravvivenza di circa 12 mesi.
(50-75%
dei
casi)
Diagnosi
Storia espositiva (durata, latenza, corpi dell’asbesto)
La diagnosi patologica non è facile, diagnosi differenziale
con
adenocarcinoma del polmone, metastasi di adenocarcinoma dell’ intestino o rene).
Toracentesi per citologia
Biopsia con ago sottile Tc guidato o a cielo aperto o per via
toracoscopia
Posizionamento di drenaggio pleurico
chimica ( diagnostica e terapeutica)
con
pleurodesi
Diagnosi Patologica
Citologia postiva in >3/4 dei casi
Immunoistochimica positiva per calretinin, WT1
(negativi negli adenocarcinoma del polmone)
Ck 5/6
Immunoistochimica negativa per CEA, TTF-1, BG8 (positivi
negli adenocarcinoma del polmone)
Presenza di depositi di asbesto
Citologia
Istologia
Mesotelioma Maligno Fibroso
Stadiazione Clinica di Neoplasia
Accertata
ü
Tac Torace con mdc: esame di I istanza
ü
RMN Torace con mdc trova giustificazioni in casi estremamente
selezionati al fine di valutare le strutture di confine (parete
toracica, diaframma, apice polmonare, mediastino )
ü
PET: nei casi potenzialmente operabili
ü
Mediastinoscopia o EBUS per FNA in caso di PET positiva sui
linfonodi mediastinici in malattia potenzialmente operabile
Malattia Limitata
stadio I-III
Malattia estesa
Stadio IV
RX Torace
TAC
TAC
Terapia Multimodale
radioterapia
neoadivante ed
adiuvante
chemioterapia
neoadiuvante ed
adiuvante
CHIRURGIA
Radioterapia
Utilità curativa limitata dalla necessità di comprendere nel
campo di applicazione svariati organi con conseguente
tossicità (soprattutto polmonare)
Non migliora la sopravvivenza
Può essere utile (60% dei casi), con adeguata dose (>40
Gy), nella palliazione del dolore ma con effetto transitorio
Potenzialmente utile nella profilassi locale parietale dopo
chirurgia radicale
Promettente la “Intensity-modulated radiation therapy”
(IMRT) che consente di distribuire la dose secondo
volumetrie concave e convesse
Chemioterapia
Il mesotelioma è stato comunemente ritenuto un tumore
resistente alla chemioterapia
Il cisplatino è il singolo farmaco più efficace
(Berghamans T, Lung
Cancer 2002)
Singoli farmaci o combinazioni di farmaci hanno
generalmente
dimostrato
risposte
<
20%
senza
miglioramento della sopravvivenza (Steele JPC, Ann Oncol 2005)
Un singolo studio di fase II ha dimostrato una % di risposta
del 48% con associazione cisplatino-gemcitabina (Byrne MJ, J
Clin Oncol 1999)
Dati incoraggianti sono emersi da due studi randomizzati con
l’impiego di farmaci antifolati in associazione con cisplatino
Pemetrexed
L’impiego di farmaci antifolati ha consentito di ottenere
miglioramenti statisticamente significativi della % di risposta
(24-41%) e della sopravvivenza
Chirurgia
La chirurgia può avere un ruolo:
üDiagnostico
üStadiativo
üPalliativo
üCurativo
Chirurgia nella Terapia
Tutti i pazienti affetti da mesotelioma, a prescindere dallo
stadio, possono beneficiare di un intervento chirurgico
MA
il ruolo della chirurgia negli stadi III e IV può essere solo
quello della palliazione del versamento pleurico
Chirurgia
3 tecniche chirurgiche adottate
ü
Pleurodesi
ü
Pleurectomia/decorticazione (P/D)
ü
Pleuropneumonectomia (EPP)
Chirurgia
Pleurodesi
La migliore tecnica è quella
toracoscopica con somministrazione
di talco (efficacia/morbidità)
Previene il versamento nell’80% dei
casi
Migliora la qualità di vita
Non condiziona la sopravvivenza
Chirurgia
Pleurectomia/decorticazione (P/D)
Rimozione di pleura parietale e
viscerale,
ev.
rimozione
di
diaframma e pericardio
Relativa bassa mortalità (1,5-5%)
Non sempre “radicale”
Limitazioni
adiuvante
per
la
radioterapia
Chirurgia
Pleuropneumonectomia (EPP)
Rimozione in blocco delle pleure e del polmone, resezione di
diaframma e pericardio con successiva loro ricostruzione
Necessità di un’adeguata riserva cardiorespiratoria
Non limita la radioterapia adiuvante
Alta morbidità (60%)
Migliore citoriduzione
P/D vs. EPP
In un un’ampia analisi storica retrospettiva di pazienti operati
per MPM con un lungo follow-up non vengono rilevate
differenze significative della sopravvivenza.
Rusch VW, Venkatraman ES. Important prognostic factors in patients with malignant pleural
mesothelioma, managed surgically. Ann Thorac Surg 1999; 68: 1799 - 1804
Stadio I-III
II Opzioni
üChirurgia
e a seguire chemioterapia
e/o radioterapia
üChemioterapia
di induzione a seguire
chirurgia e poi radioterapia
Stadio IV
Opzioni
üChemioterapia
üChirurgia
e/o radioterapia in casi
selezionati a scopo palliativo