231
CAPITOLO 11
Gemma Pelargonio
Antonio Dello Russo
Aritmie
1
Gabriele Ferrario
Gaetano A. Lanza
Per aritmia si intende qualsiasi alterazione della normale
frequenza o regolarità del battito cardiaco, ovvero della
sequenza fisiologica di conduzione dell’impulso elettrico dal nodo del seno sino ai ventricoli. Una trattazione
adeguata delle aritmie presuppone un’appropriata conoscenza dell’anatomia e della fisiologia del sistema di
conduzione elettrica del cuore.
© 2010 ELSEVIER S.R.L. Tutti i diritti riservati.
Anatomia del sistema di conduzione cardiaco
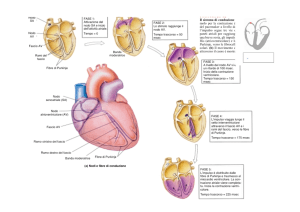
Uno schema del sistema di conduzione cardiaco è illustrato nella figura 11.1. Normalmente l’attivazione del cuore
inizia nel nodo del seno (o nodo sinusale o seno-atriale).
Il nodo del seno è una struttura allungata, delle dimensioni di 15 × 5 mm circa, situata a livello della giunzione
fra vena cava superiore e atrio destro. Esso è costituito da
almeno tre tipi di cellule, di cui quelle funzionalmente
più importanti sono le cellule P (pacemaker o segnapassi).
Queste cellule hanno la proprietà di depolarizzarsi spontaneamente a intervalli regolari.
L’impulso sorto a livello del nodo del seno si diffonde agli
atri e raggiunge il nodo atrioventricolare (AV). Sembra
peraltro ormai abbastanza dimostrata l’esistenza, a livello
atriale, di alcuni fasci, costituiti da cellule specializzate,
che connettono direttamente il nodo del seno con il nodo
AV (tratti internodali), trasportandovi l’impulso elettrico
in modo più rapido che attraverso il miocardio comune.
Di norma il nodo AV costituisce l’unica struttura che
consente la trasmissione dell’impulso elettrico dagli atri
ai ventricoli. Esso è situato alla base del setto interatriale,
a ridosso dell’anulus tricuspidale, 1-2 cm davanti al seno
coronarico, ed è costituito da cellule specializzate che conducono l’impulso elettrico in modo rallentato. Superato il
nodo AV, l’impulso prosegue verso i ventricoli attraverso il
fascio di His, le due branche, destra e sinistra, e il sistema
di Purkinje. Queste strutture sono costituite da tessuto di
conduzione specializzato, in particolare da cellule tipo
Purkinje, che, contrariamente alle cellule del nodo AV,
hanno la proprietà di condurre l’impulso elettrico molto
rapidamente. L’insieme formato dal nodo AV e dal fascio
di His viene indicato con il termine di giunzione atrioventricolare (AV).
Il fascio di His è lungo circa 15 mm; esso nasce dal bordo
antero-inferiore del nodo AV e, correndo lungo la parte
membranosa del setto interventricolare, raggiunge il setto
interventricolare muscolare. Qui si dirama in due branche.
La branca destra è un fascio sottile, ben individualizzato,
che scende lungo il lato destro della porzione muscolare
C0055.indd 231
del setto interventricolare. La branca sinistra, viceversa,
è una struttura meno organizzata e mostra anche una
spiccata variabilità individuale; poco dopo la sua origine
essa può dividersi in due principali fascicoli, il fascicolo
anteriore e il fascicolo posteriore, ma in diversi casi non
è possibile individuare suddivisioni ben definite da un
punto di vista anatomico.
Le due branche si suddividono lungo il loro decorso in
numerosi fascetti, che danno origine a una fitta rete di
fibre, il sistema di Purkinje, che si distribuisce diffusamente agli strati subendocardici dei ventricoli. Le cellule
del sistema di Purkinje sono in stretta connessione con le
cellule miocardiche contrattili degli strati subendocardici,
alle quali trasmettono alla fine l’impulso elettrico che è
alla base della loro attività meccanica. L’impulso elettrico
continua poi a trasmettersi per continuità tra le cellule
miocardiche comuni verso l’epicardio.
La funzione emodinamica del cuore si realizza in maniera ottimale solo quando la contrazione atriale e quella
ventricolare si susseguono con la sequenza che risulta
dall’ordinata trasmissione dell’impulso dal nodo del seno ai ventricoli attraverso il tessuto atriale, il nodo AV,
il fascio di His, le branche e la rete di Purkinje. A questo
proposito va osservato che il ritardo che l’impulso subisce nel nodo AV fa sì che la contrazione dei ventricoli avvenga qualche tempo dopo quella degli atri; ciò
consente che la sistole atriale partecipi efficacemente al
riempimento diastolico, ottimizzando la gittata sistolica
dei ventricoli.
È importante ricordare che il nodo del seno viene irrorato
da un’arteria che prende origine, in circa la metà dei casi,
dall’arteria coronaria destra e, nell’altra metà, dall’arteria
circonflessa dell’arteria coronaria sinistra, mentre il nodo
AV è irrorato nel 90% dei casi dall’arteria discendente posteriore sinistra, che origina dall’arteria coronaria destra.
Il fascio di His e le branche sono irrorati per lo più da vari
rami dell’arteria coronaria sinistra.
Elettrofisiologia delle cellule miocardiche
Il potenziale di azione
Come detto, il normale ciclo cardiaco prende origine dalla
spontanea insorgenza dell’eccitazione nel nodo del seno;
da qui l’eccitazione si propaga a tutto il miocardio. Sia la
formazione sia la propagazione degli impulsi derivano da
alcune proprietà elettriche delle cellule miocardiche, che
possono essere ben comprese analizzando il loro potenziale di azione. Con questo termine si intende la curva
6/9/10 9:48:09 AM
232
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Destra
Sinistra
TI
NS
FAS
BS
TI
BD
TI
Figura 11.1
Schema del
sistema di
conduzione
dell’impulso
elettrico del
cuore, visto dalla
parte destra e
sinistra del setto
interatriale e
interventricolare.
TI
BS
NAV
H
FPS
FP
FP
A sinistra si notano il nodo del seno (NS), i tratti internodali (TI), il nodo AV (NAV), il fascio di His (H) e la branca destra (BD) con le fibre di Purkinje (FP). A destra è messa in evidenza la
branca sinistra (BS) con i suoi due fascicoli, anteriore (FAS) e posteriore (FPS), e la rete di Purkinje. È da notare la differente struttura delle due branche.
che descrive le variazioni del potenziale elettrico di una
cellula in risposta a uno stimolo esterno.
Il potenziale di azione cardiaco presenta cinque fasi
(Fig. 11.2), che si verificano per una ben definita serie di variazioni di flussi ionici attraverso la membrana della cellula
in seguito alla sua stimolazione. I flussi ionici possono avvenire attraverso la membrana cellulare grazie alla presenza
di canali situati lungo la sua superficie; questi canali sono
Voltaggio transmembrana (mV)
50
VNG
1
0
0
-50
Soglia
2
3
Soglia
Figura 11.2
4
4
(a) Potenziale
VK
-100
di azione
delle cellule
miocardiche. (b)
0
100
200
300
400
500
Movimenti degli a
Tempo (ms)
ioni attraverso
la membrana
0 1
2
3
4
4
cellulare relativi
+
+
+
+
Esterno Na
K
K
K
Na+
alle varie fasi
del potenziale
m
Membrana
h
di azione; sono
evidenziate le
Interno K+
Na+ ClNa+Ca2+
Ca2+ No+
K+
variazioni dello
stato dei canali
Canali del Na+
Pompa Na+ -K+
degli ioni Na+. b
C0055.indd 232
specifici per un determinato ione e sono prevalentemente
formati da proteine che, a seconda della conformazione che
assumono, aprono o chiudono il canale, consentendo o impedendo, rispettivamente, il passaggio dello ione specifico.
Quando il canale è in posizione di apertura, lo ione può fluire liberamente attraverso la membrana in base al gradiente
elettrochimico presente ai due lati della membrana stessa (la
conduttanza elettrica della membrana per quello ione è cioè
elevata); quando il canale è invece chiuso, lo ione non può
passare attraverso la membrana (la conduttanza elettrica
della membrana per quello ione è cioè nulla). Quando un
canale è aperto, il flusso dello ione e la sua concentrazione
finale ai due lati della membrana dipenderanno sia dalla
differenza delle sue concentrazioni (gradiente chimico) sia,
anche, dalla differenza di potenziale presente ai due lati
della membrana (gradiente elettrico). Come si vedrà, i canali
ionici che intervengono nel determinare la tipica sequenza
del ciclo elettrico della cellula cardiaca (cioè il potenziale di
azione) sono canali per gli ioni sodio (Na+), gli ioni calcio
(Ca2+), gli ioni potassio (K+) e, in piccola parte, per gli ioni
cloro (Cl−) (si veda Fig. 11.2). È da notare che per uno stesso
ione possono esistere più tipi di canali, attivabili o disattivabili in momenti e per condizioni differenti.
In stato di riposo, cioè durante la diastole, le cellule miocardiche non sono elettricamente neutre, ma presentano
uno stato di polarizzazione. Il loro interno, infatti, ha
un potenziale elettrico negativo, cioè inferiore rispetto a
quello che esiste sulla superficie esterna della membrana
cellulare (e nei tessuti circostanti). Il valore di questo potenziale delle cellule miocardiche (a parte quelle del nodo
del seno e del nodo AV) è di circa − 80/ − 90 mV. Questo
potenziale transmembrana a riposo dipende dal fatto che,
in questa fase, la cellula è dotata di un patrimonio di ioni
negativi che è leggermente maggiore del patrimonio di
6/9/10 9:48:09 AM
Capitolo 11 - ARITMIE
ioni positivi. Il contrario si verifica nel liquido extracellulare che circonda le cellule, il quale contiene un leggero
eccesso di cariche positive.
Questa situazione dipende dal fatto che, a riposo, la membrana delle cellule miocardiche è in pratica impermeabile
a molti ioni che non possono quindi fluire liberamente
attraverso di essa per raggiungere un equilibrio sulla base
delle loro differenze di concentrazione e di potenziale ai
due lati della membrana stessa.
Per esempio, nelle cellule vi è una concentrazione di K+ 30
volte superiore a quella presente all’esterno delle cellule;
la concentrazione di Na+ e di Ca2+ è, rispettivamente, 15 e
10.000 volte inferiore a quella esterna. Queste differenze
rientrano nella fisiologica diversa composizione dell’ambiente cellulare rispetto ai liquidi extracellulari.
In effetti, tuttavia, a riposo la membrana delle cellule
miocardiche è permeabile agli ioni K+ (cioè, alcuni canali del K+ sono aperti). Ne consegue che il potenziale
di membrana che esse presentano dipende sostanzialmente dall’equilibrio raggiunto dal K+ ai due lati della
membrana, sulla base del suo gradiente elettrochimico. Si
osservi come, potendosi muovere liberamente attraverso
la membrana, il K+ sarà, da un lato, portato a fuoriuscire
dalla cellula sulla base della differenza di concentrazione
(come visto, molto maggiore all’interno della cellula), ma
sarà, dall’altro lato, portato a entrare nella cellula sulla
base del gradiente elettrico (essendo l’interno della cellula
carico negativamente). L’equilibrio raggiunto dal K+ sulla
base di questi due opposti flussi determinerà il potenziale
della cellula, che si può prevedere matematicamente sulla
base dell’equazione di Nernst:
Em = RT/zF × InPao/Pai
dove Em è il potenziale di membrana, R la costante dei gas,
T la temperatura assoluta, z la valenza ionica, F la costante
di Faraday, P la permeabilità allo ione, ao e ai le attività
(concentrazioni) dello ione all’esterno e all’interno della
membrana.
Come detto, nelle cellule del miocardio comune, atriale
e ventricolare e in buona parte delle cellule costituenti il
tessuto di conduzione (in particolare le fibre di Purkinje), questo potenziale transmembrana a riposo è di circa
− 80/ − 90 mV e, cosa importante, è di per sé stabile.
Se una cellula, però, viene stimolata elettricamente, si
verifica un’improvvisa e rapida inversione del potenziale
di membrana; in pochissimi millisecondi da negativo l’interno della cellula diviene carico positivamente, arrivando
a un potenziale di + 20 mV o più. Questa rapida inversione
del potenziale della cellula (overshoot) prende il nome di
depolarizzazione e corrisponde alla fase 0 del potenziale
di azione. Essa è dovuta all’improvvisa apertura dei canali
rapidi di Na+ della membrana cellulare determinata dalla
stimolazione elettrica (si veda Fig. 11.2). Attraverso questi
canali una certa quantità di ioni Na+ entra velocemente
nella cellula trasportando cariche positive, che diventano predominanti. È importante notare che, per poter
innescare la depolarizzazione, lo stimolo elettrico deve
essere sufficientemente intenso da causare l’apertura di
un numero di canali adeguato a determinare l’ingresso
di una quantità di Na+ sufficiente a far raggiungere un
potenziale-soglia (intorno a − 60 mV) perché si inneschi
C0055.indd 233
il processo completo di depolarizzazione. Se lo stimolo è
debole, si aprono solo pochi canali e le poche cariche di
Na+ che riescono a entrare possono essere insufficienti
a far raggiungere il potenziale-soglia. In questo caso si
osserva solo un piccolo, transitorio aumento del potenziale di membrana, senza che si inneschi il processo di
depolarizzazione.
Dopo l’inversione del potenziale di membrana si osserva
una fase di lieve riduzione del potenziale stesso (fase 1 del
potenziale di azione) seguita da una fase in cui il potenziale rimane positivo e su livelli piuttosto stabili per un
certo periodo di tempo (fase 2 o plateau del potenziale
di azione). Questi fenomeni si verificano perché, mentre
i canali del Na+ si chiudono rapidamente dopo la depolarizzazione, bloccando l’ulteriore flusso di questo ione,
l’inversione del potenziale avvenuta con la fase 0 causa
l’apertura di un altro tipo di canali del K+, di canali del Cl−
e, cosa importante, di canali “lenti” del Ca2+. L’apertura
dei primi e dei secondi (questa di breve durata) permette,
rispettivamente, un flusso di K+ verso l’esterno e un lieve,
transitorio flusso di Cl− nella cellula, spiegando la lieve
caduta del potenziale della fase 1. L’apertura dei canali
del Ca2+ causa invece un lento ma prolungato flusso di
questo ione nella cellula, portandovi cariche positive;
l’afflusso di Ca2+ in questa fase viene controbilanciato da
un continuo efflusso di K+ (che può muoversi all’esterno
anche per un vantaggioso gradiente elettrico); ne risulta
che il potenziale intracellulare rimane stabile e su valori
intorno allo 0 o poco superiori per un certo tempo.
Dopo un certo periodo, il potenziale di membrana torna
in modo relativamente rapido a negativizzarsi, riportandosi sui valori che esso aveva a riposo. Questa fase è detta
di ripolarizzazione cellulare o fase 3 del potenziale di
azione. Essa è dovuta all’apertura di un altro tipo di canali
del K+ (mentre i canali del Ca2+ si chiudono), che causa un
aumento piuttosto rapido del flusso di K+ all’esterno.
Alla fine della fase 3, la cellula è tornata alla sua condizione di base e rimane in una condizione stabile, con il
potenziale di membrana negativo (fase 4 del potenziale
di azione), finché non viene eccitata di nuovo. Durante la
fase 4, la cellula provvede a ripristinare la composizione
qualitativa e quantitativa del patrimonio ionico intracellulare basale, espellendo in particolare gli ioni Na+ e Ca2+
entrati nella cellula con la depolarizzazione, e riportando
all’interno della cellula ioni K+. Queste attività sono in
larga parte svolte da pompe ioniche di membrana, che,
lavorando contro gradienti elettrochimici, richiedono
energia. Ciò è importante da sottolineare, in quanto un
ridotto apporto di ossigeno al miocardio può essere causa
di una compromissione della funzione di queste pompe
ioniche che finisce con l’alterare il normale bilancio elettrolitico delle cellule, predisponendo, così, allo sviluppo di
aritmie. Tra le pompe, una delle più importanti è proprio
la pompa Na+-K+, che determina l’espulsione di tre ioni
Na+ per ogni due ioni K+ che essa riporta nella cellula (si
veda Fig. 11.2).
233
1
Proprietà elettrofisiologiche delle cellule
Le cellule miocardiche possono essere suddivise in due
tipi fondamentali: le cellule del miocardio comune o “da
lavoro” (atriali e ventricolari), il cui compito fondamentale è garantire la portata cardiaca con la contrazione e
6/9/10 9:48:10 AM
234
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
le cellule specializzate del sistema di conduzione, che,
come visto, hanno il compito di garantire una corretta
trasmissione dell’impulso elettrico a tutto il miocardio.
Entrambi i tipi di cellule sono caratterizzati da tre proprietà elettriche: l’eccitabilità, la conducibilità e la refrattarietà. Inoltre, alcune cellule del sistema di conduzione
(le cellule pacemaker) hanno una quarta proprietà, che
è l’automatismo.
Eccitabilità Con questo termine si intende l’attitudine di una cellula miocardica a rispondere a uno stimolo
elettrico depolarizzandosi e sviluppando un potenziale di
azione, come descritto in precedenza.
Conducibilità Per conducibilità si intende la capacità
delle cellule di trasmettere l’eccitazione (quindi la depolarizzazione) alle cellule vicine. Questa trasmissione
avviene perché la cellula depolarizzata rimane priva di
cariche elettriche positive in superficie; questo “vuoto”
di cariche positive attrae le cariche elettriche positive che
tappezzano la faccia esterna della membrana delle cellule
vicine. In conseguenza, il potenziale transmembrana di tali
cellule diventa minore di –90 mV e, quando raggiunge il
potenziale-soglia, le cellule si eccitano a loro volta. La conducibilità di una cellula miocardica è maggiore o minore
a seconda della velocità con cui essa trasmette l’impulso
alle cellule circostanti e in funzione della velocità con cui
la cellula si depolarizza.
Infatti, se la fase 0 di una cellula è molto ripida, essa causa
una rapida sottrazione di cariche elettriche positive dalla
superficie delle cellule vicine, che vengono quindi fatte
eccitare in poco tempo. Se, viceversa, la fase 0 è poco
ripida, la sottrazione di cariche elettriche positive dalla
superficie delle cellule avverrà più lentamente e la propagazione dello stimolo sarà rallentata.
La capacità intrinseca di eccitazione e di conducibilità di
una cellula dipende, in particolare, da una diversa composizione in canali ionici delle membrane cellulari, essendo
tanto maggiore quanto più la cellula è ricca di canali rapidi del Na+, e viceversa. Così, nel nodo AV, in cui buona
parte delle cellule non ha o ha pochi canali per il Na+ e
la depolarizzazione è mediata essenzialmente da canali
lenti del Ca2+ (si veda oltre, Automatismo), la velocità di
conduzione è lenta (circa 200 mm/sec); nel fascio di His,
nelle branche e nella rete di Purkinje, viceversa, dove le
cellule tipo Purkinje hanno numerosi canali del Na+, la
conduzione è molto rapida (circa 4000 mm/sec), mentre
nei ventricoli è intermedia (400 mm/sec).
Refrattarietà Il termine refrattarietà indica la condizione in cui una cellula miocardica non è eccitabile come di
norma dopo la depolarizzazione. Il periodo di refrattarietà
si divide in due parti. In un primo periodo la cellula non
è eccitabile da parte di alcuno stimolo (periodo refrattario
Figura 11.3
Potenziale di
azione del nodo
del seno.
o
Soglia
Si può notare l’instabilità della fase 4, la lenta ascesa della fase 0 e l’assenza del plateau.
Cellule pacemaker di altri centri automatici (come nel nodo AV) hanno un potenziale di
azione simile a quello del nodo del seno, ma con pendenza della fase 4 meno ripida.
C0055.indd 234
assoluto o effettivo); in un secondo periodo la cellula è
rieccitabile ma la sua risposta è anomala (periodo refrattario relativo). Il periodo refrattario assoluto corrisponde
alle fasi 0, 1 e 2 del potenziale di azione, quando la cellula,
essendo totalmente depolarizzata, non può ovviamente
essere eccitata; il periodo refrattario relativo corrisponde
alla fase 3 del potenziale di azione, quando la cellula sta
recuperando lo stato di polarizzazione di riposo, per cui
si può riuscire a rieccitarla, ma la velocità di rieccitazione
è più lenta e fornisce un potenziale di azione anomalo.
Come conseguenza, anche la conducibilità dell’impulso
da parte della cellula sarà minore.
Trasferiti al cuore in toto, questi principi indicano che se
una parte di miocardio (per esempio, i ventricoli) è stata
eccitata da un primo stimolo, essa può essere rieccitata da
un secondo stimolo solo se è trascorso un certo tempo.
In particolare, se il secondo stimolo segue il primo dopo
un intervallo di tempo molto breve, il miocardio può
essere ancora in periodo refrattario assoluto e, quindi,
non rispondere per niente; se il secondo stimolo segue il
primo dopo un intervallo di tempo più lungo, quando il
miocardio è in periodo refrattario relativo, quest’ultimo
può eccitarsi, ma lentamente; se il secondo stimolo segue
il primo quando il miocardio ha recuperato completamente, quest’ultimo si rieccita normalmente. Nel primo caso
la velocità di conduzione dell’eccitazione nell’ambito del
miocardio considerato è zero, nel secondo caso è rallentata rispetto alla norma, nel terzo caso è normale.
Automatismo Come si è detto, l’automatismo è caratteristica esclusiva delle cellule pacemaker. Con esso si intende la capacità che queste cellule hanno di autoeccitarsi,
al contrario di tutte le altre cellule miocardiche, che si
eccitano solo se ricevono uno stimolo dall’esterno.
Questa capacità deriva dal fatto che, in queste cellule, il
potenziale transmembrana a riposo non è stabile. Esso,
viceversa, tende a ridursi spontaneamente e progressivamente con il tempo, per cui, quando raggiunge un
potenziale-soglia, si innesca il potenziale di azione e la
cellula si depolarizza (Fig. 11.3).
Nel cuore umano vi sono diversi centri con cellule che
hanno proprietà di pacemaker: nel nodo del seno, anzitutto, ma anche negli atri (in particolare vicino al nodo AV e
lungo le presunte vie internodali), nel nodo AV, nel fascio
di His e nelle vie del sistema di conduzione intraventricolare, fino al sistema di Purkinje. Inoltre, cellule miocardiche,
soprattutto del tessuto di conduzione, che non hanno
normalmente proprietà di automatismo possono acquisirle
in condizioni patologiche (per esempio, ischemia).
La capacità di autodepolarizzazione (la frequenza, cioè,
con cui le cellule pacemaker si attivano) è diversa tra i vari
centri automatici del cuore. Ciò dipende dal fatto che la
rapidità con cui avviene la depolarizzazione spontanea
durante la fase 4 è diversa nelle diverse cellule pacemaker. Più la variazione è rapida, maggiore è la frequenza
di attivazione e di scarica del pacemaker. La pendenza
della variazione del potenziale è maggiore nelle cellule
del nodo del seno, è intermedia nelle cellule del nodo AV
e minore nei pacemaker ventricolari. Così, la frequenza
di attivazione è, in media, circa 70 bpm per il nodo del
seno, circa 50 per la giunzione AV, ma solo 30 o meno per
le fibre di Purkinje.
6/9/10 9:48:10 AM
Capitolo 11 - ARITMIE
Poiché il nodo del seno ha la frequenza di autodepolarizzazione maggiore, è questo che guida, in condizioni
normali, il ritmo del cuore (segnapassi primario). Infatti,
le cellule degli altri pacemaker cardiaci (pacemaker secondari, o sussidiari, o latenti) vengono a ogni battito eccitate
dall’impulso sinusale prima che possano raggiungere il
loro potenziale-soglia. Se per ragioni patologiche (o anche
fisiologiche) il nodo del seno riduce marcatamente la sua
frequenza, il centro automatico che si trova ad avere in
quel momento la maggiore capacità di autodepolarizzazione prende il comando del ritmo cardiaco.
È da notare che nelle cellule pacemaker non vi sono canali
veloci, ma solo un tipo di canale lento per gli ioni Na+.
Nel momento in cui viene raggiunto il potenziale-soglia,
si aprono i canali lenti del Ca2+, che sono in questo caso
i responsabili della depolarizzazione cellulare; essendo
però l’ingresso di questi ioni piuttosto lento, la fase 0 del
potenziale di azione non è verticale, ma obliqua. Il potenziale cellulare, inoltre, oltrepassa di poco il valore 0 e
manca la fase 1 del potenziale di azione. Anche la fase 2 è
breve, e la 3 è più graduale e prolungata. La fase 4, infine,
è caratterizzata dal fatto che il potenziale transmembrana
non si mantiene, ma, da un valore massimo iniziale, si
riduce lentamente, fino ad arrivare al potenziale-soglia
(si veda Fig. 11.3).
Il motivo per cui le cellule pacemaker vanno incontro ad
autodepolarizzazione è dovuto al fatto che la membrana
cellulare in fase di riposo (diastolica) non è totalmente
impermeabile agli ioni Na+ e, probabilmente, agli ioni
Ca2+ (alcuni canali, cioè, sono aperti), per cui ioni Na+ e
Ca2+ possono entrare lentamente nelle cellule riducendo
progressivamente il potenziale sino a quello soglia. Il
canale responsabile della depolarizzazione della cellula,
e quindi dell’automaticità, è un tetramero denominato
HCN attraverso cui passa una corrente detta If.
La pendenza della fase 4 del nodo del seno può essere
modificata da vari fattori (meccanici, chimici), ma è soprattutto influenzata fisiologicamente dall’attività del
sistema nervoso autonomo. L’attività simpatica, infatti,
aumenta la pendenza, causando così un aumento della
frequenza di scarica del nodo (e quindi della frequenza
cardiaca), mentre il sistema parasimpatico (vago) riduce la
pendenza, causando così una riduzione della frequenza di
scarica del nodo (e quindi della frequenza cardiaca).
questione, in caso di ricorrenza, può mettere a rischio la
vita del paziente o gravare pesantemente sulla sua qualità di vita, per cui necessita di un’attenzione terapeutica
adeguata; (3) infine, bisogna chiarire se il paziente ha
una patologia cardiaca organica di base e, comunque, il
contesto clinico in cui l’aritmia si verifica, in quanto ciò
può condizionare il significato prognostico dell’aritmia
stessa e il suo trattamento.
Le varie forme di bradiaritmia e tachiaritmia presentano
caratteristiche elettrofisiologiche, cliniche e terapeutiche peculiari, che saranno trattate nei relativi paragrafi.
Tuttavia, conseguenze fisiopatologiche, manifestazioni
cliniche e indagini diagnostiche sono spesso comuni a
varie aritmie, per cui si ritiene utile discutere questi argomenti in generale prima di trattare le singole anomalie
del ritmo cardiaco.
1
Conseguenze fisiopatologiche delle aritmie
Le aritmie possono interferire con la corretta funzione del
cuore attraverso alcuni possibili effetti conseguenti a: (1)
variazioni della frequenza cardiaca; (2) perdita della contrazione atriale; (3) variazioni del consumo miocardico di
ossigeno e del flusso coronarico; (4) alterato sincronismo
della contrazione ventricolare.
Inquadramento delle aritmie
Conseguenze delle variazioni della frequenza cardiaca In condizioni normali il cuore mantiene costante
la portata cardiaca (quantità che il sangue espelle in un
minuto) anche con ampie variazioni della frequenza (da
circa 40 a circa 160 bpm). Ciò è possibile perché il cuore
normale varia adeguatamente la quantità di sangue espulsa a ogni sistole (gittata sistolica): la aumenta in caso di
bradicardia e la riduce in caso di tachicardia.
Quando vi è una disfunzione del miocardio, il cuore può
non riuscire a incrementare adeguatamente la gittata sistolica in corso di bradicardia e, nella situazione opposta, può
ridurre eccessivamente la gittata sistolica in corso di tachicardia. In entrambi i casi la prestazione di pompa del cuore
può essere compromessa e la portata cardiaca diminuire.
In alcuni casi, inoltre, una tachiaritmia improvvisa, che
determina un’elevata frequenza ventricolare può di per
sé determinare una secondaria depressione della contrattilità miocardica (tachimiocardiopatia), con conseguente
insufficienza contrattile. Tipicamente, questa forma di
disfunzione miocardica è reversibile e si risolve con la
normalizzazione della frequenza.
Le aritmie vengono suddivise clinicamente in due grandi
gruppi, le bradiaritmie (dette anche aritmie ipocinetiche)
e le tachiaritmie (dette anche aritmie ipercinetiche). Le
prime sono caratterizzate da una riduzione della frequenza
cardiaca, mentre le seconde sono caratterizzate da una
frequenza cardiaca elevata.
Dal punto di vista clinico vi sono tre punti fondamentali
che, di fronte a un’aritmia, è necessario chiarire: (1) bisogna stabilire se, in quel momento, essa è pericolosa per
la vita del paziente, per cui va trattata immediatamente
(per esempio, una tachicardia ventricolare o un blocco
AV completo), oppure può essere risolta con calma (per
esempio, una tachicardia parossistica sopraventricolare)
o non necessita di alcun trattamento (per esempio, semplici extrasistoli); (2) bisogna poi chiedersi se l’aritmia in
Conseguenze della perdita della contrazione atriale Normalmente gli atri completano il riempimento
diastolico dei ventricoli. In alcune aritmie l’attivazione
atriale è assente o inefficace (per esempio, nella fibrillazione atriale). In altre aritmie (per esempio, alcuni blocchi
AV, ritmi giunzionali, tachicardie parossistiche sopraventricolari, tachicardie ventricolari) la sistole atriale è
presente, ma non ha un effetto emodinamicamente utile
perché non coordinata con quella ventricolare. Nel cuore
normale la perdita della contrazione atriale comporta, in
condizioni di riposo, solo un modesto effetto emodinamico. Durante l’esercizio fisico o in presenza di un’alterata
funzione contrattile, tuttavia, la perdita della normale
sistole atriale può comportare una significativa riduzione
della gittata sistolica. La sistole atriale è particolarmente
C0055.indd 235
235
6/9/10 9:48:10 AM
236
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
importante ai fini di un adeguato riempimento ventricolare nelle condizioni caratterizzate da ipertrofia del
ventricolo sinistro. Infatti, quando il ventricolo sinistro
è ipertrofico (come nella stenosi aortica, nell’ipertensione
arteriosa e nella miocardiopatia ipertrofica), la distensibilità ventricolare sinistra è compromessa; ciò determina un
ostacolo al riempimento protodiastolico ventricolare, per
cui il riempimento globale ventricolare può dipendere, in
buona parte, dalla validità della sistole atriale.
Conseguenze delle variazioni del consumo miocardico di
ossigeno e del flusso coronarico La frequenza cardiaca è
uno dei determinanti principali del consumo miocardico
di ossigeno. Infatti, un raddoppio della frequenza cardiaca
raddoppia il consumo di ossigeno.
La frequenza cardiaca, inoltre, condiziona il flusso coronarico e, quindi, l’apporto di ossigeno al miocardio. Il
flusso coronarico, infatti, avviene pressoché interamente
durante la diastole, essendo ostacolato, durante la sistole,
dall’elevata pressione intramiocardica che si sviluppa con
la contrazione, che occlude di fatto i vasi intramiocardici.
La diastole è più lunga in corso di bradicardia ed è più breve in corso di tachicardia. Pertanto, in presenza di stenosi
coronariche, l’improvvisa comparsa di una tachiaritmia
può causare ischemia, in quanto determina sia un aumento del consumo miocardico di ossigeno sia una riduzione
della perfusione miocardica causata da una riduzione
del periodo diastolico (si veda il Capitolo 5). Inoltre, in
presenza di stenosi coronariche, l’ipotensione causata da
tachiaritmie o bradiaritmie gravi può causare ischemia
miocardica in conseguenza della riduzione della pressione
di perfusione.
Conseguenze della desincronizzazione della contrazione
ventricolare La funzione ottimale del ventricolo dipende
in buona parte anche da un’ottimale sequenza di attivazione, e quindi di contrazione, del miocardio ventricolare. Alcune aritmie comportano un’alterazione di questa
sequenza fisiologica di attivazione, determinando un
desincronizzazione della contrazione ventricolare.
Esempi di questa desincronizzazione sono l’extrasistolia
ventricolare, la tachicardia ventricolare, le tachiaritmie
sopraventricolari con conduzione aberrante, o anche il
semplice sviluppo di un blocco di branca, soprattutto
sinistra. In cuori strutturalmente normali la perdita della
sincronizzazione della contrazione ventricolare non ha in
genere ripercussioni significative sulla funzione meccanica
cardiaca. Tuttavia, una contrazione asincrona può avere
effetti particolarmente importanti quando si instaura in
soggetti con grave disfunzione ventricolare sinistra.
Il caso estremo di perdita della sincronia di contrazione
ventricolare è rappresentato dalla fibrillazione ventricolare, in cui l’attivazione dei ventricoli è del tutto scompaginata e caotica, per cui l’attività contrattile è del tutto
assente (arresto cardiaco).
Manifestazioni cliniche
In generale, i sintomi che più frequentemente sono determinati dalle aritmie sono legati alla percezione di anomalie
del battito cardiaco. La presenza di semplici extrasistoli
(sia sopraventricolari sia ventricolari) può essere percepita
come sensazione di un battito mancante (per la pausa
C0055.indd 236
post-extrasistolica) o come un battito “forte” (dovuto alla
maggiore gittata sistolica del battito post-extrasistolico) o
anche come un “tonfo al cuore” o un senso di “sfarfallio”
intratoracico (quando le extrasistoli sono frequenti o in
brevi episodi di tachicardia). Nelle tachicardie parossistiche
sopraventricolari, che talora si sbloccano con stimoli che
attivano il vago, come colpi di tosse, manovra di Valsalva,
interruzione brusca di uno sforzo, il sintomo dominante è
in genere legato alla percezione del cuore che batte velocemente (cardiopalmo). In caso di fibrillazione atriale, oltre
che tachicardia, il paziente può apprezzare una totale irregolarità dei battiti, con pause di durata variabile. Anche una
tachicardia ventricolare sostenuta è spesso semplicemente
percepita come un ritmo veloce del cuore. Le bradiaritmie
significative, d’altro canto, possono dar luogo a sensazioni
di battiti “lenti” o “mancanti” e talora “forti”.
Sebbene di solito le aritmie consentano una buona portata
cardiaca, le tachiaritmie a frequenza molto alta (soprattutto tachicardia ventricolare e fibrillazione/flutter atriale)
e le bradiaritmie marcate possono causare una riduzione
improvvisa della portata cardiaca, con grave ipotensione e
conseguente ischemia cerebrale, che possono determinare
lipotimia o sincope. La riduzione della portata cardiaca
può anche accompagnarsi a segni di scompenso retrogrado
(dispnea) e anterogrado (pallore, confusione mentale, sudorazione) fino allo shock cardiogeno. Queste conseguenze
emodinamiche possono verificarsi più facilmente in pazienti con funzione contrattile miocardica depressa. In pazienti
con malattia aterosclerotica ostruttiva del circolo coronarico, sia tachiaritmie sia bradiaritmie possono compromettere
la perfusione coronarica causando angina pectoris.
Esami strumentali
Elettrocardiogramma (ECG) L’ECG consente in genere la corretta diagnosi di un’aritmia quando questa
è presente al momento della registrazione del tracciato. In alcuni casi, comunque, una tachiaritmia registrata durante un ECG standard può rimanere di dubbia
origine. In questi casi, l’uso di derivazioni particolari,
l’attuazione di alcune manovre e/o l’uso di farmaci possono aiutare a chiarire la diagnosi. In molti casi, tuttavia, i pazienti ricorrono al medico per sintomi potenzialmente riferibili ad aritmie, ma di cui non si riesce
ad avere documentazione durante la breve registrazione
di un ECG standard. In questi casi è necessario ricorrere ad
altri mezzi diagnostici per cercare di documentare eventuali
aritmie.
ECG dinamico secondo Holter Dopo l’ECG standard,
il monitoraggio ECG secondo Holter è, in genere, il primo passo nella diagnostica strumentale delle aritmie.
Esso è un esame che consente la registrazione continua
dell’ECG, in genere per 24-48 ore, sulla memoria di un
piccolo registratore al quale il paziente è collegato durante
tutte le sue normali attività giornaliere. L’ECG Holter può
quindi catturare gli eventi aritmici di cui un paziente soffre transitoriamente, e consentire una valutazione della
corrispondenza tra i sintomi del paziente ed eventuali
fenomeni aritmici; tuttavia, poiché l’esame è limitato nel
tempo, la probabilità di documentare l’aritmia è sufficientemente elevata solo quando i sintomi e/o le aritmie sono
abbastanza frequenti.
6/9/10 9:48:10 AM
Capitolo 11 - ARITMIE
Registratori di eventi e loop recorder In diversi casi le
aritmie si verificano solo occasionalmente, per cui l’ECG
Holter, anche ripetuto, non riesce a evidenziarle. Esistono
perciò registratori dell’ECG di cui il paziente può essere
munito per settimane o mesi, che hanno più probabilità di documentare l’eventuale aritmia quando essa si
verifichi.
Alcuni di questi registratori possono essere attivati dal
paziente (o anche da un suo familiare) nel momento in cui
avverte i sintomi, in modo da catturare l’eventuale anomalia del ritmo che ne è responsabile. Essendo attivati solo in
caso di sintomi, essi sono detti registratori di eventi.
In caso di sincope, tuttavia, il paziente non è in grado
di attivare il registratore, se non al suo risveglio, per cui
l’evento aritmico potrebbe non essere memorizzato. Per
tale motivo sono stati ideati registratori a memoria ciclica,
o “loop recorder”, i quali registrano di continuo il ritmo
del paziente, tenendo in memoria sempre gli ultimi 20-30
minuti dell’ECG; in questo caso, anche se ha una perdita
transitoria della coscienza, il paziente può, al risveglio,
attivare il salvataggio sulla memoria del registratore degli ultimi 20-30 minuti del suo ritmo, che comprenderà
anche il periodo dell’evento sincopale, consentendo così
l’individuazione dell’eventuale aritmia. Alcuni di questi
registratori hanno anche una capacità di analisi del ritmo
e di tenere in memoria eventuali eventi aritmici asintomatici occorsi in un dato periodo.
Alcuni di questi registratori sono molto piccoli e vengono impiantati sottocute, consentendo un monitoraggio
ECG continuo per circa 2 anni; essi possono analizzare e
memorizzare eventi aritmici e sono interrogabili dall’esterno. Esistono anche piccoli registratori portatili esterni,
analoghi a registratori ECG Holter, che presentano queste
caratteristiche; essi evitano l’incisione cutanea necessaria
con l’uso di registratori impiantabili, ma necessitano di
un collegamento al paziente tramite elettrodi cutanei,
che, alla lunga, possono presentare problemi nella registrazione del segnale.
ECG da sforzo In alcuni casi, nell’iter diagnostico delle
aritmie è utile l’esecuzione di un ECG da sforzo. Alcune
aritmie, infatti, si innescano più facilmente in condizioni
di aumentata attività adrenergica, quali sforzi, attività
sportive o stati emotivi. Inoltre, questo test può dare informazioni utili sul significato clinico di alcune aritmie
(per esempio, extrasistoli ventricolari frequenti di base che
sono soppresse dallo sforzo hanno, in genere, un carattere
benigno), oltre che sull’eventuale relazione tra aritmie e
comparsa di ischemia miocardica.
Tilt test Il tilt test consiste nel porre e mantenere il paziente in posizione semiortostatica (a 60-70°), mediante
un apposito lettino, per 30-40 min, valutando la risposta della pressione arteriosa e della frequenza cardiaca
(mediante monitoraggio continuo dell’ECG). In soggetti predisposti questa situazione porta a un’attivazione
del sistema nervoso vagale associata a ipotensione e/o
bradiaritmie. È quindi indicato per valutare l’eventuale
origine neurovegetativa di episodi sincopali, consentendo
anche di individuare la natura vasodepressiva (sviluppo
di marcata ipotensione) e/o cardioinibitoria (sviluppo di
marcate bradiaritmie) degli episodi stessi. Per aumentare
C0055.indd 237
la sensibilità del test, si possono somministrare nella parte
finale dell’esame, quando esso è fino a quel momento
negativo, farmaci in grado di potenziare la stimolazione
vagale riflessa (come isoproterenolo o nitrati).
Studio elettrofisiologico transesofageo Lo studio elettrofisiologico (SEF) transesofageo si esegue introducendo per
via orale o nasale un sondino sottile che contiene, nella
parte finale, alcuni piccoli elettrodi e viene fatto avanzare
in esofago sino a portarsi a ridosso della parete posteriore
dell’atrio sinistro. Il sondino consente sia la registrazione
dell’attività elettrica cardiaca (mediante collegamento
esterno a un elettrocardiografo standard) sia la stimolazione degli atri. Il sondino può essere collegato, infatti,
a un pacemaker artificiale esterno, i cui impulsi elettrici
sono in grado di stimolare gli atri.
Il SEF transesofageo può, in alcuni casi, essere utilizzato al
posto del SEF intracavitario per studiare la funzione del nodo seno-atriale e del nodo AV. La stimolazione atriale può,
inoltre, essere utilizzata per valutare l’inducibilità di tachiaritmie sopraventricolari (tachicardia parossistica, flutter,
fibrillazione atriale), in particolare in età pediatrica, nella
quale è preferito per la diagnosi e la guida alla terapia farmacologica delle aritmie sopraventricolari come metodica
meno invasiva rispetto al SEF intracavitario. Consentendo
di evidenziare bene l’attività atriale, la registrazione di una
derivazione mediante catetere esofageo può, infine, essere
utile per la diagnosi differenziale delle tachiaritmie (in particolare per distinguere una tachicardia ventricolare da una
tachicardia sopraventricolare condotta con aberranza).
237
1
Studio elettrofisiologico intracavitario Il SEF intracavitario è uno studio invasivo dell’attività elettrica cardiaca,
condotto con cateteri avanzati attraverso vene centrali o
periferiche (vena giugulare, succlavia, femorale) e posizionati prevalentemente nelle camere destre del cuore, in
cui consentono sia di registrare il segnale cardiaco endocavitario sia di stimolare localmente la porzione di cuore
a contatto con la loro punta.
In questo modo il SEF consente anzitutto di esaminare in
dettaglio la funzione delle principali strutture del sistema
di conduzione elettrico cardiaco (nodo del seno, nodo AV,
fascio di His) e di documentare la presenza di anomalie
della formazione e della conduzione elettrica dell’impulso.
I cateteri sono posizionati in genere in tre punti strategici:
(1) nell’atrio destro alto, in prossimità del nodo seno-atriale,
dove registra essenzialmente un’onda di attivazione atriale
(onda A), corrispondente all’onda P di superficie; (2) a livello
del nodo AV-fascio di His, a cavallo cioè della valvola tricuspide, in modo da registrare il segnale elettrico che entra nel
nodo AV e che passa poi dall’atrio al ventricolo attraverso
il fascio di His; nel canale di registrazione di questo catetere si evidenziano, in sequenza, tre tipi di onde elettriche:
l’onda di attivazione atriale (onda A), l’onda di attivazione
del fascio di His (onda H), che, per la sua bassa ampiezza,
non ha un corrispettivo sull’ECG di superficie, e l’onda di
depolarizzazione dei ventricoli (onda V), che corrisponde al
QRS sull’ECG di superficie; (3) all’apice del ventricolo destro,
dove si registra essenzialmente l’onda V di depolarizzazione
ventricolare. Talora un quarto catetere multielettrodo viene
avanzato lungo il seno coronario, struttura che decorre
intorno all’anulus mitralico, da destra verso sinistra, al fine
6/9/10 9:48:10 AM
238
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
di registrare i potenziali sia atriali sia ventricolari della porzione settale interatriale e dell’atrio sinistro.
La registrazione contemporanea dei potenziali endocavitari e di una o più derivazioni elettrocardiografiche di
superficie consente di ottenere i seguenti due tipi principali di informazione.
1. Scomporre il tempo di conduzione atrioventricolare
(intervallo PR all’ECG di superficie) in tre
componenti (Fig. 11.4):
• intervallo P-A, che va dall’inizio dell’onda P
all’ECG di superficie all’inizio dell’onda A ed è
normalmente di 30-55 msec;
• intervallo A-H, che va dall’inizio dell’onda A
all’inizio dell’onda H, ed è normalmente di 60130 msec;
• intervallo H-V, che va dall’inizio dell’onda H all’inizio
dell’onda V, ed è normalmente di 35-55 msec.
2. Conoscere in dettaglio la via seguita dall’impulso
elettrico.
I
II
21
22
23
aVR
V1
V5
A
HRA p
HBE p
Figura 11.4
Registrazione dei
potenziali cardiaci
durante studio
elettrofisiologico
endocavitario, con
indicazione dei
periodi in cui può
essere suddiviso
l’intervallo di
conduzione AV
(intervalli P-A,
A-H, H-V).
A-H
V
A
H
HBE d
P-A
H-V
RVA p
A
V
CS 9-10
CS 7-8
CS 5-6
CS 3-4
CS 1-2
Page: IC Speed: 100 mm/s
HRA = registrazione da un elettrodo posto nella parte alta dell’atrio; HBEp = registrazione
da un elettrodo posto nella parte prossimale del fascio di His; HBEd = registrazione da un
elettrodo posto nella parte distale del fascio di His; RVA = registrazione da un elettrodo posto
nel ventricolo destro; CS = registrazioni da un catetere elettrodo posto nel seno coronarico.
In alto si evidenzia la registrazione di alcune derivazioni ECG di superficie.
Analizzare in dettaglio la conduzione AV è importante in
quanto, in caso di una sua compromissione, il significato
clinico-prognostico e l’approccio terapeutico sono diversi
a seconda che la sede del blocco sia soprahissiana o sottohissiana. L’ECG di superficie, al proposito, consente in
genere di orientarsi sulla sede del disturbo di conduzione,
ma soltanto la registrazione dei potenziali endocavitari
permette di documentarla con certezza.
Per esempio, in caso di un rallentamento del tempo di
conduzione AV all’ECG di superficie, espresso dall’allungamento dell’intervallo PR (si veda Blocco AV di I grado),
la registrazione ECG endocavitaria consente di stabilire
se il rallentamento è a livello intra-atriale (allungamento
dell’intervallo P-A), a livello del nodo AV (allungamento
dell’intervallo A-H) o a livello delle branche (allungamento dell’intervallo H-V). Come detto, i cateteri possono essere usati non solo per registrare, ma anche per stimolare
il cuore attraverso uno stimolatore esterno al quale sono
collegati. La stimolazione cardiaca può essere utilizzata sia
per studiare meglio la funzione del sistema di conduzione
sia per valutare se, in pazienti con sintomi aritmici non
chiariti, sono inducibili tachiaritmie che potrebbero esserne la causa. A questo scopo si procede con la semplice
introduzione di stimoli prematuri (extrastimoli), isolati,
o in coppia o triplette, sul ritmo regolare del paziente
(spontaneo o stimolato), a intervalli programmati e progressivamente più precoci. Oltre ad avere valore diagnostico, l’induzione di tachiaritmie permette di studiarne in
dettaglio le caratteristiche (origine, meccanismo fisiopatologico, pericolosità), ottenendo così informazioni utili ai
fini della prognosi e dell’impostazione della terapia.
Per una diagnosi dettagliata delle tachiaritmie, sia atriali
sia ventricolari, sono oggi disponibili nei laboratori di elettrofisiologia sistemi di mappaggio sofisticati. Questi sistemi
consentono, con tecniche diverse, di ricostruire una mappa
tridimensionale dei voltaggi delle varie zone del miocardio
e una mappa di attivazione temporale del miocardio stesso,
permettendo così di individuare la sede, il substrato e le
modalità di innesco delle aritmie e di mirare un eventuale
trattamento di ablazione dell’area aritmogena.
Bradiaritmie
Come detto, il termine bradiaritmia indica un ritmo cardiaco anomalo caratterizzato da una bassa frequenza
cardiaca. Ciò può avvenire per un’alterazione della formazione dell’impulso sinusale o per un’alterazione della
conduzione dell’impulso in qualche punto del sistema di
conduzione (dal nodo seno-atriale ai ventricoli). Una sinossi delle principali bradiaritmie rilevabili con l’ECG è
riportata nella tabella 11.1.
Bradicardia sinusale
Nella bradicardia sinusale l’impulso nasce come di norma
dal nodo del seno, ma con una frequenza inferiore a 60
bpm (Fig. 11.5). La bradicardia sinusale è una condizione
fisiologica in molti soggetti giovani e negli atleti, dovuta a
una predominanza dell’attività vagale sul nodo seno-atriale. In alcuni casi, tuttavia, può essere una spia iniziale di
una malattia del nodo del seno (si veda oltre), soprattutto
C0055.indd 238
Tabella 11.1 Principali bradiaritmie rilevabili
all’elettrocardiogramma
Bradicardia sinusale
Aritmia sinusale
Blocchi seno-atriali
di II grado tipo 1
䊉 di II grado tipo 2
䊉
Pause / arresto sinusali
Blocchi atrioventricolari
di I grado
䊉 di II grado tipo 1
䊉
di II grado tipo 2
䊉 di II grado avanzato
䊉 di III grado o completo
䊉
6/9/10 9:48:10 AM
Capitolo 11 - ARITMIE
quando si rileva in circostanze che di norma si associano a
un aumento della frequenza cardiaca (scompenso cardiaco,
esercizio fisico, emozioni ecc.), o può verificarsi in alcune condizioni patologiche (infarto miocardico inferiore,
ipotiroidismo). Essa, infine, può essere espressione di un
effetto farmacologico o di una tossicità da farmaci (digitale,
-bloccanti, antiaritmici ecc.).
Aritmia sinusale
L’aritmia sinusale non è una vera bradiaritmia, ma si presenta più spesso in presenza di bradicardia sinusale (si veda
Fig. 11.5). Essa è caratterizzata da una variabilità significativa degli intervalli P-P (≥ 120 msec), con attività elettrica
cardiaca per il resto normale. Nella sua forma più tipica le
variazioni del ciclo sinusale avvengono in modo fasico, in
relazione al ciclo respiratorio, con un’accelerazione della
frequenza durante l’inspirazione (per l’inibizione riflessa
del vago) e una riduzione durante l’espirazione (aritmia
sinusale respiratoria). Questa forma è fisiologica e presente
soprattutto nei bambini e nei giovani. Le forme di aritmia
sinusale non respiratoria (con variazioni anche marcate
del ciclo sinusale non correlate agli atti respiratori), d’altro canto, possono essere una manifestazione iniziale di
disfunzione sinusale o essere comunque correlate alla
presenza di patologie cardiache.
Blocchi seno-atriali
Nel blocco seno-atriale l’impulso nasce normalmente a
livello del nodo del seno, ma la sua conduzione agli atri
attraverso la via che connette le cellule pacemaker del nodo al miocardio atriale (giunzione seno-atriale), è alterata.
Come per i blocchi AV (descritti in seguito), sono descritte
tre forme di blocco seno-atriale. Nel blocco seno-atriale di
I grado vi è solo un rallentamento della conduzione senoatriale. Il tempo di conduzione seno-atriale non è valutabile
all’ECG, che registra solo la depolarizzazione atriale, per cui
questo tipo di blocco non può essere, in pratica, diagnosticato al tracciato elettrocardiografico.
Nel blocco seno-atriale di II grado, l’impulso nato nel
nodo seno-atriale viene bloccato in maniera intermittente
nella giunzione seno-atriale, per cui alcuni impulsi non
attivano gli atri. Dal punto di vista elettrocardiografico ne
risulta una pausa con assenza di onde P (e dei relativi QRS).
Poiché, come detto, la formazione dell’impulso sinusale è
intrinsecamente regolare, la pausa che risulta dal blocco
(l’intervallo, cioè, fra le due onde P che contengono la pausa) è multipla dell’intervallo P-P di base, e precisamente è
n + 1 volte il numero (n) di impulsi bloccati. Per esempio,
se tre impulsi normalmente originati nel nodo sinusale
sono bloccati in successione nella giunzione seno-atriale,
la pausa sarà quattro volte il ciclo P-P di base; nel caso, più
frequente, di un solo impulso bloccato, la pausa è uguale
al doppio del ciclo sinusale (P-P) di base (si veda Fig. 11.5).
Questo blocco seno-atriale di II grado è detto di tipo 2.
Esiste, infatti, anche un blocco seno-atriale di II grado
di tipo 1, caratterizzato da un allungamento progressivo
della conduzione seno-atriale prima che un impulso venga
bloccato (periodismo di Wenckebach), analogamente a ciò
che avviene nel nodo AV in caso di blocco AV di II grado
tipo 1. Questo tipo di blocco è caratterizzato da pause
C0055.indd 239
239
A. Bradicardia sinusale
1
B. Aritmia sinusale respiratoria
C. Blocco seno-atriale di II grado
1,96 s
3,92 = 1,96 x 2
D. Pausa/arresto sinusale
Figura 11.5
Esempi di aritmie
sinusali.
(a) Bradicardia sinusale (frequenza cardiaca circa 50 bpm); (b) aritmia sinusale respiratoria
fisiologica; (c) bradicardia marcata di base (frequenza sinusale appena superiore a 30 bpm),
con episodio di blocco seno-atriale di II grado (intervallo delle onde P comprendente la
pausa uguale al doppio dell’intervallo P-P di base); (d) ritmo sinusale con due pause sinusali,
una breve e una più lunga, interrotta da un battito di scappamento ventricolare; si noti che
la prima pausa non ha relazione matematica con l’intervallo P-P di base.
di durata inferiore al doppio dell’intervallo P-P di base e
precedute da un progressivo accorciamento dell’intervallo
P-P (che corrisponde all’accorciamento dell’intervallo R-R
dell’analogo blocco AV di II grado).
Nel blocco seno-atriale di III grado, infine, nessuno degli
impulsi originati dal nodo del seno può essere condotto agli atri. Se non intervengono altri centri ad attivare
gli atri, quindi, l’attività atriale è assente. Poiché la persistenza di un’attività regolare del nodo del seno (non
condotta) non può essere rilevata all’ECG, ne deriva che,
come quello di I grado, anche il blocco seno-atriale di III
grado non può essere diagnosticato al tracciato elettrocardiografico.
Blocchi seno-atriali di II grado possono essere semplicemente espressione di una predominanza del tono vagale
sul nodo seno-atriale, soprattutto in soggetti giovani o
che svolgono attività sportiva, o anche essere dovuti a
un effetto farmacologico (digitale, calcio-antagonisti,
β-bloccanti ecc.). Spesso, però, sono espressione di un’alterazione patologica dell’attività del nodo sinusale (si veda
Malattia del nodo del seno).
Arresto o pausa sinusale
Questa condizione indica un’alterazione della genesi
dell’impulso nel nodo del seno. Come nel blocco senoatriale, all’ECG si noteranno alcune pause con assenza di
onde P (e del relativo QRS). Tuttavia, in questo caso, gli
intervalli di inibizione dell’attività automatica del nodo
del seno responsabili delle pause sono in genere variabili,
per cui, contrariamente al blocco seno-atriale, non vi è
alcuna relazione matematica tra la durata delle pause e
l’intervallo P-P normale (si veda Fig. 11.5). Valgono per
il significato clinico delle pause sinusali le stesse considerazioni fatte per i blocchi seno-atriali.
Malattia del nodo del seno
Il termine malattia del nodo del seno viene riferito al
rilievo di bradiaritmie che indicano un’alterata formazione e/o conduzione agli atri dell’impulso sinusale per
6/9/10 9:48:11 AM
240
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
una compromissione patologica della funzione del nodo
seno-atriale.
Le aritmie di solito rilevabili all’ECG nella malattia del
nodo del seno comprendono, in modo variabile da
soggetto a soggetto, la bradicardia sinusale marcata e/o
inappropriata, i blocchi seno-atriali e le pause (o arresti)
sinusali.
In alcuni casi, in associazione e in alternanza alle bradiaritmie, il paziente può presentare ricorrenti episodi
parossistici di tachiaritmie atriali (tachicardia, flutter e
fibrillazione atriali). Questa forma particolare di malattia
del nodo del seno viene definita sindrome bradicardiatachicardia ed è verosimilmente dovuta a una compromissione diffusa del miocardio atriale da parte della patologia
responsabile anche della disfunzione sinusale.
Eziopatogenesi
I meccanismi patogenetici della malattia del nodo del
seno sono eterogenei e comprendono processi ischemici,
infiammatori e, più spesso, degenerativi. Come detto le
alterazioni patologiche possono essere circoscritte al nodo
del seno o possono essere più estese, coinvolgendo talora,
oltre il tessuto atriale, anche il nodo AV, con evidenza di
relative turbe di conduzione AV associate.
Manifestazioni cliniche e diagnosi
I sintomi della malattia del nodo del seno si manifestano
quando la frequenza cardiaca è molto bassa o si verificano pause molto prolungate. In caso di bradiaritmie
sinusali marcate, in effetti, l’attività cardiaca è spesso
garantita dall’emergenza di battiti o ritmi da pacemaker
secondari, atriali o giunzionali (ritmi di scappamento)
(si veda Fig. 11.5). Tuttavia, nella malattia del nodo del
seno, l’arresto o i blocchi seno-atriali non sempre si
accompagnano all’emergenza di ritmi di scappamento,
per cui possono verificarsi periodi di asistolia anche
prolungati.
I sintomi sono in genere secondari soprattutto all’ipoperfusione cerebrale che consegue alla marcata riduzione
della portata cardiaca, dovuta alla bassa frequenza cardiaca, e consistono di episodi lipotimici o di vera e propria
A. Blocco AV di I grado
B. Blocco AV di II grado tipo 1
C. Blocco AV di II grado tipo 2
Figura 11.6
Esempi di blocchi
atrioventricolari.
D. Blocco AV di III grado
(a) Normale ritmo sinusale, con semplice allungamento dell’intervallo P-R (0,28 sec);
(b) blocco AV di II grado tipo 1, con conduzione AV 3:2-4:3; si noti l’allungamento progressivo
del P-R prima dell’onda P bloccata (non seguita da QRS); (c) blocco AV di II grado tipo 2, con
conduzione AV 3:2-2:1; si noti la costanza dell’intervallo P-R delle onde P condotte e il QRS
slargato, che indica la presenza di un’alterazione della conduzione intraventricolare di base;
(d) blocco AV di III grado; si noti l’assenza di qualsiasi relazione tra onde P e QRS; i ventricoli
sono attivati da un ritmo di scappamento giunzionale a frequenza 37 bpm.
C0055.indd 240
sincope; se la bradiaritmia marcata, e quindi l’ipoperfusione cerebrale, si prolunga per più di 15-20 sec, alla
perdita di coscienza si possono associare scosse tonicocloniche, cianosi, respiro stertoroso e incontinenza degli
sfinteri (con perdita di feci e/o urine). Questo quadro clinico, che può essere causato da qualsiasi forma di grave
aritmia cardiaca che determina ipoperfusione cerebrale
(soprattutto blocco AV completo, ma anche tachiaritmie), è noto come sindrome di Morgagni-Adam-Stokes
(MAS). È da sottolineare che se l’ischemia cerebrale si
protrae ulteriormente (oltre i 30 sec) il paziente va in
arresto respiratorio e muore se non compare rapidamente un ritmo cardiaco efficiente o non si instaurano
appropriate manovre rianimatorie in breve tempo. Inoltre, se un circolo efficace viene ripristinato solo dopo
2-3 min dall’esordio della sincope, possono residuare
lesioni ischemiche cerebrali irreversibili, a causa della
prolungata ipoperfusione cerebrale. Questo rischio è
presente soprattutto nei pazienti anziani, che spesso
hanno già di base un’importante compromissione del
circolo vascolare cerebrale.
In caso di sindrome bradicardia-tachicardia, alla presenza
dei sintomi legati alle bradiaritmie, il paziente presenta
sintomi dovuti alla comparsa di tachiaritmie sopraventricolari (palpitazioni, in particolare).
Se si visita il paziente nel momento in cui presenta le
alterazioni del ritmo, si riscontra una frequenza cardiaca
molto bassa con toni ritmici o aritmici a seconda del tipo
di aritmia presente. Spesso, tuttavia, il paziente si rivolge
al medico quando è asintomatico e non aritmico, riferendo sintomi lipotimici, sincopali, o anche tachiaritmici. In
questo caso, l’obiettività e l’ECG possono essere del tutto
normali. L’esecuzione di un ECG dinamico di 24-48 ore
è spesso sufficiente a identificare anomalie dell’attività
sinusale che orientano la diagnosi.
Blocchi atrioventricolari
I blocchi AV sono una condizione caratterizzata da
un’anomala diffusione dell’impulso dagli atri ai ventricoli. Classicamente, vengono suddivisi in tre gradi, di
progressiva gravità.
Blocco AV di I grado
Nel blocco AV di I grado (Fig. 11.6) tutti gli impulsi che
originano dal nodo del seno vengono condotti ai ventricoli, ma con una velocità ridotta rispetto al normale. Ciò
si esprime all’ECG con un allungamento dell’intervallo
P-R, che risulta superiore al valore massimo normale, che
è di 0,20 sec.
Blocco AV di II grado
Nel blocco AV di II grado uno o più impulsi sinusali non
raggiungono i ventricoli in quanto sono bloccati in qualche punto del sistema di conduzione AV. Il blocco AV di
II grado viene ulteriormente suddiviso in due varianti
principali: il blocco AV di II grado tipo 1 (o Mobitz I) e il
blocco AV di II grado tipo 2 (o Mobitz II).
Blocco AV di II grado tipo 1 In questo caso il tempo di conduzione atrioventricolare (P-R) si allunga
progressivamente fino a che un impulso sinusale non
6/9/10 9:48:12 AM
Capitolo 11 - ARITMIE
viene condotto (viene, cioè, bloccato nel sistema di
conduzione AV). L’ECG mostra una serie di complessi
P-QRS in cui, mentre le P sono ritmiche (gli intervalli
P-P, cioè, sono sempre uguali), l’intervallo P-R diventa
progressivamente più lungo, fino a che un’onda P non
è seguita dal QRS (si veda Fig. 11.6). Il complesso P-QRS
che segue l’onda P bloccata solitamente riprende con
un intervallo P-R normale; esso inizia una nuova serie
di complessi P-QRS, con l’allungamento progressivo del
P-R sino al nuovo blocco della P, e così via. Il progressivo
allungamento del tempo di conduzione AV indica che
in questo tipo di blocco vi è un progressivo peggioramento della conduzione AV fi no a che questa non
avviene. Questo fenomeno è denominato “fenomeno di
Luciani-Wenckebach”. È da notare che, in questo tipo
di blocco AV, a fronte di un allungamento progressivo
dell’intervallo P-R, l’intervallo tra i QRS (R-R) si riduce
progressivamente, per cui l’intervallo R-R più breve è
quello immediatamente precedente l’onda P bloccata.
La riduzione dell’intervallo R-R si ha perché l’entità
dell’incremento dell’intervallo P-R diminuisce progressivamente sino al blocco.
Blocco AV di II grado tipo 2 In questo caso, per
quanto riguarda la conduzione AV, vige la legge del
tutto o nulla: alcune volte l’impulso atriale raggiunge
i ventricoli, altre volte no. Quando l’impulso raggiunge i ventricoli il tempo di conduzione AV è costante.
All’ECG si osservano onde P ritmiche seguite regolarmente dal QRS, con un intervallo P-R costante. In
modo più o meno frequente, però, alcune onde P sono bloccate, non sono cioè seguite dal complesso QRS
(si veda Fig. 11.6).
Il blocco AV di II grado (sia Mobitz I, sia Mobitz II) può
manifestarsi con una cadenza regolare; si può avere,
cioè, un’onda P bloccata ogni dato numero di onde P.
Questa caratteristica del blocco è in genere indicata più
frequentemente come rapporto di conduzione AV (rapporto cioè tra numero di onde P e numero di QRS della
sequenza ritmica). Così, si parla di blocco AV 2:1, 3:2 o
4:3 quando un’onda P è bloccata rispettivamente ogni
2, 3 o 4 onde P.
Blocco AV di II grado avanzato Si parla di blocco AV
di II grado avanzato quando più onde P non sono condotte ai ventricoli in successione. Così si può avere, per
esempio, un blocco AV 3:1 o 4:1 (una sola onda P, cioè, è
condotta ai ventricoli ogni 3 o 4 onde P, rispettivamente),
o anche maggiore.
Blocco AV di III grado o completo
Nel blocco AV di III grado nessuno degli impulsi che origina negli atri viene condotto ai ventricoli. All’ECG si
osserva una sequenza di onde P regolari prive del loro QRS
corrispondente. In genere, i ventricoli vengono attivati in
modo regolare da un pacemaker posto distalmente alla
sede del blocco (si veda Fig. 11.6).
Poiché nel blocco AV di III grado gli atri e i ventricoli
sono attivati da due ritmi tra loro indipendenti e non
vi è alcuna possibilità di influenza dell’uno sull’altro,
è presente una dissociazione atrioventricolare. All’ECG
questa è evidenziata dal fatto che le onde P sono tra loro
C0055.indd 241
ritmiche e i QRS sono anch’essi tra loro ritmici, ma i rapporti temporali fra complessi atriali e ventricolari sono
del tutto casuali e variabili, indicando, appunto, che i due
ritmi non hanno tra loro alcuna relazione.
Dal punto di vista clinico è importante diagnosticare
la sede dei blocchi AV, differenziando i blocchi che si
realizzano nelle strutture situate al di sopra del fascio di
His da quelli che si realizzano nelle strutture situate al di
sotto. Questa distinzione in blocchi soprahissiani e blocchi sottohissiani ha, infatti, implicazioni prognostiche e
terapeutiche fondamentali.
Nei blocchi completi soprahissiani (nodali), infatti, l’attività automatica del cuore e l’eccitazione ventricolare
sono garantite da pacemaker posti nello stesso nodo AV
o nel fascio di His, che hanno una frequenza intrinseca
di scarica di 40-60 bpm, sufficiente a garantire una buona
funzione cardiaca; quasi mai, inoltre, questi blocchi si
associano a riduzioni critiche della frequenza cardiaca.
All’ECG si noterà un ritmo di attivazione dei ventricoli
con complessi QRS di morfologia analoga a quella di QRS
sinusali (QRS stretti, di durata 0,08-0,10 sec), in quanto
l’attivazione dei ventricoli avviene attraverso le normali
vie di conduzione (si veda Fig. 11.6).
Nei blocchi completi sottohissiani, la conduzione AV è
bloccata a livello delle branche di conduzione, per cui
il ritmo sostitutivo dovrà necessariamente originare dai
ventricoli. I ritmi ventricolari, tuttavia, hanno solitamente una frequenza di scarica molto bassa (25-30 bpm,
o addirittura meno); ne consegue che i pazienti con
questo tipo di blocco completo hanno spesso riduzioni
molto critiche della frequenza, con episodi sincopali;
frequenze così basse, inoltre, più frequentemente favoriscono uno scompenso emodinamico e predispongono
anche allo sviluppo di tachiaritmie ventricolari gravi,
sino alla fibrillazione ventricolare. All’ECG si noterà
un’attivazione ventricolare regolare caratterizzata da
complessi QRS slargati (in genere di 0,12 sec o più) e
atipici (si veda Fig. 11.6).
La diagnosi della sede del blocco AV è possibile con certezza solo mediante registrazione dell’ECG endocavitario.
Esistono, tuttavia, dati desumibili dall’ECG di superficie
che consentono di porre una diagnosi corretta con ragionevole certezza. Così, si può affermare che, in presenza
di un QRS stretto, qualunque tipo di blocco AV ha sede
soprahissiana.
In presenza di un QRS largo, viceversa, la situazione è un
po’ più complessa: (1) un blocco AV di II grado tipo 1 è,
anche in questo caso, indicativo di una localizzazione
soprahissiana del blocco; infatti, il nodo AV, ma non il
sistema di conduzione sottohissiano, ha la proprietà di
presentare il periodismo di Wenckebach; (2) il blocco AV
di II grado tipo 2 ha sede sottohissiana; infatti, le branche
di conduzione hanno la caratteristica di rispondere nella
maniera “tutto o nulla” agli stimoli che gli provengono
dagli atri; (3) i blocchi AV di III grado nei quali il ritmo
di scappamento è sostenuto da complessi QRS slargati
sono probabilmente sottohissiani se la frequenza del ritmo di sostituzione ventricolare è molto bassa, ma sono
verosimilmente soprahissiani se la frequenza del ritmo
sostitutivo è > 40-50 bpm (in questi casi l’impulso è probabilmente di origine nodale, ma la conduzione ai ventricoli
è a blocco di branca).
241
1
6/9/10 9:48:12 AM
242
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Eziologia
I blocchi AV possono essere congeniti o acquisiti. I blocchi AV congeniti sono rari, possono avere andamento
familiare ed eventualmente associarsi ad altre cardiopatie. Una causa relativamente frequente di blocco AV
congenito è il lupus eritematoso sistemico materno.
L’attivazione dei ventricoli in questi pazienti è data
da un ritmo giunzionale che garantisce una sufficiente
frequenza cardiaca sia a riposo sia, entro certi limiti,
sotto sforzo.
I blocchi AV acquisiti possono essere secondari a processi
infettivi, possono manifestarsi per la prima volta in corso
di cardite reumatica, nella cardiopatia ischemica e nelle
cardiomiopatie primitive. Forme acquisite di blocchi
sono anche quelle indotte da farmaci, tra i quali quelli
più spesso responsabili sono il verapamil, i -bloccanti,
la digitale, l’amiodarone e vari altri antiaritmici.
La conduzione nel nodo AV è sottoposta prevalentemente alla regolazione vagale. Forti stimoli vagali possono
quindi aggravare anomalie della conduzione nodale AV
preesistenti; stimoli vagali sufficientemente intensi, inoltre, possono indurre blocchi AV nodali, anche di grado
elevato, anche in soggetti sani.
Tra i blocchi AV meritano un commento quelli che insorgono in corso di infarto miocardico acuto (si veda il
Capitolo 5). Da un punto di vista pratico, è opportuno
distinguere i blocchi che compaiono in corso di infarto
miocardico inferiore da quelli che compaiono in corso
di infarto miocardico anteriore. Nel primo caso i blocchi
sono in genere soprahissiani (il nodo AV è infatti irrorato
nella maggior parte dei casi dall’arteria coronaria destra).
Nell’infarto anteriore il blocco è, viceversa, sottohissiano (essendo l’irrorazione di tale territorio pertinenza in
prevalenza dell’arteria coronaria sinistra), mostra una
maggiore evoluzione verso il blocco AV completo ed è
gravato da una prognosi infausta.
Manifestazioni cliniche e diagnosi
I sintomi dei blocchi AV dipendono da due fattori:
(1) dalla gravità del blocco e, in caso di blocco AV completo, dalla frequenza dei pacemaker sussidiari; (2) dalla
cardiopatia di base che ha determinato il blocco e da altre
patologie eventualmente associate.
Il blocco AV di I grado non complicato è asintomatico e
non può essere diagnosticato se non con l’ECG. Il blocco
AV di II grado può essere sintomatico se è di grado elevato
e determina pause sufficientemente lunghe e/o frequenze
cardiache basse. Il blocco AV di III grado è quasi sempre
sintomatico, anche se diversi blocchi AV completi nodali
possono essere scoperti del tutto casualmente a un ECG
di routine, essendo spesso la frequenza del pacemaker
sussidiario sufficientemente alta.
Analogamente a quanto visto per le malattie del nodo
del seno, i sintomi predominanti sono legati alla scarsa
irrorazione cerebrale: quindi, lipotimie e sincope, con
caratteristica evoluzione della sindrome di MorgagniAdam-Stokes in caso di bradicardia estrema o arresto
prolungato.
In alcuni casi possono comparire sintomi di scompenso
cardiaco, soprattutto quando il blocco si manifesta in
soggetti in compenso labile a causa di una cardiopatia
organica di base.
C0055.indd 242
Alla visita clinica, in un paziente con blocco AV di II
grado si apprezzano al polso e all’auscultazione cardiaca alcune pause più o meno frequenti. Tipicamente,
nel blocco AV di III grado la frequenza è molto bassa
sia all’auscultazione sia alla palpazione del polso, ma
il ritmo è regolare. Il primo tono cardiaco ha intensità
variabile, in quanto, per la presenza di dissociazione AV,
il rapporto temporale fra la sistole atriale e la sistole ventricolare varia continuamente. Quando la sistole atriale
è sincrona con la sistole ventricolare, il primo tono è
particolarmente intenso e viene definito “a colpo di cannone”. L’ECG consente, in questo caso, di confermare
la diagnosi utilizzando i criteri esposti in precedenza.
Spesso, tuttavia, il paziente si rivolge al medico quando
è asintomatico e non è aritmico, riferendo sintomi lipotimici o sincopali. In questo caso l’obiettività e l’ECG
possono essere del tutto normali. L’esecuzione di un ECG
dinamico di 24-48 ore spesso è sufficiente a identificare
le anomalie della conduzione AV. Se nemmeno l’Holter
consente la diagnosi, diventa opportuno utilizzare i registratori di eventi o i loop recorder.
Blocchi di branca
Si definisce blocco di branca la condizione nella quale
la conduzione dell’impulso trasmesso attraverso il fascio
di His è alterata a livello di una delle sue suddivisioni, la
branca destra (blocco di branca destra o BBD) o la branca sinistra (blocco di branca sinistra o BBS). I blocchi di
branca possono essere completi o incompleti. Nel blocco
di branca completo, la conduzione nella branca è completamente interrotta; nel blocco incompleto la conduzione
nella branca è solo rallentata.
Nei cenni di anatomia si è già visto che la branca destra
è un’entità anatomica discreta, mentre la branca sinistra
ha un’anatomia più variabile. Sia da un punto di vista
funzionale sia da un punto di vista elettrocardiografico,
tuttavia, si è soliti raggruppare le suddivisioni della branca sinistra in due gruppi di fibre: il gruppo anteriore e il
gruppo posteriore. Sebbene questi (soprattutto il gruppo
di fibre posteriori) non costituiscano necessariamente
dei fasci unici, li si denominerà per comodità, e anche
in accordo con una terminologia ormai consolidata e
tuttora utile nella pratica clinica, fascicolo anteriore sinistro e fascicolo posteriore sinistro. In diversi casi la
compromissione della conduzione riguarda uno solo dei
due fascicoli. In questi casi si parla di blocco fascicolare
o emiblocco, rispettivamente anteriore sinistro (BFAS) e
posteriore sinistro (BFPS).
Quando una delle due branche è bloccata, lo stimolo che
proviene dall’atrio può raggiungere comunque tutto il
miocardio ventricolare percorrendo la branca indenne
e diffondendosi poi al miocardio normalmente attivato
dalla branca malata attraverso il tessuto muscolare non
specifico. La stessa cosa avviene se si ha un blocco dell’impulso nella branca destra e in uno dei due fascicoli della
branca sinistra (definito blocco bifascicolare). In questo
caso l’unica via percorribile è il fascicolo della branca
sinistra non interessato dal blocco.
Se, in presenza di un blocco bifascicolare di base, anche
il fascicolo che consentiva la trasmissione dell’impulso
ai ventricoli viene a sviluppare un blocco, l’impulso che
6/9/10 9:48:12 AM
Capitolo 11 - ARITMIE
proviene dagli atri non potrà più raggiungere i ventricoli, per cui si ha un blocco AV completo (di III grado,
sottohissiano).
In alcuni casi è possibile ipotizzare un’alterazione della
conduzione nella branca destra e in entrambi i fascicoli
della branca sinistra, una condizione definita blocco
trifascicolare. In particolare, si può ipotizzare un blocco
trifascicolare in presenza dei seguenti quadri ECG: (1)
BBD più BFAS o BFPS, più blocco AV di I grado (che
può essere dovuto a rallentamento della conduzione
piuttosto che nel nodo AV, nel fascicolo della branca
sinistra apparentemente indenne); (2) BBD più alternanza di BFAS e BFPS. Il termine blocco trifascicolare
esprime una condizione nella quale l’unica struttura
che in un dato momento è ancora in grado di condurre
l’impulso ha già anch’essa problemi di conduzione,
per cui il rischio di sviluppare un blocco AV completo
è elevato.
La prognosi dei blocchi di branca è legato all’evolutività
verso una compromissione progressiva del sistema di
conduzione che può portare al blocco AV completo.
Questo rischio, tuttavia, è, in genere, ampiamente dipendente dal contesto clinico nel quale i blocchi di
branca sono rilevati. Esso, per esempio, è elevato quando un blocco di branca compare durante una patologia cardiaca acuta come l’infarto miocardico, mentre è
molto basso in pazienti con cuore strutturalmente sano
nei quali il blocco è riscontrato occasionalmente a un
controllo ECG.
Si descrivono di seguito gli aspetti principali dei blocchi
di conduzione intraventricolare, i cui criteri diagnostici
ECG sono riassunti nella tabella 11.2.
Blocco di branca destra
Nel BBD la durata dell’attivazione ventricolare è prolungata in quanto il miocardio, di norma attivato dalla
branca destra, viene attivato tardivamente e lentamente
da un’onda che proviene dal ventricolo sinistro attraverso il miocardio comune del setto interventricolare, che,
come visto, ha una velocità di conduzione molto meno
rapida di quella del tessuto specifico di conduzione.
Il BBD si definisce completo quando determina una durata
del QRS uguale o maggiore di 0,11 sec. Per semplicità, la
sequenza di attivazione ventricolare in presenza di BBD
può essere distinta in quattro fasi (Fig. 11.7).
1. Durante la prima fase, poiché la branca sinistra
è intatta, viene attivata, come di norma, la parte
sinistra del setto interventricolare, generando
un vettore diretto da sinistra a destra; ciò determina
all ECG l’inscrizione di una normale piccola onda r
in V1 e di una piccola q in V6 e in D1.
2. Nella seconda fase, mentre continua l’attivazione
del setto da sinistra a destra, inizia anche
l’attivazione del ventricolo sinistro; ne deriva
un vettore diretto sempre in avanti, ma un po’ a
sinistra, che determina il completamento dell’onda
R nelle precordiali destre e l’inizio dell’onda R nelle
precordiali sinistre e in D1.
3. Nella terza fase continua l’attivazione del setto
(sempre da sinistra a destra) e si completa quella
del ventricolo sinistro nelle regioni antero-laterale
e basale; i potenziali dominanti del ventricolo
C0055.indd 243
Tabella 11.2 Principali criteri elettrocardiografici
dei blocchi di branca
Blocco di branca destra (BBD)
䊉 QRS di durata ≥ 0,11 sec
䊉 Complesso rSR’ nelle precordiali destre (V -V ), con onda R’
1 2
ampia (≥ 0,04 sec) e di solito di ampiezza maggiore di R
䊉 Complesso qRS nelle precordiali sinistre (V -V ) e in D -aVL,
5 6
1
con S finale larga (≥ 0,04 sec)
䊉 Tratto ST slivellato verso il basso e onda T negativa
nelle precordiali destre (V1-V2)
䊉 Nel BBD incompleto i criteri di diagnosi elettrocardiografica
sono analoghi a quelli del BBD completo, ma la durata
del QRS è tra 0,10 e 0,11 sec
243
1
Blocco di branca sinistra (BBS)
QRS di durata ≥ 0,12 sec
䊉 Complesso QS o rS nelle precordiali destre (V -V ).
1 4
䊉 Complesso R, RR’ o RsR’ nelle precordiali sinistre e in D -aVL
1
䊉 Tratto ST slivellato in basso e onda T negativa nelle
precordiali sinistre e in D1-aVL
䊉 Nel BBS incompleto i criteri di diagnosi elettrocardiografica
sono analoghi a quelli descritti per il BBS completo,
ma la durata è tra 0,11 e 0,12 sec
䊉
Blocco fascicolare anteriore sinistro
䊉 QRS di durata normale (< 0,11 sec)
䊉 Complesso qR in D -aVL
1
䊉 Complesso rS in D -D -aVF
2
3
䊉 Asse elettrico tra − 30 e − 90°
Blocco fascicolare posteriore sinistro
QRS di durata normale (< 0,11 sec)
䊉 Complesso qR in D -D -aVF
2
3
䊉 Complesso rS in D -aVL
1
䊉 Asse elettrico oltre + 120°
䊉
sinistro causano un vettore diretto verso sinistra,
inferiormente e posteriormente; ciò determina
un’onda S nelle precordiali destre e un’onda R nelle
precordiali sinistre e in D1.
4. Nell’ultima fase si ha il completamento
dell’attivazione settale, l’attivazione della parete
apicale del ventricolo destro e, infine, della parete
libera e della parte restante del ventricolo destro;
il vettore della quarta fase è diretto a destra e
anteriormente, per cui all’ECG si inscrive un’onda
R nelle precordiali destre e una S nelle precordiali
sinistre e in D1.
Il BBD apporta anche modificazioni della ripolarizzazione
che derivano direttamente dall’alterata depolarizzazione
ventricolare. Le alterazioni più significative si osservano
nelle precordiali destre, dove il segmento ST è slivellato
verso il basso e l’onda T è invertita (si veda Fig. 11.7).
Blocco di branca sinistra
Nel BBS la durata dell’attivazione ventricolare è aumentata per motivi analoghi a quelli già esposti per il BBD.
6/9/10 9:48:12 AM
244
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Essendo la massa di tessuto miocardico attivato dalla
branca sinistra molto maggiore, tuttavia, la quantità di
miocardio attivato tardivamente attraverso il miocardio
comune nel BBS è maggiore rispetto al BBD. Ne deriva
che l’allungamento della durata del QRS è, in media,
anch’esso maggiore nel BBS. Anche nel BBS la sequenza
di attivazione ventricolare può essere schematicamente
divisa in quattro fasi (Fig. 11.8).
1. Nella prima fase si ha l’iniziale attivazione del
setto, che, in questo caso, comincia dal lato
destro, essendo la branca sinistra bloccata, e,
contemporaneamente, dall’apice e dalla porzione
anteriore del ventricolo destro; ne deriva un vettore
diretto da destra a sinistra e dall’apice verso la base;
all’ECG ciò si esprime con la comparsa di un’iniziale
onda R nelle derivazioni laterali (D1-aVL-V5-V6) e
un’iniziale onda negativa (inizio di un QS finale) o
di una piccola onda r in V1.
2. Nella seconda fase, continua e si completa
l’attivazione del setto (in direzione destra-sinistra)
e si completa l’attivazione del ventricolo destro;
poiché i potenziali settali sono dominanti ne deriva
un vettore diretto a sinistra e posteriormente;
all’ECG continua l’inscrizione del QS (o compare
Fase 1
3
Fase 2
Figura 11.7
Blocco di branca
destra. Modalità
di propagazione
dell’impulso, vettori
corrispondenti
alle quattro fasi
in cui l’attivazione
ventricolare può
essere suddivisa ed
esempio tipico
di BBD all’ECG
(si vedano il testo
per la spiegazione e
la tabella 11.2 per
i criteri diagnostici
elettrocardiografici).
2
1
4
V5
Fase 3
V4
Fase 4
aVR
V1
V4
aVL
V2
V5
aVF
V3
V6
V1
V2
V3
3
Fase 1
4
2
Figura 11.8
Blocco di branca
sinistra. Modalità
di propagazione
dell’impulso,
vettori
corrispondenti
alle quttro fasi
in cui l’attivazione
ventricolare può
essere suddivisa
ed esempio tipico
di BBS all’ECG
(si vedano il testo
per la spiegazione
e la tabella 11.2
per i criteri
diagnostici
elettrocardiografici).
C0055.indd 244
V6
Fase 2
V6
Fase 3
V5
V4
Fase 4
V1
aVR
V1
V4
aVL
V2
V5
aVF
V3
V6
V2
V3
6/9/10 9:48:12 AM
Capitolo 11 - ARITMIE
una S dopo la piccola r iniziale) in V1 e della R nelle
derivazioni laterali.
3. Nella terza fase ha luogo l’attivazione delle porzioni
posteriore e basali del ventricolo sinistro, per cui si
avrà un vettore diretto a sinistra e posteriormente;
all’ECG questa fase coincide con il nadir dell’onda
negativa (QS o S) in V1 e lo zenit dell’onda R nelle
derivazioni laterali.
4. Nell’ultima fase si completa l’attivazione delle
pareti anteriore e laterale del ventricolo sinistro;
il vettore che ne deriva è sempre diretto a
sinistra, ma un po’ più anteriormente rispetto
al precedente; all’ECG si completa l’inscrizione
del QS (o della S) in V1 e quella dell’onda R nelle
derivazioni laterali.
Anche nel BBS la ripolarizzazione è alterata secondariamente all’anomala sequenza della depolarizzazione ventricolare. In particolare, il segmento ST è slivellato verso
il basso e l’onda T è invertita nelle precordiali sinistre e
in D1-aVL (si veda Fig. 11.8).
Emiblocchi
Normalmente l’onda di eccitazione diffonde in modo
uniforme lungo i due fascicoli in cui viene schematicamente divisa la branca sinistra. Se la conduzione
viene bloccata in uno dei due fascicoli, la sequenza di
attivazione ventricolare viene alterata in modo caratteristico.
Nel BFAS (o emiblocco anteriore sinistro) l’onda di eccitazione percorre la branca destra e il fascicolo postero-inferiore della branca sinistra e diffonde solo in un secondo
tempo in avanti e in alto, attraverso il miocardio contrattile. Ne deriva che il vettore terminale del QRS è diretto a
sinistra e in alto; all’ECG l’asse elettrico è quindi deviato
a sinistra (oltre − 30°), dando un aspetto qR in D1-aVL e rS
in D2-D3-aVF; il QRS può essere lievemente slargato, ma,
in genere, è entro valori normali.
Nel BFPS (o emiblocco posteriore sinistro) l’onda di attivazione percorre la branca destra e il fascicolo anterosuperiore e poi diffonde inferiormente e posteriormente
attraverso il tessuto di conduzione non specializzato.
Ne deriva che il vettore terminale del QRS è diretto
a destra e in basso; all’ECG l’asse elettrico è quindi
deviato a destra (oltre + 120°), dando un aspetto qR
in D2-D3-aVF e rS D1-aVL; anche in questo caso il QRS
può essere lievemente slargato, ma, in genere, è entro
valori normali.
Prognosi delle bradiaritmie
La prognosi delle bradiaritmie è legata essenzialmente
alla patologia cardiaca di base, in quanto i problemi strettamente connessi all’aritmia sono efficacemente risolti
dall’impianto di un pacemaker definitivo.
Terapia delle bradiaritmie
Il trattamento delle bradiaritmie è indicato in due
condizioni principali: (1) quando l’aritmia è sintomatica; (2) quando, anche se l’aritmia non è sintomatica,
C0055.indd 245
le sue caratteristiche e/o il contesto clinico nel quale
si verificano fanno ritenere che vi è un rischio sufficientemente alto che l’aritmia possa evolvere verso
forme più gravi, pericolose per la vita del paziente. La
terapia delle bradiaritmie può essere farmacologica o
elettrica.
La terapia farmacologica viene impiegata solo in condizioni di emergenza, quando il paziente è sintomatico
per la bassa frequenza cardiaca, per lo più in attesa
di intraprendere, appena possibile, una stimolazione
elettrica cardiaca artificiale.
Il farmaco di elezione per tutte le bradiaritmie legate
a disfunzioni del nodo seno-atriale (blocchi, arresto)
e del nodo AV (blocchi di II e III grado) è l’atropina
per via endovenosa (0,5-1 mg in bolo rapido, eventualmente ripetibili). L’atropina, infatti è un farmaco
vagolitico, che, nelle forme aritmiche suddette, è in
grado di determinare sia un rapido aumento della
frequenza sinusale cardiaca, sia un miglioramento
della conduzione del nodo AV. I suoi effetti, tuttavia, sono transitori ed essa può causare tachicardia
eccessiva (indesiderabile in alcune condizioni, come
nell’infarto miocardico acuto) e altri effetti collaterali, come ritenzione urinaria. L’atropina non ha effetti in caso di blocchi AV sottohissiani (di II grado tipo
Mobitz II e di III grado), né sulla frequenza dei ritmi
di scappamento ventricolari (idioventricolari).
In questi casi un effetto può essere ottenuto, ma spesso in modo insufficiente, con l’uso di farmaci simpaticomimetici -stimolanti, come l’isoproterenolo e il
metaproterenolo, o anche, in casi estremi, l’adrenalina. In presenza di blocchi sottohissiani sintomatici,
tuttavia, è in genere necessario procedere in tempi
veramente rapidi all’impianto di uno stimolatore elettrico cardiaco per ottenere un aumento soddisfacente
e stabile della frequenza cardiaca.
Sebbene alcune forme di trattamento farmacologico
siano state tentate per la prevenzione o il miglioramento di bradiaritmie nodali seno-atriali o AV (per
esempio, teofillina, belladonna, cortisonici), esse hanno dato in genere risultati insoddisfacenti, per cui il
trattamento curativo e profilattico delle bradiaritmie,
quando indicato, è rappresentato dalla stimolazione
elettrica cardiaca mediante stimolatori elettrici (pacemaker). La stimolazione elettrica cardiaca può essere
temporanea o definitiva.
La stimolazione elettrica temporanea è indicata in
tutte le condizioni di urgenza dovute a bradiaritmie
sintomatiche o a immediato rischio di aggravamento. Essa può essere mantenuta per alcuni giorni,
in attesa di effettuare l’impianto di un pacemaker
definitivo, se si considera l’aritmia irreversibile o
a rischio di recidiva, o sino alla risoluzione della
bradiaritmia, quando questa è dovuta a cause reversibili (per esempio, ischemia acuta, farmaci, disordini elettrolitici). La stimolazione viene effettuata
mediante un catetere elettrodo, che viene inserito
attraverso una vena periferica (vena femorale, succlavia o giugulare interna) e fatto avanzare, sotto
controllo radioscopico, sino a essere posto a contatto
245
1
6/9/10 9:48:13 AM
246
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Figura 11.9
Rappresentazione
schematica (a)
e radioscopica
(b) del corretto
posizionamento
in apice del
ventricolo destro
di un catetere
elettrodo per
la stimolazione
permanente.
Valvola
tricuspide
a
con la parete del ventricolo destro (in genere l’apice)
(Fig. 11.9). All’estremità opposta (che rimane fuori
dalla vena) il catetere viene collegato a un generatore
di impulsi elettrici (pacemaker artificiale esterno),
che può stimolare così i ventricoli alla frequenza
desiderata dal cardiologo.
Nella stimolazione elettrica definitiva, si possono
introdurre, a seconda del tipo di bradiaritmia, uno o
due cateteri a contatto con le pareti delle cavità cardiache destre (solo in ventricolo, solo in atrio, oppure
un catetere in ventricolo e uno in atrio). I cateteri, in
questo caso, sono introdotti tramite una vena succlavia (in genere la sinistra) e collegati sottocute a un
piccolo pacemaker artificiale, della dimensione di una
scatoletta di cerini, che viene, a sua volta, impiantato nel sottocute del paziente in un’apposita “tasca”
precedentemente preparata, solitamente situata sopra
il muscolo pettorale in regione sottoclaveare sinistra.
La frequenza di scarica del pacemaker (insieme ad
altri parametri) può essere programmata dall’esterno
mediante un telecomando. A seconda del numero e
della sede dei cateteri introdotti, il pacemaker potrà
essere in grado di stimolare solo l’atrio destro, solo il
ventricolo destro o entrambe le camere cardiache. I
pacemaker con un solo catetere elettrodo impiantato
sono detti monocamerali, mentre quelli con due cateteri elettrodi impiantati nelle due camere cardiache
sono detti bicamerali.
Il tipo di pacemaker utilizzato e la sua programmazione dipendono dal tipo di aritmia ipocinetica che
si deve trattare. In generale, si cerca, comunque, di
programmare il pacemaker in modo da favorire il
più possibile l’attivazione cardiaca da parte del ritmo spontaneo e far subentrare il pacemaker solo
quando si manifesta la bradiaritmia. Questo si può
ottenere grazie alla possibilità di programmare il
C0055.indd 246
b
pacemaker a domanda. Infatti, gli attuali pacemaker,
oltre alla capacità di stimolare il cuore (proprietà di
cattura), hanno anche la capacità di percepire (proprietà di “sentire”, o sensing) l’attività spontanea della
camera cardiaca con cui il catetere è a contatto. Ne
deriva che il pacemaker emette impulsi per stimolare
il cuore solo quando l’attività spontanea è assente o
sotto una certa frequenza; quando, invece, è presente
un’attività spontanea valida, il pacemaker la percepisce e si inibisce, lasciando che il cuore sia attivato
dall’attività elettrica spontanea.
Per indicare il tipo di pacemaker di cui un paziente
è portatore viene correntemente utilizzato un codice
a tre lettere, che ne riassumono le modalità di funzionamento.
La prima lettera stabilisce quale camera può essere
stimolata dal pacemaker. Essa può essere una A, una
V o una D. La lettera A indica che il pacemaker può
stimolare solo l’atrio, la lettera V indica che il pacemaker può stimolare solo il ventricolo, la lettera D
(che sta per dual chamber) indica che il pacemaker
può stimolare sia l’atrio sia il ventricolo (è, quindi,
un pacemaker bicamerale).
La seconda lettera del codice definisce di quale camera il pacemaker può percepire l’attività spontanea
(funzione di sensing). Essa può essere una A, una V,
una D o una O. Anche in questo caso le lettere A, V e
D vengono utilizzate per indicare se questa funzione
è presente, rispettivamente, solo per l’altrio, solo per
il ventricolo o per entrambe le camere. La lettera O,
invece, indica l’assenza di qualsiasi funzione di sensing da parte del pacemaker.
La terza lettera definisce il tipo di comportamento
del pacemaker in risposta al segnale di sensing. Essa
può essere una O, una I, una D o una T. La lettera O,
in questo caso, indica che il pacemaker impiegato
6/9/10 9:48:13 AM
Capitolo 11 - ARITMIE
247
A. Pacemaker ventricolare (VVI)
non prevede alcun tipo di risposta a un eventuale
segnale di sensing; la lettera I indica che il pacemaker
inibisce l’elettrodo stimolatore in risposta al segnale
di sensing della camera principale stimolata; la lettera
D indica un doppio controllo, atriale e ventricolare,
del sensing (pacemaker bicamerale). Infine, la lettera
T (da triggered) indica che il pacemaker risponde alla
percezione di un’attività spontanea emettendo una
scarica.
Come detto, la scelta del tipo di pacemaker da impiegare dipende dalla situazione clinica e dal tipo di aritmia ipocinetica da correggere. A dispetto dell’ampia
gamma di possibili programmazioni di un pacemaker,
quelli di gran lunga più impiegati sono i pacemaker
VVI e quelli DDD.
Sulla base di quanto detto, il pacemaker VVI ha un
unico catetere elettrodo, che stimola in ventricolo
(prima V), sente l’attività ventricolare (seconda V)
ed è inibito quando è presente un’attività spontanea dei ventricoli a frequenza superiore a quella di
stimolazione del pacemaker (lettera I). Esso, quindi,
subentra a stimolare il ventricolo solo quando la
frequenza ventricolare spontanea cala al di sotto di
un certo valore (in genere, 60-70 bpm) (Fig. 11.10).
Sebbene un pacemaker di questo tipo sia efficace e
potrebbe essere impiantato in qualsiasi tipo di bradiaritmia, attualmente viene applicato soprattutto
nei casi di fibrillazione atriale cronica con bassa frequenza ventricolare.
Il pacemaker DDD è oggi preferito in molte condizioni, in quanto consente un’attivazione atrioventricolare più fisiologica. Questo pacemaker consente
sia la stimolazione atriale sia quella ventricolare; ha
una funzione di sensing sia in atrio sia in ventricolo
e dà una risposta sequenziale al segnale di sensing
dell’attività sia atriale sia ventricolare. Pertanto, se
sono presenti una normale attivazione degli atri e
una normale conduzione atrioventricolare, il pacemaker è totalmente inibito. Se però è presente
una normale attività sinusale, ma la conduzione
atrioventricolare tarda ad arrivare, il pacemaker
risponde all’atrio stimolando il ventricolo, ottenendo così un’attivazione sequenziale fisiologica
della conduzione (e dell’attivazione) AV. Se viene
a mancare l’attività atriale, il pacemaker risponde
stimolando l’atrio; se lo stimolo atriale è seguito da
una conduzione spontanea ai ventricoli, la stimolazione ventricolare del pacemaker viene inibita,
mentre se, come prima, la conduzione atrioventricolare tarda ad arrivare, dopo l’atrio il pacemaker
stimola anche il ventricolo (si veda Fig. 11.10). Il
vantaggio di questo tipo di pacemaker, quindi, è
che viene preservata, quando possibile, la normale
attività sinusale e/o la normale conduzione AV,
e viene, allo stesso tempo, sempre garantita una
stimolazione sequenziale atrioventricolare di tipo
fisiologico.
Una sintesi delle principali indicazioni cliniche
all’impianto di un pacemaker definitivo nei soggetti
adulti è riportata nella tabella 11.3.
C0055.indd 247
B. Pacemaker bicamerale (DDD)
(a) Attivazione ventricolare da stimolazione artificiale (pacemaker VVI a frequenza 70 bpm);
si noti lo stimolo elettrico inviato dal pacemaker (frecce) seguito dal complesso QRS; si noti
anche che, in questo caso, vi è una costante attivazione degli atri per via retrograda da parte
del pacemaker, come indicato dalla presenza di onde P che seguono il complesso ventricolare.
(b) Ritmo da pacemaker bicamere (DDD) a frequenza 60 bpm; si noti la costante presenza di
due spike (indicati dalle linee verticali) da stimolazione atriale e ventricolare in sequenza.
1
Figura 11.10
Esempi di ritmo
da pacemaker
all’ECG.
Tabella 11.3 Indicazioni assolute all’impianto
di pacemaker permanente nell’adulto
Malattia del nodo del seno
1. Bradiaritmie sinusali sintomatiche spontanee (sincopi,
lipotimie, instabilità emodinamica)
2. Bradiaritmie sinusali sintomatiche causate da farmaci
(per esempio, -bloccanti) che non possono essere sospesi
in quanto necessari per il paziente
3. Mancato aumento della frequenza cardiaca durante sforzi
(incompetenza cronotropa) responsabile della comparsa
di sintomi (per esempio, dispnea, lipotimie)
Blocco atrioventricolare (AV) acquisito
1. Blocco AV di III grado o di II grado sintomatico (sincopi,
lipotimie, instabilità emodinamica)
2. Blocco AV di III grado o di II grado sintomatico causato da
farmaci (per esempio, -bloccanti) che non possono essere
sospesi in quanto necessari per il paziente
3. Blocco AV di III grado o di II grado avanzato asintomatico,
presente in stato di veglia, con periodi di asistolia ≥ 3 sec,
ritmo di scappamento < 40 bpm o ritmo di scappamento
di origine ventricolare
4. Blocco AV di III grado asintomatico, presente in stato di veglia,
in ritmo da fibrillazione atriale, con pause di durata ≥ 5 sec
5. Blocco AV di III grado o di II grado avanzato secondario
ad ablazione transcatetere della giunzione AV o insorto
successivamente a intervento cardiochirurgico
6. Blocco AV di III grado o di II grado avanzato, anche
asintomatico, associato a malattie neuromuscolari a rischio di
asistolia, come distrofia miotonica, distrofia di Erb, amiotrofia
peroneale, sindrome di Kearns-Sayre
7. Blocco AV di III grado asintomatico con frequenza ventricolare
da sveglio ≥ 40 bpm se è presente cardiomegalia o disfunzione ventricolare sinistra, o se la sede del blocco è sottonodale
8. Blocco AV di II o III grado indotto dall’esercizio in assenza
di ischemia miocardica
Altre indicazioni
1. Blocco bifascicolare con blocco AV di blocco AV di III grado
intermittente, di II grado avanzato o di II grado Mobitz 2
2. Blocco bifascicolare con blocco di branca alternante
3. Sincope ricorrente causata da stimolazione spontanea
e compressione del seno carotideo che induce asistolia
ventricolare > 3 sec
6/9/10 9:48:14 AM
248
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Tachiaritmie
Per tachiaritmie (o aritmie ipercinetiche) si intendono
aritmie di origine sopraventicolare o ventricolare che
determinano un’accelerazione del battito cardiaco, subentrando e sostituendosi attivamente al regolare ritmo
sinusale.
Le principali tachiaritmie che si riscontrano nella pratica
clinica sono le seguenti (Tab. 11.4):
• extrasistolia;
• tachicardie sopraventricolari;
• flutter e fibrillazione atriali;
• tachiaritmie ventricolari.
Prima di discuterle è opportuno rivedere la loro patogenesi.
È inoltre opportuno farle precedere dalla descrizione
dei principali tipi di trattamento, al fine di una migliore
comprensione delle loro indicazioni nelle singole forme
cliniche.
Patogenesi
Le tachiaritmie possono essere generate da tre principali
meccanismi: (1) accentuato automatismo cellulare; (2)
rientro; (3) triggered activity.
Tabella 11.4 Principali tachiaritmie rilevabili
all’elettrocardiogramma
Battiti ectopici prematuri
Extrasistoli atriali
䊉 Extrasistoli giunzionali
䊉 Extrasistoli ventricolari
䊉 Parasistolia
䊉
Tachicardie sopraventricolari
Tachicardia sinusale
䊉 Tachicardia sinusale inappropriata
䊉 Tachicardia da rientro seno-atriale
䊉 Tachicardia atriale (ectopica e da rientro)
䊉 Tachicardia atriale polifocale
䊉 Ritmo atriale accelerato
䊉 Ritmo giunzionale accelerato/tachicardia giunzionale
automatica
䊉 TPSV da rientro nodale AV
䊉
TPSV da rientro AV
䊉
Flutter atriale
Fibrillazione atriale
Accentuato automatismo Come visto in precedenza a
proposito dell’elettrofisiologia cellulare, l’automatismo è
una proprietà presente in diverse cellule del tessuto specializzato di conduzione del cuore, ma normalmente non
si evidenzia per la dominanza delle cellule del nodo del
seno. In alcune condizioni patologiche, tuttavia, cellule
pacemaker di altri centri possono aumentare la propria
capacità di autodepolarizzazione prendendo il sopravvento sull’attività sinusale. L’attività del focus ectopico può
esplicarsi solo saltuariamente con singoli battiti che si
sovrappongono, disturbandolo, al ritmo sinusale di fondo
(extrasistoli), ma può essere ripetitiva e durare nel tempo,
generando una tachicardia.
X
A
Figura 11.11
Meccanismo del
rientro.
X
B
C
A
B
C
Il substrato del rientro è rappresentato dalla presenza di un ostacolo alla conduzione
dell’impulso (area triangolare colorata), per cui per attivare il miocardio C l’impulso si
sdoppia e si trova a percorrere due vie, A e B, di cui la prima conduce l’impulso più
rapidamente (linee continue), ma ha un periodo refrattario maggiore e la seconda conduce
l’impulso più lentamente (linee tratteggiate), ma ha un periodo refrattario minore. A
sinistra è illustrato cosa avviene durante un normale battito sinusale. A destra le linee
in blu indicano un impulso prematuro che trova la via B ancora refrattaria, per cui esso
si trova a percorre solo la via lenta A. Se arrivato distalmente a B la zona del blocco ha
recuperato l’eccitabilità, la via B può essere percorsa in senso retrogrado (linea rossa)
dando origine al rientro (si veda il testo per la spiegazione dettagliata). Si noti che ogni
volta che arriva nel punto di origine delle due vie (X), l’impulso è trasmesso ai ventricoli
dando origine a un battito ectopico.
C0055.indd 248
Tachicardia ventricolare
Monomorfa
䊉
Polimorfa
䊉
“A torsione di punta”
䊉
Flutter ventricolare
Fibrillazione ventricolare
I centri responsabili di tachiaritmie possono essere localizzati a livello di qualsiasi punto del sistema di conduzione AV e, negli atri, lungo il setto interatriale e la crista
terminalis a destra, e allo sbocco delle vene polmonari
e nel seno coronarico a sinistra. In caso di patologie
cardiache (ischemia, infiammazione ecc.), inoltre, anche
cellule cardiache muscolari comuni possono assumere
capacità di automatismo ed essere responsabili di tachiaritmie.
Rientro Il meccanismo del rientro è responsabile di numerose aritmie clinicamente rilevanti. Esso può verificarsi
quando la conduzione verso una struttura o una zona più
o meno ampia di tessuto miocardico avviene attraverso
due vie differenti. Il fronte d’onda inizialmente unico,
cioè, si trova davanti un ostacolo, di tipo anatomico (per
esempio, una cicatrice), o anche solo funzionale (cellule
vitali, ma incapaci di essere attivate), per cui si sdoppia,
girando intorno all’ostacolo, per poter attivare il tessuto
a valle dell’ostacolo stesso.
Il motivo per cui una tale situazione predispone al rientro e alle relative aritmie è illustrato nella figura 11.11.
Durante il normale ritmo sinusale, il fronte di attivazione elettrica, giunto a livello dell’ostacolo, si propaga
contemporaneamente lungo le fibre di miocardio che
costituiscono le due vie (denominate A e B nella figura),
contribuendo insieme ad attivare il miocardio a valle
6/9/10 9:48:15 AM
Capitolo 11 - ARITMIE
(C nella figura). Se però le due vie hanno un differente
periodo refrattario, può accadere che uno stimolo (per
esempio, un battito ectopico prematuro) che giunga con
una certa precocità trovi la via che ha il periodo refrattario maggiore (B nella figura) ancora non eccitabile,
quando l’altra (A nella figura) ha già recuperato la sua
eccitabilità. Ne deriva che l’impulso verrà condotto solo
lungo la via A. Avanzando lungo il tessuto miocardico
distale (C), l’eccitazione arriverà anche alla parte distale
della via B. Se le cellule di questa hanno nel frattempo
recuperato la loro eccitabilità, l’impulso potrà attivare la
via in senso retrogrado. Da qui, l’impulso può tornare a
rieccitare la via A in senso anterogrado (potrà, cioè, rientrare lungo A), riattivare il miocardio distale C e rientrare
retrogradamente attraverso B, e così via. Si crea, quindi
un circuito, grazie al quale l’impulso elettrico si automantiene percorrendolo continuamente. È da notare
che ogni volta che l’impulso, rientrando in via retrograda attraverso B, arriva al punto dove le due vie originano
(X nella figura), può diffondersi ad attivare il miocardio
attraverso (nell’esempio) la via prossimale comune,
dando origine a un battito anomalo. Il perpetuarsi del
rientro genera, d’altro canto, una tachicardia, la cui frequenza dipenderà dal tempo di percorrenza del circuito
da parte dell’impulso.
Da quanto illustrato si può evincere che, perché un rientro
possa avere luogo, sono necessarie tre condizioni:
1. deve esistere un circuito, anatomico o funzionale,
piccolo o grande, caratterizzato da due vie di
conduzione (A e B) in grado di attivare una struttura
o una zona di tessuto miocardico a valle (C);
2. deve, per qualche motivo, instaurarsi un blocco
unidirezionale; l’impulso, cioè, durante la
conduzione anterograda deve essere bloccato in una
delle due vie (B); perché ciò sia possibile, come detto,
è necessario che esista una differenza di periodo
refrattario tra le due vie;
3. la conduzione lungo la via non bloccata (A) deve
essere sufficientemente lenta da arrivare alla
parte distale della via bloccata (B) solo dopo che
questa ha recuperato la condizione di eccitabilità;
se infatti arrivasse troppo presto troverebbe B
ancora refrattaria, e quindi il rientro non potrebbe
avvenire.
Quando il circuito attraverso cui si verifica il rientro è
piccolo (come nel caso della tachicardia da rientro nel
nodo AV; si veda oltre), il fenomeno è definito microrientro; quando esso è invece grande (come nella tachicardia
parossistica della sindrome di Wolff-Parkinson-White; si
veda oltre), si parla di macrorientro.
Triggered activity Le aritmie causate da questo meccanismo (che in italiano si potrebbe tradurre come “attività
innescata”) sono dovute alla presenza di oscillazioni del
potenziale di membrana durante la fase 3 (o la fase 2),
oppure durante la fase 4 del potenziale di azione, dovute
a brevi correnti in entrata nella cellula che causano un
transitorio aumento del potenziale di membrana, cioè una
parziale depolarizzazione cellulare. Quando queste correnti si verificano durante la fase 3 o la fase 2 del potenziale
di azione si parla di postdepolarizzazione precoce, mentre
C0055.indd 249
249
Postdepolarizzazione precoce
O
1
a
Postdepolarizzazione tardiva
O
b
Figura 11.12
Esempi di
potenziali di
postdepolarizzazione precoce
in fase 3 e di
postdepolarizzazione tardiva
(in fase 4)
(si veda il testo
per la spiegazione
dettagliata).
se si verificano nella fase 4, si parla di postdepolarizzazione tardiva (Fig. 11.12). Se la piccola corrente in entrata
raggiunge un potenziale-soglia, si innesca una vera e propria depolarizzazione della cellula, che si diffonde poi a
eccitare tutto il miocardio, generando un battito ectopico
prematuro. Il ripetersi del fenomeno porta all’origine di
una tachicardia.
La postdepolarizzazione precoce è stata documentata in
fibre di Purkinje e in tessuti cardiaci isolati sottoposti a
stiramento, ipossia, acidosi, alterazioni elettrolitiche e
vari agenti farmacologici (in particolare antiaritmici).
La sua comparsa è, in particolare, favorita da condizioni
che causano allungamento della fase di ripolarizzazione
e dalla bradicardia marcata; in alcuni casi, tuttavia, l’insorgenza di postdepolarizzazioni precoci è favorita dalla
tachicardia. Il meccanismo ionico sembra complesso, ma
coinvolge principalmente una diminuzione della conduttanza del canale della corrente in uscita del potassio e/o
un aumento della corrente in entrata del calcio. In campo
clinico, la postdepolarizzazione precoce si ritiene implicata nella genesi delle tachicardie ventricolari a torsione
di punta che insorgono in condizioni di allungamento
congenito o acquisito dell’intervallo QT, oltre che di alcune aritmie che insorgono in pazienti con ipertrofia
ventricolare o scompenso cardiaco.
Le correnti di postdepolarizzazione tardiva insorgono
soprattutto in condizioni che favoriscono l’attivazione
di correnti depolarizzanti del Ca2+, con aumento significativo della concentrazione intracellulare di questo ione,
e sono favorite dalla tachicardia. Tra le cause più tipiche
vi è l’intossicazione digitalica; altre cause comprendono
l’ischemia, condizioni di iperattivazione adrenergica e,
anche in questo caso, ipertrofia ventricolare e scompenso
cardiaco.
6/9/10 9:48:15 AM
250
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Terapia
Non sempre una tachiaritmia necessita di un trattamento farmacologico specifico. L’indicazione alla
terapia si pone per tre motivi principali: (1) quando
la presenza dell’aritmia compromette la funzione
di pompa del cuore, alterandone l’emodinamica in
maniera significativa; (2) quando l’aritmia è potenzialmente associata a un rischio significativo di degenerare in aritmie più gravi (in particolare in fibrillazione ventricolare); (3) quando l’aritmia determina
sintomi comunque fastidiosi per il paziente. Queste
condizioni possono essere presenti singolarmente o
in modo variamente combinato, per cui si crea una
vasta gamma di circostanze nelle quali l’indicazione
al trattamento è più o meno presente e più o meno
imperativa o urgente.
Da quanto detto risulta evidente che una stessa aritmia può richiedere o meno una terapia a seconda del
contesto clinico nel quale si manifesta e del quadro
clinico che determina. Per esempio, i battiti prematuri ventricolari, anche frequenti, che insorgono in
soggetti con un cuore sano, non vengono avvertiti dal
paziente e non compromettono la funzione cardiaca,
non necessitano di alcun trattamento antiaritmico.
D’altro canto, questo diventa necessario se l’aritmia
causa disturbi fastidiosi (palpitazioni, colpi di tosse,
salti al cuore, lipotimie) che compromettono le normali attività del paziente.
Analogamente, il trattamento di una tachicardia atriale
parossistica oligosintomatica, che insorge in un soggetto giovane, apparentemente esente da cardiopatie organiche, può essere dilazionata, mentre la stessa aritmia
che si presenti in un soggetto anziano con compromissione del sistema cardiovascolare e che induca sintomi
(di ischemia cerebrale o miocardica o di scompenso
cardiaco) richiede un trattamento d’urgenza.
Manovre di stimolazione vagale Nel caso di una
tachicardia parossistica sopraventricolare da rientro
che coinvolga in qualche modo il nodo AV (si veda
oltre), spesso l’aritmia può essere risolta ricorrendo
a una manovra molto semplice, rappresentata dal
massaggio del seno carotideo (MSC). L’MSC determina una stimolazione riflessa del vago che inibisce la conduzione a livello del nodo AV, impedendo
che l’impulso elettrico prosegua attraverso di esso
e interrompendo quindi il circuito che è alla base
dell’aritmia.
L’MSC si effettua con il paziente supino, con il capo
esteso e ruotato leggermente dalla parte opposta a
quella dove si intende effettuare la manovra. Il massaggio deve essere praticato a livello della biforcazione
della carotide, immediatamente al di sotto dell’angolo
della mandibola, sotto controllo elettrocardiografico.
Esso non deve essere prolungato (non più di 5-6 sec),
deve essere inizialmente praticato con cautela (possibilità di riflessi eccessivi) e deve essere esercitato con
prudenza in presenza di un fremito carotideo (soprattutto in soggetti anziani); questo, infatti, sugerisce
la presenza di un grado significativo di ostruzione a
C0055.indd 250
carico del circolo carotideo, per cui la manovra potrebbe far precipitare un’ischemia cerebrale.
È importante notare che, poiché l’MSC ha un effetto
terapeutico solo su tachicardie sopraventricolari, nei
casi in cui esistano dubbi sull’origine sopraventricolare o ventricolare di una tachicardia, lo sblocco
dell’aritmia con questa manovra consente anche di
effettuare la corretta diagnosi aritmologica. L’MSC è
inoltre utile a scopo diagnostico anche in tachiaritmie di origine atriale (per esempio, un flutter o una
tachicardia atriale). Grazie al suo effetto inibitorio
sul nodo AV, infatti, esso determina una riduzione
della risposta ventricolare all’aritmia atriale, per cui,
aumentando gli intervalli tra i QRS, l’attività atriale
si rende meglio visualizzabile sul tracciato ECG (più
onde P senza QRS), consentendo la corretta diagnosi
della tachiaritmia.
Effetti simili a quelli dell’MSC si possono ottenere con
altre manovre di attivazione vagale, quali la manovra
di Valsalva (espirazione forzata a glottide chiusa) e la
compressione dei globi oculari.
Farmaci antiaritmici La terapia farmacologica
delle tachiaritmie mira a intervenire sul meccanismo
che è alla base di una determinata aritmia. I farmaci
antiaritmici sono variamente in grado di influenzare
l’automatismo di eventuali foci ectopici automatici
(modificando la pendenza della fase 4 del potenziale
di azione), di inibire le correnti di depolarizzazione alla base della triggered activity, e di interrompere
i circuiti di rientro (variando la refrattarietà e/o la
conduzione delle due vie che sono alla base del fenomeno).
Quando il meccanismo di un’aritmia è palese (per
esempio, nelle tachicardie da rientro della sindrome
di Wolff-Parkinson-White), la scelta del farmaco può
essere fatta su basi razionali. In molti casi, tuttavia,
il meccanismo dell’aritmia è ipotetico e la scelta del
farmaco è più empirica.
I farmaci antiaritmici vengono abitualmente classificati in quattro classi in base ai loro principali effetti
elettrofisiologici, che si esplicano spesso in modo differenziato sui vari tipi di cellule miocardiche del sistema di conduzione, e anche del miocardio comune.
Classe I Appartengono a questa classe i cosiddetti
farmaci stabilizzatori di membrana, che agiscono
principalmente inibendo i canali rapidi del sodio durante la fase 0 del potenziale di azione. Questi farmaci
vengono, a loro volta, suddivisi in tre gruppi (A, B e C)
sulla base del loro effetto sul periodo refrattario. I farmaci della classe IA aumentano il periodo refrattario
cellulare, quelli di classe IB lo riducono, mentre quelli
di classe IC hanno scarso effetto sul periodo refrattario, ma rallentano in modo significativo la velocità di
conduzione dell’impulso. I farmaci di classe IA e IC
hanno effetti negativi sulla contrattilità cardiaca, per
cui non vanno utilizzati (o vanno utilizzati con molta
cautela, e possibilmente solo in acuto) in presenza di
una compromissione significativa della contrattilità
6/9/10 9:48:15 AM
Capitolo 11 - ARITMIE
meno cardiodepressivi, per cui è il farmaco da preferire ogni volta che la funzione ventricolare sinistra
è compromessa. L’amiodarone può essere usato per
lo sblocco e la prevenzione della fibrillazione atriale
e in altre tachiaritmie sopraventricolari, oltre che
nelle tachicardie ventricolari, soprattutto in quelle
postinfartuali.
ventricolare. I farmaci di classe IA, inoltre, sono quelli
che hanno il maggior rischio di causare tachicardie
ventricolari a torsione di punta.
I farmaci di classe IA e IC sono impiegati più spesso
per lo sblocco e la prevenzione di tachiaritmie sopraventricolari. Quelli di classe IC sono comunque
utilizzati anche per sbloccare o prevenire, in assenza
di controindicazioni, aritmie ventricolari. I farmaci di
classe IB non hanno effetti rilevanti sulla contrattilità
e possono essere utilizzati per lo sblocco di tachicardie
ventricolari, in particolare se a eziologia ischemica.
Classe III Appartengono a questa classe i farmaci che
hanno come effetto principale l’allungamento della
fase 3 del potenziale di azione, e quindi del periodo
refrattario delle cellule. Comprendono l’amiodarone e il sotalolo (che ha anche azione -bloccante),
più altri farmaci (per esempio, ibutilide, dofetilide,
dronedarone) attualmente non disponibili in Italia. A causa della loro azione intrinseca, allungano il
QT, aumentando potenzialmente il rischio di tachicardia ventricolare a torsione di punta. Tuttavia, un
aumento significativo di questo effetto proaritmico
è presente per il sotalolo, ma non per l’amiodarone,
con il quale il rischio di questa complicanza è molto basso. L’amiodarone è tra i farmaci antiaritmici
Chinidina
Disopiramide
Lidocaina
Mexiletina
Propafenone
Flecainide
-bloccanti
Amiodarone
Sotalolo
Verapamil
Diltiazem
Adenosina
Digossina
1
Classe IV Appartengono a questa classe i farmaci
calcio-antagonisti non diidropiridinici, il verapamil
e il diltiazem. Questi farmaci inibiscono la corrente
lenta in entrata del calcio nella fase 2 del potenziale di
azione, riducendo la velocità di conduzione e allungando il periodo refrattario soprattutto delle cellule
nodali AV e del nodo del seno, di cui rallentano anche la fase 4 di autodepolarizzazione. Sono utilizzati
elettivamente per il trattamento e la prevenzione di
varie forme di tachiaritmie sopraventricolari.
Oltre ai farmaci inquadrabili in una delle precedenti
quattro classi, ve ne sono alcuni comunemente utilizzati nel trattamento di alcune tachiaritmie sopraventricolari che non rientrano nella classificazione, come
l’adenosina e la digossina. Entrambi questi farmaci
hanno la capacità di prolungare il periodo refrattario
e rallentare la conduzione del nodo AV. L’adenosina
ha un’emivita molto breve, per cui può essere utilizzata solo acutamente, endovena, per sbloccare episodi
di tachicardia parossistica sopraventricolare. La digossina trova oggi la principale indicazione nel controllo
della frequenza ventricolare (in acuto e in cronico) in
pazienti con tachiaritmie atriali (fibrillazione atriale
in primo luogo) che presentino anche una significativa compromissione della funzione ventricolare.
I principali effetti esplicati dai farmaci antiaritmici
più utilizzati nella pratica clinica sulle varie strutture
cardiache e su alcuni parametri ECG sono riassunti
nella tabella 11.5.
Classe II Appartengono a questa classe i -bloccanti,
che esercitano la loro azione antiaritmica antagonizzando l’azione aritmogena delle catecolamine. Molto
utili nella prevenzione del rischio aritmico (e non solo)
nel postinfarto, vengono ampiamente utilizzati per il
controllo della risposta ventricolare in corso di aritmie sopraventricolari quali fibrillazione atriale e flutter
atriale, e per il trattamento di aritmie ventricolari o
sopraventricolari associate a condizioni di aumentata
attivazione adrenergica (sforzo, stress, ipertiroidismo).
Tabella 11.5
251
Caratteristiche dei principali farmaci antiaritmici utilizzati nella pratica clinica
Classe
Nodo
del seno
Conduzione
nodo AV
Conduzione
sottonodale
Durata QRS
QTc
IA
IA
IB
↓
↓
0
0
0/↓
0/↓
↓↓
↓
↓↓
↓
↓
↓
↓
0
0
0
0
0/↓
0/↓
↓↓
↓
↓↓
↓↓
↓↓
↓↓
↓
↓
0/↓
0
0/↓
↓↓
↓↓
0
0/↓
0
0
0
0
0
↑↑
↑
0
0/↓
↑↑
↑↑
0
0
0
0
0
0
0
↑↑
↑
0
0
0/↑
0/↑
0
↑↑
↑↑
0
0
0
↓
IC
IC
II
III
II-III
IV
IV
-
Conduzione
in vie
accessorie*
↓
↓
0/↓
0/↓
↓
↓
0
0/↓
0
0/↑
0/↑
↑
0/↑
↑ = aumenta; ↓ = deprime; 0 = assenza di effetti rilevanti.
*
Fasci atrioventricolari di Kent.
C0055.indd 251
6/9/10 9:48:15 AM
252
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Cardioversione e defibrillazione elettrica La cardioversione elettrica consiste nell’applicazione sulla
superficie del torace di una scarica o shock elettrico
a corrente continua. Lo shock elettrico ha lo scopo di
provocare una depolarizzazione simultanea di tutto
il miocardio, che consente un’equalizzazione rapida
e omogenea dei potenziali transmembrana di tutti
i miocardiociti. Ciò causa l’inibizione di tutti i foci
ectopici e degli eventuali circuiti di rientro attivi,
dando modo al nodo sinusale (che, di norma, è il
primo centro a riattivarsi dopo lo shock) di riprendere
il comando del ritmo del cuore.
Teoricamente la cardioversione elettrica può essere
utilizzata per sbloccare qualsiasi tipo di tachiaritmia
resistente alla terapia farmacologica. Essa si rende
spesso necessaria nella fibrillazione e nel flutter atriale, nonché nelle tachicardie ventricolari sostenute.
L’applicazione tempestiva di uno shock elettrico è
infine l’unico trattamento possibile in caso di fibrillazione ventricolare per evitare la morte del paziente.
Lo shock elettrico viene applicato mediante un apparecchio chiamato defibrillatore. La corrente, la cui
intensità può essere regolata dall’operatore, viene
erogata attraverso due elettrodi, rappresentati da
due piastre, connesse all’apparecchio. Le piastre del
defibrillatore vengono poste sul torace del paziente
(tipicamente alla base e all’apice della regione cardiaca) e la scarica elettrica viene erogata attraverso
un comando manuale. Se è vigile, il paziente viene
prima addormentato mediante la somministrazione di una benzodiazepina endovena. In presenza
di un’attività ventricolare organizzata, la scarica
del defibrillatore viene sincronizzata con la sistole
ventricolare (picco del QRS); esiste, infatti la possibilità che una scarica applicata in corrispondenza
dell’onda T causi l’induzione di una fibrillazione
ventricolare.
Nel caso che il paziente presenti una fibrillazione
ventricolare, invece, si effettua la scarica elettrica in
asincronia (defibrillazione elettrica), non essendo presente alcuna attività cardiaca organizzata. L’intensità
della corrente da erogare per risolvere l’aritmia varia
a seconda dell’aritmia stessa. Se il primo shock non
ha successo le scariche vengono ripetute aumentando
l’intensità della corrente erogata.
Stimolazione elettrica o pacing
In pazienti con
tachiaritmie da rientro che si presentino emodinamicamente stabili, un’alternativa alla cardioversione elettrica, in caso di insuccesso farmacologico, è
rappresentata dallo sblocco dell’aritmia mediante
stimolazione elettrica artificiale con un catetere elettrodo introdotto nell’appropriata camera cardiaca
per via percutanea. L’introduzione di un extrastimolo prematuro in un momento critico del ciclo
della tachicardia, infatti, può penetrare nel circuito di rientro e depolarizzarne la parte in quel momento eccitabile, che viene così resa refrattaria al
fronte d’onda del rientro che arriva subito dopo. Il
circuito viene così interrotto e l’aritmia sbloccata.
C0055.indd 252
In molti casi, però, singoli extrastimoli sono incapaci di
terminare l’aritmia, per cui si ricorre all’erogazione
di brevi salve di extrastimoli a frequenza più elevata
di quella della tachicardia (burst), che rendono probabile la penetrazione di uno di essi nel circuito per
sbloccare l’aritmia. In alcuni casi, la stimolazione ad
alta frequenza viene prolungata per alcuni secondi
(overdrive), aumentando ulteriormente la probabilità
di sblocco dell’aritmia.
Attualmente queste forme di terapia elettrica non
vengono quasi mai utilizzate per sbloccare una tachiaritmia, se non in casi particolari. Viceversa, il
pacing antitachicardia viene utilizzato abitualmente
dai defibrillatori impiantabili (ICD, Implantable Cardioverter Defibrillator) per tentare di sbloccare una
tachicardia ventricolare.
L’overdrive atriale, effettuato mediante sondinopacemaker introdotto per via transesofagea, come
descritto in precedenza, viene talora utilizzato per
sbloccare le tachicardie sopraventricolari e il flutter
atriale.
Ablazione con radiofrequenza Le tecniche di ablazione di un’aritmia consistono nel causare un danno
(in genere permanente) alle strutture cardiache responsabili o coinvolte nell’aritmia, o in prossimità
di esse, in modo da renderle incapaci di generare
o sostenere la tachiaritmia. Nella forma ormai più
consolidata esse utilizzano, a tale scopo, energia a
radiofrequenza, che viene erogata mediante cateteri introdotti nel cuore per via percutanea, come
descritto a proposito del SEF. L’ablazione con radiofrequenza è utilizzata in molti tipi di tachiaritmie,
con successo variabile a seconda dell’aritmia e del
tipo di paziente.
Esistono anche tecniche chirurgiche elaborate allo
stesso scopo, ma ormai sono utilizzate solo nei casi
in cui il paziente debba sottoporsi a un intervento
cardiochirurgico per altri motivi.
Defibrillatore impiantabile L’ICD è un apparecchio sostanzialmente simile a un pacemaker (si veda
in precedenza), anche se di dimensioni maggiori, che
quando rileva, con la sua funzione di sensing, un’aritmia a elevata frequenza, come una tachicardia o una
fibrillazione ventricolare, eroga, attraverso i cateteri,
una corrente elettrica (di energia sino a 30-40 J) che
determina una defibrillazione elettrica intracavitaria
in grado di sbloccare l’aritmia.
Esso è dunque impiantato in pazienti con aumentato
rischio di aritmie fatali o potenzialmente fatali, come
la tachicardia ventricolare sostenuta e la fibrillazione
ventricolare, al fine di prevenire la morte improvvisa con l’immediato riconoscimento e trattamento
dell’aritmia, qualora essa si verifichi.
Gli ICD moderni sono in grado di eseguire l’analisi del
segnale ECG intracavitario per cercare di distinguere
un’aritmia ventricolare pericolosa (che necessita del
trattamento) da una tachiaritmia sopraventricolare o
una semplice tachicardia sinusale (che non necessita
6/9/10 9:48:16 AM
Capitolo 11 - ARITMIE
253
Extrasistolia
di trattamento), e attivarsi, così, solo in presenza di
forme ventricolari rapide. Una diagnosi errata è, tuttavia, possibile, per cui l’apparecchio a volte eroga degli
shock inappropriati, che possono essere fastidiosi
per il paziente. È possibile comunque programmare
l’ICD in modo che esso, in caso di tachicardia regolare, tenti prima di sbloccare l’aritmia con salve di
stimolazioni ventricolari rapide a frequenza superiore
a quella della tachicardia (pacing antitachicardia).Le
principali indicazioni all’impianto di un ICD sono
riassunte nella tabella 11.6.
Tabella 11.6 Indicazioni all’impianto di defibrillatore
automatico (ICD) nell’adulto
Indicazioni assolute
1. Pazienti sopravvissuti ad arresto cardiaco dovuto a FV o TV
sostenuta emodinamicamente instabile dopo esclusione
di qualsiasi causa reversibile
2. Pazienti con TV sostenuta emodinamicamente instabile
o stabile in presenza di una cardiopatia organica
3. Pazienti con sincope di origine non determinata che hanno
induzione di FV o TV clinicamente rilevante indotta allo
studio elettrofisiologico
4. Pazienti con FEVSn inferiore al 35% dovuta a pregresso
infarto miocardico a distanza di almeno 40 giorni dall’infarto,
in classe funzionale NYHA > II*
5. Pazienti con FEVSn inferiore al 30% dovuta a pregresso
infarto miocardico a distanza di almeno 40 giorni dall’infarto,
in classe funzionale NYHA I*
6. Miocardiopatia dilatativa non ischemica con FE inferiore
o pari al 35% in classe funzionale NYHA > II*
Le extrasistoli costituiscono la forma più elementare e,
per certi versi, l’elemento base di tutte le tachiaritmie.
Si definisce extrasistole un battito originato da un punto
del cuore diverso dal nodo sinusale, che interviene prematuramente rispetto al ciclo sinusale interrompendo la
normale regolarità del ritmo cardiaco.
In base alla sede di origine, le extrasistoli possono essere
suddivise in atriali, giunzionali e ventricolari. Poiché le
extrasistoli atriali e giunzionali hanno in genere analoghe
implicazioni cliniche, che possono invece essere differenti
per le ventricolari, esse sono abitualmente raggruppate
insieme a formare il più ampio gruppo delle extrasistoli
sopraventricolari. All’esame clinico è pressoché impossibile distinguere tra i vari tipi di extrasistoli, per cui per
una corretta diagnosi è necessaria la loro registrazione e
analisi all’ECG.
Le extrasistoli più spesso si presentano isolate, ma in
molti pazienti sono più o meno frequenti le forme ripetitive; le extrasistoli, cioè, si presentano in successione di due battiti (coppie) o di tre o più battiti (salve o
run). Quando frequenti, inoltre, le extrasistoli possono
presentarsi, per un periodo più o meno lungo, con una
cadenza ritmica: intervenire cioè costantemente dopo un certo numero di battiti sinusali. Extrasistoli che
intervengono dopo ogni battito sinusale sono dette
bigemine (e il ritmo che ne deriva bigeminismo extrasistolico); quelle che intervengono dopo ogni due
battiti sinusali sono dette trigemine (e il ritmo che ne
deriva trigeminismo extrasistolico) (Fig. 11.13) e così
via. In uno stesso paziente, infine, le extrasistoli (atriali
o ventricolari) possono avere tutte la stessa morfologia
(extrasistoli monomorfe), indicando un’origine da un
1
A. Extrasistolia atriale
Indicazioni discusse
1. Pazienti con TV sostenuta e funzione ventricolare sinistra
normale o lievemente ridotta
2. Pazienti con miocardiopatia ipertrofica che abbiano uno o
più fattori di rischio maggiori per morte improvvisa cardiaca
3. Pazienti con displasia ventricolare destra aritmogena che
abbiano uno o più fattori di rischio per morte improvvisa
cardiaca
4. Pazienti con sindrome del QT lungo che presentino sincope
e/o TV durante terapia con -bloccanti
5. Pazienti con sindrome di Brugada e storia di sincope o di TV
documentata che non abbia provocato arresto cardiaco
6. Pazienti non ospedalizzati in attesa di trapianto cardiaco
7. Pazienti con TV polimorfa catecolaminergica con sincope e/o
TV sostenuta documentata durante terapia con -bloccanti
8. Pazienti con sarcoidosi cardiaca, miocardite a cellule giganti
o malattia di Chagas
FEVSn = frazione di eiezione del ventricolo sinistro; FV = fibrillazione
ventricolare; NYHA = New York Heart Association; TV = tachicardia
ventricolare.
*
Sebbene gli studi clinici siano a sostegno di queste indicazioni, diversi
autori ritengono tuttavia che in questi gruppi di pazienti sarebbe indicato
identificare sottogruppi effettivamente a più alto rischio di andare incontro ad arresto cardiaco da tachiaritmie ventricolari, nei quali l’impianto di
ICD può significativamente ridurre l’incidenza di morte improvvisa con
un favorevole rapporto costo-beneficio.
C0055.indd 253
B. Extrasistolia giunzionale e ventricolare
C. Extrasistoli ventricolari trigemine
D. Parasistolia ventricolare
1,76 sec
Figura 11.13
Esempi di
extrasistolia
sopraventricolare
e ventricolare
e di parasistolia
ventricolare.
(a) Extrasistole atriale: il quarto battito della striscia mostra un’onda P anticipata e con
morfologia diversa dalle onde P sinusali, seguita da un QRS normale. (b) Extrasistole
giunzionale: il terzo battito della striscia è rappresentato da un QRS identico a quello
dei battiti sinusali, ma non preceduto da onda P; sono presenti nella striscia anche due
extrasistoli ventricolari (quinto e ultimo battito). (c) Extrasistoli ventricolari: sono presenti
4 battiti slargati e aberranti, tipici delle extrasistoli ventricolari, che cadono ritmicamente
dopo ogni due battiti sinusali (trigeminismo); si noti la copula costante dei battiti prematuri
ventricolari. (d) Parasistolia ventricolare: il primo, terzo, sesto e ultimo battito della striscia
(pallini rossi) sono atipici e non preceduti da onde P (battiti ectopici ventricolari); la copula
di questi battiti con il precedente battito sinusale è tuttavia variabile e l’intervallo tra i
QRS ventricolari è uguale a 1,76 o a un suo multiplo; il pallino giallo indica dove il battito
parasistolico sarebbe dovuto comparire, ma non compare, in quanto in quel momento i
ventricoli sono in periodo refrattario (onda T) (si veda il testo per i dettagli).
6/9/10 9:48:16 AM
254
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
unico centro ectopico, o avere due o più morfologie differenti (extrasistoli polimorfe), suggerendo una possibile
origine polifocale.
È da notare, infine, che l’intervallo tra un determinato
tipo di extrasistole e il battito precedente (l’onda P sinusale precedente per le extrasistoli atriali e il QRS del
battito sinusale precedente per le extrasistoli giunzionali
e ventricolari) è sostanzialmente costante, suggerendo
un legame fisiopatologico della scarica ectopica con il
precedente battito normale. Per tale motivo questo intervallo è definito intervallo di copula (o di accoppiamento)
dell’extrasistole.
Extrasistolia atriale
Le extrasistoli atriali possono nascere in punti diversi degli
atri. Esse possono insorgere sia in cuori malati sia in cuori
sani. Nei soggetti sani esse sono favorite dallo stress (psichico e fisico), dall’abuso di sostanze eccitanti (tè, caffè,
tabacco, droghe) e da disturbi gastroesofagei (reflusso,
distensione gastrica). Nei soggetti con problemi medici,
esse si manifestano più spesso in condizioni caratterizzate da una distensione della parete degli atri (cardiopatie
valvolari, scompenso cardiaco) e nella cardiopatia ischemica, e a volte preludono ad aritmie clinicamente più
importanti, quali la fibrillazione atriale o le tachicardie
sopraventricolari.
All’ECG le extrasistoli atriali sono caratterizzate da onde
P che hanno una morfologia diversa da quella dell’onda
P del normale ritmo sinusale. L’onda P ectopica extrasistolica (definita, in genere, onda P’) è inoltre prematura:
presenta, cioè, un intervallo dall’onda P sinusale del complesso precedente inferiore all’intervallo compreso fra due
P sinusali del ritmo di base (si veda Fig. 11.13).
La morfologia dell’onda P consente di individuare da
quale zona degli atri l’extrasistolia origina. Se l’onda P’
è negativa in V1, essa verosimilmente origina da destra;
se l’onda P’ è negativa in sede inferiore (D2, D3, aVF), il
focus è in prossimità della porzione atriale destra bassa;
se essa è negativa nelle derivazioni laterali, allora il focus
extrasistolico è in atrio sinistro. Una durata breve dell’onda P’, intorno a 0,10 sec, suggerisce un’origine nel setto
interatriale.
L’impulso che nasce dal focus ectopico atriale diffonde, come i battiti sinusali, al nodo AV, al fascio di His e,
quindi, ai ventricoli. Tale diffusione avviene in genere
in maniera del tutto normale, per cui la morfologia del
complesso QRS del battito prematuro atriale è identica a
quella dei battiti sinusali. Tuttavia, se l’impulso ectopico
atriale è molto prematuro, esso può giungere al nodo AV
quando questo è ancora in condizioni di refrattarietà
assoluta o relativa. Nel primo caso (refrattarietà assoluta)
l’impulso ectopico non potrà attivare il nodo AV, per cui
viene “bloccato” e non raggiunge i ventricoli (all’ECG
l’onda P ectopica non è seguita dal QRS); nel secondo caso
(refrattarietà relativa) il nodo AV può essere attivato, ma in
modo più lento, per cui il tempo di conduzione dell’impulso dagli atri ai ventricoli risulta allungato rispetto a
quello rilevabile durante il ritmo sinusale (allungamento
dell’intervallo P’-R all’ECG).
Un comportamento anomalo della conduzione ai ventricoli di un’extrasistole atriale può verificarsi anche a
livello del sistema specifico di conduzione intraventri-
C0055.indd 254
colare. Il periodo refrattario della branca destra, infatti,
è abitualmente più lungo di quello della branca sinistra.
L’onda di depolarizzazione di un’extrasistole atriale può
quindi giungere alle branche quando la branca destra
è ancora in condizioni di refrattarietà, ma la branca
sinistra ha già recuperato la sua eccitabilità. In questo
caso l’impulso elettrico sarà bloccato nella branca destra
e potrà attivare i ventricoli solo attraverso la branca
sinistra. All’ECG il QRS che ne risulta, che segue la P
extrasistolica, avrà una morfologia che indica una conduzione dell’impulso diversa da quella del normale ritmo sinusale (per questo definita conduzione aberrante),
e per la precisione, in questo caso, tipica del blocco di
branca destra (si veda Fig. 11.7). È da osservare tuttavia
che, in diversi casi (soprattutto in presenza di alcune
cardiopatie), è la branca sinistra a presentare un periodo
refrattario più lungo rispetto alla branca destra, per cui
un’extrasistole atriale suffi cientemente precoce verrà
bloccata nella branca sinistra e il QRS all’ECG avrà una
morfologia “aberrante” a blocco di branca sinistra.
Abitualmente un’extrasistole atriale, insorgendo prematuramente dopo una scarica del nodo del seno, nel
depolarizzare gli atri riesce anche a penetrare nello
stesso nodo del seno, depolarizzando precocemente
le cellule segnapassi in un momento della loro fase 4.
Ciò comporta un “azzeramento” del ciclo di autodepolarizzazione delle cellule sinusali, che inizieranno
il nuovo ciclo dal momento in cui hanno recuperato
dalla depolarizzazione indotta dall’extrasistole. Se non
intervengono altri fenomeni, il nodo del seno emetterà
il primo impulso di attivazione degli atri dopo l’extrasistole con un intervallo di tempo simile a quello
del ciclo sinusale. All’ECG questa sequenza di eventi
è manifestata dai seguenti reperti: 1) l’intervallo tra
l’extrasistole (P’) e l’onda P precedente è più corto di un
normale intervallo P-P sinusale; 2) l’intervallo tra l’extrasistole e l’onda P sinusale successiva è simile a quello
del normale intervallo P-P sinusale; 3) come risultato,
l’intervallo tra le due onde P sinusali che contengono
l’extrasistole, che è dato dalla somma dei due intervalli
precedenti, è inferiore al doppio di un normale ciclo
P-P sinusale.
In realtà, l’intervallo che segue l’extrasistole atriale è in
genere leggermente più lungo del normale ciclo sinusale, in quanto al tempo che il nodo del seno impiega
per raggiungere nuovamente il potenziale di soglia dopo
la depolarizzazione da parte dell’extrasistole (che corrisponde al ciclo sinusale) bisogna sommare il tempo che
l’extrasistole impiega per raggiungere e depolarizzare il
nodo del seno. In ogni caso, la somma degli intervalli
che separano l’extrasistole dalla P sinusale precedente
e dalla P sinusale seguente rimane inferiore al doppio
dell’intervallo tra due battiti sinusali; si può dire, perciò,
che la breve pausa che segue il battito extrasistolico non è
sufficiente a compensare l’accorciamento dell’intervallo di
copula, per cui questa pausa è definita non compensatoria
(si veda Fig. 11.13).
Le extrasistoli atriali di solito non influenzano in modo significativo l’attività di pompa del cuore. Esse sono spesso
asintomatiche, ma in diversi casi possono essere avvertite
come sensazione di “cuore che si ferma”, “salti del cuore”
o, se frequenti, di “sfarfallio” nel petto.
6/9/10 9:48:16 AM
Capitolo 11 - ARITMIE
All’esame obiettivo del paziente si apprezza un polso
regolare, ma interrotto più o meno frequentemente
dall’apparente salto di un battito o da un battito anticipato di scarsa ampiezza; ciò è dovuto al fatto che
l’extrasistole, inducendo la contrazione dei ventricoli
in una fase in cui il riempimento ventricolare è limitato, determina una gittata sistolica ridotta rispetto al
normale, per cui l’onda sfi gmica corrispondente può
essere ridotta a tal punto da non essere percepita o essere appena percepita al polso radiale. Parallelamente,
all’auscultazione del cuore si avvertono saltuariamente
dei toni anticipati.
Si è visto che le extrasistoli giunzionali diffondono ai
ventricoli in modo normale, determinando la formazione
di QRS con morfologia analoga a quella dei complessi
sinusali. Come per le extrasistoli atriali, tuttavia, se il battito prematuro giunzionale è molto precoce, la diffusione
dello stimolo ai ventricoli può avvenire con conduzione
aberrante (si veda in precedenza).
Cause, fisiopatologia, sintomi e segni clinici delle extrasistoli giunzionali sono analoghi a quelli dei battiti
prematuri atriali. Anche le extrasistoli giunzionali hanno
di solito un andamento benigno e non richiedono abitualmente un trattamento specifico.
255
1
Extrasistolia ventricolare
Terapia
In genere le extrasistoli atriali sono aritmie benigne
che non richiedono uno specifico trattamento antiaritmico. Quando possibile, vanno eliminati o corretti
eventuali fattori che possono favorire l’aritmia (fumo, sostanze eccitanti, stress, disordini elettrolitici,
disturbi gastroesofagei, distiroidismo, scompenso
cardiaco ecc.). Spesso, però, non è possibile individuare specifici fattori favorenti. Se i sintomi sono
frequenti e poco tollerati, farmaci utili sono quelli
di classe I, II e III.
Extrasistolia giunzionale
Le extrasistoli giunzionali sono meno comuni di quelle
atriali e ventricolari. Hanno origine nella giunzione AV
(nodo AV e fascio di His) e possono diffondere sia verso
gli atri sia verso i ventricoli. L’ordine con cui l’impulso
ectopico diffonde verso gli atri e i ventricoli dipende anzitutto dalla sede di origine dell’extrasistole.
Se l’extrasistole ha origine nella parte media del nodo
AV, l’impulso attiverà pressoché contemporaneamente
gli atri e i ventricoli. All’ECG si osserverà un complesso
QRS prematuro, di morfologia identica a quello sinusale
(l’attivazione dei ventricoli, infatti, avviene anche in
questo caso attraverso le normali vie di conduzione) ma
non preceduto da onde P (si veda Fig. 11.13); l’attivazione atriale, infatti, avvenendo contemporaneamente
a quella ventricolare, sarà mascherata dal QRS, che ha
un’ampiezza molto maggiore. Se l’extrasistole giunzionale ha origine nella parte bassa del nodo AV (o nel fascio
di His), l’impulso arriverà prima ai ventricoli che, per via
retrograda, agli atri. All’ECG si osserverà ancora un QRS
normale prematuro, questa volta con un’onda P subito
dopo la sua fine. Se, infine, l’extrasistole giunzionale ha
origine nella parte alta del nodo AV, l’impulso arriverà
prima, per via retrograda, agli atri che, per via anterograda, ai ventricoli; in questo caso all’ECG si osserverà
ancora un QRS normale prematuro, ma immediatamente
preceduto da un’onda P ectopica, con un intervallo P’-R
molto breve (≤ 0,10 sec).
È importante osservare che l’attivazione retrograda degli
atri da parte di un impulso che provenga dal nodo AV
avviene con una sequenza tipica, con direzione inferosuperiore e postero-anteriore; all’ECG ciò dà origine a
un’onda P caratteristica, negativa nelle derivazioni inferiori (D2, D3, aVF) e positiva e appuntita in V1.
C0055.indd 255
Le extrasistoli ventricolari costituiscono la forma di aritmia più frequente. Anch’esse si possono manifestare sia
in presenza sia in assenza di cardiopatia. In assenza di
cardiopatia riconoscono gli stessi fattori favorenti descritti per le extrasistoli atriali. In presenza di cardiopatia
si manifestano molto frequentemente in corso di infarto
miocardico e scompenso cardiaco.
All’ECG le extrasistoli ventricolari sono caratterizzate
da complessi QRS prematuri più larghi di quelli del
normale ritmo sinusale (di solito la durata è superiore
a 0,12 sec), non preceduti da onde P (si veda Fig. 11.13).
Nella maggior parte dei casi l’extrasistole ventricolare non riesce ad arrivare ad attivare gli atri e, quindi,
a penetrare nel nodo del seno, in quanto l’impulso
elettrico è in genere bloccato nel nodo AV; ne deriva
che l’extrasistole non interferisce con la formazione
ritmica dell’impulso sinusale e la relativa attivazione
sinusale degli atri. Tuttavia, l’onda P sinusale che cade all’interno del battito ventricolare prematuro non
riesce a sua volta a propagarsi ai ventricoli, in quanto
trova le vie di conduzione o gli stessi ventricoli ancora
in uno stato di refrattarietà, causata dall’extrasistole
ventricolare appena occorsa. Ciò determina una pausa
dopo l’extrasistole, che termina con la comparsa del
successivo battito sinusale.
Poiché l’extrasistole ventricolare non influenza il ciclo
sinusale, ma causa comunque la mancata conduzione
della P che interviene subito dopo la sua comparsa, ne
deriva che l’intervallo tra le due P sinusali condotte che
precedono e seguono l’extrasistole è pari al doppio del
normale ciclo sinusale; poiché questo intervallo è dato
dalla somma dell’intervallo prematuro di copula dell’extrasistole e dall’intervallo della pausa postextrasistolica, si
dice che quest’ultima è compensatoria, in quanto è lunga
tanto da compensare la brevità dell’intervallo di copula,
facendo risultare l’intervallo fra il complesso normale che
precede e quello che segue il battito prematuro uguale a
due cicli sinusali (si veda Fig. 11.13).
Quando la frequenza del nodo del seno è sufficientemente
bassa, tuttavia, è possibile che il battito del ritmo sinusale immediatamente successivo all’extrasistole giunga al
sistema di conduzione e ai ventricoli quando essi hanno
già recuperato una normale eccitabilità, e quindi riesca ad
attivare i ventricoli. In questo caso anche questa P sinusale
è seguita da un QRS normale, per cui l’extrasistole ventricolare si viene a porre fra due battiti sinusali consecutivi normalmente condotti. Quando si verifica questa circostanza,
si parla di extrasistole ventricolare interpolata.
6/9/10 9:48:16 AM
256
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Si deve anche osservare che, in alcuni casi, i battiti prematuri ventricolari possono diffondere per via retrograda
agli atri (battiti “retrocondotti”); la retroconduzione può
essere, in genere, identificata all’ECG dalla presenza di
un’onda P anomala che si inscrive sul tratto ST dell’extrasistole. In questi casi, l’extrasistole ventricolare può
arrivare a depolarizzare il nodo del seno e, quindi, non
essere seguita da una pausa compensatoria (si veda in
precedenza, Extrasistolia atriale).
Le extrasistoli ventricolari possono essere considerate
più o meno rilevanti dal punto di vista clinico in base
ad alcune loro caratteristiche, ma il loro significato
dipende soprattutto dal contesto clinico nel quale si
manifestano. I caratteri ECG considerati potenzialmente a rischio comprendono: (1) una frequenza elevata
(≥ 10 per ora); (2) la presenza di forme ripetitive (coppie, salve di tachicardia ventricolare non sostenuta);
(3) polimorfismo; (4) una precocità marcata, indicata
dall’occorrenza delle extrasistoli all’apice o nella branca
discendente dell’onda T del battito sinusale precedente
(fenomeno “R su T”).
Quest’ultimo fenomeno è una condizione a rischio, in
quanto l’extrasistole interviene in un momento (onda T)
in cui vi è una disomogeneità dello stato elettrico delle
cellule ventricolari, essendo alcune già ripolarizzate, ma
altre ancora nel loro periodo refrattario assoluto o relativo. La lenta eccitazione di queste ultime potrà favorire la
successiva eccitazione delle cellule colte durante il periodo
refrattario assoluto, creando le premesse per meccanismi
di rientro che rischiano di degenerare in fibrillazione
ventricolare.
Il valore che le forme “a rischio” delle extrasistoli ventricolari hanno, tuttavia, dipende in modo fondamentale dal
quadro clinico in cui si verificano. Così, in presenza di un
cuore strutturalmente e funzionalmente sano, il rischio di
eventi aritmici maggiori a esse connesso è sostanzialmente
nullo. D’altro canto, il loro riscontro in alcune forme di
cardiopatia indica un aumento significativo del rischio di
eventi aritmici potenzialmente fatali. In questo senso il
contesto clinico di maggiore pericolo è l’infarto miocardico acuto, in cui le extrasistoli ventricolari, soprattutto
ripetitive e precoci, possono innescare aritmie mortali.
Dal punto di vista emodinamico, l’extrasistole ventricolare interrompe il riempimento diastolico rapido dei ventricoli e priva il riempimento ventricolare della quota dovuta
alla sistole atriale. Questa interferenza è tanto maggiore
quanto più il battito ectopico è precoce. La sistole indotta
dal battito prematuro svuota un ventricolo che ha potuto
riempirsi solo parzialmente e genera pertanto una gittata
sistolica ridotta. D’altro canto, la pausa compensatoria
che segue l’extrasistole consente un tempo di riempimento diastolico più lungo. Ne consegue che la quantità di
sangue presente al termine della pausa postextrasistolica
è maggiore di quella presente al termine di una normale
diastole, per cui la gittata sistolica del battito sinusale
postextrasistolico è maggiore del normale, tanto da poter
essere avvertita dal paziente come un “battito forte” o un
“colpo nel petto”.
L’interferenza delle extrasistoli ventricolari sull’emodinamica cardiaca è, comunque, insignificante quando esse
sono isolate, ma può essere significativa se sono frequenti,
ripetitive e il miocardio presenta alterazioni funzionali.
C0055.indd 256
Come le sopraventricolari, anche le extrasistoli ventricolari sono nella maggior parte dei casi asintomatiche.
In diversi casi, tuttavia, esse possono causare disturbi
legati alla percezione dell’aritmia, come senso di irregolarità del battito cardiaco, o sensazioni tipo “cuore
che si ferma, che perde colpi o che dà colpi più forti”.
Raramente, e in genere solo in pazienti che presentano
gravi deficit contrattili di base, extrasistoli ventricolari
frequenti possono facilitare la comparsa di segni di
scompenso cardiaco (dispnea e segni di bassa portata
periferica).
L’esame obiettivo evidenzia reperti analoghi a quelli delle extrasistoli sopraventricolari, principalmente
polso regolare interrotto da pulsazioni anticipate di
scarsa ampiezza oppure da brevi pause senza apparenti
pulsazioni, con battito successivo (postextrasistolico)
particolarmente ampio. Se a livello del polso radiale le
extrasistoli si manifestano solo come saltuaria mancanza
di battiti, l’auscultazione cardiaca permette di apprezzare la presenza dei battiti prematuri, consentendo la
diagnosi corretta.
L’auscultazione del cuore, insieme alla palpazione del
polso radiale, può essere importante anche nei casi di
bradicardia regolare al polso. Questa, infatti, potrebbe
essere legata, piuttosto che a una bradicardia vera, alla
presenza di un’extrasistolia ventricolare bigemina, che
simula una bradicardia al polso perché in periferia si
apprezzano solo i battiti sinusali e non quelli extrasistolici.
Terapia
La terapia delle extrasistoli ventricolari deve essere
principalmente rivolta alla rimozione o al miglioramento di eventuali condizioni che ne favoriscono la
manifestazione. In particolare, va interrotta l’eventuale assunzione di sostanze eccitanti, va corretto
uno stato di scompenso cardiaco o un’eventuale
ipokaliemia e vanno sospesi farmaci potenzialmente
proaritmici, come la digitale, in caso di sospetto o
accertato sovradosaggio. L’indicazione a un trattamento antiaritmico farmacologico è legata alla
frequenza con cui l’aritmia si manifesta (numero
di extrasistoli all’ora), ai sintomi che induce e alla
condizione patologica alla quale è associata. Durante un infarto miocardico acuto, in particolare,
i battiti prematuri ventricolari non richiedono un
trattamento farmacologico specifico. I farmaci principalmente impiegati sono quelli della I e II classe
e l’amiodarone. Nei casi, veramente eccezionali, di
extrasistoli ventricolari molto frequenti, fortemente sintomatiche e refrattarie al trattamento medico, può essere tentato un trattamento di ablazione
transcatetere del focus aritmico, individuato al SEF
mediante mappaggio intracavitario.
Parasistolia
La parasistolia è una forma rara di aritmia dovuta alla presenza di un centro automatico ectopico (atriale,
6/9/10 9:48:16 AM
Capitolo 11 - ARITMIE
giunzionale o ventricolare) che ha la caratteristica di essere
protetto dal ritmo sinusale (e da altri ritmi esterni) da un
blocco in entrata, per cui esso non può essere depolarizzato
da nessun impulso elettrico che attivi il cuore; allo stesso
tempo, però, gli impulsi da esso generati possono attivare normalmente il miocardio ogniqualvolta questo può
essere eccitato (quando non è, cioè, in uno stato di refrattarietà).
La parasistolia di gran lunga più frequente è quella
ventricolare, che all’ECG può essere diagnosticata sulla base di tre criteri: (1) la copula dei battiti ectopici
ventricolari è variabile; infatti, il focus parasistolico
ha una sua frequenza di scarica regolare che non è influenzata dal ritmo sinusale, quindi non ha con questo
alcuna relazione; (2) gli intervalli tra i battiti ectopici
sono multipli di un comune denominatore (che rappresenta il ciclo intrinseco di scarica del focus) (si veda
Fig. 11.13); (3) sono spesso presenti battiti di fusione
ventricolare; infatti, in diverse occasioni la scarica del
centro parasistolico avviene casualmente contemporaneamente all’arrivo ai ventricoli dell’impulso sinusale,
per cui i ventricoli saranno attivati da due fronti d’onda; ne risulterà un QRS intermedio tra quello sinusale
e quello parasistolico.
La parasistolia non ha in genere un significato clinico
particolare e non necessita di trattamento, a meno che
la sua frequenza di scarica sia molto elevata e dia origine
a una tachicardia ventricolare (tachicardia parasistolica),
evenienza peraltro molto rara.
257
A. Tachicardia sinusale
B. Tachicardia atriale con conduzione AV 2:1
C. Tachicardia atriale polifocale
D. Ritmo giunzionale accelerato
(a) Semplice tachicardia sinusale; (b) tachicardia atriale a frequenza 160 bpm, con
conduzione (o blocco) AV 2:1; (c) tachicardia atriale polifocale; si notino la presenza
di onde P con diverse morfologie e la notevole irregolarità degli intervalli tra le onde P;
(d) ritmo giunzionale accelerato; si notino i complessi QRS stretti, non preceduti da onde
P; all’inizio della striscia sono in effetti presenti tre onde P sinusali (frecce) appena prima
dei complessi QRS; queste onde P, tuttavia, non sono condotte (intervallo P-R troppo
corto): dissociazione AV.
1
Figura 11.14
Alcune forme
di tachiaritmie
sopraventricolari.
All’auscultazione il medico avverte toni frequenti, leggermente variabili con gli atti del respiro; spesso l’intensità
dei toni è ridotta quando la tachicardia è secondaria a
scompenso cardiaco. In questo caso sono in genere presenti anche altri segni di scompenso. Non è necessaria
una terapia specifica della tachicardia sinusale, se non
quella di evidenziare e curare eventuali patologie che ne
sono causa.
Tachicardie sopraventricolari
Tachicardia sinusale inappropriata
Per tachicardia si intende, in generale, un ritmo con una
frequenza cardiaca superiore o uguale a 100 bpm. Esistono
in clinica vari tipi di tachicardia, che vengono classificate
in base alla loro sede di insorgenza e ai meccanismi che
ne sono responsabili (si veda Tab. 11.4).
Tachicardia sinusale
La tachicardia sinusale è caratterizzata da una sequenza
ritmica di battiti con frequenza ≥ 100/min che partono,
come di norma, dal nodo del seno e danno luogo a una
normale successione dell’onda di attivazione del cuore
(Fig. 11.14). Essa, in genere, rappresenta semplicemente
una risposta normale a condizioni fisiologiche (classicamente uno sforzo o una situazione di stress emotivo) o
patologiche (per esempio, febbre, anemia, ipotensione,
ipertiroidismo, scompenso cardiaco) che aumentano, in
modo diretto o indiretto, l’attività adrenergica che, come
visto in precedenza, insieme alla riduzione dell’attività
vagale è la principale causa dell’accelerazione della frequenza di scarica del nodo sinusale.
All’ECG la tachicardia sinusale si presenta come una successione regolare di onde P di morfologia normale, seguite regolarmente dal QRS. L’intervallo P-R è entro valori
normali. L’MSC determina solo una lieve e transitoria
riduzione della frequenza cardiaca, che risale rapidamente
ai valori precedenti dopo la sua interruzione.
La tachicardia sinusale insorge e termina di solito in modo
graduale, senza quelle variazioni repentine della frequenza cardiaca che sono, viceversa, tipiche della tachicardie
ectopiche.
C0055.indd 257
Questa rara forma di tachicardia presenta tutte le caratteristiche ECG di una tachicardia sinusale fisiologica,
con onda P tipica di un’origine sinusale. Essa ricorre in
modo incessante senza apparenti cause (sia fisiologiche
sia patologiche) o in seguito a sforzi anche leggeri, per
cui l’accelerazione del ritmo sinusale appare appunto
“inappropriata”. Le cause di questa tachicardia non sono
chiare, ma essa potrebbe essere legata a un nodo sinusale
intrinsecamente tendente a una frequenza di scarica elevata, a un’attività adrenergica di base più elevata o anche
all’attività di un focus ectopico molto vicino al nodo del
seno che dà origine a onde P sostanzialmente identiche
a quelle sinusali.
La tachicardia sinusale inappropriata si riscontra più
frequentemente in ragazze e giovani donne e, se causa
disturbi (palpitazioni), può essere trattata con farmaci di
classe II e IV.
Tachicardia da rientro seno-atriale
Questa rara forma di tachicardia, come dice il termine,
è dovuta a un rientro nei tessuti perinodali sinusali.
È caratterizzata da onde P del tutto identiche a quelle
sinusali, con una frequenza in genere relativamente
bassa, intorno a 120-130 bpm (range 110-150). Per tale
motivo essa è di solito ben tollerata. Contrariamente
alle precedenti, ha un’origine improvvisa ed è innescata
da extrasistoli.
L’aritmia può essere sbloccata con il semplice MSC. La
terapia farmacologica è basata su antiaritmici di classe II
e IV (-bloccanti e calcio-antagonisti).
6/9/10 9:48:16 AM
258
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Tachicardia atriale
La tachicardia atriale si caratterizza per la presenza
all’ECG di un ritmo atriale regolare con onde P identiche, ma diverse dalla P sinusale. La tachicardia atriale
può avere origine da un centro atriale ectopico (tachicardia atriale automatica o focale) o essere dovuta a un
circuito di rientro intra-atriale. La frequenza abituale è
di 130-220 bpm.
L’attivazione dei ventricoli avviene attraverso le normali
vie di conduzione, e quindi il QRS è in genere normale.
La conduzione AV può avvenire con un rapporto 1:1; in
questo caso, la frequenza ventricolare è tachicardica e
uguale a quella atriale. Nei casi in cui la frequenza atriale è
elevata (in genere > 200 bpm), tuttavia, la conduzione AV
può avvenire con un rapporto AV maggiore (per esempio,
2:1-3:1), configurando la cosiddetta tachicardia atriale
bloccata (si veda Fig. 11.14), spesso dovuta a intossicazione digitalica o ipokaliemia.
La tachicardia atriale risponde soprattutto a farmaci di
classe IA, IC e III. Se si vuole controllare semplicemente la
frequenza cardiaca, si possono utilizzare farmaci di classe
II e IV. Sporadicamente è necessario ricorrere alla cardioversione elettrica per sbloccare l’aritmia.
il ritmo ectopico prende il sopravvento sull’attivazione
fisiologica del nodo del seno.
Dal punto di vista elettrocardiografico, questi ritmi si
esprimono come successione regolare di complessi QRS di
morfologia normale non preceduti da onde P sinusali. Gli
atri possono essere attivati per via retrograda, con onde
P tipiche della retroconduzione dal nodo AV (si veda in
precedenza, Extrasistolia giunzionale) oppure continuare
a essere attivati, come di norma, dal nodo del seno. In
quest’ultimo caso, le onde P hanno aspetto normale, ma
non hanno alcuna relazione con i complessi QRS, cioè con
l’attività ventricolare. Atri e ventricoli, cioè, presentano
due ritmi differenti del tutto indipendenti (dissociazione
atrioventricolare).
Queste aritmie sono relativamente frequenti in condizioni di tossicità digitalica, di febbre reumatica o di infarto miocardico diaframmatico, ma possono verificarsi
anche in soggetti con cuore del tutto sano. La frequenza
di attivazione aumenta con l’esercizio fisico e può essere
rallentata dall’MSC.
Il ritmo giunzionale accelerato di solito non dà sintomi
e raramente richiede una terapia specifica; la tachicardia
giunzionale si avvale principalmente del trattamento con
calcio-antagonisti e -bloccanti.
Tachicardia atriale polifocale
Questa forma particolare di tachicardia atriale è così chiamata in quanto sono presenti due o più onde
P ectopiche a morfologia differente, che suggeriscono
un’origine da almeno due foci ectopici atriali; gli intervalli tra le onde P sono irregolari; come risultato, anche
l’attività ventricolare è irregolare, simulando, in diversi
casi, una fibrillazione atriale (si veda Fig. 11.14). Questa
aritmia insorge con una certa frequenza in pazienti con
broncopneumopatia cronica ostruttiva o insufficienza
respiratoria.
La terapia è mirata soprattutto alla patologia di base ed
eventualmente al controllo della frequenza cardiaca con
calcio-antagonisti e, in casi selezionati, -bloccanti.
Ritmo atriale accelerato
Si parla di ritmo atriale accelerato quando un centro ectopico atriale aumenta la sua frequenza di scarica a valori
superiori a quella del nodo del seno, in modo da prendere
il comando del ritmo cardiaco. L’ECG mostra un ritmo
regolare, a frequenza inferiore a 100 bpm e l’onda P è
morfologicamente atipica. Questa aritmia può verificarsi
in soggetti sani, come in varie malattie cardiache, ma è
assolutamente benigna e non richiede alcuna forma di
trattamento.
Ritmo giunzionale accelerato e tachicardia
giunzionale automatica
Il ritmo giunzionale accelerato e la tachicardia giunzionale
automatica sono caratterizzati da un esaltato automatismo
di pacemaker situati nel nodo AV. La distinzione tra i due
ritmi è basata essenzialmente su un criterio di frequenza.
Si parla di ritmo giunzionale accelerato se la frequenza
è inferiore a 100 bpm (si veda Fig. 11.14), di tachicardia
giunzionale se superiore o uguale a 100 bpm. Come visto
in precedenza, in condizioni normali la frequenza di attivazione intrinseca di questi pacemaker è di circa 40-60
bpm. In alcune condizioni la loro frequenza aumenta e
C0055.indd 258
Tachicardia parossistica sopraventricolare
da rientro nel nodo AV o reciprocante nodale
Si definisce tachicardia parossistica sopraventricolare (TPSV) una tachicardia di origine sopraventricolare, di durata
variabile da pochi minuti a ore, che insorge e termina improvvisamente. La TPSV da rientro nel nodo AV è la forma
più frequente di queste tachicardie, rappresentando circa i
due terzi dei casi. Essa si manifesta più di frequente in età
giovanile, ma si può presentare anche nella fascia di età
superiore ai 40 anni, soprattutto tra le donne.
Patogenesi
Il substrato anatomofunzionale della TPSV da rientro
nel nodo AV è costituito dall’esistenza, nel nodo AV di
questi pazienti, di due vie di conduzione, con proprietà
elettrofisiologiche diverse: una con capacità di conduzione rapida (via veloce o fast pathway) e una a conduzione
meno rapida (via lenta o slow pathway) (Fig. 11.15). Le due
vie, inoltre, differiscono anche per il periodo refrattario,
che è significativamente più lungo nelle cellule della via
veloce. Poiché il circuito di rientro è localizzato interamente nel nodo AV, esso costituisce un tipico esempio
di microrientro.
La TPSV da rientro nodale AV è, nella maggior parte dei
casi, innescata da un’extrasistole atriale. Quando questa,
infatti, arriva al nodo AV in un momento in cui la via
rapida è ancora nel periodo di refrattarietà, mentre la
via lenta ha già recuperato la sua eccitabilità dopo la
precedente attivazione (periodo refrattario più corto),
l’impulso sarà bloccato nella prima e potrà essere condotto solo lungo la seconda. Tuttavia, mentre prosegue
anterogradamente verso il fascio di His, l’impulso elettrico può attivare la via rapida in senso retrogrado, qualora
questa abbia recuperato l’eccitabilità nella zona in cui
l’impulso era stato bloccato. L’attivazione retrograda
della via rapida continua con la trasmissione retrograda
dell’impulso agli atri, ma, contemporaneamente, con una
6/9/10 9:48:17 AM
Capitolo 11 - ARITMIE
nuova attivazione anterograda della via lenta, innescando
e perpetuando il rientro.
È da notare che, per le differenti proprietà elettrofisiologiche delle due vie, il tempo che l’impulso impiega a
scendere lungo la via lenta (e poi andare ai ventricoli)
è più lungo rispetto al tempo che l’impulso impiega a
risalire lungo la via rapida (e agli atri). Ne risulta che
l’attivazione dei ventricoli e degli altri è pressoché contemporanea.
All’ECG la TPSV da rientro nodale AV si presenta con QRS
regolari, di solito normali e, in genere, senza chiare onde
P visibili, in quanto queste sono situate dentro il QRS,
oppure con onde P appena visibili, come piccole incisure,
nella parte terminale del QRS o immediatamente dopo.
Ne deriva che, quando le onde P sono visibili, l’intervallo
P-R (tra un’onda P e il QRS successivo) è maggiore dell’intervallo R-P (tra un QRS e la P successiva), che non misura
mai più di 70-80 msec (Fig. 11.16).
La tachicardia descritta è la forma di gran lunga più frequente e tipica di TPSV da rientro nodale AV, ed è detta
tipo slow-fast, perché utilizza la via lenta per la conduzione anterograda e la rapida per quella retrograda.
In un piccolo numero di casi, tuttavia, il rientro avviene
in senso inverso al precedente, dando origine alla TPSV
da rientro nodale AV tipo fast-slow. In questo caso, infatti,
l’impulso scende lungo la via rapida e risale lungo la via
lenta. All’ECG, durante la tachicardia, le onde P retrograde sono visibili dopo il QRS e l’intervallo R-P è maggiore
di 80 msec, in genere circa 110-120 msec, e il P-R è simile
a quello del ritmo sinusale. In questo caso è più difficile la
diagnosi differenziale con la tachicardia parossistica della
sindrome di Wolff-Parkinson-White (WPW).
Manifestazioni cliniche
La tachicardia ha insorgenza improvvisa e termina altrettanto improvvisamente. Può talora comparire in seguito
a sforzi, emozioni o tutto ciò che in un paziente contribuisce alla comparsa di extrasistoli, che, come detto,
rappresentano il “trigger” della tachicardia. La durata
è molto variabile, da qualche minuto a ore. Anche la
frequenza è variabile (da 130 a 220 bpm), ma di solito è
sui 170-200 bpm.
Per lo più la TPSV da rientro nodale AV dà solo palpitazioni, mentre raramente il paziente riferisce lipotimie. Il
comportamento nel tempo è anch’esso variabile, anche
se spesso vi è una tendenza all’aumento della frequenza
e della durata degli episodi, che possono anche diventare
più difficili da prevenire con una terapia farmacologica. La
TPSV da rientro nodale AV si verifica di solito in soggetti
esenti da cardiopatie strutturali.
Diagnosi
Deve sempre essere sospettata in soggetti giovani che
riferiscono episodi di tachicardia improvvisa. L’ECG al di
fuori della tachicardia è in genere del tutto normale. La
diagnosi all’ECG durante la tachicardia è abitualmente
semplice da porre. Nei casi in cui non si riesca a documentare la tachicardia, può essere utile un monitoraggio
continuo dell’ECG o un SEF transesofageo che in genere
consente di indurre l’aritmia e di porre diagnosi. Un SEF
endocavitario diventa necessario solo in previsione di una
procedura di ablazione.
C0055.indd 259
Terapia
La TPSV da rientro nodale AV può essere risolta in
molti casi dall’applicazione di manovre di stimolazione vagale (MSC anzitutto). I farmaci di elezione per lo sblocco dell’aritmia sono l’adenosina e il
verapamil, somministrati per e.v., sebbene diversi
altri farmaci antiaritmici (-bloccanti, propafenone ecc.) siano potenzialmente in grado di sbloccare
l’aritmia.
I farmaci di prima scelta per la prevenzione degli
episodi di TPSV sono quelli di classe IV (verapamil,
diltiazem) e classe II (-bloccanti). Il trattamento
definitivo si può ottenere con l’ablazione, con radiofrequenza o con crioablazione, della via lenta, eseguita con successo nel 99% dei casi. Vista comunque
la vicinanza della porzione compatta del nodo AV,
l’ablazione ha un rischio, seppure a oggi estremamente basso, di lesione del nodo AV, con sviluppo di
blocco AV completo.
Nodo AV
I
aVR
V1
V4
II
aVL
V2
V5
II
aVF
1
Nodo AV
Il substrato è rappresentato dalla presenza di una doppia via di conduzione all’interno del
nodo AV (qui schematizzato), che presenta diverse proprietà elettrofisiologiche. Una (via
veloce) conduce l’impulso più rapidamente (linee continue), ma ha un periodo refrattario
maggiore; l’altra (via lenta) conduce l’impulso più lentamente (linee tratteggiate), ma ha
un periodo refrattario minore. A sinistra è illustrato che cosa avviene durante un normale
battito sinusale. A destra le linee in blu indicano un impulso prematuro che trova la via
rapida B ancora refrattaria, per cui esso si trova a percorre solo la via lenta A. Arrivato al
punto di congiunzione distale, tuttavia, l’impulso può percorrere la via rapida in senso
retrogrado (linea rossa), se questa ha recuperato l’eccitabilità, dando origine al microrientro.
L’impulso attiva gli atri (retrogradamente) e i ventricoli (anterogradamente) ogni volta che
transita, rispettivamente, nel punto di divisione e di ricongiunzione delle due vie (si veda
il testo per i dettagli).
III
259
V3
V6
Figura 11.15
Meccanismo della
tachicardia da
rientro nodale AV.
Figura 11.16
Esempio di
tachicardia
parossistica
sopraventricolare
da rientro nodale
AV (frequenza
200 bpm).
6/9/10 9:48:17 AM
260
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Tachicardia parossistica sopraventricolare
da rientro AV
La TPSV da rientro AV è dovuta a un meccanismo di rientro il cui circuito comprende una via di conduzione atrioventricolare accessoria anomala, insieme al miocardio
atriale, alla normale via di conduzione AV e al miocardio
ventricolare (macrorientro).
Abbiamo già visto come, in condizioni normali, atri e
ventricoli siano elettricamente isolati e che l’unica via di
connessione tra di essi sia rappresentata dalle strutture
della giunzione AV. In alcuni soggetti, tuttavia, possono
essere presenti vie accessorie anomale che connettono
atri e ventricoli in aggiunta alla giunzione AV. Queste vie
accessorie sono costituite da piccoli fasci di fibre muscolari lungo le quali lo stimolo può essere condotto sia in
senso anterogrado (dagli atri ai ventricoli) sia in senso
retrogrado (dai ventricoli agli atri).
In questa situazione, se un impulso atriale sufficientemente prematuro (per esempio, un’extrasistole) trova
la via anomala in condizioni di refrattarietà quando
il nodo AV è ancora normalmente eccitabile, esso sarà
bloccato nella via accessoria, mentre potrà essere condotto ai ventricoli seguendo la via normale. Nell’attivare i ventricoli, l’impulso arriverà anche nella zona di
inserzione della via anomala ai ventricoli. Se questa ha
intanto recuperato la sua normale eccitabilità, essa può
condurre l’impulso per via retrograda agli atri (rientro).
Dagli atri, l’impulso può nuovamente ripercorrere per via
anterograda la via normale e così via, dando origine alla
His
Fascio
di Kent
a
Figura 11.17
Meccanismo
della tachicardia
parossistica.
b
(a) Meccanismo della tachicardia parossistica da rientro AV ortodromica. Il substrato è
rappresentato dalla presenza di una doppia via di conduzione AV, rappresentata dalla via
normale (nodo-His-branche) e da una via accessoria atrioventricolare (fascio di Kent), la
quale conduce l’impulso più rapidamente, ma ha un periodo refrattario maggiore rispetto
alle normali strutture di conduzione AV. A sinistra è illustrato che cosa avviene durante un
normale battito sinusale: l’impulso è condotto sia attraverso la via normale sia attraverso il
fascio anomalo. Al centro si osserva ciò che succede in caso di extrasistole atriale: l’impulso
è bloccato nel fascio di Kent per il suo maggiore periodo refrattario, per cui è condotto solo
attraverso la via normale. Arrivato al punto di connessione del fascio anomalo al ventricolo,
tuttavia, l’impulso può percorrere la via accessoria in senso retrogrado, se questa ha intanto
recuperato l’eccitabilità, dando origine al macrorientro. (b) Analogo schema che mostra il
meccanismo e il circuito di rientro della tachicardia parossistica da rientro AV antidromica
(si veda il testo per la spiegazione dettagliata).
C0055.indd 260
tachicardia (Fig. 11.17). Il tempo di percorrenza di questo
circuito (atrio-giunzione AV-ventricolo-via accessoriaatrio) avviene, in genere, in tempi molto brevi, per cui
si genera una tachicardia abbastanza veloce (in genere,
170-220 bpm). Questo tipo di TPSV da rientro AV è di
gran lunga la forma più frequente ed è definita ortodromica in quanto, durante la tachicardia, la conduzione
anterograda avviene attraverso le normali vie di conduzione AV e quella retrograda attraverso la via anomala.
Poiché la conduzione anterograda avviene attraverso
la giunzione AV, il QRS della tachicardia è stretto e di
morfologia di solito normale.
Tuttavia, in una piccola percentuale di pazienti (circa
il 5%), il rientro può avvenire in senso inverso a quello
descritto in precedenza. La via accessoria, cioè, è utilizzata per condurre l’impulso in senso anterogrado,
mentre la conduzione retrograda avviene attraverso la
giunzione AV. Questa forma di TPSV da rientro AV è
definita antidromica. In questo caso, i ventricoli sono
attivati interamente attraverso la via anomala, per cui
la tachicardia sarà caratterizzata da QRS molto slargati e
atipici (si veda Fig. 11.17).
Manifestazioni cliniche e diagnosi
Le crisi di TPSV da rientro AV possono cominciare molto presto nella vita di soggetti portatori di vie accessorie
AV o possono insorgere nella fase adolescenziale, quando gli stimoli ormonali e la crescita improvvisa fanno
aumentare i trigger (le extrasistoli) che possono scatenare l’aritmia. La durata e la frequenza degli episodi
aritmici variano molto da soggetto a soggetto e possono
cambiare significativamente con il tempo nello stesso
soggetto. La sintomatologia è altrettanto varia. La tachicardia è molto spesso l’unico sintomo. In alcuni casi
può essere presente dispnea o una sensazione lipotimica
all’innesco dell’aritmia. Nella maggior parte dei casi il
cuore è strutturalmente sano; tuttavia, è riportata una
maggiore prevalenza di vie accessorie nei pazienti con
anomalia di Ebstein, trasposizione delle grandi arterie,
prolasso mitralico e cardiomiopatia ipertrofica.
In un paziente con riferite crisi di tachicardia parossistica,
il riscontro all’ECG di un quadro di pre-eccitazione ventricolare di Wolff-Parkinson-White (WPW), che è diagnosticato dalla presenza di una via di conduzione anomala
(si veda Sindrome di WPW), suggerisce che gli episodi
siano dovuti a TPSV da rientro AV. Tuttavia, il riscontro di
WPW non indica necessariamente che è la via accessoria
la responsabile della tachicardia, così come non si può
escludere una TPSV da rientro AV in assenza di segni ECG
che indicano la presenza di una via anomala. In molti casi,
infatti, la via anomala è occulta, ma può essere utilizzata
ugualmente come via retrograda per dare origine a una
TPSV da rientro AV.
Se, come di solito avviene, si può registrare la tachicardia
all’ECG, la diagnosi di TPSV da rientro AV ortodromica
può essere abitualmente posta facilmente, o quanto meno
sospettata. La tachicardia ha frequenza 170-220 bpm, per
quanto può variare da 150 anche sino a 250 bpm; il QRS
è stretto e regolare ed è possibile in genere evidenziare
l’onda P retrograda dopo il QRS (di solito nel tratto ST
del complesso ventricolare) (Fig. 11.18).
6/9/10 9:48:19 AM
Capitolo 11 - ARITMIE
Più difficile è la diagnosi dei rari casi di TPSV da rientro
AV antidromica, che, presentandosi come una tachicardia a QRS slargati e atipici, può non essere differenziata facilmente da una tachicardia ventricolare (si veda
oltre). Un’anamnesi positiva per WPW può, tuttavia,
fare sospettare la diagnosi. Nei casi dubbi, lo studio
elettrofisiologico endocavitario consente in genere di
porre la diagnosi corretta e dà inoltre informazioni sulle proprietà elettrofisiologiche e sulla localizzazione
esatta della via accessoria, cosa importante per poter
procedere alla sua ablazione quando si ritenga indicato
(si veda sotto).
Terapia
Come la TPSV da rientro nodale, la TPSV da rientro
AV può essere sbloccata in diversi casi con manovre
di attivazione vagale (massaggio del seno carotideo).
Se queste sono inefficaci, i farmaci di elezione per lo
sblocco dell’aritmia sono quelli che allungano il periodo refrattario del nodo AV e facilitano, quindi, il
blocco dell’impulso a questo livello, interrompendo
il rientro. Questi farmaci comprendono l’adenosina,
i calcio-antagonisti non diidropiridinici (verapamil,
diltiazem) e i -bloccanti (propranololo, metoprololo ecc.), somministrati per via venosa. Il trattamento
farmacologico profilattico degli episodi di tachicardia parossistica è anch’esso basato sull’uso di farmaci
di classe II e IV, anche se possono essere utilizzati
farmaci di classe IC o III. La terapia definitiva delle
TPSV da rientro AV consiste nell’ablazione mediante
radiofrequenza o crioablazione della via accessoria
in corso di SEF. La percentuale di successo va dal
95 al 99%.
Sindrome di Wolff-Parkinson-White
Con il termine sindrome di Wolff-Parkinson-White si
dovrebbe intendere una storia clinica di TPSV in presenza
del tipico quadro ECG di pre-eccitazione ventricolare da
via anomala atrioventricolare (si veda oltre). Tuttavia,
nella pratica clinica il termine è spesso usato per indicare
il quadro ECG tipico della pre-eccitazione ventricolare,
anche in assenza di tachiaritmie.
Con il termine pre-eccitazione ventricolare si intende, in
generale, una condizione nella quale una parte del miocardio ventricolare viene attivata precocemente dall’impulso che proviene dagli atri attraverso una via diversa
dal normale sistema di conduzione AV, rappresentata da
una via accessoria atrioventricolare. Queste vie accessorie
sono costituite da fibre muscolari lungo le quali lo stimolo
viene condotto più velocemente che lungo il nodo AV.
L’attivazione che proviene dagli atri, quindi, utilizzando una di queste vie, arriva a stimolare una zona della
base dei ventricoli prima che l’impulso possa giungere
ai ventricoli seguendo la via di conduzione AV normale
(Fig. 11.19).
Anatomia
Durante le fasi iniziali dello sviluppo del cuore, le camere cardiache non sono separate dal punto di vista
C0055.indd 261
elettrico; al contrario, esse sono strettamente interconnesse senza soluzione di continuo. Quando si costituisce il tessuto fibroso che forma la struttura del trigono
centrale e i due anelli atrioventricolari, scompaiono pian
piano tutte le fibre muscolari di connessione tra gli atri
e i ventricoli, residuando solo il sistema di conduzione
specializzato della giunzione AV. Talora, però, alcuni di
questi fasci muscolari di connessione atrioventricolare
non scompaiono, costituendo una potenziale via accessoria di conduzione AV. Queste vie possono essere
localizzate ovunque nel solco atrioventricolare (si veda Fig. 11.19), eccetto che nella sede in cui la valvola
mitrale è in stretta continuità con l’aorta. Intorno al
50-60% esse sono localizzate a livello della parete libera
del ventricolo sinistro.
I fasci anomali atrioventricolari di conduzione (denominati anche fasci di Kent) sono costituiti da fibre Na+dipendenti, la cui capacità di conduzione è del tipo “tutto
o nulla”. Infatti, a differenza del nodo AV, che ha proprietà
decrementali, per cui uno stimolo progressivamente più
precoce rispetto al suo ciclo è condotto sempre più lentamente, sino a essere bloccato, queste vie o non conducono
affatto l’impulso elettrico, o lo conducono normalmente.
La conduzione può avvenire, in genere, sia dall’atrio al
ventricolo sia viceversa.
I fasci anomali di conduzione AV sono localizzati quasi
sempre a livello subendocardico, ma talora essi sono
intramiocardici o anche subepicardici. Quelli che più
frequentemente sono localizzati più in profondità nel
tessuto miocardico sono le vie postero-settali, mentre
le vie accessorie destre sono più spesso epicardiche rispetto alle vie sinistre. Nella maggior parte dei casi, in
un individuo è presente una sola via accessoria. In un
piccolo numero di soggetti, tuttavia, si possono avere
due o più vie anomale di conduzione (vie accessorie
multiple).
Una via anomala atrioventricolare presente in un paziente può essere manifesta, ossia conduce in modo
precoce l’impulso dagli atri ai ventricoli rispetto al nodo AV, e questa pre-eccitazione può essere chiaramente evidenziata all’ECG, oppure può essere occulta. In
questo caso, pur essendo anatomicamente presente, il
fascio anomalo non conduce mai l’impulso dagli atri
ai ventricoli, per cui all’ECG non viene notata alcuna
anomalia. Una via anomala presente in un paziente può
a volte rendersi manifesta e a volte può essere occulta
(pre-eccitazione intermittente).
261
1
Figura 11.18
Esempio di
tachicardia
parossistica
sopraventricolare
da rientro AV
(frequenza 250
bpm circa). Si
notino le onde
P chiaramente
visibili dopo il
QRS (frecce).
6/9/10 9:48:19 AM
262
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
1
10
65
2
35
Figura 11.19
A sinistra:
rappresentazione
schematica della
conduzione. A
destra: possibili
localizzazioni
delle vie anomale
lungo l’anello
atrioventricolare.
30
80
H
9
3
8
45
7
6
1 Parasettale anteriore destra
2 Anteriore destra
3 Laterale destra
4 Posteriore destra
5 Parasettale destra
5
6
7
8
9
10
4
Parasettale posteriore sinistra
Posteriore sinistra
Laterale sinistra
Anteriore sinistra
Parasettale anteriore sinistra
AV in presenza di un fascio di Kent (K); la conduzione attraverso la via anomala è complessivamente più rapida (in questo caso 60 msec + 35 msec = 95 msec) rispetto a quella che avviene
attraverso la via di conduzione AV normale (in questo caso 35 msec + 80 msec + 45 msec = 160 msec), per cui l’attivazione ventricolare inizierà nella zona del miocardio dove ha sede la via
accessoria prima che l’impulso possa giungere ai ventricoli attraverso il nodo AV, dando origine al quadro della pre-eccitazione ventricolare (si veda il testo per i dettagli).
Diagnosi e manifestazioni cliniche
Nel caso di una via accessoria manifesta l’ECG in ritmo
sinusale presenta il quadro caratteristico della pre-eccitazione di WPW, caratterizzato da:
• normali onde P;
• intervallo P-R più corto del normale (inferiore
o uguale a 0,12 sec);
• presenza di un impastamento iniziale nel QRS
(denominato onda );
• complessi QRS di morfologia anomala e di durata
aumentata, con alterazioni di vario grado
della ripolarizzazione (Fig. 11.20).
L’onda P è normale perché l’eccitazione atriale avviene
come di norma. Il P-R è più corto del normale perché
lo stimolo raggiunge i ventricoli più precocemente del
solito attraverso la “scorciatoia” rappresentata dal fascio
anomalo. L’onda (o onda di pre-eccitazione) è dovuta
all’eccitazione del settore di muscolo ventricolare che
riceve l’impulso precocemente attraverso la via anomala.
La lenta e precoce attivazione di questa parte del muscolo
ventricolare è inoltre responsabile dello slargamento e
dell’alterata morfologia del QRS. Il QRS, infatti, rappresenta la “fusione” di due fronti di attivazione dei ventricoli,
quello che scende precocemente lungo la via anomala e
quello che, un po’ dopo, raggiunge i ventricoli attraverso
la via normale.
Figura 11.20
Tipico quadro
di WPW tipo A
(localizzazione
posteriore della
via anomala). Si
osservi il P-R corto
e l’impastamento
della branca
ascendente del
QRS ben evidente
nelle precordiali e
in D1-aVL (onda ).
C0055.indd 262
Classicamente, sono distinti all’ECG due tipi di WPW in
base alla morfologia dell’onda δ: il WPW tipo A e il WPW
tipo B. Il WPW tipo A si caratterizza per l’onda positiva
nelle derivazioni precordiali anteriori (in V1 in particolare) (si veda Fig. 11.20); questo quadro è dovuto al fatto
che la pre-eccitazione avviene nel ventricolo sinistro, per
cui i vettori dell’onda sono diretti in avanti. Il WPW
tipo B, d’altro canto, si caratterizza per l’assenza di onda
o onda negativa nelle precordiali anteriori, a indicare
una pre-eccitazione a carico del ventricolo destro, per cui
i vettori iniziali sono diretti posteriormente e a sinistra.
In realtà, questa suddivisione è semplicistica. Infatti,
i quadri ECG determinati dalla pre-eccitazione ventricolare variano signifi cativamente in base alla sede
dell’inserzione del fascio anomalo nel ventricolo, sede
che, come detto, può essere in un punto qualsiasi della circonferenza dell’anello atrioventricolare. Un’analisi vettoriale dettagliata dell’onda di pre-eccitazione
all’ECG consente di localizzare con un’approssimazione
molto buona la sede della via anomala. Per esempio,
un’onda negativa in V1 identifica una via destra, una
negativa nelle derivazioni inferiori (D 2, D 3, avF) una
via posteriore, un’onda negativa in D1 e aVL una via
laterale. La manifestazione clinica tipica della sindrome
di WPW è la TPSV da rientro AV ortodromica. In molti
casi, tuttavia, i pazienti con WPW sono asintomatici e la
presenza della pre-eccitazione è rilevata occasionalmente a un ECG eseguito di routine. È importante notare che
all’ECG l’onda δ scompare durante la TPSV da rientro
AV ortodromica, in quanto la via accessoria è utilizzata
per la conduzione retrograda. Nei rari casi di TPSV da
rientro AV antidromica, d’altro canto, l’attivazione dei
ventricoli avviene interamente attraverso la via accessoria, per cui la tachicardia sarà caratterizzata da QRS
anomali (si veda TPSV da rientro AV).
Prognosi
La prognosi dei pazienti con sindrome di WPW è generalmente buona. Per un piccolo gruppo di pazienti,
6/9/10 9:48:21 AM
Capitolo 11 - ARITMIE
tuttavia, esiste il rischio di sviluppare aritmie che possono causare sincope e morte improvvisa, un evento particolarmente drammatico in questi casi perché colpisce
soggetti giovani, o anche solo adolescenti. L’incidenza
di questa grave complicanza è, in ogni caso, molto bassa
(<1 per 1000 per anno). Essa, inoltre, solo eccezionalmente costituisce la prima manifestazione sintomatica
della malattia, mentre di solito si verifi ca in pazienti
sintomatici per tachiaritmie, che quindi devono essere
ben valutati per escludere la presenza di un rischio significativo di morte improvvisa. Il fattore più importante in
questo senso è l’evidenza di un periodo refrattario della
via anomala particolarmente corto (< 250 msec).
La ragione per cui in questo gruppo di pazienti con
WPW vi è un certo rischio di morte improvvisa risiede
nel fatto che l’elevata frequenza della TPSV da rientro
AV può facilitare la degenerazione dell’aritmia in fi brillazione atriale, e la sindrome di WPW rappresenta,
infatti, una delle principali cause di fibrillazione atriale
in età giovanile. La fibrillazione atriale è un’aritmia che
interessa esclusivamente gli atri ed è caratterizzata da
un’attività elettrica del tutto caotica, irregolare e ad alta
frequenza (si veda oltre, Fibrillazione atriale). In presenza
di una sindrome di WPW, la conduzione ai ventricoli
può avvenire, in modo irregolare e variabile da battito
a battito, solo attraverso la via normale (QRS normale),
solo attraverso la via accessoria (QRS totalmente atipico) o contemporaneamente attraverso le due vie (con
onda e QRS di fusione come nel ritmo sinusale con
pre-eccitazione). Il prevalere dei diversi tipi di battiti e
la loro frequenza dipenderà notevolmente dal periodo
refrattario delle due vie. Quando il periodo refrattario
della via anomala è molto breve, essa potrebbe condurre numerosi impulsi durante la fibrillazione atriale,
con conseguente attivazione ventricolare a frequenze
molto alte (> 300 bpm), il che espone il paziente allo
sviluppo di una fibrillazione ventricolare e, quindi, alla
morte improvvisa.
Il periodo refrattario della via anomala può essere studiato
con precisione durante un SEF. Tuttavia, il comportamento della pre-eccitazione durante le normali attività e durante un test da sforzo può già fornire indicazioni chiare
sull’assenza del rischio di aritmie fatali. Per esempio, sono
a bassissimo rischio di potenziali eventi fatali pazienti
con WPW intermittente e quelli in cui la pre-eccitazione
scompare durante lo sforzo.
Terapia
Il paziente con pre-eccitazione di WPW asintomatico non necessita abitualmente di alcun tipo di trattamento, mentre del trattamento e la prevenzione
della TPSV da rientro AV si è detto in precedenza.
In caso di episodi di fibrillazione atriale con elevata
frequenza ventricolare in un paziente con WPW,
il trattamento immediato è rappresentato dalla
cardioversione elettrica o, se questa per qualche
motivo non è possibile, dall’uso di farmaci della
classe IC o III, che hanno la capacità di aumentare
il periodo refrattario della via anomala, riducendo i
C0055.indd 263
rischi secondari all’elevata frequenza di attivazione
ventricolare attraverso di essa. Come detto, il trattamento definitivo delle aritmie della sindrome di
WPW è l’ablazione della via accessoria.
Varianti di pre-eccitazione ventricolare
263
1
Oltre ai classici fasci anomali atrioventricolari di Kent,
una pre-eccitazione ventricolare, può, in alcuni casi,
essere dovuta alla presenza di altri tipi di fasci anomali,
che presentano caratteristiche elettrofisiologiche analoghe (Fig. 11.21). I fasci atrio-hissiani (o fasci di James)
sono così chiamati in quanto connettono direttamente il tessuto atriale al fascio di His (scavalcando così il
nodo AV); ne deriva che essi determinano all’ECG un
intervallo P-R corto, ma il QRS ha morfologia normale.
Per un certo periodo si è ritenuto che questi fasci potessero essere utilizzati come via retrograda per TPSV
da rientro, dando origine alla cosiddetta sindrome di
Lown-Ganong-Levine (TPSV, P-R corto, assenza di onda
), ma attualmente si ritiene che sia improbabile che ciò
possa avvenire.
Altri tipi di fasci anomali, che non sembrano associati
a tachiaritmie, sono quelli nodo-ventricolari (che collegano il nodo AV con il ventricolo, scavalcando così la
parte terminale del nodo AV e il fascio di His) e quelli
atrio-nodali (che uniscono l’atrio alla parte distale del
nodo AV).
Un tipo piuttosto particolare, molto raro, di via anomala
di conduzione è rappresentato dai fasci atrio(nodo)fascicolari di Mahaim , che connettono quasi sempre
l’atrio destro alla branca destra, scavalcando il nodo
AV e il fascio di His. Questi fasci sono costituiti da fibre
non comuni, con proprietà elettrofisiologiche simili al
nodo AV (tempo di conduzione non breve; proprietà
decrementali). Essi sono in genere localizzati lungo la
zona posteriore o postero-laterale dell’anello tricuspidale e sono capaci di condurre gli impulsi solo in senso
anterogrado. I fasci di Mahaim formano il substrato per
una forma di tachicardia da rientro di cui costituiscono
la via anterograda, mentre quella retrograda è costituita
da branca destra-His-nodo AV. In virtù del tipico decorso
di questi fasci la morfologia della TPSV è tipicamente a
blocco di branca sinistra. I fasci di Mahaim si possono
riscontrare associati con una certa frequenza all’anomalia di Ebstein.
Tachicardia giunzionale
non parossistica incessante
Anche questa forma di tachicardia, nota anche come
tachicardia tipo Coumel , è rara. Essa è caratterizzata
da episodi incessanti di TPSV, cioè ricorrenti dopo solo
alcuni battiti sinusali dalla risoluzione di un episodio.
All’ECG si notano onde P tipicamente da retroconduzione atriale dal nodo AV e un intervallo P’-R minore
dell’intervallo R-P’. Si ritiene che questa tachicardia
sopraventricolare sia dovuta a un rientro che coinvolge un fascio accessorio postero-settale a conduzione
lenta, che costituisce la via retrograda del circuito di
rientro, la cui via anterograda è rappresentata dalla
giunzione AV.
6/9/10 9:48:21 AM
264
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Atrio
NAV
BS
NAV
C
His
His
BS
BD
BS
BD
BD
Ventricolo
Ventricolo
Ventricolo
A sinistra: fascio accessorio atrio-hissiano (fascio di James); al centro: fasci accessori nodo-ventricolare (A), atrio-nodale (B) e fascicolo-ventricolare (C); a destra: fascio accessorio
atrio-fascicolare (fascio di Mahaim). BD = branca destra. BS = branca sinistra. NAV = nodo atrioventricolare.
Flutter e fibrillazione atriali
Flutter atriale
Si definisce flutter atriale un’aritmia regolare in cui l’atrio
ha un’attivazione molto rapida, con una frequenza superiore a 240 impulsi/min. Essendo la frequenza atriale così
rapida, non tutti gli impulsi di attivazione atriale riescono in genere a essere condotti ai ventricoli attraverso il
nodo AV. Spesso la conduzione AV avviene, infatti, con
un rapporto 2:1, per cui la frequenza ventricolare è la
metà di quella atriale, e quindi comunque tachicardica
e regolare; altre volte la conduzione AV ha un rapporto
maggiore (per esempio, 3:1, 4:1), per cui la frequenza ventricolare è regolare e non elevata; in molti casi, tuttavia,
il rapporto di conduzione AV è molto variabile, per cui
la frequenza ventricolare (e quindi il battito cardiaco) è
irregolare.
Patogenesi
Il flutter atriale è dovuto a un rientro intra-atriale, legato
ad alterazioni anatomiche e/o funzionali, che, nella
forma più tipica, interessa gran parte dell’atrio destro
(macrorientro). Il fronte d’onda in questo caso parte
dal basso e attiva l’atrio verso la parete laterale; quindi
seguono il tetto e il setto interatriale. Il circuito, che
ha l’area di blocco unidirezionale e di conduzione rallentata che sostiene il rientro tra lo sbocco della vena
cava inferiore e la tricuspide (istmo cavo-tricuspidale),
viene percorso quindi in senso antiorario (flutter atriale
tipico comune). In diversi casi, tuttavia, si può avere
una progressione in senso orario del fronte d’onda nel
circuito di rientro (flutter atriale tipico non comune).
In altri casi il circuito di rientro ha forme più complesse
(per esempio, a otto) o si verifica in altre zone degli atri
(per esempio, in atrio sinistro), dando origine a quadri
ECG differenti da quelli del flutter tipico (flutter atriale
atipico).
Manifestazioni cliniche e diagnosi
Il fl utter atriale è un’aritmia che si verifi ca in genere
in presenza di alterazioni strutturali della parete atriale, per lo più associate a dilatazione degli atri. Tra le
cause più frequenti vi sono varie forme di cardiopatie
C0055.indd 264
B
NAV
A
His
Figura 11.21
Schema di alcune
vie accessorie
(linee rosse)
diverse dai fasci
atrioventricolari
di Kent.
Atrio
Atrio
(scompenso cardiaco congestizio, valvulopatie, miocardiopatie, cardiopatie congenite); processi infiammatori
(per esempio, in caso di pericardite) o infiltrativi che
interessano gli atri, cuore polmonare acuto ed embolia
polmonare, e cuore polmonare cronico e broncopneumopatia cronica.
Il sintomo più frequente è la percezione di una frequenza
cardiaca elevata (palpitazione), regolare o irregolare a seconda delle caratteristiche della conduzione AV (si veda
in precedenza). In diversi casi, tuttavia, il sintomo dominante può essere una dispnea improvvisa, soprattutto in
presenza di una malattia cardiaca di una certa gravità.
In questi pazienti, infatti, il flutter atriale può scatenare
uno scompenso cardiaco sia perché determina la perdita
di una sistole atriale efficace sia perché determina la riduzione del tempo diastolico di riempimento ventricolare e
coronarico, a causa della frequenza cardiaca solitamente
elevata. Per questo motivo, in pazienti con malattia coronarica di una certa gravità, il flutter può anche causare
la comparsa di angina.
L’obiettività è caratterizzata, in genere, dall’auscultazione
di toni frequenti (ritmici o aritmici) accompagnati eventualmente da una riduzione della pressione arteriosa e,
raramente, da segni di bassa portata. Il polso è tachicardico (anch’esso ritmico o aritmico).
L’ECG del flutter atriale è piuttosto caratteristico. L’attivazione atriale è rappresentata dalla successione regolare di onde di aspetto costante (dette onde F, o di
fl utter) ben visibili nelle derivazioni D 2 D 3, aVF e V 1
(Fig. 11.22), soprattutto quando la conduzione AV ha
un rapporto superiore a 2:1 (due o più onde F in successione, cioè, non trasmettono l’impulso al ventricolo).
Nella forma caratteristica del flutter tipico comune le
onde F sono negative nelle derivazioni inferiori e positive in V1 e si succedono l’una dopo l’altra senza essere
separate da tratti di linea isoelettrica, configurando
così il tipico aspetto a denti di sega. Nel flutter atriale
tipico non comune, in cui l’impulso procede in senso
orario nello stesso tipo di circuito di rientro, le onde F
sono in prevalenza positive nelle derivazioni inferiori
e negative in V1.
Nei casi di flutter atriale atipico la morfologia delle onde
F è differente da quelle descritte per le forme tipiche e la
6/9/10 9:48:21 AM
Capitolo 11 - ARITMIE
frequenza atriale tende a essere più elevata. È importante
saper discernere tra un flutter tipico e atipico, in quanto
il primo è più sensibile ai farmaci e all’overdrive, rispetto
al secondo.
a. Flutter atriale
Terapia
La terapia del flutter atriale può essere mirata a due
obiettivi: (1) ridurre la frequenza cardiaca, in genere
elevata, oppure (2) sbloccare l’aritmia ripristinando
il ritmo sinusale.
Il primo obiettivo è indicato quando il paziente
presenta angina o sintomi iniziali di scompenso e
quando è controindicato procedere a una cardioversione dell’aritmia (si veda oltre), e si ottiene con la
somministrazione di farmaci che riducono la conduzione AV, e cioè -bloccanti, calcio-antagonisti non
diidropiridinici o, in caso di significativo scompenso
cardiaco, digossina.
Lo sblocco dell’aritmia può essere ottenuto con l’uso
di farmaci (cardioversione farmacologica) o mediante
cardioversione elettrica. La cardioversione (farmacologica o elettrica) non è indicata quando l’aritmia
data da più di 48 ore, a causa di un aumento del
rischio di fenomeni tromboembolici conseguenti al
ripristino del ritmo sinusale dopo questo periodo (si
veda Fibrillazione atriale).
I farmaci usati per lo sblocco dell’aritmia sono soprattutto quelli di classe III (amiodarone), di classe
IC (propafenone, flecainide) e di classe IA (chinidina,
disopiramide). Nel caso l’aritmia non si sblocchi in
breve tempo con la terapia farmacologica, si ricorre
alla cardioversione elettrica, che è efficace praticamente nella totalità dei casi, con l’applicazione, peraltro, di basse dosi di corrente (sono sufficienti, in
genere, scariche di soli 50 J).
Gli stessi farmaci antiaritmici possono essere impiegati per la prevenzione delle recidive dell’aritmia,
con un’efficacia, tuttavia, spesso limitata. Anche i
farmaci che migliorano le patologie associate (ipertensione, scompenso ecc.) sono utili per ridurre gli
episodi.
L’ablazione con radiofrequenza del circuito alla base
del flutter rappresenta una valida terapia per trattare
in modo definitivo l’aritmia, con una percentuale
di successo molto elevata. In caso di flutter atriale
tipico, l’ablazione consiste nel creare una barriera
lineare al passaggio del fronte d’onda con lesioni
tra la valvola tricuspide e la vena cava inferiore. In
pazienti con aumentato rischio di fenomeni tromboembolici, in caso di recidiva dell’aritmia, è indicato effettuare una terapia anticoagulante orale a
lungo termine.
Fibrillazione atriale
Epidemiologia
Come il flutter, la fibrillazione atriale è più frequente
in presenza di patologie cardiache strutturali. Essa,
tuttavia, è un’aritmia relativamente frequente in persone anziane senza evidenti anomalie cardiache e può
C0055.indd 265
b. Fibrillazione atriale
265
1
Figura 11.22
Esempi all’ECG
di flutter atriale
e fibrillazione
atriale.
presentarsi anche in soggetti giovani o adulti in assenza
di apparenti cause organiche, una condizione definita
fibrillazione atriale solitaria (lone atrial fibrillation). La
fi brillazione atriale si presenta, infi ne, con una certa
frequenza in pazienti con ipertiroidismo, ipertensione
o diabete.
Patogenesi
Nella fibrillazione atriale gli atri vengono eccitati in maniera caotica, disorganizzata, con una frequenza di attivazione variabile da 400 a 650 impulsi/min. Per lo più
questo deriva dalla formazione negli atri di molteplici,
piccoli circuiti di rientro che collidono, si estinguono
e si riformano. Questi fronti d’onda multipli viaggiano
attraverso l’atrio in modo del tutto casuale e le cellule
miocardiche ne risultano attivate ogni volta che un impulso le raggiunge in uno stato di eccitabilità. Di recente
è stato riconosciuto che la fibrillazione atriale è spesso
innescata dalla presenza di uno o più foci ectopici che
scaricano a elevata frequenza, situati di solito allo sbocco
di una o più vene polmonari.
Il numero di impulsi atriali che, in modo irregolare
e caotico, raggiunge il nodo AV è elevato, ma viene
variamente bloccato nel nodo AV stesso, limitando la
frequenza ventricolare. L’attivazione dei ventricoli avviene, comunque, sempre in modo del tutto irregolare e
con una frequenza di solito elevata (spesso 140-150 impulsi/min).
Manifestazioni cliniche
Il paziente quasi sempre presenta sintomi all’insorgenza
dell’aritmia, anche se non sono infrequenti casi di fibrillazione atriale del tutto asintomatici che vengono scoperti
casualmente durante una visita clinica o l’esecuzione di
un ECG.
Il sintomo più frequente è rappresentato da “palpitazioni”,
che il paziente riferisce presentarsi come battiti accelerati,
ma allo stesso tempo irregolari, con pause variabili.
In diversi casi la fibrillazione atriale può manifestarsi
con sintomi di scompenso cardiaco (dispnea), soprattutto quando è presente una patologia cardiaca di base. Infatti, la perdita di una sistole atriale efficace e la
tachicardia favoriscono lo scompenso emodinamico.
L’aumentata frequenza cardiaca, inoltre, può causare la
comparsa di angina, in caso di sottostante cardiopatia
ischemica.
6/9/10 9:48:22 AM
266
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
Il medico può sospettare una fibrillazione atriale già alla
valutazione del polso radiale, dove apprezzerà una frequenza totalmente aritmica e una variabile ampiezza dei
battiti. Analogamente, all’auscultazione del cuore i toni
saranno completamente aritmici, con pause sempre diverse tra il II tono di un battito e il I tono di quello successivo;
l’intensità del I tono, inoltre, varia continuamente.
A questo proposito va ricordato che, in presenza di fibrillazione atriale, la frequenza cardiaca va valutata con
l’auscultazione piuttosto che al polso periferico. Infatti,
il polso consente di rilevare solo le sistoli emodinamicamente efficaci, mentre non consente di percepire quelle
che insorgono molto vicino alla sistole che le precede, a
causa di un riempimento ventricolare (e, quindi, di una
gittata sistolica) insufficiente (si veda quanto già detto a
proposito delle conseguenze emodinamiche delle extrasistoli ventricolari precoci).
Diagnosi
All’ECG, la fibrillazione atriale è caratterizzata dall’assenza di onde di attivazione atriale regolari e morfologicamente simili. L’attività elettrica consiste, viceversa,
di defl essioni assolutamente irregolari, di ampiezza e
polarità molto variabili, non separate da un’evidente
linea isoelettrica e, come detto, ad alta frequenza (onde
“f”); analogamente, i complessi QRS di attivazione ventricolare si succedono a intervalli totalmente irregolari
(si veda Fig. 11.22).
La fibrillazione atriale può verificarsi in crisi episodiche ed
è definita parossistica quando si risolve spontaneamente
entro 7 giorni dall’esordio dei sintomi (l’aritmia si risolve
nel volgere di 24 ore in circa due terzi dei casi), persistente
quando si risolve dopo 7 giorni (spesso con terapia farmacologica o elettrica). In diversi casi e soprattutto con il passare del tempo e/o in presenza di cardiopatie strutturali, la
fibrillazione atriale non si risolve (né spontaneamente né
con interventi medici), per cui diventa permanente.
Prognosi
Tranne che nei casi di fibrillazione atriale solitaria, la
fibrillazione atriale è associata a un’aumentata incidenza
di eventi cardiovascolari durante il follow-up. L’aumento
del rischio sembra in gran parte connesso all’evoluzione
naturale della sottostante cardiopatia, più che all’aritmia
in sé. Tuttavia, anche se molte persone con questo disordine possono condurre a lungo una vita soddisfacente, la
fibrillazione atriale può avere di per sé alcune conseguenze
negative. Come detto, essa può facilitare l’insorgenza di
scompenso cardiaco e facilitare l’ischemia miocardica e,
soprattutto, espone al rischio di fenomeni tromboembolici
in misura anche maggiore di quanto avvenga per il flutter.
Per ragioni anatomiche, le embolie originate da formazioni trombotiche atriali si localizzano prevalentemente nel
distretto encefalico e sono un’importante causa di attacchi
ischemici transitori e ictus cerebrali ischemici.
Terapia
La terapia può avere due obiettivi principali: (1) controllare semplicemente la frequenza cardiaca o (2)
C0055.indd 266
ripristinare il ritmo sinusale. Dal punto di vista prognostico, le due strategie sono equivalenti; pertanto
l’impiego dell’una o dell’altra va valutato caso per
caso, tenendo presenti anche le preferenze del paziente.
Come nel flutter, lo sblocco dell’aritmia può essere
ottenuto con l’uso di farmaci o mediante cardioversione elettrica. I farmaci indicati per ottenere questo
obiettivo sono soprattutto quelli di classe III (amiodarone), IC (flecainide, propafenone) o IA (chinidina,
disopiramide).
La cardioversione (farmacologica o elettrica) non
è tuttavia indicata quando l’aritmia data da più di
48 ore. Durante la fibrillazione (e il flutter) atriale vi è, infatti, la possibilità che si formino trombi
in atrio. Ciò è dovuto al rallentamento del flusso
ematico nelle camere atriali, provocato dal ridotto
svuotamento in ventricolo conseguente alla riduzione del tempo diastolico e alla perdita della contrazione atriale, nonché, a volte, alla riduzione della
contrattilità miocardica secondaria alla tachicardia.
La formazione di trombi in atrio sinistro (in particolare nell’auricola) aumenta significativamente
quando l’aritmia si protrae per oltre 48 ore, esponendo il paziente al rischio di embolie periferiche
(cerebrali in particolare); questo rischio è ulteriormente aumentato nel momento del ripristino del
ritmo sinusale, quando la ripresa della contrazione
atriale può favorire il dislocamento di emboli in
circolo dall’atrio sinistro. Per questi motivi, quando
la fibrillazione atriale è presente da più di due giorni
non è consigliabile procedere a una cardioversione
immediata dell’aritmia, a meno che la cardioversione
elettrica non si renda necessaria per la presenza di
condizioni cliniche gravi (edema polmonare, grave
ipotensione) che suggeriscono l’utilità di un rapido
ripristino del ritmo sinusale.
Negli altri casi è bene mirare solo a controllare la
frequenza ventricolare ed effettuare, per almeno 4-6
settimane, un trattamento anticoagulante prima di
procedere al ripristino del ritmo sinusale. In questi
casi, peraltro, si ricorre alla cardioversione elettrica
per sbloccare l’aritmia, in quanto quella farmacologica ha una probabilità di successo solo del 10-30%
quando tentata a una così lunga distanza dalla comparsa dell’aritmia.
Nei pazienti in cui sia ripristinato il ritmo sinusale,
per la prevenzione delle recidive dell’aritmia possono essere impiegati gli stessi farmaci utilizzati per la
cardioversione.
L’amiodarone si è dimostrato, a questo proposito, più
efficace degli altri farmaci antiaritmici, ma presenta
un significativo numero di effetti collaterali a lungo
termine.
Nei pazienti che tollerano bene la fibrillazione
atriale cronica (non hanno cioè sintomi né una
compromissione significativa della capacità funzionale) può essere indicato non intervenire sulla
fibrillazione atriale controllando semplicemente la frequenza cardiaca con l’uso di -bloccanti,
6/9/10 9:48:23 AM
Capitolo 11 - ARITMIE
calcio-antagonisti o digossina (anche se quest’ultima
è sempre meno utilizzata per il possibile rischio di
intossicazione, specialmente in pazienti con disfunzione renale). Diversi studi, infatti, hanno dimostrato come non vi siano differenze prognostiche tra i
pazienti in cui si tenta di ripristinare e mantenere il
ritmo sinusale (strategia per il controllo del ritmo)
e quelli in cui si interviene solo per mantenere la
frequenza su valori accettabili (inferiori a 100 bpm
a riposo: strategia per il controllo della frequenza
cardiaca).
Nei pazienti con un rischio significativo di fenomeni tromboembolici è inoltre indicato il trattamento
con anticoagulanti orali. Questi pazienti comprendono anzitutto quelli con cardiopatie valvolari
reumatiche (o anche di altra natura), nei quali il
trattamento anticoagulante è sempre indicato. In
altri pazienti sono considerati fattori di rischio per
tromboembolie un pregresso episodio ischemico
cerebrale, lo scompenso cardiaco, l’ipertensione
arteriosa, il diabete mellito e l’età avanzata (> 75
anni). Questi fattori sono considerati nella formazione di un punteggio di rischio (il CHADS2 score)
per guidare l’indicazione alla terapia anticoagulante
(Tab. 11.7).
L’indicazione deve comunque essere sempre valutata tenendo conto della capacità del paziente di
seguire correttamente la terapia anticoagulante.
Questa prevede, infatti, controlli periodici dello stato della coagulazione del sangue mediante valutazione dell’attività protrombinica con la misurazione
dell’INR (International Normalized Ratio), il quale
va mantenuto costantemente tra valori di 2,0 e 3,.0,
al fine di evitare un eccessivo rischio tromboembolico (in caso di valori < 2,0) o emorragico (in caso di
valori >3,0). Va osservato, a questo proposito, che
le persone anziane, con questi trattamenti, sono
più facilmente soggette a emorragie. Inoltre, uno
scompenso che determini una stasi cronica a livello
epatico rende molto sensibile un paziente all’azione
degli anticoagulanti orali. Perciò, nel giudizio sulla
terapia anticoagulante si devono valutare vantaggi
e pericoli.
Nei pazienti a più basso rischio e in quelli in cui si
ritiene inadatta la terapia anticoagulante, la prevenzione degli episodi tromboembolici è basata sull’uso
di antiaggreganti piastrinici (in particolare acido acetilsalicilico a basse dosi).
Quando la fibrillazione atriale, parossistica o cronica, causa sintomi importanti per il paziente e non
si riesce a controllarla con la terapia farmacologica, sono indicate altre forme non farmacologiche
di trattamento, che riassumiamo brevemente di
seguito.
• Ablazione della fibrillazione atriale. L’ablazione
dell’aritmia consiste nell’isolare i foci ectopici a
rapida scarica, che sono spesso il trigger dell’aritmia, mediante la formazione con radiofrequenze
di aree cicatriziali attorno allo sbocco delle vene
polmonari, dove in genere questi centri sono
C0055.indd 267
Tabella 11.7 Punteggio CHADS2 per la stima del rischio
tromboembolico in pazienticon fibrillazione
atriale
C
H
A
D
S2
Condizione
Scompenso cardiaco congestizio
(Congestive heart failure)
Ipertensione arteriosa, anche se
trattata (Hypertension)
Età > 75 anni (Age)
Diabete mellito (Diabetes mellitus)
Precedente ictus o attacco ischemico transitorio
Punteggio
1
267
1
1
1
1
2
Punteggio = 0: rischio tromboembolico basso; indicata terapia con sola
aspirina (100-325 mg/die).
Punteggio = 1: rischio tromboembolico medio (indicata terapia con
acido acetilsalicilico (100-325 mg/die) o terapia anticoagulante orale
(tenere l’INR a un valore compreso tra 2,0 e 3,0), considerando anche
le preferenze del paziente e altri fattori individuali.
Punteggio = 2: rischio tromboembolico alto; indicata terapia con
anticoagulanti orali (tenere l’INR a un valore compreso tra 2,0 e 3,0), in
assenza di controindicazioni.
situati; le lesioni sono invece estese a più aree
atriali sinistre, ed eventualmente anche destre
(zone comunque ritenute coinvolte nel mantenimento dell’aritmia), qualora ci sia una fibrillazione permanente. In questo caso, infatti, non
sono tanto i foci ma le modificazioni strutturali
degli atri conseguenti alla patologia di base e alla
stessa aritmia (infiammazione, fibrosi, alterazioni
delle proprietà elettriche del tessuto) a sostenere
la fibrillazione;
• Intervento del “labirinto” (maze). È questo un intervento cardiochirurgico il cui impiego è attualmente limitato a pazienti con fibrillazione atriale
permanente (o anche parossistica) sottoposti a
interventi cardiochirurgici per altre indicazioni
cliniche (malattia coronarica, valvulopatie). Esso
consiste nell’esecuzione di incisioni nella parete
degli atri, in modo da creare una via stretta e
tortuosa per la propagazione dello stimolo dal
nodo seno-atriale a quello AV. Le incisioni sono
collocate in modo tale che nessuna area sia larga abbastanza da consentire multipli circuiti di
rientro;
• Ablazione del nodo AV. Questo tipo di intervento
può essere indicato quando la fibrillazione atriale
si associa a un’elevata frequenza cardiaca che non
si riesce in alcun modo a controllare e i tentativi
di ablazione sono inefficaci. Poiché l’ablazione
del nodo AV causa un blocco AV completo, si
impianta contestualmente un pacemaker per la
stimolazione ventricolare (tecnica cosiddetta di
ablate and pace);
• Impianto di pacemaker. Il semplice impianto di
un pacemaker sembra utile in pazienti con fibrillazione atriale parossistica che hanno di base
un ritmo sinusale bradicardico. La stimolazione
atriale a più alta frequenza potrebbe prevenire le
6/9/10 9:48:23 AM
268
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
crisi di fibrillazione riducendo la disomogeneità
della conduzione interatriale o intra-atriale che
predispone allo sviluppo dell’aritmia. Il successo
di questo trattamento è tuttavia molto dubbio.
Tachiaritmie ventricolari
Tachicardia ventricolare
La tachicardia ventricolare è un’aritmia ipercinetica caratterizzata dalla sequenza di un minimo di tre battiti
ectopici di origine ventricolare in immediata successione,
con una frequenza uguale o superiore a 100 bpm.
Le tachicardie ventricolari insorgono molto spesso in
soggetti portatori di cardiopatie strutturali (cardiopatia ischemica e miocardiopatie in primo luogo). Esse
inoltre, come si vedrà, sono la manifestazione clinica
principale di alcune malattie cardiache caratterizzate
esclusivamente o principalmente da anomalie della
sola attività elettrica delle cellule miocardiche, senza
coinvolgimento sostanziale della sua attività meccanica.
Tuttavia, in alcuni casi, episodi di tachicardia ventricolare possono insorgere in soggetti con cuore sano, cioè
senza apparenti alterazioni cardiache sia strutturali, sia
dell’attività elettrica.
La tachicardia ventricolare può essere non sostenuta o
sostenuta. È definita non sostenuta se dura meno di 30 sec;
è sostenuta se dura più di 30 sec o, pur durando meno,
determina una rapida compromissione emodinamica,
con ipotensione, lipotimia o sincope. La tachicardia ventricolare, inoltre, può essere monomorfa o polimorfa.
Nella maggior parte dei casi una tachicardia ventricolare sostenuta monomorfa è dovuta a un meccanismo di
rientro a livello di alterazioni strutturali dei ventricoli
(si veda Fig. 11.11). Le tachicardie ventricolari che insorgono in cuori apparentemente esenti da cardiopatie organiche, d’altro canto, sono spesso dovute a meccanismi
di automatismo o di triggered activity.
All’ECG la tipica tachicardia ventricolare sostenuta monomorfa si presenta come una successione ritmica di
complessi QRS larghi, di durata in genere superiore a
0,12 sec, a frequenza più spesso compresa tra 130 e 200
bpm (range 100-250 bpm). La morfologia dei complessi è
atipica e varia a seconda della sede da cui origina l’aritmia
(Fig. 11.23).
La tachicardia ventricolare deve essere distinta dalla tachicardia sopraventricolare a QRS largo per la presenza
di un blocco di branca nella conduzione dagli atri ai
ventricoli (tachicardia sopraventricolare a conduzione
Figura 11.23
Esempio di
tachicardia
ventricolare
sostenuta
monomorfa.
C0055.indd 268
aVR
V1
V4
aVL
V2
V5
aVF
V3
V6
aberrante). La distinzione è molto importante dal punto
di vista clinico, perché una tachicardia ventricolare è
associata a un rischio di eventi infausti (nell’immediato
e a distanza) che le TPSV non hanno, e ha, quindi, implicazioni terapeutiche diverse.
La diagnosi differenziale è basata soprattutto sulla presenza o meno di una dissociazione AV. Nella tachicardia ventricolare, infatti, quasi sempre l’impulso ectopico
originato nei ventricoli non riesce a raggiungere gli atri,
che sono attivati indipendentemente dal ritmo sinusale
(o da un altro ritmo). Viceversa, nella tachicardia sopraventricolare è presente una relazione costante tra onde P
e QRS. Una morfologia del QRS a blocco di branca destra
tipico (rSR’ in V1 e qRs in V6) è, inoltre, più suggestiva di
una tachicardia sopraventricolare aberrante. La diagnosi
differenziale è spesso possibile con il solo ECG di superficie sulla base di questi criteri e di altri riassunti nella
tabella 11.8. Tuttavia, in diversi casi può persistere un
dubbio sulla diagnosi, che può essere chiarita solo con
ulteriori indagini.
Tabella 11.8 Alcuni dei criteri più affidabili e utilizzati
per la diagnosi differenziale all’ECG tra
tachicardia ventricolare e tachiaritmia
sopraventricolare con aberranza in presenza
di una tachicardia a QRS largo
Dissociazione atrioventricolare
Diagnosi
Tachicardia ventricolare
Battiti di cattura sinusali o
battiti di fusione*
Tachicardia ventricolare
Morfologia del QRS concordante in tutte le derivazioni
precordiali†
Tachicardia ventricolare
Morfologia del QRS a BBD:
qR, R o RR’ in V1
䊉 rsR’ o RsR’ in V
1
Tachicardia ventricolare
Tachicardia sopraventricolare
Morfologia del QRS a BBS:
qR o QS in V6
䊉 rS in V -V e R in V
1 2
6
Tachicardia ventricolare
Tachicardia sopraventricolare
䊉
䊉
Manovre di stimolazione
vagale
䊉 Inefficaci
䊉 Interruzione o slatentizzazione di attività atriale da
flutter o tachicardia
Tachicardia ventricolare‡
Tachiaritmia sopraventricolare
*
I battiti di cattura sinusali sono battiti prematuri a QRS stretto
nell’ambito della tachicardia e si verificano in presenza di dissociazione
atrioventricolare quando un’onda P riesce a condurre normalmente
l’impulso ai ventricoli cadendo casualmente in un momento in cui
questi (e le vie di conduzione) sono in una fase di eccitabilità; i battiti di
fusione sono legati allo stesso fenomeno, ma la cattura dei ventricoli da
parte dell’impulso sinusale avviene in contemporanea con l’attivazione
dei ventricoli da parte del centro aritmico (per cui ne risulta un battito
con morfologia intermedia tra il QRS della tachicardia e quello sinusale).
†
Il QRS, cioè, è tutto o prevalentemente positivo o negativo in tutte le
derivazioni precordiali, da V1 a V6.
‡
La mancata risposta alla stimolazione vagale può solo fare sospettare
l’origine ventricolare dell’aritmia.
6/9/10 9:48:23 AM
Capitolo 11 - ARITMIE
La tachicardia ventricolare interferisce con la normale funzione del cuore attraverso quattro principali meccanismi:
(1) priva il riempimento diastolico ventricolare della componente dovuta alla sistole atriale; (2) l’elevata frequenza cardiaca riduce il tempo di riempimento diastolico del
ventricolo e del flusso ematico nel circolo coronarico; (3) la
contrazione ventricolare indotta dall’impulso ectopico non
è coordinata in maniera fisiologica e pertanto non è completamente efficace; (4) può di per sé causare una depressione
contrattile tachicardia-dipendente. Tutto ciò, in pazienti
cardiopatici, può favorire lo sviluppo di uno scompenso
cardiaco, uno stato di shock o un’ischemia miocardica.
La tachicardia ventricolare è un’aritmia da trattare con
urgenza perché, anche se emodinamicamente stabile, può
sia essere causa di un rapido deterioramento emodinamico
sia degenerare in fibrillazione ventricolare, causando un
arresto cardiaco.
Il paziente con tachicardia ventricolare avverte principalmente sintomi legati alla bassa portata (sincope, lipotimia,
scompenso) o alla ridotta perfusione coronarica (angina),
ma, in non pochi casi, essa è ben tollerata e l’unico sintomo è rappresentato da un senso di palpitazione.
Il medico riscontra tachicardia al polso, che appare anche
piccolo o può essere inapprezzabile, e può notare i segni
obiettivi della bassa portata (ipotensione, ipoperfusione
cutanea, dispnea, sudorazione). All’auscultazione del cuore i toni sono di ridotta intensità, frequenti, ritmici.
Terapia
La terapia deve essere instaurata con urgenza. Se il
paziente è in stato di shock o ha addirittura perso
coscienza, va effettuata subito la cardioversione elettrica (in genere è sufficiente una scarica di 100 J).
Se le condizioni emodinamiche sono stabili si può
cercare di sbloccare l’aritmia con l’uso di farmaci e.v.,
come l’amiodarone, il propafenone o la lidocaina. Il
farmaco da scegliere dipende dal contesto clinico. Se
il tentativo è inefficace, bisogna procedere appena
possibile con la cardioversione elettrica. La terapia
dell’aritmia deve sempre essere accompagnata dall’individuazione e correzione di eventuali fattori che ne
hanno favorito l’insorgenza. In particolare vanno
corretti eventuali squilibri elettrolitici ed eliminati
eventuali farmaci proaritmici.
La prevenzione delle recidive della tachicardia ventricolare (e della sua possibile degenerazione in fibrillazione ventricolare) è basata soprattutto sull’uso
di -bloccanti e dell’amiodarone, oltre che sul trattamento ottimale della patologia cardiaca di base.
Farmaci di classe IA e IC possono essere indicati in
alcuni casi in presenza di una normale funzione ventricolare sinistra, mentre vanno evitati in presenza
di una depressa contrattilità miocardica. Le forme di
tachicardia ventricolare in cuore sano (idiopatica)
a origine dal tratto di efflusso del ventricolo destro
(morfologia a BBS e asse verticale o deviato a destra)
o dal fascicolo posteriore sinistro (morfologia a BBD
e iperdeviazione assiale sinistra) rispondono spesso
efficacemente al verapamil.
C0055.indd 269
Nella maggior parte dei casi di tachicardia ventricolare sostenuta, tuttavia, per l’aumentato rischio
di sincope e morte improvvisa che essa comporta, è
indicato l’impianto di un ICD (si veda Tab. 11.6). In
diversi casi è possibile prevenire la tachicardia ventricolare mediante l’ablazione con radiofrequenze del
substrato aritmogeno individuato con il mappaggio
intracardiaco (Fig. 11.24).
269
1
Tachicardia ventricolare a torsione di punta
o “torsade de pointes”
La tachicardia ventricolare a torsione di punta è una forma di tachicardia ventricolare polimorfa, caratterizzata
all’ECG da una variazione della morfologia del QRS, che
da una polarità (per esempio, positiva) passa più o meno
gradatamente, nella stessa derivazione, a una polarità
opposta (nell’esempio, negativa) (Fig. 11.25). Insorge più
tipicamente in soggetti che presentano un ritmo molto
bradicardico e un intervallo QT allungato. Quest’ultimo
dato indica che vi sono zone del miocardio ventricolare
che si ripolarizzano con molto ritardo, causando una condizione favorevole all’instaurazione di fenomeni di rientro;
anche fenomeni di triggered activity, tuttavia, sembrano
importanti nella genesi di questa aritmia. L’allungamento
del QT può essere congenito o acquisito (si veda oltre).
L’aritmia viene per lo più iniziata da un’extrasistole ventricolare tardiva, è in genere molto rapida (> 200 bpm),
e spesso si autolimita ma recidiva, però, nel volgere di
poco tempo. Se non trattata adeguatamente può infine
degenerare in fibrillazione ventricolare.
Terapia
La terapia della torsione di punta deve mirare a: (1)
rimuovere la causa che ha favorito l’allungamento
dell’intervallo QT (correzione degli squilibri elettrolitici e sospensione di eventuali farmaci); (2) aumentare
la frequenza cardiaca. La frequenza può essere aumentata con la stimolazione endocavitaria mediante
catetere stimolatore. Se ciò non è rapidamente possibile, è opportuno tentare di indurre un aumento della
frequenza del cuore con atropina o isoproterenolo.
Ritmo idioventricolare accelerato (RIVA)
Il RIVA si manifesta per esaltato automatismo di un pacemaker situato nel tessuto di conduzione distalmente al fascio
di His. I pacemaker ventricolari hanno abitualmente una
frequenza di eccitazione intrinseca di circa 30-40/min, per
cui la loro attività può emergere solo in caso di grave malattia
Figura 11.24
Tachicardia
ventricolare a
torsione di punta:
progressivo
cambiamento
della polarità
del QRS nelle
tre derivazioni
e l’intervallo QT
lungo del battito
sinusale prima
della tachicardia.
6/9/10 9:48:24 AM
270
Figura 11.25
(a) Tracciato
endocavitario
di ablazione
di tachicardia
ventricolare
monomorfa in
un paziente con
miocardiopatia
dilatativa
postischemica
e portatore di
pacemaker.
(b) Mappaggio
elettroanatomico
con metodica
CARTO.
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
a
b
La mappa di attivazione permette di identificare il circuito della tachicardia ventricolare mostrando un rientro nel setto interventricolare con punto di uscita sul versante destro (freccia). Le
aree con colore rosso e arancione-giallo sono zone anomale con bassi potenziali e bassa velocità di conduzione.
del nodo seno-atriale e del nodo AV (si veda in precedenza,
Blocchi atrioventricolari). In alcune condizioni patologiche,
tuttavia, l’automatismo di questi centri può aumentare fino
a 60-90/min e subentrare, quindi, attivamente al ritmo sinusale. Episodi di RIVA sono frequenti soprattutto in presenza di
infarto miocardico acuto, tossicità digitalica e ipokaliemia.
La diagnosi di RIVA è in genere semplice da porre all’ECG,
dove l’aritmia si presenta con una frequenza ritmica di complessi QRS di aspetto anomalo e con una durata superiore ai
0,12 sec. In genere sono visibili onde P sinusali dissociate dai
QRS, e possono essere presenti battiti di fusione per la contemporanea attivazione dei ventricoli da parte dello stimolo
sinusale, normalmente condotto attraverso il nodo AV, e di
quello originato dal focus ectopico ventricolare.
di attivazione ventricolare che possono assumere in alcuni
casi un aspetto quasi sinusoidale. Dal punto di vista meccanico, il cuore riesce a determinare solo una bassissima gittata
sistolica o appare addirittura fermo, per cui il paziente perde
rapidamente coscienza. Se non si interviene rapidamente, il
flutter degenera in poco tempo in fibrillazione ventricolare
e, quindi, in arresto cardiaco e morte del paziente.
Terapia
L’unico trattamento valido è l’immediata cardioversione elettrica.
Fibrillazione ventricolare
Terapia
Solitamente il RIVA non dà sintomi, ha un’evoluzione
favorevole e non richiede trattamento. Eccezionalmente può essere necessaria una terapia medica se la
dissociazione fra attività atriale e ventricolare comporta una compromissione emodinamica. In questi rari
casi, sono di solito sufficienti piccole dosi di atropina
per via venosa per aumentare la frequenza sinusale e
sopprimere l’attività del centro ectopico o utilizzare
un farmaco antiaritmico (di classe II, III o IC).
Flutter ventricolare
Il flutter ventricolare si può considerare una tachicardia ventricolare a frequenza molto alta (> 250 bpm), per cui all’ECG,
per il breve intervallo tra i complessi ventricolari, non è in
genere possibile distinguere bene il tratto ST e l’onda T. Si
osserva, viceversa, un serie ravvicinata e ritmica di complessi
C0055.indd 270
La fibrillazione ventricolare definisce una condizione di
attività elettrica caotica e disorganizzata dei ventricoli,
che sono simultaneamente percorsi da fronti d’onda di
eccitazione multipli e incoordinati che si modificano in
continuazione, in rapporto al fatto che ognuno di essi si
trova davanti cellule che, di volta in volta, hanno recuperato la loro eccitabilità o sono ancora in fase di refrattarietà.
All’ECG si nota anzitutto la completa assenza di qualsiasi
attività elettrica organizzata. Non sono, quindi, riconoscibili onde P-QRS-T, mentre si osserva una serie di onde sinusoidali di ampiezza, intervalli e direzione continuamente
variabili, e a frequenza in genere molto alta (Fig. 11.26).
Dal punto di vista meccanico, il cuore in fibrillazione ventricolare è fermo e non c’è alcuna gittata sistolica; il paziente
è quindi in arresto cardiaco. Una volta insorta, la fibrillazione ventricolare abitualmente non tende a cessare, e
quindi, se non si interviene rapidamente, l’esito è la morte
del paziente; in effetti, la fibrillazione ventricolare è la causa
più frequente di morte improvvisa per arresto cardiaco.
6/9/10 9:48:25 AM
Capitolo 11 - ARITMIE
271
1
Terapia
L’unica terapia della fibrillazione ventricolare è la defibrillazione elettrica (scariche da 200 sino a 360 J). Se
questa non è immediatamente attuabile, è indispensabile eseguire il massaggio cardiaco esterno e la ventilazione assistita per garantire un minimo di circolo
e di apporto ematico soprattutto all’encefalo. L’interruzione del circolo per un tempo superiore a 2-3 min
comporta, infatti, lesioni cerebrali irreversibili.
Figura 11.26
Episodio di
tachicardia
ventricolare
polimorfa
degenerata
in fibrillazione
ventricolare.
Malattie dei canali ionici e dei recettori di membrana
Sindrome del QT lungo
Un intervallo QT lungo comporta un aumento del rischio
di aritmie ventricolari gravi, che possono esitare in morte
improvvisa. Esso, infatti, è spesso indicativo di una significativa differenza dei periodi refrattari delle cellule miocardiche (dispersione della refrattarietà), per cui predispone
a tachiaritmie da rientro. Anche meccanismi triggerati,
tuttavia, possono essere coinvolti nella genesi di tachiaritmie in questa condizione, in quanto le cellule miocardiche
possono presentare instabilità del potenziale cellulare con
formazione di post-potenziali precoci e tardivi. La sindrome del QT lungo può essere congenita o acquisita.
La sindrome del QT lungo congenito è una condizione
geneticamente determinata, individuabile solo per il riscontro di un allungamento dell’intervallo QT corretto per
la frequenza cardiaca all’ECG, al quale possono associarsi
anomalie morfologiche dell’onda T (Fig. 11.27). Sono
state descritte sinora 12 varianti genetiche di questa patologia, designate con una sigla che va da LQT1 a LQT12
(dove LQT sta per “long” QT), la maggior parte dovute
ad anomalie funzionali di diversi canali di membrana del
potassio, ma alcune, come la forma LQT3, dovute ad alterazioni funzionali dei canali del sodio, e una dei canali del
calcio. Le forme decisamente più frequenti, comunque,
sono la LQT1, la LQT2 e la LQT3, che costituiscono il 95%
o più di queste sindromi. Tutte le forme sono trasmesse
in modo autosomico dominante. La penetranza di questi
geni è, tuttavia, ridotta e l’espressione fenotipica è variabile. Una forma clinica particolare di sindrome del QT
lungo congenito, che è associata a sordità, è la sindrome
di Jervell- Lange Nielsen, che è causata da una mutazione
del gene responsabile della sindrome LQT1 o LQT5, ma è
trasmessa in modo autosomico recessivo.
I soggetti con sindrome del QT lungo congenito possono
stare benissimo, ma hanno una predisposizione a sviluppare episodi di tachicardia ventricolare polimorfa, a torsione
di punta e fibrillazione ventricolare. Possono perciò andare
incontro a episodi di sincope e a morte improvvisa.
Una sindrome del QT lungo deve essere sospettata in
tutti i casi di persone giovani che presentano episodi
C0055.indd 271
sincopali, soprattutto se esiste una familiarità per morte
improvvisa. Cosa importante, in questa sindrome il fenotipo è in larga parte gene-specifico, cioè le mutazioni
genetiche delle singole forme determinano quadri clinici
specifici per ogni genotipo. Così, nella sindrome LQT1
le tachiaritmie sono favorite dall’attivazione simpatica,
per cui le sincopi (o l’arresto cardiaco) da tachiaritmie si
verificano tipicamente durante sforzo. La sindrome LQT2
è invece caratterizzata da eventi sincopali indotti da forti
stress acuti conseguenti più tipicamente a stimoli uditivi
(per esempio, il suono improvviso di una sveglia). D’altro
canto, nella sindrome LQT3 le tachiaritmie si verificano
più frequentemente durante il sonno o il riposo.
Tachiaritmie analoghe a quelle delle forme congenite si
possono osservare nelle sindromi del QT lungo acquisite, che sono principalmente legate a disordini elettrolitici
(ipokaliemia, ipomagnesiemia) e all’uso di alcuni farmaci (chinidina, disopiramide, sotalolo, alcune fenotiazine,
antidepressivi triciclici, alcuni antibiotici). In presenza di
I
aVR
V1
V4
II
aVL
V2
V5
III
aVF
V3
V6
a
aVR
V1
V4
II
aVL
V2
V5
aVF
V3
V6
Figura 11.27
ECG tipici di un
paziente con
intervallo QT
lungo (a) e di
un paziente con
intervallo QT
corto (b).
b
6/9/10 9:48:31 AM
272
Parte 1 - MALATTIE DEL SISTEMA CIRCOLATORIO
tachiaritmie ventricolari o sincope associate al riscontro
di un QT lungo all’ECG vanno, quindi, sempre esclusi tali
fattori causali (si veda in precedenza, Tachicardia ventricolare
a torsione di punta).
to ST molto breve nelle derivazioni precordiali (si veda
Fig. 11.27).
A causa del basso numero di casi sinora riportati in letteratura (solo circa 50) non è possibile avere un’indicazione
precisa sulla storia naturale e la stratificazione del rischio
di questi pazienti.
Terapia
Nei pazienti con sindrome LQT1 il trattamento con
farmaci β-bloccanti è molto efficace nel ridurre il
rischio di tachiaritmie gravi e, quindi, di morte improvvisa, per cui costituisce il trattamento di scelta
iniziale. D’altro canto, la terapia β-bloccante è meno
efficace nella prevenzione della morte improvvisa
nella sindrome LQT2 e, ancor più, LQT3. La differente
risposta alla terapia β-bloccante sottolinea l’importanza della corretta diagnosi della forma di QT lungo. Mentre altri farmaci antiaritmici non sono utili
per migliorare la sopravvivenza di questi pazienti,
l’impianto di un ICD costituisce l’unico trattamento
efficace per ridurre l’incidenza di morte improvvisa
nei pazienti a rischio che non possono essere protetti
con la terapia β-bloccante.
Il trattamento delle sindromi del QT lungo acquisito
consiste essenzialmente nella correzione o rimozione
dei fattori che ne sono causa.
Sindrome del QT corto
La sindrome del QT corto è stata descritta di recente come
una forma ereditaria di malattia aritmogena caratterizzata
da un intervallo QT corretto ≤ 320 msec associato a vari
tipi di aritmie, sopraventricolari (fibrillazione e flutter
atriale, in particolare) e ventricolari, sino alla fibrillazione
ventricolare.
Il paziente può presentarsi con palpitazioni o episodi
sincopali, ma l’esordio della malattia avviene in circa un
terzo dei casi con un arresto cardiaco e i pazienti hanno
comunque un elevato rischio di morte improvvisa.
Le mutazioni genetiche responsabili di questa sindrome causano un’aumentata attività di alcuni canali del
K+ o una ridotta attività di canali del Ca2+, con marcato
accorciamento del periodo refrattario delle cellule miocardiche.
La sindrome è diagnosticata all’ECG, che oltre all’intervallo QT corto, mostra onde T alte e appuntite e un trat-
I
aVR
II
Figura 11.28
(a) ECG di un
paziente con
sindrome di
Brugada. (b)
ECG in bambina
con tachicardia
ventricolare.
III
aVL
aVF
V1
V4
V2
V5
V3
V6
a
b
La tachicardia ventricolare bidirezionale è degenerata in una breve fase di tachicardia
ventricolare polimorfa e seguita da fibrillazione ventricolare, in una bambina di 9 anni con
tachicardia ventricolare polimorfa catecolaminergica confermata dall’analisi genetica.
C0055.indd 272
Terapia
Tra i farmaci antiaritmici solo la chinidina sembra
essere promettente per controllare le aritmie ventricolari. Per l’alto rischio di morte improvvisa, tuttavia,
l’impianto di un ICD sembra al momento indicato in
molti di questi pazienti.
Sindrome di Brugada
La sindrome di Brugada è caratterizzata dall’occorrenza
o predisposizione a tachiaritmie ventricolari potenzialmente fatali in associazione alla presenza di un quadro
ECG piuttosto tipico di morfologia a blocco di branca
destra (completo o incompleto) e sopraslivellamento del
tratto ST nelle derivazioni precordiali anteriori (V1-V3)
( Fig. 11.28 ). La presentazione clinica è in genere la
sincope o l’arresto cardiaco durante il sonno o in coincidenza con febbre o consumo di alcol. Colpisce nella
maggioranza soggetti maschi, con netta prevalenza
per la razza asiatica, e con esordio intorno ai 40 anni.
Si ritiene legata a mutazioni genetiche che causano
un’alterazione funzionale dei canali di membrana del
sodio (gli stessi responsabili della sindrome LQT3, con
la quale presenta diverse analogie), ma tale alterazione
genetica è dimostrabile solo nel 30% dei casi; sono
comunque allo studio nuove mutazioni genetiche riguardanti altre proteine di membrana come causa della
sindrome. In circa un quarto dei pazienti è presente
familiarità, suggerendo che numerosi casi sono conseguenti a nuove mutazioni genetiche. Il cuore si presenta
strutturalmente sano.
La sindrome di Brugada va sospettata nei soggetti che,
insieme al quadro ECG descritto, presentano storia di
sincope o familiarità per morte improvvisa.
Terapia
Sebbene alcuni dati suggeriscano un certo effetto
protettivo dell’idrochinidina, nei casi a rischio di
morte improvvisa è attualmente indicato l’impianto
di un ICD.
Tachicardia ventricolare polimorfa
catecolaminergica
La tachicardia ventricolare polimorfa catecolaminergica
(TVPC) è una forma rara di tachicardia ventricolare tipicamente indotta da sforzi o condizioni di iperattività
adrenergica, a elevato rischio di degenerazione in aritmie
ventricolari fatali. Anche la morfologia della tachicardia
ventricolare è tipica, presentando un’alternanza battito-
6/9/10 9:48:32 AM
Capitolo 11 - ARITMIE
battito di due tipi di QRS con asse elettrico opposto (tachicardia ventricolare bidirezionale) (si veda Fig. 11.28).
La TVPC è una forma geneticamente determinata, dovuta a mutazioni del gene che codifica per il recettore
cardiaco della rianodina (RyR2). Questa svolge un ruolo
centrale nella regolazione dei flussi intracellulari di calcio
e nell’accoppiamento eccitazione-contrazione, in particolare a livello del reticolo sarcoplasmatico. La sincope,
indotta da sforzo o da un’emozione improvvisa, costituisce spesso la prima manifestazione di TVPC, sebbene un
arresto cardiaco possa verificarsi in soggetti fino ad allora
asintomatici. In circa il 30% dei casi l’anamnesi familiare
273
rivela una o più morti improvvise premature, verificatesi
di solito durante l’infanzia.
Terapia
Il trattamento antiadrenergico con i -bloccanti è il
fulcro della terapia di questi pazienti. L’impianto di
un ICD può essere indicato se il test ergometrico e il
monitoraggio Holter suggeriscono che con i -bloccanti
si ottiene solo un’incompleta protezione dall’aritmia.
1
Bibliografia
Anderson RH, Yanni J, Boyett MR et al. The anatomy of the cardiac
conduction system. Clin Anat 2009;22:99–113.
Arruda MS, McClelland JH, Wang X et al. Development and
validation of an ECG algorithm for identifying accessory
pathway ablation site in Wolff-Parkinson-White syndrome.
J Cardiovasc Electrophysiol 1998;9:2–12.
Boyett MR, Honjo H, Kodama I. The sinoatrial node, a
heterogeneous pacemaker structure. Cardiovasc Res
2000;47:658.
Brugada J, Brugada R, Brudada P. Right-bundle-branch block and STsegment elevation in leads V1 through V3: a marker for sudden
death in patients without demonstrable structural heart disease.
Circulation 1998;97:457–60.
Casella M, Dello Russo A. An atlas of radioscopic catheter placement
for the electrophysiologist. London: Springer-Verlag, 2008.
Epstein AE, DiMarco JP, Ellenbogen KA et al. American College
of Cardiology/American Heart Association Task Force on
Practice Guidelines: Guideline update for implantation of
cardiac pacemakers and antiarrhythmia devices. Circulation
2008;117:e350–408.
C0055.indd 273
Fisher W, Ritter Ph. Cardiac pacing in clinical practice. London:
Springer-Verlag, 1998.
Haïssaguerre M, Jaïs P, Shah DC et al. Spontaneous initiation of
atrial fibrillation by ectopic beats originating in the pulmonary
veins. N Engl J Med 1998;339:659–66.
Josephson ME. Clinical cardiac electrophysiology: techniques
and interpretations solution. 4th ed. Philadelphia: Lippincott
Williams & Wilkins, 2008.
Katz AM. Fisiologia del cuore. Torino: Centro Scientifico Editore, 1994.
MacFarlane PW, Lawrie TDV. Comprehensive electrocardiology.
New York: Pergamon Press, 1989.
Oreto G. I disordini del ritmo cardiaco. Torino: Centro Scientifico
Editore, 1997.
Schwartz PJ, Priori SG, Locati EH et al. Long QT syndrome patients
with mutations of the SCN5A and HERG genes have differential
responses to Na+ channel blockade and to increases in heart rate.
Implications for gene-specific therapy. Circulation 1995;92:3381–6.
Wiber D, Packer D, Stevenson W. Catheter ablation of cardiac
arrhythmias: basic concepts and clinical applications. San
Francisco: Wiley-Blackwell, 2007.
6/9/10 9:48:34 AM
C0055.indd 274
6/9/10 9:48:34 AM