Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
INTRODUZIONE
La stenosi valvolare aortica, indipendentemente dalla sua eziologia,
genera ripercussioni che interessano la valvola mitrale e il ventricolo
sinistro, realizzando un quadro fisiopatologico complesso con
manifestazioni cliniche variabili, la cui entità sarà dovuta al diverso grado
di interessamento di ciascuna struttura.
Riveste inoltre grande importanza, nella determinazione del quadro
clinico, la presenza di comorbilità, con particolare riferimento ad altre
patologie dell’apparato cardiovascolare, soprattutto se rilevanti dal punto
di vista emodinamico.
La prevalenza della patologia, per quanto riguarda la stenosi
valvolare aortica calcifica, risulta essere, nella popolazione
ultrasessantacinquenne dei paesi occidentali, il 2% (1). Molti di questi
pazienti vengono sottoposti ad intervento cardiochirurgico di sostituzione
valvolare aortica con conseguenti ripercussioni sulla valvola mitrale e sul
ventricolo sinistro. L’obiettivo di questo lavoro è quello di valutare,
attraverso la misurazione di parametri clinici e strumentali, l’outcome di
tali pazienti ed evidenziare eventuali condizioni che risultino predittive
dell’esito dell’intervento.
STENOSI AORTICA
La stenosi valvolare aortica viene definita come un’ostruzione al
passaggio del flusso ematico dal ventricolo sinistro all’aorta durante la
fase sistolica del ciclo cardiaco. Si tratta della patologia valvolare
cardiaca più comune tra gli adulti nei paesi occidentali ed interessa circa il
25% di tutti i pazienti con patologie valvolari (2); l’80% dei soggetti con
stenosi aortica sintomatica è di sesso maschile. La stenosi aortica calcifica
1
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
degenerativa costituisce, tra le malattie valvolari, la causa più comune di
ricorso al trattamento sia medico che chirurgico.
L’ostruzione si localizza, nella maggior parte dei casi, a livello
dell’apparato valvolare (stenosi aortica propriamente detta). Esistono,
tuttavia, anche altre condizioni di ostacolo all’efflusso del ventricolo
sinistro quali la miocardiopatia ipertrofica, la stenosi aortica
sottovalvolare congenita e la stenosi aortica sopravalvolare. Tali
patologie presentano caratteristiche peculiari e pertanto non rientrano
nella casistica di questo lavoro.
Figura 1: Tipologie più comuni di stenosi aortica. A, valvola normale; B,
Bicuspidia congenita; C, stenosi aortica reumatica; D, stenosi calcifica
degenerativa.
Zipes, Libby, Bonow, Braunwald “Braunwald’s Heart Disease, 7th Edition,
2005, Elsevier Saunders
2
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
I meccanismi eziopatogenetici che generano la stenosi valvolare
aortica propriamente detta sono molteplici: più frequentemente è dovuta
ad alterazioni degenerativo calcifiche delle semilunari, a malformazioni
congenite ed a lesioni infiammatorie meta reumatiche. Negli anni si è
verificato un progressivo mutamento nella frequenza relativa di ciascuna
di queste alterazioni: si assiste ad un incremento sempre maggiore della
prevalenza delle alterazioni degenerativo-calcifiche inducenti stenosi
(46% dei casi nei pazienti di oltre 65 anni) (3) e ad una notevole riduzione
della patogenesi infiammatoria, specie di quella post-reumatica (dal 30%
al 18%) (4). Anche il riscontro di bicuspidia valvolare congenita è in lieve
decremento (dal 37% al 33%).
Figura 2: Differenti aspetti che può assumere una valvola aortica stenotica
Slavich G. “Ecocardiografia clinica”, Padova, Piccin Nuova Libraria, 1989, vol. I,
p.398.
A sostegno della predominante eziologia degenerativo-calcifica della
stenosi c’è, inoltre, l’osservazione che la sclerosi della valvola aortica
3
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
(cioè il semplice ispessimento e la calcificazione dei lembi valvolari senza
lo sviluppo di gradienti pressori patologici) sembra riguardare un soggetto
su quattro tra quelli di età superiore ai 65 anni, mentre la vera e propria
stenosi (con aumento patologico dei gradienti) è presente nel 2-9% della
popolazione, sempre ultrasessantacinquenne; l’incidenza di entrambe le
condizioni aumenta parallelamente con l’età (5).
La stenosi calcifico-degenerativa è caratterizzata da progressivi
depositi di sali di calcio, che impediscono la normale escursione delle
cuspidi generalmente senza determinare la fusione delle commissure né
insufficienza valvolare particolarmente significativa.
Il diabete mellito e l’ipercolesterolemia sono fattori di rischio per lo
sviluppo della stenosi, che si associa frequentemente a calcificazioni
dell’anello mitralico e a coronaropatia, tanto da essere ormai considerata
un vero e proprio marker di patologia coronarica(5).
FISIOPATOLOGIA
La caratteristica emodinamica principale della Stenosi Aortica ( SA)
è costituita dall’ostruzione all'efflusso del ventricolo sinistro, che
determina un gradiente pressorio tra camera ventricolare e aorta; tale
gradiente si instaura progressivamente nel tempo e diviene rilevabile
quando la superficie orifiziale della valvola è ridotta a meno del 50%.
Il ventricolo, in una prima fase, riesce a mantenere la normale portata
cardiaca attraverso lo sviluppo di un meccanismo compensatorio
rappresentato dall’ipertrofia ventricolare sinistra concentrica, che tende a
compensare l’aumento dello stress sistolico sviluppato nel miocardio a
causa del gradiente aggiuntivo.
La massa cardiaca aumenta e il peso complessivo del cuore può
incrementare anche di 500-1000 grammi (3). In questa fase non si verifica
contestuale dilatazione della camera ventricolare e, anche durante lo
4
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
sforzo fisico, viene in genere mantenuta una normale capacità di
incremento della gittata.
Sono state descritte differenze legate al sesso nell’adattamento del
ventricolo sinistro alla stenosi aortica: le donne presentano più
frequentemente una performance ventricolare normale o aumentata in
risposta al sovraccarico pressorio, con ipertrofia concentrica della parete e
ventricolo sinistro piccolo e ipercinetico, mentre negli uomini si
instaurano più spesso ipertrofia e dilatazione ventricolare sinistra
(ipertrofia eccentrica).
Progressivamente si rendono evidenti alcune alterazioni
ultrastrutturali caratteristiche, quali nuclei dei miocardiociti insolitamente
grandi, perdita di miofibrille, accumulo di mitocondri, proliferazione di
fibroblasti e di fibre collagene nello spazio interstiziale; quest’ultimo
evento, in particolare, è associato all’aumento del diametro trasverso e del
volume dei miocardiociti ed è alla base della riduzione della compliance
ventricolare e dell’aumento della pressione telediastolica.
Di conseguenza, la curva pressoria atriale dei pazienti con stenosi
aortica mostra, più o meno precocemente, un’ampia onda “a”, dovuta alla
più intensa contrazione dell’atrio sinistro dilatato. Contestualmente si nota
una ridotta compliance ventricolare sinistra; il ruolo chiave svolto
dall’atrio nel riempimento ventricolare è evidente in quanto la perdita di
una contrazione atriale sincronizzata (fibrillazione atriale o dissociazione
atrioventricolare) provoca generalmente un rapido peggioramento del
compenso emodinamico.
L’aorta ascendente può presentare una dilatazione post-stenotica di
grado variabile, talora con medionecrosi della parete e possibile
dissezione aortica di tipo A secondo la classifficazione di Stanford.
Si ritiene che un gradiente sistolico di picco superiore a 50 mmHg
e/o un'area valvolare effettiva inferiore a 0,8 cm² in un adulto di
corporatura media (area normale di 2,5-3 cm²) rappresentino, in genere,
un’ostruzione critica all’efflusso ventricolare sinistro.
5
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Nelle fasi avanzate della malattia una ulteriore progressione del vizio
valvolare e la contemporanea comparsa di insufficienza ventricolare
sinistra conducono alla riduzione, anche a riposo, della gittata sistolica;
sopraggiungono tachicardia compensatoria, dilatazione della camera
ventricolare sinistra, aumento della pressione atriale sinistra e delle
pressioni polmonari.
SINTOMI
La stenosi aortica assume raramente rilevanza clinica o emodinamica
a riposo, almeno fino a quando l’area valvolare non si riduce a circa un
terzo del normale; anche i pazienti con stenosi grave possono essere
asintomatici per lungo tempo, grazie ai meccanismi di compenso messi in
atto dal ventricolo sinistro.
I sintomi principali che caratterizzano la stenosi aortica sono la
dispnea da sforzo, la sincope e l'angina pectoris, in aggiunta ad
un’anamnesi spesso positiva per graduale riduzione dell’attività fisica.
La dispnea è dovuta all’incremento della pressione capillare
polmonare, provocato dall’aumento della pressione telediastolica del
ventricolo sinistro secondaria a ridotta compliance. Il quadro clinico varia
in relazione all'entità e alla velocità dell'aumento delle suddette pressioni e
può essere caratterizzato da dispnea da sforzo, ortopnea e dispnea
parossistica notturna, fino all’edema polmonare acuto non
necessariamente in quest'ordine.
L’angina pectoris compare, in genere, tardivamente come
espressione della discrepanza tra le aumentate richieste metaboliche di
ossigeno e la ridotta disponibilità. L’aumento delle richieste è
direttamente proporzionale all’aumento della massa miocardica e della
pressione intraventricolare. La ridotta disponibilità è spesso dovuta alla
frequente coesistenza di coronaropatia e alla compressione dei vasi
6
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
coronarici da parte del miocardio ipertrofico, nonché alla ridotta durata
della diastole se presente tachicardia compensatoria o aritmie
ipercinetiche.
La sincope è un sintomo frequente nei pazienti con stenosi valvolare
aortica. L’anatomia valvolare rende difficoltoso l’aumento della portata
cardiaca ogni volta che questo si rende necessario. Ciò può accadere, ad
esempio, a causa dell’ipotensione arteriosa determinata dalla
vasodilatazione in corso di attività fisica oppure in caso di rapida
riduzione della portata provocata da una concomitante aritmia o in altre
situazioni che richiedono un aumento del flusso ematico sistemico
(ipertiroidismo, sepsi, stress intensi).
STORIA NATURALE
Contrariamente alla stenosi mitralica, i cui sintomi insorgono poco
dopo l’instaurarsi della valvulopatia, i pazienti con stenosi aortica grave
possono rimanere asintomatici anche per anni nonostante la presenza di
un’ostruzione significativa.
Tra i fattori prognostici, quello maggiormente rilevante è senz’altro
rappresentato dalla rapidità con cui evolve la malattia, che risulta variabile
e difficilmente prevedibile.
Una progressione particolarmente rapida è stata rilevata nelle forme
degenerativo-calcifiche, nei pazienti più anziani, nei casi di bicuspidia
aortica e in quelli con notevole depressione della funzione ventricolare (6).
La comparsa dei sintomi rappresenta, inoltre, un’evidente prova di
malattia in fase avanzata ed ha una valenza prognostica importante; è stato
stimato, infatti, che l’aspettativa media di vita, in assenza di intervento
chirurgico, è di 3-5 anni dopo l’insorgenza di angina pectoris, di 2-3 anni
7
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
dopo la prima sincope e di 1,5-2 anni dopo la prima manifestazione di
scompenso cardiaco.
Il quadro clinico decorre spesso in modo asintomatico o
paucisintimatico e le prime manifestazioni di malattia possono essere
embolie sistemiche, endocardite batterica e morte improvvisa in genere da
causa aritmica. Indipendentemente dalla presenza dei sintomi, l’incidenza
di morte improvvisa resta elevata, pari al 15-20% /anno(7).
TERAPIA MEDICA
Il trattamento della stenosi aortica è essenzialmente chirurgico.
Tuttavia il ruolo della terapia medica non è marginale; se infatti non
esiste una terapia in grado di rallentare o arrestare la progressione
funzionale del danno valvolare, lo stesso non può dirsi per il controllo
dei sintomi e la prevenzione delle complicanze.
Nei pazienti con stenosi lieve/moderata, i quali raramente sono
sintomatici, sarà sufficiente impostare un programma di follow up
ecocardiografico per monitorare la progressione della stenosi con
frequenza annuale ( il gradiente pressorio aumenta di 4-8 mmhg/ anno e
la superficie della valvola si riduce di 0.2-0.3 cm2/anno (6)). Sarà inoltre
opportuno raccomandare al paziente di non sottovalutare quei sintomi
che possono essere la spia di un ulteriore peggioramento (dispnea,
angina, sincope).
Nei pazienti con stenosi severa occorrerà procedere ad una attenta
valutazione dei sintomi, a riposo e sotto sforzo. Questo permetterà di
avviare alcuni pazienti all’intervento immediato, mentre per gli altri, in
cui l’intervento è procrastinabile, sarà raccomandata una limitazione
dell’attività fisica e l’applicazione di norme igienico-comportamentali
atte a ridurre il rischio di eventi gravi. In questo gruppo di pazienti avrà
8
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
un ruolo ancora più importante il follow up ecocardiografico che sarà
effetuato con frequenza semestrale.
La comparsa di fibrillazione atriale o flutter si verifica nel 10 %
dei pazienti con stenosi valvolare aortica, a causa della dilatazione
atriale sinistra in risposta all’aumento di precarico. La perdita
dell’attività atriale produce una severa e repentina riduzione del
riempimento ventricolare e conseguentemente della portata cardiaca che
si può tradurre clinicamente nell’insorgenza di angina pectoris e/o
ipotensione. Tale condizione richiede un’immediata cardioversione
farmacologica o elettrica.
In tutti i pazienti portatori di stenosi valvolare aortica è
raccomandata la profilassi antibiotica per la prevenzione
dell’endocardite.
Inoltre la terapia medica assume un’importanza fondamentale in
quei pazienti che per età o comorbilità vengono giudicati non operabili.
I principali interventi medici, in attesa di un trattamento invasivo,
sono riportati nella seguente figura a pagina seguente.
Figura 3: Terapia medica
9
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Fuster V., Alexander R.W., O’Rourke R.,“Hurst – Il cuore”, Milano, McGrawHill, 2005, 11a edizione, vol II, p.1994.
TERAPIA CHIRURGICA
Le linee guida ed i documenti di consenso degli esperti hanno
l’obiettivo di riassumere e valutare le evidenze disponibili in merito ad
una specifica materia al fine di coadiuvare il medico nella scelta della
migliore strategia per ciascun paziente tenendo in considerazione non
solo l’impatto sull’outcome ma anche il rapporto rischio beneficio. In
considerazione del loro impatto sulla pratica clinica sono stati definiti
dei criteri di qualità per la realizzazione di queste. L’iter che si deve
compiere per giungere alla pubblicazione si potrebbe cosi, brevemente
riassumere: gli esperti prescelti compiono un’approfondita rassegna
della letteratura disponibile per una disamina critica delle procedure
terapeutiche e diagnostiche e per una valutazione del rapporto rischiobeneficio associato alle terapie raccomandate per il trattamento e/o la
prevenzione di una determinata condizione clinica. I livelli di evidenza e
la forza delle raccomandazioni a favore o contro un particolare
trattamento sono classificati sulla base di scale predefinite, riportati nelle
tabelle seguenti.
Tabella 1:Classi delle raccomandazioni
Classe I
Classe II
II a
II b
Classe III
Evidenza e/o consenso generale che un determinato trattamento o intervento sia
vantaggioso, utile ed efficace.
Evidenza contrastante e/o divergenza di opinione circa l’utilità/efficacia di un
determinato trattamento o intervento.
Il peso dell’evidenza/opinione è a favore dell’utilità/efficacia.
L’utilità/efficacia risulta meno chiaramente stabilita sulla base dell’evidenza.
Evidenza e/o consenso generale che un determinato trattamento o intervento non
sia utile/efficace e che il taluni casi possa essere dannoso.
Tabella 2: Livelli di evidenza
Livello di evidenza
A
Livello di evidenza
B
Livello di evidenza
Dati derivati da numerosi trials clinici randomizzati o metanalisi.
Dati rilevati da un singolo trial clinico randomizzato o da ampi studi non
randomizzati.
Consenso degli esperti e/o studi di piccole dimensioni, studi retrospettivi e
10
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
C
registri.
Anche per la sostituzione valvolare aortica sono state elaborate (ed
aggiornate nel 2008) delle linee guida, usando i criteri precedentemente
citati, dall’American College of Cardiology/American Heart Association
(8)
.
La sostituzione valvolare aortica chirurgica (AVR) è indicata nei
clinici in cui coesistono una riduzione di grado severo dell’orifizio
valvolare aortico (<1,2 cm2) e una delle seguenti condizioni:
•
Sintomaticità per angina o scompenso cardiaco (classe I,
livello B di evidenza).
•
Indicazione
concomitante
ad
un
altro
intervento
di
cardiochirurgia (rivascolarizzazione coronarica, chirurgia
dell’aorta, sostituzione o riparazione di altre valvole) (classe I,
livello C di evidenza).
•
Disfunzione sistolica del ventricolo sinistro (FE <50%) (classe
I, livello A) .
I pazienti con stenosi aortica moderata (area valvolare >1 cm²)
possono essere sottoposta ad AVR ( Classe II a).
Le seguenti condizioni cliniche sono raccomandate con classe II b:
• Pazienti asintomatici con stenosi aortica severa e anormale
risposta all’esercizio fisico (livello C di evidenza).
•
Adulti asintomatici con stenosi aortica severa e notevole
probabilità di progressione rapida della malattia (presenza di
fattori predittivi, quali età, calcificazioni e malattia coronarica)
oppure pazienti in cui si
ritiene che la chirurgia possa
11
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
ritardare effettivamente l’insorgenza dei sintomi (livello C di
evidenza).
• Pazienti con stenosi aortica moderata sottoposti a CABG, in
presenza di calcificazioni della valvola di grado moderatosevero, cioè di entità tale da far ipotizzare una rapida
progressione della malattia (livello C di evidenza).
•
Pazienti asintomatici con stenosi aortica serrata (AVA < 0,6
cm2, gradiente transvalvolare medio >60 mmHg e jet di
rigurgito con velocità > 5 m/s), quando la mortalità operatoria
stimata si supponga sia < 1% (livello C di evidenza).
La classe III di raccomandazione non considera la sostituzione
valvolare aortica un’indicazione terapeutica utile nel prevenire la morte
improvvisa di pazienti con stenosi aortica asintomatica.
Nella seguente flow chart è riassunto l’algoritmo diagnostico e
terapeutico da seguire in caso di stenosi aortica:
12
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Figura 4: Algoritmo diagnostico e terapeutico
La sostituzione valvolare aortica (AVR) è oggi considerata il
presidio terapeutico definitivo nei pazienti con stenosi aortica e
rappresenta, in termini numerici, il secondo intervento cardiochirurgico
a cuore aperto nei soggetti ultrasettantenni (9) e l’intervento chirurgico
valvolare più frequentemente messo in atto (10).
La mortalità operatoria è molto variabile a seconda delle casistiche
chirurgiche e dell’associazione o meno con altre procedure, ma, in
media, nei pazienti senza franca insufficienza ventricolare sinistra, si
attesta tra il 2 e l’8% e in quelli di età inferiore a 70 anni si abbassa a
meno dell’1%.
13
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
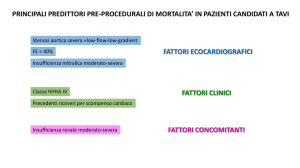
I fattori determinanti un maggior rischio di mortalità operatoria
comprendono l’appartenenza ad una classe NYHA elevata, la
compromissione della funzione del ventricolo sinistro, l’età avanzata e la
presenza di una concomitante insufficienza aortica, ma anche l’obesità,
l’endocardite infettiva, l’insufficienza renale e la broncopneumopatia
cronica ostruttiva (BPCO).
Il tasso di sopravvivenza a 5 anni tra i pazienti sottoposti a
chirurgia è approssimativamente dell’85%, quello a 10 anni del 70%
(contro il 10% in assenza di intervento chirurgico).
I fattori di rischio per decesso tardivo sono molto simili a quelli per
mortalità perioperatoria e comprendono la coesistenza di grave
scompenso cardiaco, l’alterata funzione ventricolare sinistra, la presenza
di aritmie precedenti l’intervento, una concomitante insufficienza aortica
grave, l’età avanzata e una coesistente coronaropatia non trattata.
E’ da sottolineare come la mortalità a distanza sia influenzata
significativamente dalla presenza della protesi, visto che, tra i decessi, il
20% sono protesi-correlati (11).
Figura 5: Protesi Pericarbon espiantata: si notano la mancata coaptazione del
bordo libero delle cuspidi e la presenza di inspessimenti nodulari sul corpo di ogni
singola cuspide.
14
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Nicolosi G.L. “Trattato di ecocardiografia clinica”, Padova, Piccin Nuova Libraria,
1999, vol. II, p.1276.
Inoltre, nell’immediato postoperatorio e specie tra i pazienti più
anziani, si rileva un’elevata incidenza di danni neurologici (emiparesi,
emiplegia, afasia ecc.), la cui causa è da ricercare probabilmente nella
correlazione tra la valvulopatia aortica e una malattia aterosclerotica
diffusa ingravescente.
L’incidenza di tali complicanze aumenta notevolmente con l’età,
passando dallo 0,5% nei soggetti giovani al 5% nei soggetti di oltre 65
anni, fino all’8% riscontrato tra i pazienti ultrasettantenni.
Protesi
meccaniche
Evento
Complicanze totali
valve- related
58-66%
Embolia sistemica
12-20%
Sanguinamento
39-47%
Endocardite
5-9%
Trombosi protesica
1-3%
Perivalvular leak
2-6%
Reintervento
5-9%
Structural failure
0-0,5%
Tabella 3:Incidenza delle complicanze postchirurgiche
Protesi
biologiche
60-68%
12-18%
20-28%
6-10%
0,5-2%
1-3%
12-20%
11-19%
Colombo T. “La scelta della protesi del paziente adulto: questioni controverse”; atti
del 39°
La protesi valvolare ideale dovrebbe consentire un flusso
transvalvolare simile a quello fisiologico, avere lunga durata, non
provocare emolisi, essere facile da impiantare, nonché resistente
all’endocardite e non essere trombogenica; poiché tali caratteristiche sono
15
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
difficilmente ottenibili, le protesi valvolari cardiache continuano a subire
modifiche, nel tentativo di renderle sempre più simili alla protesi ideale.
Le protesi presentano vari diametri, riportati dal costruttore: è
necessario ricordare che il diametro non è quello dell’orifizio, ma di tutta
la protesi, compreso l’anello di supporto.
In linea generale vi sono due tipi di protesi valvolari oggi disponibili,
ognuna con pregi e difetti caratteristici: le protesi meccaniche e le protesi
biologiche.
La scelta dell’una o dell’altra è di fondamentale importanza, in
quanto condiziona sia la vita del paziente che la gestione della malattia
successivamente all’intervento.
Le protesi valvolari meccaniche sono caratterizzate da un’ottima
durata, garantita dalla durezza dei materiali che le compongono; infatti
sono costituite da un anello in lega d'acciaio ricoperto di carbonio e da
due foglietti mobili, anch'essi in carbonio.
Figura 6: Protesi valvolari meccaniche
I materiali descritti non sono soggetti a particolari processi di usura e
quindi la durata di una protesi meccanica è praticamente illimitata.
Il principale svantaggio di queste valvole è costituito, però, dalla
necessità di somministrare al paziente una terapia anticoagulante a vita, in
16
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
quanto il sangue, a contatto con il carbonio, come con qualunque altro
materiale artificiale, tende a formare coaguli in grado di depositarsi sulla
valvola e di alterarne il funzionamento.
L’eventuale disfunzione potrebbe insorgere repentinamente e
costituire un’urgenza.
Tutte le protesi meccaniche presentano, in ogni caso, un rigurgito
fisiologico, che si verifica tra elemento mobile ed anello; tale rigurgito è
detto flusso di lavaggio e risulta, a volte, difficilmente distinguibile da un
lieve rigurgito periprotesico.
Le protesi valvolari biologiche, invece, sono costruite utilizzando
valvole cardiache (o altri tessuti, come la membrana pericardica) di
animali (bovini e suini). Queste valvole richiedono la somministrazione
della terapia anticoagulante solo per un breve periodo, in genere non
superiore a 3 mesi.
Il principale svantaggio consiste nel fatto che la loro durata nel
tempo è limitata e direttamente proporzionale all'età del paziente.
In un paziente giovane (sotto i 40 anni), queste valvole durano,
infatti, soltanto 8-10 anni, mentre nell’ anziano possono garantire una
corretta funzionalità per circa 15 anni (in rari casi anche di più).
Questa differenza è dovuta essenzialmente al metabolismo del calcio,
che nel giovane è molto più efficiente e tende a depositare in minor tempo
sali di calcio nei foglietti valvolari, causandone l’indurimento.
Le protesi biologiche sono ulteriormente suddivise in protesi stented
e protesi stentless.
Le protesi stented sono protesi ibride, i cui lembi sono costituiti da
materiale biologico (pericardio bovino o valvola aortica porcina trattata
17
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
con glutaraldeide) e da uno stent metallico rivestito in Dacron; in comune
con le protesi meccaniche hanno la relativa facilità di impianto, mentre si
differenziano da quest’ultime per quanto riguarda la durata, che non
supera i 15-20 anni.
Le protesi stentless sono costituite da materiale biologico (pericardio
bovino o valvola aortica porcina) e sono prive dell'anello di impianto che
caratterizza le protesi stented. Nonostante siano tecnicamente più
complesse da impiantare, le protesi stentless presentano, a parità di
diametro, un rendimento emodinamico superiore, non alterando la
geometria della valvola e ritardando, di conseguenza, la formazione di
calcificazioni; vengono, quindi, utilizzate soprattutto quando l’anello
valvolare aortico è di piccolo calibro (1,9-2 cm 2). La loro durata è
sostanzialmente sovrapponibile a quella delle protesi biologiche stented.
Figura 7:Protesi valvolari biologiche
Le bioprotesi stentless si dividono, a loro volta, in eterologhe
(tessuto animale), omologhe (homograft: tessuto umano da donatore) e
autologhe (autograft: tessuto dello stesso paziente, utilizzato soprattutto in
caso di stenosi aortica giovanile).
18
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Da ricordare è, infine, l’intervento di Ross, consistente nell’impianto
della valvola polmonare dello stesso paziente in sostituzione dell’aortica,
con l’inserimento di una protesi homograft al posto della polmonare.
La decisione sul tipo di valvola da utilizzare viene presa tenendo
conto dell'età del paziente, delle sue condizioni generali, del suo stile di
vita ed anche delle sue preferenze.
In linea di massima vengono adottate protesi meccaniche nei soggetti
giovani e con aspettativa di vita superiore ai 10-15 anni, specie se costretti
ad assumere la terapia anticoagulante per altro motivo (ad esempio per
fibrillazione atriale).
Mancano sufficienti evidenze cliniche in merito a determinate
situazioni in cui la scelta della protesi si dimostra ancora particolarmente
controversa, come nel caso in cui la terapia anticoagulante sia
controindicata (per patologie associate) o sia rifiutata per motivi personali
(ad esempio in previsione di gravidanza) (11).
19
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Figura 8: Alcuni modelli di protesi valvolare
Nel paziente anziano la scelta del sostituto protesico deve seguire tre
fondamentali criteri:
Utilizzare
delle protesi che abbiano un’ampia area effettiva e
che garantiscano bassi gradienti transvalvolari.
La presenza di un gradiente transprotesico residuo dopo AVR è un
reperto piuttosto comune sia in caso di protesi meccanica che biologica,
tranne che negli autograft polmonari, negli homograft e nelle bioprotesi
stentless (11).
Il gradiente transprotesico, in assenza di errori tecnici al momento
dell’impianto o di eventi patologici quali presenza di panno o trombi, è
influenzato principalmente dalle caratteristiche della protesi, dal suo
20
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
diametro in rapporto alla superficie corporea del paziente e dalla gittata
cardiaca.
E’ stato rilevato che protesi aortiche di diametro superiore a 21 mm
difficilmente generano gradienti elevati, mentre il rischio è molto più alto
nel caso di stenosi aortica calcifica in pazienti anziani con anulus aortico
naturale di piccole dimensioni rispetto alla superficie corporea.
Se, infatti, viene impiantata una protesi con calibro troppo piccolo
rispetto all’anulus è più facile che si instauri un gradiente di una certa
entità.
Da un punto di vista clinico l’importanza della valutazione dei
gradienti transprotesici è determinata dal fatto che valori anche modesti in
condizioni di riposo possono aumentare notevolmente sotto sforzo, con
ripercussioni emodinamiche molto significative; il risultato della
permanenza di tali gradienti è quello di impedire una regressione
dell’ipertrofia ventricolare, con il conseguente persistere del rischio di
aritmie ventricolari.
Valutare accuratamente il rischio di un eventuale reintervento
a distanza.
La degenerazione strutturale delle bioprotesi si verifica molto
tardivamente ed è inversamente proporzionale all’avanzare dell’età; dai
dati esistenti in letteratura si evince che, in pazienti di età > 65 anni, il
95% delle protesi a 10 anni è libero da processi degenerativi.
E’ quindi ragionevole pensare che la durata della bioprotesi sia
superiore all’aspettativa di vita dell’anziano al momento dell’intervento.
Non
istituire un trattamento anticoagulante protratto nel
tempo. Nell’anziano, spesso, la presenza di patologie
concomitanti extracardiache e l’aumentato rischio di eventi
21
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
trombotici ed emorragici consigliano l’utilizzo di bioprotesi,
che, a differenza delle protesi meccaniche, non necessitano
di terapia anticoagulante a vita.
Un altro aspetto a sostegno di questa scelta è la frequente
impossibilità, da parte del paziente anziano, di seguire un regime
terapeutico anticoagulante adeguato nel tempo.
Secondo studi recenti la sopravvivenza dopo AVR tra i pazienti >65
anni è praticamente sovrapponibile a quella della popolazione generale e
anche i dati raccolti riguardo pazienti particolarmente anziani confermano
risultati molto incoraggianti.
Nei pazienti affetti da stenosi aortica, quando la sostituzione
valvolare ha successo, si rilevano sostanziali miglioramenti clinici ed
emodinamici, associati ad una graduale riduzione dell’ipertrofia e al
recupero della funzionalità ventricolare sinistra (12).
Figura 9:rapporto vantaggi/svantaggi dei vari tipi di protesi
Ecco, in conclusione, i principali vantaggi e svantaggi relativi
all’impianto dei vari tipi di protesi:
22
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Tipo di
protesi
Bioprotesi
Durata
Rischio di Rischio di
trombosi emorragia
Gradiente
Difficoltà *Vantaggi
transproteico tecnica e svantaggi
++
+
+
+++
+
0,8
+++
+
+
++
++
0,6
+++++
+++++
+++++
+++
+
0,5
Homograft
++++
0
0
0
++++
0,4
Autograft
++++
0
0
0
+++++
0,2
Stented
Bioprotesi
Stentless
Bioprotesi
Meccaniche
Tabella 4: caratteristiche dei vari tipi di protesi
*vantaggi/svantaggi: scala da 0 a 1 (dove 1 è il rapporto vantaggioso e 0
svantaggioso)
ALTERNATIVE ALLA SOSTITUZIONE VALVOLARE
CHIRURGICA
La tecnica di decalcificazione della valvola Ultrasonic Debridement,
utilizzata in passato in alcuni centri, è stata definitivamente abbandonata,
in quanto responsabile dell’instaurarsi di una progressiva insufficienza
aortica, dovuta a fibrosi e retrazione delle cuspidi valvolari.
In caso di stenosi aortica degenerativa dell’anziano è stata
recentemente riproposta la tecnica di Manual Debridement della valvola,
con l’evidenza di risultati sufficientemente soddisfacenti nel breve
termine (mortalità intraospedaliera pari al 5,8%), ma con alta incidenza di
restenosi e necessità di reintervento nel lungo termine.
Questa metodica dovrebbe perciò essere presa in considerazione solo
in casi molto selezionati, in cui l’anatomia della valvola risulti
particolarmente favorevole (depositi di calcio solo sulla faccia aortica
23
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
delle cuspidi, assenza di distorsione ecc.) e in presenza di un anulus
aortico di dimensioni ridotte.
Ben altra attenzione meritano, soprattutto dopo i progressi degli
ultimi anni, le tecniche percutanee di trattamento della stenosi aortica.
La prima in ordine cronologico ad essere stata messa a punto è la
Valvuloplastica Aortica Percutanea
Con questa metodica viene inserito un catetere per via arteriosa che
viene spinto fino all’ostio valvolare. Sulla punta del catetere si trova un
palloncino che, una volta gonfiato, raggiunge un diametro di 20 mm. Si
tenta così di ottenere un allargamento della superficie dell’area valvolare
con conseguente riduzione della stenosi.
Figura 10: Valvuloplastica Aortica con palloncino
I risultati ottenuti a breve termine sembravano molto incoraggianti:
un incremento dell’area valvolare da 0,4 a 0,9 cm2 e una mortalità del 315 % lasciavano prospettare per questa tecnica un largo utilizzo.
24
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Tuttavia successivamente si notava una percentuale di restenosi a 18
mesi dell’80% (13) e senza una significativa riduzione della mortalità a
lungo termine(14).
Per questi motivi questa tecnica non viene comunemente utilizzata
nella stenosi aortica dell’adulto ma rappresenta un’alternativa alla terapia
chirurgica soltanto nei bambini affetti dalla forma congenita di stenosi
aortica (15) e negli adulti di giovane età.
La valvuloplastica può comunque essere presa in considerazione in
particolari situazioni ed essere utilizzata con le seguenti finalità:
Ø Procedura di attesa (intervento “ponte”) prima di una successiva
SVA, nel caso in cui il paziente si trovi in condizione di shock cardiogeno
oppure nella situazione in cui debba affrontare un intervento urgente di
chirurgia generale.
Ø Misura palliativa in pazienti non candidati a cardiochirurgia per
gravi patologie associate o in soggetti che rifiutino l’intervento.
Il miglioramento delle tecniche e l’innovazione dei materiali ha
aperto le frontiere alla seconda metodica: l’ impianto percutaneo di
valvola aortica protesica.L’obiettivo non è più quello di ottenere un
miglioramento della stenosi ma, al pari dell’intervento chirurgico,
sostituire la valvola danneggiata.
Sono state messe a punto diverse vie d’accesso:
- Anterograda, nella quale si raggiunge la valvola inserendo il
catetere in vena femorale e perforando il setto interatriale.
- Retrograda, nella quale il vaso utilizzato è l’arteria femorale da
dove si raggiunge la valvola risalendo il flusso.
25
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
- Transapicale: più invasiva, si entra nel ventricolo sinistro
perforando l’apice. Si utilizza nei pazienti con accessi vascolari
difficili, patologie dell’arco aortico e difficoltoso passaggio aortoventricolare.
All'estremità del catetere che raggiunge l’ostio valvolare malato è
applicata la valvola protesica, le cui semilunari sono realizzate in
pericardio equino (16) ( in altri studi è stato utilizzato materiale suino)
montati su una rete metallica espandibile simile ai comuni stent utilizzati
nell’angioplastica ma di diametro maggiore.
Figura 11: Esempio di protesi valvolare con rete metallica
Una volta espansa la rete mediante il gonfiaggio del palloncino la
protesi si salda alla parete, sovrapponendosi ai lembi malati e
salvaguardando la pervietà degli ostii coronarici.
26
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Figura 12: Protesi valvolare in sede con osti coronarici pervi
I risultati dei primi studi sull’applicazione di questa tecnica sono stati
decisamente incoraggianti: la superficie valvolare è aumentata da 0.5 +0.1 cm2 a 1.70 +- 0.03 cm2 e la sopravvivenza ad 8 settimane (16) in
pazienti in classe NYHA 4 e giudicati non sottoponibili ad intervento
chirurgico è stata comunque superiore al 50%.
Tutto ciò spiega il crescente numero di centri in che stanno
implementando questa tecnica.
27
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
L’INSUFFICIENZA MITRALICA
La valvola mitrale è una struttura complessa, costituita da vari
elementi: l’anulus, i lembi valvolari, le corde tendinee, i muscoli
papillari e la parete del ventricolo sinistro, che partecipa attivamente alla
continenza valvolare.
L’anulus è asimmetrico, con una porzione fissa (corrispondente al
lembo anteriore) condivisa con l’anulus aortico e una porzione mobile
(corrispondente al lembo posteriore) che comprende la maggior parte
della sua circonferenza.
I due lembi, anteriore e posteriore, sono asimmetrici; il lembo
anteriore è più lungo, ma occupa una porzione minore della
circonferenza dell’anulus rispetto al posteriore.
Le corde tendinee collegano ciascun muscolo papillare alla
corrispondente commessura, avvicinano le metà di entrambi i lembi e li
mantengono in una posizione di coaptazione.
I due muscoli papillari e la parete adiacente legano l’apparato
valvolare mitralico al ventricolo sinistro e sono posti simmetricamente
alle commessure, inserendosi con una larga base di impianto sul
miocardio ventricolare; pertanto la valvola, sul piano anatomofunzionale, corrisponde a tutto il ventricolo sinistro e sia alterazioni
strutturali che funzionali della struttura ventricolare possono
determinarne una minore continenza.
L’efficienza della valvola mitrale durante la sistole viene assicurata
normalmente dalla presenza di un’ampia area di coaptazione fra i lembi,
che permette la resistenza ai movimenti abnormi della valvola stessa, e,
in secondo luogo, dalla posizione sistolica del lembo anteriore, parallela
alla direzione del flusso sanguigno.
L’insufficienza mitralica è una delle patologie valvolari più
frequenti nella popolazione generale, con un’incidenza stimata intorno al
28
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
10,9% nei pazienti di età compresa tra 23 e 35 anni (di cui il 93% di
entità lieve) e pari a circa il 30,1% nei pazienti di età superiore ai 65
anni (di cui il 26,6% di entità lieve – moderata).
Da un punto di vista patogenetico si possono distinguere due
categorie principali di insufficienza mitralica:
INSUFFICIENZA MITRALICA ORGANICA
La malattia reumatica costituiva, in passato, la causa principale di
insufficienza mitralica organica; essa è ancora frequente nei paesi in via
di sviluppo, ma oggi piuttosto rara nei paesi industrializzati.
Si manifesta con una tipica lesione, caratterizzata da retrazione
fibrosa dei lembi valvolari e delle corde tendinee, che provoca perdita
della coaptazione valvolare e conseguente dilatazione dell’anulus
mitralico; in genere è associata a stenosi e fusione delle commessure e
raramente è limitata alla sola valvola mitralica.
Un’altra causa organica è l’endocardite infettiva, sempre
interessante i lembi valvolari e le corde tendinee e responsabile della
formazione di vegetazioni, fissurazioni e perforazioni della valvola, fino
alla rottura dei lembi da parte del patogeno coinvolto e conseguente
insufficienza mitralica acuta.
Infine sono da ricordare la degenerazione fibrocalcifica dei lembi,
dell’anulus e dell’apparato sottovalvolare, frequente nei pazienti anziani,
e le anomalie congenite (difetto dei cuscinetti endocardici o alterazioni
connettivali nelle sindromi di Marfan e Ehlers-Danlos).
INSUFFICIENZA MITRALICA FUNZIONALE
Tale definizione indica una situazione patologica in cui il rigurgito
mitralico dipende da una riduzione del movimento dei lembi valvolari,
con incompleta chiusura della valvola in sistole, in presenza di lembi
mitralici e apparato sottovalvolare strutturalmente normali.
Questa evenienza è riscontrabile in varie condizioni cliniche, in
quanto può associarsi a pregressa ischemia transitoria, può svilupparsi
29
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
come conseguenza del rimodellamento ventricolare o della fibrosi di un
muscolo papillare dopo infarto miocardico, può essere rilevata in acuto
dopo infarto miocardico coinvolgente la base di un muscolo papillare.
L’insufficienza mitralica funzionale è inoltre secondaria a
cardiomiopatia ipertrofica e, comunque, a qualsiasi causa che provochi
ingrandimento ventricolare, dilatazione dell’anulus e dislocazione
laterale dei muscoli papillari, interferendo con la corretta posizione dei
lembi.
Figura 13: Alterazioni anatomopatologiche delle componenti della valvola mitralica
Nicolosi G.L. “Trattato di ecocardiografia clinica”, Padova, Piccin Nuova Libraria, 1999, vol. II, p.1048.
Nell’insufficienza mitralica si riducono le resistenze allo
svuotamento del ventricolo sinistro che, di conseguenza, durante la fase
sistolica, invia sangue anche all’atrio.
Il meccanismo di compenso iniziale dell’insufficienza consiste in
un maggiore svuotamento sistolico del ventricolo sinistro, che però, a
30
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
lungo termine, esita in un progressivo incremento del volume
telediastolico e in un deterioramento della funzione ventricolare.
L’entità del rigurgito varia direttamente in funzione della pressione
ventricolare sistolica sinistra e della dimensione dell’orifizio
rigurgitante, fortemente influenzata dal grado di dilatazione ventricolare
e atriale.
Infatti la concomitante dilatazione atriale sinistra provoca lo
sviluppo di tensioni anomale a carico del lembo posteriore mitralico, che
viene spinto lontano dall’orifizio, provocando un ulteriore
deterioramento dell’apparato valvolare.
Analogamente la dilatazione del ventricolo sinistro determina un
progressivo incremento del rigurgito, secondo un circolo vizioso che ha
ispirato l’aforisma “l’insufficienza mitralica aggrava l’insufficienza
mitralica”17.
Inoltre è importante ricordare che, poiché in presenza di una
normale funzione del ventricolo sinistro la frazione d’eiezione aumenta
anche nell’insufficienza mitralica grave, è sufficiente una modesta
riduzione di questo parametro (<60%) a dimostrare una disfunzione
significativa e ad indirizzare il paziente all’intervento chirurgico, così
come il riscontro di dimensioni ventricolari vicine ai 45 mm in
telesistole.
Nei pazienti con insufficienza mitralica cronica non compaiono
sintomi sino a quando il ventricolo non si scompensa; pertanto, in molti
casi, l’intervallo tra l’instaurarsi dell’insufficienza mitralica e la
comparsa dei sintomi è di decenni e alcuni pazienti con insufficienza
lieve o moderata restano asintomatici per tutta la vita.
La dilatazione compensatoria dell’atrio sinistro e la compliance del
letto venoso polmonare condizionano notevolmente il quadro clinico.
I pazienti con insufficienza mitralica acuta presentano
generalmente compliance atriale normale o ridotta; il sovraccarico
emodinamico che investe l’atrio sinistro secondariamente al rigurgito
mitralico si viene ad instaurare, infatti, su un cuore ancora di dimensioni
normali.
31
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
L’atrio risulta quindi poco dilatato e la pressione atriale media è
molto elevata, come testimoniato dall’ampiezza dell’onda “v” del polso
venoso.
In questi casi è frequente la comparsa di congestione o di edema
polmonare, associati a dispnea di grado variabile e, successivamente, di
ipertensione polmonare e dilatazione acuta del cuore destro, per
trasmissione retrograda del sovraccarico emodinamico.
I pazienti con compliance sinistra marcatamente aumentata si
trovano all’estremo opposto dello spettro clinico, presentando una grave
insufficienza mitralica di lunga data e ingrandimento massivo atriale
sinistro (per adattamento al sovraccarico di volume), con pressioni atriali
normali o solo lievemente aumentate; l’astenia e la facile stancabilità
risultano, in questo caso, secondarie alla bassa gittata, mentre sono meno
frequenti i sintomi provocati dalla congestione polmonare.
I pazienti con caratteristiche cliniche o emodinamiche intermedie
tra quelle precedentemente descritte rappresentano, tuttavia, i casi di più
comune riscontro nella pratica clinica.
L’insorgenza di fibrillazione atriale, infine, pressoché costante nei
pazienti con dilatazione dell’atrio sinistro, può aggravare i sintomi,
comportando una riduzione del riempimento ventricolare e della gittata
cardiaca.
32
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Figura 14: Schema di analisi morfofunzionale della valvola mitrale rigurgitante
Nicolosi G.L., “Trattato di ecocardiografia clinica”, Padova, Piccin Nuova Libraria, 1999, vol II, p.1049.
INSUFFICIENZA MITRALICA
RIMODELLAMENTO POST-ISCHEMICO
Tra i fattori determinanti l’insufficienza mitralica è stato
particolarmente studiato il danno miocardico di tipo ischemico, nel caso
in cui risulti di entità tale da indurre un’alterazione della contrazione
sistolica delle pareti ventricolari18, in particolare di quella inferiore, o in
generale un rimodellamento del ventricolo sinistro caratterizzato dalla
dilatazione della cavità, dalla riduzione della contrattilità parietale e
dallo spostamento verso l’apice dei muscoli papillari19.
La dislocazione del muscolo papillare determina, infatti, un
incremento della distanza tra l’apice del muscolo papillare stesso e
l’anulus anteriore della valvola mitrale, detto “tethering” mitralico, che
33
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
induce la perdita della coaptazione sistolica e, quindi, l’incontinenza
dell’apparato valvolare, con la genesi del rigurgito mitralico.
La presenza di una zona infartuata di miocardio può alterare la
geometria del ventricolo sinistro in modo tale da determinare un
tethering “asimmetrico” sui lembi ed una conseguente malcoaptazione,
con rigurgito a direzione eccentrica20.
Circa il 30% dei pazienti affetti da cardiopatia ischemica e ritenuti
candidati a bypass coronarico presenta un certo grado di insufficienza
mitralica secondaria a danno ischemico dei muscoli papillari e/o a
dilatazione dell’anello valvolare21.
E’ ormai riconosciuta una correlazione diretta tra l’entità del
rigurgito mitralico e la mortalità a lungo termine nei pazienti con
insufficienza mitralica funzionale e si ritiene che essa rappresenti un
fattore indipendente di mortalità nei pazienti con più di 70 anni affetti
da scompenso cardiaco e disfunzione sistolica del ventricolo sinistro22.
Se l’evento ischemico è di entità sufficiente a determinare la rottura
di un muscolo papillare o delle corde tendinee, si verifica una grave
insufficienza mitralica iperacuta per fluttuazione di un lembo valvolare,
visibile all’ecocardiogramma come “flail”; l’80% dei casi di danno
ischemico coinvolge il muscolo papillare posteriore, perché
vascolarizzato soltanto dal ramo discendente posteriore dell’arteria
coronaria destra, a differenza del muscolo anteriore, che riceve numerosi
rami diagonali dalla discendente anteriore e rami marginali dalla
circonflessa.
La rottura del muscolo papillare può essere completa o meno e
rappresenta, comunque, un’emergenza chirurgica.
Con il passare degli anni, tanto all’insufficienza mitralica
conseguente a rimodellamento post-ischemico, quanto alle forme
secondarie a qualsiasi altra causa di progressiva dilatazione e
sfericizzazione ventricolare, possono sovrapporsi fenomeni di tipo
degenerativo; il rimaneggiamento fibro-sclerotico e la deposizione di
sali di calcio sovvertono ulteriormente l’anatomia valvolare e
34
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
sottovalvolare e accentuano la già imperfetta coaptazione dei lembi
mitralici.
Non è tuttavia scopo di questa trattazione affrontare la
fisiopatologia della valvola mitrale ischemica mentre è molto importante
sottolineare come la continuità mitro-aortica, unitamente agli intimi
rapporti esistenti tra le due valvole ventricolari sinistre, renda ragione
della facilità con cui alterazioni a carico di una delle due valvole si
ripercuotono inevitabilmente anche sull’altra, sia da un punto di vista
anatomico, per contiguità, che attraverso modificazioni emodinamiche
interdipendenti; è con questa ultima riflessione che affrontiamo il
prossimo capitolo.
35
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
CONCOMITANZA DI STENOSI AORTICA E
INSUFFICIENZA MITRALICA E CORRELAZIONI
CON IL VENTRICOLO SINISTRO
La presenza di insufficienza mitralica (IM) di vario grado si associa
alla stenosi aortica (SA) in oltre il 67% di casi, determinando spesso
manifestazioni di scompenso cardiaco più gravi e precoci, soprattutto nei
pazienti anziani.
La combinazione tra SA severa e IM rappresenta, infatti,
un’evenienza particolarmente pericolosa; l’ostruzione all’efflusso
ventricolare sinistro, che si osserva in caso di SA, aumenta il volume
rigurgitante attraverso la valvola mitralica, la cui insufficienza riduce, a
sua volta, il precarico ventricolare necessario a garantire la gittata
cardiaca.
Il risultato è una bassa portata cardiaca con dilatazione atriale
sinistra ed ipertensione polmonare, prima passiva, poi reattiva.
Il quadro fisiopatologico, pertanto, si complica notevolmente, tanto
che l’IM può essere conseguenza sia dell’incremento della pressione
intraventricolare dovuto all’ostacolo all’eiezione del ventricolo sinistro 23
sia della disfunzione ventricolare sinistra secondaria al
rimodellamento24, oltre che delle già descritte cause di IM funzionale; in
alternativa, l’IM può riflettere una disfunzione intrinseca della valvola
legata ad alterazioni morfologiche degenerative dei lembi.
L’esame obiettivo risulta, spesso, molto complesso e non dirimente,
in quanto possono essere variabilmente associati il polso carotideo
piccolo e tardo della SA e lo stato ipercinetico dell’IM; inoltre i due soffi
sistolici possono risultare difficilmente distinguibili l’uno dall’altro.
In tali situazioni è di fondamentale importanza l’esame
ecocardiografico, sia per determinare l’esatta natura ed entità delle
patologie valvolari, sia per valutare correttamente il sovraccarico
36
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
emodinamico sul ventricolo, sull’atrio di sinistra e sul circolo
polmonare.
Nella condizione di doppia patologia valvolare l’opportunità della
terapia chirurgica è molto dibattuta, in quanto l’intervento di
concomitante sostituzione di valvola aortica e valvola mitrale,
nonostante i recenti progressi in campo cardiochirurgico, è ancora
associato ad un rischio operatorio maggiore di circa il 50% rispetto alla
chirurgia monovalvolare (in cui si attesta al 3-5%), unitamente al fatto
che la situazione clinica di questi pazienti è gravata, di base, da una
prognosi molto più sfavorevole rispetto a quella della patologia di una
sola valvola.
La sopravvivenza dipende soprattutto dalla classe funzionale a cui
appartiene il paziente secondo la valutazione preoperatoria ed i fattori di
rischio che la riducono nel lungo termine comprendono l’età avanzata, la
classe NYHA elevata, una notevole dilatazione ventricolare sinistra e la
coesistenza di malattia coronarica6.
Per queste ragioni vengono raramente attuate procedure
interventistiche su casi di IM di lieve entità, visto anche il non
infrequente miglioramento dell’insufficienza dopo semplice sostituzione
valvolare aortica.
In ogni caso, in presenza di IM severa concomitante alla SA, le
linee guida ACC-AHA 2008 suggeriscono di associare alla sostituzione
valvolare aortica anche la chirurgia mitralica, preferibilmente di tipo
conservativo.
I problemi decisionali maggiori si presentano, pertanto, nei casi di
IM di grado intermedio tra lieve e severo, dato che la persistenza di IM
moderata dopo l’intervento di AVR è un fattore di rischio indipendente
accertato di mortalità postoperatoria25.
Ad oggi numerosi studi hanno sottolineato come l’IM sia
conseguenza dell’alterata performance ventricolare sinistra secondaria
alla SA e come il rigurgito mitralico dopo AVR tenda a ridursi
parallelamente al rimodellamento ventricolare; tuttavia non c’è ancora
accordo, in letteratura, su quale sia la storia naturale dell’IM dopo AVR
37
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
e soprattutto non sono ancora stati individuati parametri clinici o
strumentali preoperatori predittivi di riduzione dell’entità dell’IM dopo
AVR.
Lo scopo di questo studio è proprio quello di valutare la presenza, il
tipo ed il grado di IM nei pazienti con SA severa e la sua evoluzione
dopo AVR isolata o associata a CABG.
Si è cercato quindi di trovare un’eventuale correlazione tra l’entità
della SA, gli aspetti anatomici e funzionali dell’atrio e del ventricolo
sinistro, le caratteristiche dell’apparato valvolare mitralico e l’entità
dell’IM prima e dopo l’intervento chirurgico.
Quindi nel tentativo di individuare possibili parametri predittivi di
miglioramento dell’IM dopo AVR, si sono confrontati i risultati dei
pazienti sottoposti ad AVR dividendoli in base al tipo di intervento
(AVR isolata o associata a CABG) e successivamente in base alla
presenza o meno nell’anamnesi clinica del fattore ipertensione.
38
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
VALUTAZIONE ECOCARDIOGRAFICA
DELLA STENOSI AORTICA
L’ecocardiografia
transtoracica
bidimensionale
e
monodimensionale permette di porre una diagnosi qualitativa di stenosi
valvolare aortica con specificità e sensibilità elevatissime.
La metodica consente, infatti, nei suoi diversi approcci,
un’eccellente visualizzazione e caratterizzazione morfologica dei lembi
valvolari, oltre che del loro movimento; l’ecocardiografia fornisce,
inoltre, una visione complessiva del cuore, evidenziando con chiarezza i
segni indiretti, quali l’ipertrofia ventricolare sinistra di tipo concentrico,
la dilatazione post-stenotica dell’aorta sopravalvolare, le eventuali
anomalie associate a carico della valvola mitrale e l’ingrandimento
atriale sinistro.
L’approccio parasternale sinistro o precordiale è il migliore nella
maggior parte dei pazienti per lo studio morfologico della valvola
aortica; le cuspidi sono ipomobili, presentano un vario grado di
inspessimento ed iperecogenicità e perdono, in fase sistolica, l’aspetto
normale, caratterizzato da echi paralleli tra loro e alle pareti della aorta,
assumendo una caratteristica conformazione a cupola (doming).
La tecnica Doppler completa l’esame standard ed è lo strumento
principale per quantificare la severità dell’ostruzione al flusso sanguigno
attraverso la valvola aortica durante la fase sistolica.
La stima della severità della stenosi aortica può essere ottenuta in
vari modi, tra i quali i più comunemente utilizzati sono la misurazione
dei gradienti transvalvolari massimo e medio, quantificabili
invasivamente con cateterismo cardiaco o tramite studio Doppler ad
onda continua, e la valutazione dell’area valvolare aortica (AVA),
determinata unicamente con l’ecocardiografia.
Il gradiente pressorio considerato singolarmente, pur essendo un
elemento essenziale per stabilire il grado di severità della stenosi, può
39
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
risultare insufficiente per una valutazione definitiva, in quanto non sono
rare discordanze tra quello calcolato al cateterismo e quello al Doppler.
A volte, infatti, il Doppler può sovrastimare il gradiente calcolato
tramite studio emodinamico, specie in condizioni di elevata velocità
prestenotica, situazione che può verificarsi in caso di alta gittata
cardiaca, insufficienza aortica o stenosi sottovalvolare associata.
Figura 15: Curve di pressione del ventricolo sinistro e dell’aorta in caso di stenosi
valvolare aortica
Slavich G., “Ecocardiografia clinica”, Padova, Piccin Nuova Libraria, 1989, vol. I, p.408.
D’altro canto, è possibile anche una sottostima del gradiente,
soprattutto per motivi tecnici (legati ad inadeguata registrazione del
segnale o inaccurato allineamento del fascio ultrasonoro), ma anche nei
casi di ridotta funzione ventricolare sinistra, in cui la stenosi aortica può
risultare severa nonostante i gradienti non appaiano eccessivamente
elevati.
Per questi motivi è particolarmente utile associare alla valutazione
dei gradienti pressori transvalvolari la misura dell’area valvolare aortica,
utilizzando l’equazione di continuità.
40
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Tale equazione si basa sulla legge di conservazione della massa,
secondo cui il flusso di un fluido incomprimibile all’interno di un
sistema chiuso rimane costante in ogni punto del sistema.
Poiché la quantità di flusso in un determinato punto è data dal
prodotto tra l’area di sezione e la velocità, ne deriva che l’area di sezione
a livello del tratto di efflusso ventricolare sinistro moltiplicata per la
velocità del flusso a tale livello è uguale al prodotto dei due parametri
misurati in corrispondenza della valvola aortica stenotica (A1 x V1 = A2
x V2).
Tre dei quattro fattori di questa equazione di primo grado sono
ricavabili con l’ecocardiografia Doppler e l’incognita (A2), che
corrisponde all’AVA, può essere agevolmente calcolata.
Figura 16: Schema raffigurante il principio dell’equazione di continuità
Slavich G., “Ecocardiografia clinica”, Padova, Piccin Nuova Libraria, 1989, vol. I, p.410.
41
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Il vantaggio fondamentale dell’equazione di continuità consiste nel
fatto di non essere influenzata da modificazioni della portata cardiaca né
dalla presenza di insufficienza aortica associata.
Tuttavia tale metodica non è esente da limitazioni, visto che non
sempre il diametro del tratto di efflusso ventricolare sinistro viene
misurato con precisione (soprattutto nelle forme che presentano estese
calcificazioni) e che anche variazioni di pochi millimetri, considerata la
relazione quadratica tra diametro e area di sezione, possono portare ad
errori significativi.
VALUTAZIONE ECOCARDIOGRAFICA
DELL’INSUFFICIENZA MITRALICA
Nella valutazione diagnostica di un paziente con insufficienza
mitralica le informazioni che devono essere ottenute con l’esame
ecocardiografico riguardano:
L’entità del rigurgito mitralico.
Le principali caratteristiche morfofunzionali della valvola, per
stabilire il meccanismo patogenetico responsabile del rigurgito
allo scopo di vagliare la migliore strategia terapeutica.
Il grado di compromissione della funzionalità ventricolare sinistra, che influisce sulla scelta del timing chirurgico.
Da un punto di vista ultrasonologico è possibile differenziare le
varie forme patogenetiche di insufficienza mitralica secondo la
classificazione di Carpentier, che permette la distinzione tra le IM a
prevalente genesi organica e quelle a prevalente genesi funzionale.
42
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Figura 17: Classificazione funzionale di Carpentier
Nell’esame ecocardiografico si procede, in primo luogo, ad una
valutazione morfologica della valvola mitrale, attraverso l’analisi dello
spessore dei lembi e della loro ridondanza in relazione all’infiltrazione
degenerativa; si ricercano, inoltre, eventuali processi mixomatosi e/o
calcificazioni.
Successivamente si evidenziano eventuali lesioni caratteristiche a
carico dei lembi valvolari; la retrazione del lembo valvolare posteriore,
ad esempio, è di frequente riscontro nella IM funzionale ischemica, con
la tipica morfologia eccentrica del jet di rigurgito, mentre il simmetrico
disallineamento dei muscoli papillari, conseguente alla dilatazione
progressiva ventricolare e a quella dell’anello valvolare, determina un jet
di rigurgito centrale.
Infine, utilizzando metodiche eco-color-Doppler, si quantifica
l’entità del rigurgito valvolare, sottolineando il risvolto emodinamico del
rigurgito e stimando il grado di coinvolgimento delle cavità destre.
E’ frequente, infatti, specie nei casi cronici, il riscontro di
ipertensione polmonare, dilatazione ventricolare destra, deficit
contrattile e insufficienza tricuspidale.
43
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Figura 18 :Immagini ecocardiografiche di un’insufficienza mitralica con doppio
jet di rigurgito, uno diretto in senso inferiore e mediale, l’altro in direzione centrale.
• Sopra: sezione precordiale longitudinale di atrio e ventricolo di sinistra.
• Sotto: sezione trasversale, in cui si apprezzano simultaneamente i due getti.
Slavich G., “Ecocardiografia clinica”, Padova, Piccin Nuova Libraria, 1989, vol. I, p. 366.
La valutazione dell’entità del rigurgito rappresenta un problema di
difficile risoluzione in ecocardiografia, poiché non esiste un metodo di
misurazione ideale, dato che tutti i parametri
sono resi solo
parzialmente attendibili da limiti tecnici ed il rigurgito stesso varia da
fase a fase del ciclo cardiaco, in relazione a fattori fisiologici quali
contrattilità, precarico e postcarico.
44
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
In realtà non si ritiene necessaria una quantificazione in valore
assoluto del volume di rigurgito, ma si considera sufficiente una stima
del suo livello di severità tramite un punteggio da 1+ a 4+, secondo una
progressione del livello patologico da lieve a severo.
Figura 19: Immagini ecocardiografiche di insufficienza mitralica:
• A sinistra: la sezione parasternale in asse lungo rileva un alterato collabimento
dei lembi da prolasso del lembo anteriore.
• A destra: l’esame eco-color-Doppler mostra un jet eccentrico che si dirige in basso verso la parete libera dell’atrio.
Nicolosi G.L., “Trattato di ecocardiografia clinica”, Padova, Piccin Nuova Libraria, 1999,
vol. II, p.1051.
Tale metodo di valutazione, basato su un’analisi di tipo
semiquantitativo, è stato utilizzato anche nel presente studio, secondo la
seguente scala di gravità:
1+ :IM lieve
2+ :IM moderata
3+ :IM moderata-severa
4+ :IM severa
45
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Un’altra metodica
di stima semiquantitativa del grado di
insufficienza mitralica prevede il calcolo dell’area del jet rigurgitante
mediante planimetria al color-Doppler, con la misurazione del rapporto
tra area del jet di rigurgito e area dell’atrio sinistro.
Le aree maggiori tracciate in almeno due piani di scansione (4 e 2
camere apicale) correlano con la gravità dell’insufficienza valvolare
misurata con la ventricolografia. Un’area maggiore di 8 cm 2 o un’area
relativa maggiore del 40% rispetto a quella dell’atrio sinistro
suggeriscono un’insufficienza valvolare di grave entità, mentre un’area
minore di 4 cm2 o un’area relativa del 20% identificano un’insufficienza
di lieve entità.
Il metodo si fonda sulla nitida visualizzazione di un uniforme jet da
rigurgito; tuttavia jet a direzione fortemente eccentrica sono sottostimati.
La sovrastima, invece, è possibile in presenza di un jet molto
veloce che origina da un piccolo orifizio e si estende solo nella fase
protosistolica del ciclo cardiaco, creando un notevole movimento di
globuli rossi nell’atrio sinistro e simulando un’area di jet rigurgitante
molto più grande di quella effettiva.
Il metodo di misurazione della vena contracta prevede, invece, la
valutazione della più stretta area a sezione trasversale di un flusso di
rigurgito che si crea in corrispondenza dell’orifizio valvolare. La
larghezza della vena contracta correla con il volume rigurgitante: una
larghezza di 5 mm con un volume rigurgitante di 60 ml suggerisce una
grave insufficienza, mentre una larghezza inferiore a 3 mm è indice di
insufficienza lieve.
Questo metodo, secondo alcuni autori, sarebbe indipendente dalle
variabili emodinamiche, dalla geometria dell’orifizio e dal setting
dell’ecografo ed è associato ad una bassa variabilità confrontando le
diverse misurazioni raccolte da vari operatori.
I laboratori di ecocardiografia completano, in genere, la valutazione
semiquantitativa sopra descritta con altri parametri, che contribuiscono
46
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
ad una stima ancora più attendibile dell’entità del rigurgito. I principali
sono:
La valutazione delle isovelocità prossimali dell’area di superficie
(PISA): si calcola l’area dell’orifizio rigurgitante dividendo il picco
di flusso per la massima velocità attraverso l’orifizio (ottenuto con
il doppler a onda continua). Si tratta, comunque, di un metodo soggetto alle complesse geometrie dell’orifizio di rigurgito, tali da dover richiedere fattori di conversione, come accade per esempio nei
rigurgiti eccentrici.
La stima della durata del flusso rigurgitante nel ciclo cardiaco e
dell’intensità del doppler del flusso di rigurgito in rapporto a quella
del flusso anterogrado misurato con Doppler continuo.
La misura della penetrazione del jet in atrio sinistro, valutato con
metodo color-Doppler, e delle dimensioni dell’atrio sinistro, in presenza di dilatazione associata di grado lieve, moderato o severo.
La valutazione del flusso venoso polmonare, campionato con Doppler pulsato sulla vena superiore destra; si rilevano l’eventuale
uguaglianza sisto-diastolica del flusso venoso polmonare, la prevalenza diastolica o l’inversione del flusso sistolico nelle vene polmonari.
La verifica dell’aumento della pressione venosa polmonare, derivata dalla massima velocità del flusso di rigurgito mitralico.
La complessità della misurazione di tutti questi parametri richiede
un notevole dispendio di tempo ed i vantaggi della quantizzazione della
severità del rigurgito valvolare mitralico possono essere ridimensionati
da potenziali errori durante il calcolo.
Ulteriori fattori che consentono di stimare l’entità dell’insufficienza
mitralica, sono, infine, la distanza che intercorre tra i muscoli papillari e
la porzione anteriore dell’anulus e la dilatazione (o comunque
l’alterazione) della geometria dell’anulus.
L’alterazione geometrica secondaria al processo di rimodellamento
del ventricolo sinistro, infatti, non si ripercuote solo sull’apparato
47
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
valvolare mitralico, ma anche sul piano valvolare, costituito dall’anulus
e dai lembi mitralici; in seguito alla dislocazione del punto di
coaptazione mitralico si crea uno spazio triangolare, la cui base è
rappresentata dal piano valvolare mitralico e l’apice dal punto di
coaptazione mitralico stesso.
L’area di tale triangolo è facilmente misurabile mediante
ecocardiografia e viene definita, bidimensionalmente, come area di
“tenting” della valvola mitrale.
La formazione del “tenting” determina un’alterazione del piano
della valvola mitrale, testimoniata dalla perdita della normale morfologia
“a sella” dell’anulus mitralico, che mostra la tendenza ad assumere una
forma appiattita e monoplanare.
La distanza di tenting rappresenta, dunque, un parametro di
fondamentale importanza, tanto nella genesi dell’insufficienza mitralica
funzionale, quanto nel determinare l’incremento del rigurgito mitralico,
fornendo una misura del grado di deformazione valvolare, della
progressione del rimodellamento ventricolare e della gravità della
patologia sottostante.
48
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
METODI E PROTOCOLLO DI STUDIO
SELEZIONE DEI PAZIENTI
Nello studio effettuato si sono considerati gli interventi di
sostituzione valvolare per stenosi aortica (AVR) effettuati presso il
Dipartimento Cardio-toraco-vascolare dell’Azienda Ospedaliera S.
Maria di Terni, relativi al periodo 01/01/2002 – 29/07/2009, per un
totale di 341 pazienti.
Sulla base degli obiettivi della ricerca sono stati definiti dei criteri
di inclusione che hanno permesso di individuare, all’interno della
popolazione iniziale, un campione il più omogeneo possibile di pazienti.
Tra i pazienti sottoposti ad AVR, 327 su 341 presentavano anche
concomitante IM di vario grado.
Sono stati arruolati nello studio soltanto i pazienti in cui si
riscontrava, oltre alla SA da sottoporre ad AVR, anche una IM di grado
almeno moderato (≥2+), a carattere prevalentemente funzionale,
escludendo, cioè, tutte le condizioni di marcate alterazioni della valvola
mitrale dovute a patologie primitive, reumatiche o a stenosi associata.
Sono stati conseguentemente esclusi i pazienti che presentavano:
IM di entità lieve ( < 2+)
Insufficienza aortica moderata o severa associata alla SA
Dilatazione della radice aortica concomitante alla SA
Cardiomiopatie primitive
Genesi endocarditica delle alterazioni valvolari
Sono stati arruolati, quindi, complessivamente 49 pazienti.
49
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
I risultati ottenuti dall’osservazione longitudinale del campione
sono stati poi analizzati suddividendo la popolazione secondo due
diverse variabili: la tipologia di intervento (AVR o AVR + CABG) e la
presenza o meno in anamnesi di ipertensione arteriosa sistemica.
50
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
PROTOCOLLO DI STUDIO
I pazienti arruolati sono stati sottoposti a valutazione clinica
durante il ricovero ospedaliero e sono stati registrati i seguenti
parametri:
Età
Peso
Altezza
Ritmo cardiaco
Classe NYHA
Comorbilità principali
Tutti i pazienti sono stati valutati con esame ultrasonologico
completo nel preoperatorio e nel postoperatorio, secondo il seguente
timing:
51
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Un esame preoperatorio.
Un primo controllo postoperatorio effettuato 2-24 giorni dopo
l’intervento.
Un secondo controllo postoperatorio effettuato almeno 30 giorni dopo l’intervento ed entro i 18 mesi successivi.
Il secondo controllo postoperatorio non è stato effettuabile in alcuni
pazienti, in quanto risultati non rintracciabili durante il periodo del
follow–up, deceduti durante la degenza ospedaliera o nel periodo
intercorso tra i controlli.
L’esame eco-Doppler transtoracico è stato effettuato con
apparecchi Philips 5500 o Envisor e sonda 2-2.5 MHz; sono state
utilizzate metodiche M-mode, 2D, Doppler pulsato, continuo e color.
Gli ecocardiogrammi sono stati registrati in decubito laterale
sinistro, in asse lungo e asse corto parasternale e in sezione apicale
quattro camere e due camere.
MISURAZIONE DEI PARAMETRI
ECOCARDIOGRAFICI
Sono state valutate, per ogni paziente, la morfologia del ventricolo
sinistro (VS), i diametri telediastolico (DTD) e telesistolico (DTS), lo
spessore del setto (SIV) e della parete posteriore (PP); sulla base di tali
valori, sono stati derivati l’indice di massa ventricolare sinistra (i.m.) e
l’indice di sfericità (i.s.), quest’ultimo secondo la formula di Kono,
parametro in particolare correlazione con l’entità del rigurgito
mitralico26.
52
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Figura 20: Tracciati M-Mode:
A.
Esame sottocostale in un caso di vizio aortico a stenosi prevalente. L’ipertrofia ventricolare sinistra interessa in modo simmetrico setto (SIV) e parete posteriore
(PP).
B.
Esame parasternale. Evidente ipertrofia asimmetrica del setto in paziente
affetto da stenosi aortica severa.
Slavich G., “Ecocardiografia clinica”, Padova, Piccin Nuova Libraria, 1989, vol I, p. 400
E’ stata definita, inoltre, la funzionalità del ventricolo sinistro
attraverso la misura della frazione di eiezione (FE), secondo la formula
di Simpson modificata.
Una particolare attenzione è stata rivolta anche alla valutazione
morfologica dell’atrio sinistro, con la misurazione del suo diametro
antero-posteriore (dAS), e alla rilevazione della pressione arteriosa
polmonare sistolica (PAPS). Tale rilevazione è stata effettuata con
metodo Doppler sul jet di rigurgito della valvola tricuspide e, al
gradiente sistolico massimo tra ventricolo destro e atrio destro, è stata
aggiunta la pressione atriale destra (5-10 mmHg), in relazione al
diametro ed alle escursioni respiratorie della vena cava inferiore.
53
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Nel protocollo di studio utilizzato si è valutata l’entità della stenosi
aortica in base alla misura del gradiente sistolico transvalvolare aortico
nei suoi valori massimi e medi, calcolato con l’equazione di Bernoulli, e
si è eseguita la misurazione dell’area valvolare aortica (AVA), calcolata
solo negli esami preoperatori, con l’equazione di continuità; l’uso di
questa metodica è stato necessario per la presenza, tra i casi considerati,
di pazienti con gradienti transvalvolari sottostimati per la presenza di
disfunzione sistolica del ventricolo sinistro.
Per la stima del grado di insufficienza mitralica con eco-colorDoppler si è invece preferito adottare un metodo di valutazione di tipo
semiquantitativo, secondo la seguente scala di gravità:
1+ :IM lieve
2+ :IM moderata
3+ :IM moderata-severa
4+ :IM severa
METODI PER L’ ANALISI STATISTICA
In ogni scienza sperimentale si effettuano indagini per verificare se
è accettabile o meno una determinata ipotesi, ricavata da un modello
teorico e, poiché non è possibile nella realtà studiare gli ipotetici infiniti
casi, ogni studio riguarda necessariamente un numero limitato di
situazioni, definite “campione”.
Sulla base dei risultati ottenuti dall’analisi dei diversi aspetti del
campione, si è in grado di stabilire, attraverso la statistica, se una data
ipotesi può essere accettata o deve essere confutata rispetto all’ intera
popolazione.
54
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
La verifica delle ipotesi formulate durante la progettazione dello
studio avviene attraverso un test statistico, cioè una regola di decisione
quantitativa, legata ad un determinato livello di significatività.
In primo luogo, la procedura prevede la scelta del test statistico da
utilizzare: in tale studio si è applicato il test “t di Student”, dopo aver
calcolato la media matematica dei valori ottenuti e le relative deviazioni
standard.
Il “t di Student” è un test statistico utilizzato per confrontare due
gruppi di dati replicati; semplificando, tale test confronta la differenza
tra la media dei due gruppi, considerando la dispersione dei dati
(espressa come deviazione standard).
In secondo luogo si sono determinate le zone numeriche di
accettazione dell’ipotesi nulla (cioè della probabilità che l’eventuale
cambiamento tra le due serie di dati fosse dovuto al caso) e,
conseguentemente, gli intervalli numerici complementari che ne
rappresentano l’intervallo di rifiuto.
Nel caso specifico si è considerato statisticamente significativo
ogni confronto che avesse una p ≤0,05, quindi ogni caso in cui la
probabilità di vedere confermata l’ipotesi nulla fosse inferiore o pari al
5%.
Di conseguenza la probabilità che si verifichi l’ipotesi alternativa,
cioè che le due serie di dati non siano uguali o siano soltanto
casualmente correlate tra loro, è almeno del 95% e, pertanto, da
considerare significativa.
ANALISI DEI RISULTATI
55
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Obiettivo dello studio è quello di descrivere correttamente il
fenomeno del rimodellamento ventricolare post chirurgico ed
individuare l’eventuale predittività delle variabili in esame.
Secondo tale ottica sono state quindi condotte due analisi
indipendenti dei risultati raccolti. Il campione è stato suddiviso
confrontando prima le due tipologie di intervento AVR e AVR + CABG
( indice della presenza o meno di concomitante cardiopatia ischemica) e
successivamente considerando gli outcomes distinti tra pazienti ipertesi
e non ipertesi.
ANALISI DELLA VARIABILE “ TIPOLOGIA DI
INTERVENTO”
I 49 pazienti arruolati sono stati suddivisi in due gruppi:
GRUPPO A: 29 pazienti che sono stati sottoposti ad AVR isolata.
GRUPPO B: 20 pazienti che hanno subito, contestualmente alla
AVR, anche un intervento di rivascolarizzazione miocardica
(CABG).
L’indicazione a CABG contestuale alla AVR veniva posta ogni
qual volta fosse presente una stenosi coronarica maggiore del 50 %.
PARAMETRI CLINICI
Tra i 49 pazienti arruolati, 39 erano in ritmo sinusale prima dell’
intervento (72,4% nel gruppo A, 90% nel gruppo B) e 10 pazienti erano
in fibrillazione atriale (27,6% nel gruppo A, 10% nel gruppo B).
56
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Il gruppo A e il gruppo B presentavano 2 portatori di pacemaker
ciascuno.
Nonostante le condizioni cliniche dei pazienti prima dell’
intervento fossero piuttosto eterogenee, nella maggioranza dei casi
risultavano severamente compromesse, in relazione alla gravità del
quadro valvolare sia aortico che mitralico, all’entità della coronaropatia
sottostante e, talvolta, alle concomitanti patologie osservate.
La classe NYHA preoperatoria si presentava con questa
distribuzione:
Classe II nel 26,5% (gruppo A 11 pazienti; gruppo B 2 pazienti).
Classe III nel 57,1% dei casi (gruppo A 14 pazienti; gruppo B
14 pazienti).
Classe IV nel 16,3% (gruppo A 4 pazienti; gruppo B 4 pazienti).
57
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Da questi dati si evince come nei pazienti sottoposti a CABG
(gruppo B) la classe NYHA più rappresentata fosse la III; la presenza, in
questo gruppo, di un grado di scompenso in media più elevato è da
mettere in relazione con l’azione sinergica della coronaropatia e della
valvulopatia nel determinare la compromissione della funzione
ventricolare sinistra.
I pazienti arruolati, anche a causa dell’età avanzata, mostravano un
quadro di comorbilità marcata e, nella ricerca di patologie che avessero
un impatto particolare sulla funzione cardiaca, si è riscontrato che:
L’ipertensione arteriosa sistemica era presente nel 59,1% dei
casi.
Il diabete ricorreva nel 34,7% dei casi.
L’insufficienza renale cronica era presente nel 18,2% dei casi.
La BPCO nel 22,4% dei casi.
58
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
L’iperlipidemia e l’arteriopatia polidistrettuale si rilevavano nel
16,3% dei casi ciascuna.
59
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Caratteristiche preoperatorie
dei pazienti
Sesso
Maschi
Femmine
Età media
Ipertensione arteriosa sistemica
Diabete mellito di tipo 2
Insufficienza renale cronica
BPCO
Arteriopatia polidistrettuale
Iperlipidemia
Ritmo cardiaco
Sinusale
Fibrillazione atriale
Classe NYHA
Classe I
Classe II
Classe III
Classe IV
Gruppo A
Gruppo B
12
17
79,28
18 (62,1%)
10 (34,5%)
5 (17,2%)
7 (24,1%)
6 (20,7%)
5 (17,2%)
11
23
9
26
78,05
78,77
11 (55,0%) 29 (59,1%)
7 (35,0%) 17 (34,7%)
4 (20,0%) 9 (18,4%)
4 (20,0%) 11 (22,4%)
2 (10,0%) 8 (16,3%)
3 (15,0%) 8 (16,3%)
21 (72,4%)
8 (27,6%)
18 (90,0%) 39 (79,5%)
2 (10,0%) 10 (20,4%)
0
11 (37,9%)
14 (48,2%)
4 (13,7%)
0
Totale
0
2 (10,0%) 13 (26,5%)
14 (70,0%) 28 (57,1%)
4 (20,0%) 8 (16,3%)
Nota: il valore percentuale riportato tra parentesi è riferito allo stesso gruppo di appartenenza.
Tabella 5: riassunto dei valori
DATI RELATIVI ALL’INTERVENTO CHIRURGICO
In tutti i pazienti arruolati nella presente casistica, la chirurgia
effettuata è stata di tipo monovalvolare sia nel del gruppo A (AVR
isolata) che nel gruppo B (AVR più CABG). Sono stati esclusi dallo
studio tutti i pazienti in cui era stato effettuato anche un trattamento
chirurgico della valvola mitrale.
L’AVR è stata effettuata, vista l’età mediamente elevata dei
pazienti, con protesi biologica in 44 casi (89,8%) e meccanica in 5
(10,2%);
60
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Le protesi valvolari aortiche biologiche più frequentemente
utilizzate per le AVR sono state la Medtronic Mosaic n. 25, la Mitroflow
n. 21 e le Sorin Solo n. 23, n. 25 e n. 27.
La chirurgia coronarica effettuata nei pazienti del gruppo B ha
previsto:
1 graft in 10 pazienti (50%)
2 grafts in 4 pazienti (20%)
3 grafts in 3 pazienti (15%)
4 grafts in 3 pazienti (15%)
L’incidenza della mortalità intraospedaliera tra i pazienti arruolati è
stata pari al 4,3% (2 pazienti su 47), in linea con le percentuali presenti
in letteratura.
Il decesso di una paziente, affetta da IRC (insufficienza renale
cronica) e in classe NYHA IV preoperatoria, è avvenuto dopo 20 giorni
dall’intervento a causa di MOF (multi-organ failure); la paziente era
stata, in ogni caso, sottoposta ad un primo controllo ecocardiografico
61
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
postoperatorio che aveva mostrato una riduzione dell’entità del rigurgito
mitralico e una buona funzione della protesi aortica.
EVOLUZIONE DEI PARAMETRI
VALVOLA AORTICA
Tutti i pazienti considerati presentavano stenosi valvolare aortica
di grado severo; la media fra tutti i pazienti del gradiente sistolico
massimo preoperatorio era pari a 86,9 ± 26 mmHg (quella del solo
gruppo A arrivava a 95,1 ± 25,6 mmHg) e il gradiente medio era di 53,2
± 14,9 mmHg. L’AVA risultava pari a 0,69 ± 0,19 cm 2 e il valore più
elevato si riscontrava tra i pazienti del gruppo B (0,71 ± 0,18 mmHg).
Dopo l’ intervento di AVR i valori del gradiente transprotesico
sono risultati tutti nella norma al secondo controllo postoperatorio, sia
nei pazienti con protesi meccaniche che in quelli con protesi biologiche
e indipendentemente dal gruppo considerato, con un valore pressorio
massimo medio di 25,9 ± 10,7 mmHg.
62
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
VALVOLA MITRALE
63
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Secondo i criteri di esclusione adottati dallo studio non si sono
rilevate in nessun caso patologie primitive della valvola mitrale, sebbene
tutti i pazienti (tranne uno, appartenente al gruppo A) presentassero, alla
valutazione ecocardiografica, alterazioni sclerocalcifiche dell’apparato
valvolare.
Dai valori emersi al controllo preoperatorio si può evidenziare che
l’incidenza di IM moderata-severa era quasi doppia nei soggetti del
gruppo B (50%) rispetto a quelli del gruppo A (34,4%); Quindi,
nonostante sia minore il numero di casi considerati in quest’ultimo
gruppo, è possibile notare la maggiore tendenza alla presentazione, nel
preoperatorio, di una IM di grado moderato-severo tra i pazienti con
associata patologia coronarica.
L’andamento dell’IM nel primo controllo postoperatorio è stato il
seguente: in 37 pazienti (75,5%) l’entità dell’IM si è ridotta, in 10
(20,4%) è rimasta invariata, in 2 pazienti (4,0%) è peggiorata.
64
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
In particolare nel gruppo A il rigurgito mitralico si è ridotto in 21
pazienti (72,4%) è rimasto invariato in 7 (24,1%) peggiorando in 1
soltanto.
Nel gruppo B è diminuito in 16 pazienti (80,0%), è rimasto
invariato in 3 pazienti (15,0%) ed è peggiorato in un solo caso,
determinato per altro dalla rottura di una corda mitralica.
Complessivamente la riduzione dell’entità dell’IM è stata rilevata
già al primo controllo postoperatorio nella maggioranza dei casi, cioè in
37 pazienti (75,5% dei casi migliorati), in accordo con altri studi presenti
in letteratura27.
L’analisi dei valori misurati nel secondo controllo post-operatorio
ha sostanzialmente confermato questo andamento. Occorre tuttavia
considerare che essendo il secondo controllo avvenuto a distanza di
65
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
diversi mesi ( da 4 a 18) la popolazione in esame è diminuita a causa del
decesso di alcuni pazienti, rendendo il dato meno significativo.
66
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
VENTRICOLO SINISTRO
I dati preoperatori hanno messo in evidenza una frazione d’eiezione
del ventricolo sinistro (FE) mediamente nella norma; tra i pazienti del
gruppo B questo valore, tuttavia, risultava lievemente ridotto.
Questo parametro, dopo l’intervento, ha subito un incremento più
evidente nei pazienti del gruppo B, probabilmente in relazione al
contestuale intervento di CABG.
67
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Il valore preoperatorio dell’indice di massa risultava aumentato
nella totalità dei casi (circa 150 g/m2), senza differenze significative tra i
pazienti dei vari gruppi; nel postoperatorio si assiste ad una evidente
riduzione dei valori, segno questo che correla con il ridotto carico di
lavoro dovuto alla rimozione della stenosi.
68
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
L’indice di sfericità mostrava, prima dell’ intervento, valori nella
maggioranza dei casi superiori a 0,6; in particolare nei pazienti di
gruppo B questo parametro raggiungeva il valore di 0,72 ± 0,15,
riducendosi a 0,63 ± 0,20 al secondo controllo postoperatorio.
69
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
ATRIO SINISTRO
Il diametro antero-posteriore dell’atrio sinistro risultava
mediamente superiore alla norma nel controllo preoperatorio di tutti i
pazienti e non ha mostrato variazioni evidenti nei controlli successivi,
tanto tra i soggetti con IM ridotta, quanto tra quelli con IM invariata o
peggiorata.
Si è passati, infatti, considerando tutti e tre i gruppi, da un valore
preoperatorio medio di 45,1 ± 5,6 mm alla misura di 44,4 ± 8,1 mm,
rilevata al secondo postoperatorio.
70
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Tutti i pazienti mostravano, alla valutazione preoperatoria con
esame eco-Doppler, un’insufficienza della valvola tricuspide, in genere
di entità lieve o moderata.
Il valore medio della pressione arteriosa polmonare sistolica
(PAPS) era, infatti, di 37,9 mmHg (38,5 mmHg nel gruppo A, 37,0
mmHg nel gruppo B).
Al primo esame postoperatorio la pressione è stata stimata, invece,
pari a 35,2 mmHg e al secondo controllo pari a 34,2 mmHg.
I dati rilevati mostrano, quindi, pur senza alcuna correlazione
lineare con l’andamento dell’IM, una generale tendenza al ripristino di
valori pressori fisiologici, dovuta alla rimozione dell’ostacolo
all’efflusso ventricolare sinistro e alla conseguente riduzione del
rigurgito a livello della valvola tricuspide.
71
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
72
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Tabelle riassuntive:
parametri relativi alla totalità dei pazienti
Parametri
Preoperatorio 1° Postoperatorio
2° Postoperatorio
IM (% sul totale pz.)
assente
0
1( 2,0%)
2 (5,7%)
1+
0
29 (59,2%)
19 (54,3%)
2+
29 (59,2%)
12 (24,5%)
12 (34,3%)
3+
20 (40,8%)
7 (14,3%)
2 (5,7%)
4+
0
0
0
86,9 ± 26,08
28,5 ± 14,1
25,9 ± 10,7
(mmHg)
55,1 ± 16,6
15,8 ± 7,8
14,5 ± 6,5
AVA (cm²)
0,69 ± 0,19
LVEF (frazione d'eiezione)
54,7 ± 11,9
55,9 ± 11,8
60,11 ± 9,2
Indice di massa
151,2 ± 39,2
135,3 ± 27,4
125,1 ± 22,3
Indice di sfericità
0,65 ± 0,15
0,62 ± 0,14
0,58 ± 0,18
Diametro atrio sinistro (mm)
45,1 ± 5,3
45,7 ± 6,8
44,4 ± 8,1
PAPS
37,9 ± 10,2
35,2 ± 7,08
34,3 ± 7,1
Gradiente aortico max. (mmHg)
Gradiente aortico medio
73
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Gruppo A
Parametri
Preoperatorio 1° Postoperatorio
2° Postoperatorio
IM (% sul totale pz.)
assente
0
1 (3,4%)
1 (4,8%)
1+
0
18 (62,1%)
12 (57,1%)
2+
19 (65,5%)
6 (20,7%)
8 (38,1%)
3+
10 (34,5%)
4 (13,8%)
0
4+
0
0
0
95,1 ± 25,6
28,9 ± 15,6
25,0 ± 11,2
59,8 ± 16,46
15,4 ± 8,1
13,4 ± 6,0
Gradiente aortico max. (mmHg)
Gradiente aortico medio
(mmHg)
AVA (cm²)
0,67 ± 0,2
LVEF (frazione d'eiezione)
58,4 ± 7,95
58,5 ± 10,3
59,9 ± 8,7
Indice di massa
149,6 ± 35,6
135,5 ± 26,3
123,3 ± 22,1
Indice di sfericità
0,60 ± 0,13
0,57 ± 0,11
0,55 ± 0,16
Diametro atrio sinistro (mm)
45,5 ± 5,6
45,3 ± 6,8
45,7 ± 6,9
PAPS
38,5 ± 8,6
36,3 ± 7,2
34,4 ± 6,6
74
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Gruppo B
Parametri
Preoperatorio 1° Postoperatorio
2° Postoperatorio
IM (% sul totale pz.)
assente
0
0
1 (7,1%)
1+
0
11 (55,0%)
7 (50%)
2+
10 (50%)
6 (30,0%)
4 (28,6%)
3+
10 (50%)
3 (15,0%)
2 (14,3%)
4+
0
0
0
75,0 ± 22,4
28,0 ± 11,9
27,1 ± 10,2
(mmHg)
48,3 ± 14,6
16,5 ± 7,5
16,1 ± 7,2
AVA (cm²)
0,71 ± 0,18
LVEF (frazione d'eiezione)
49,5 ± 14,7
52,2 ± 13,0
60,4 ± 10,2
Indice di massa
153,3 ± 44,8
135,1 ± 29,8
127,9 ± 23,0
Indice di sfericità
0,72 ± 0,15
0,67 ± 0,17
0,63 ± 0,20
Diametro atrio sinistro (mm)
44,6 ± 4,9
46,2 ± 7,0
42,5 ± 9,6
PAPS
37,0 ± 12,3
33,7 ± 6,72
34,1 ± 8,0
Gradiente aortico max. (mmHg)
Gradiente aortico medio
75
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
ANALISI DELLA VARIABILE “PRESENZA DI
IPERTENSIONE”
Gli stessi 49 pazienti arruolati sono successivamente stati suddivisi
in altri due gruppi:
GRUPPO H (hypertension): 29 pazienti che al controllo preoperatorio risultavano ipertesi.
GRUPPO N ( non hypertension): 20 pazienti che nel preoperatorio non risultavano ipertesi.
Si è considerato come cut off per definire i pazienti ipertesi quello
suggerito dalle linee guida ESC 2009 (28) :
−
P. A. superiore a 140/90
−
Pazienti normotesi grazie alla terapia già in atto.
PARAMETRI CLINICI
76
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Come già citato nella precedente analisi dei 49 pazienti arruolati 39
erano in ritmo sinusale e 10 presentavano fibrillazione atriale. Il grafico
sottostante mostra come il fattore “ ritmo” si distribuisce nei due nuovi
gruppi H ed N.
Il gruppo H e il gruppo N presentano 2 portatori di pacemaker
ciascuno.
Essendo i due gruppi creati dallo stesso campione dei precedenti, la
distribuzione totale dei pazienti in classi NYHA rimane la stessa. E’
tuttavia rilevante notare come questa caratteristica si distribuisca nei due
gruppi.
Nel gruppo H si individuano 10 (34,4%) pazienti in classe II, 16
(55,1%) in classe III e 3 (10,3%) in classe IV.
Nel gruppo N troviamo 3 pazienti (15%) in classe II, 12 (60%) in
classe III e 5 (25%) in classe IV.
Confrontando questi dati appare evidente che nel gruppo H la
classe NHYA II raccolga una percentuale di pazienti doppia rispetto a
77
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
quanto avviene nel gruppo N. Al contrario, la percentuale di pazienti
ipertesi in classe IV è nettamente inferiore a quella osservabile
all’interno del campione N. Questo dato si può spiegare considerando
che tutti i pazienti in esame presentano stenosi aortica. In quei pazienti
nei quali, nonostante la stenosi, si raggiunge una pressione arteriosa
superiore a 140 mm Hg è lecito, infatti, presumere una funzionalità
ventricolare maggiormente conservata.
Essendo l’ipertensione il dato in esame, questo parametro non
compare nell’elenco delle comorbilità. Le altre patologie si
distribuiscono nell’intero campione come visto nell’analisi precedente:
Il diabete nel 34,7% dei casi.
L’insufficienza renale cronica nel 18,2% dei casi.
La BPCO nel 22,4% dei casi.
78
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
L’iperlipidemia e l’arteriopatia polidistrettuale nel 16,3%
dei casi.
Il grafico sottostante mostra l’incidenza delle diverse patologie nei
gruppi H e N:
79
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Caratteristiche preoperatorie
dei pazienti
Sesso
Maschi
Femmine
Età media
Diabete mellito di tipo 2
Insufficienza renale cronica
BPCO
Arteriopatia polidistrettuale
Iperlipidemia
Ritmo cardiaco
Sinusale
Fibrillazione atriale
Classe NYHA
Classe I
Classe II
Classe III
Classe IV
Gruppo H
Gruppo N
Totale
13
16
78,2
10
10
79,5
23
26
78,8
7 (24,1%)
5 (17,2%)
6 (20,7%)
6 (20,7%)
4 (13,8%)
10 (50,0%) 17 (34,7%)
4 (20,0%) 9 (18,4%)
5 (25,0%) 11 (22,4%)
2 (10,0%) 8 (16,3%)
3 (15,0%) 8 (16,3%)
22 (75,9%)
7 (24,1%)
17 (85,0%) 39 (79,5%)
3 (15,0%) 10 (20,4%)
0
10 (34,4%)
16 (55,2%)
3 (10,3%)
0
0
3 (15,0%) 13 (26,5%)
12 (60,0%) 28 (57,1%)
5 (25,0%) 8 (16,3%)
Nota: il valore percentuale riportato tra parentesi è riferito allo stesso gruppo di appartenenza.
Tabella 6: riassunto dei valori
DATI RELATIVI ALL’INTERVENTO CHIRURGICO
In questa nuova analisi i due gruppi sono suddivisi in base al
parametro ipertensione; di conseguenza in ciascun gruppo troviamo
pazienti sottoposti a sola AVR ed altri sottoposti a AVR + CABG.
Tuttavia non emerge una maggiore incidenza di AVR+CABG nel gruppo
ipertesi tale da poter ipotizzare un collegamento tra l’ipertensione e la
malattia coronarica dei pazienti.
80
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
EVOLUZIONE DEI PARAMETRI
I due gruppi di questa seconda analisi sono stati estrapolati dalla
stessa popolazione di quelli precedenti. Pertanto nella valutazione dei
parametri clinici e della loro evoluzione dal pre al post operatorio, i dati
riferiti all’intero campione saranno identici a quelli sopra descritti.
Ciò che in questa fase è rilevante ai fini dello studio è verificare
l’eventuale differenza nell’outcome tra i pazienti ipertesi e non ipertesi.
Pertanto nelle seguenti tabelle vengono presentati i dati relativi ai
parametri presi in esame dallo studio, suddivisi questa volta nei gruppi N
ed H.
VALVOLA AORTICA
81
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
La media fra tutti i pazienti del gradiente sistolico massimo
preoperatorio era pari a 86,9 ± 26 mmHg; questo valore nel gruppo
ipertesi raggiungeva i 90,6± 25,1 mmHg come per altro era prevedibile.
Il gradiente medio era di 53,2 ± 14,9 mmHg.
L’AVA risultava pari a 0,69 ± 0,19 cm2 e il valore più elevato si
riscontrava tra i pazienti del gruppo N (0,7 ± 0,16 mmHg).
Dopo l’ intervento di AVR i valori del gradiente transprotesico
sono risultati tutti nella norma al secondo controllo postoperatorio, sia
nei pazienti con protesi meccaniche che in quelli con protesi biologiche
e indipendentemente dal gruppo considerato, con un valore pressorio
massimo in media di 25,9 ± 10,7 mmHg.
82
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
VALVOLA MITRALE
Dai valori emersi al controllo preoperatorio si può evidenziare che
l’incidenza di IM moderata-severa era sostanzialmente la stessa nei due
gruppi H ed N; Quindi non risulta possibile correlare all’ipertensione un
diverso grado di danno alla valvola mitrale.
83
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
L’andamento dell’IM nel primo controllo postoperatorio è stato il
seguente: in 37 pazienti (75,5%) l’entità dell’IM si è ridotta, in 10
(20,4%) è rimasta invariata, in 2 pazienti (4,0%) è peggiorata; il secondo
controllo conferma il trend migliorativo
Anche in questo caso non emergono sostanziali differenze tra i due
gruppi.
84
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
85
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
VENTRICOLO SINISTRO
I dati preoperatori hanno messo in evidenza una frazione d’eiezione
del ventricolo sinistro (FE) mediamente nella norma; tuttavia nel gruppo
dei pazienti normotesi questo valore è più basso.
86
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Il valore preoperatorio dell’indice di massa risultava aumentato
nella totalità dei casi (circa 150 g/m 2). Si può notare come ci sia una
certa differenza tra i due gruppi: i pazienti normotesi avevano, già nel
pre operatorio, un indice mediamente di 10 g/m2 più basso. Nel
postoperatorio si assiste ad una evidente riduzione dei valori. Tale
riduzione è più marcata per i pazienti ipertesi, che, pur essendo partiti da
un valore mediamente più alto, risultano all’ultimo controllo il gruppo
con l’indice migliore.
87
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
L’indice di sfericità mostrava, prima dell’ intervento, valori di
circa 0,65 senza particolari differenze tra i gruppi; Dopo l’intervento si
assiste ad un miglioramento uniforme; tale dato può far dedurre come
l’ipertensione non correli con la sfericità del ventricolo.
88
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
ATRIO SINISTRO
Il diametro antero-posteriore dell’atrio sinistro è risultato
mediamente superiore alla norma nel controllo preoperatorio di tutti i
pazienti.
Considerando l’intero campione, si è passati da un valore
preoperatorio medio di 45,1 ± 5,6 mm alla misura di 44,4 ± 8,1 mm,
rilevata al secondo postoperatorio. Questo dato non indica un recupero
medio significativo; tuttavia i due gruppi presentano due evoluzioni
diverse: nei pazienti non ipertesi (gruppo N) si assiste ad un recupero di
circa 2mm mentre lo stesso dato per i pazienti ipertesi (gruppoH) resta
pressochè invariato.
Questo perché oltre alla stenosi, che in entrambi i gruppi si risolve
dopo l’intervento, nei pazienti del gruppo H permane l’ipertensione,
89
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
fattore sufficiente a generare, o in questo caso mantenere, la dilatazione
dell’atrio.
Il valore medio della pressione arteriosa polmonare sistolica
(PAPS) era, nel preoperatorio, di 37,9 mmHg (38,9 mmHg nel gruppo
H, 36,5 mmHg nel gruppo N).
Al primo esame postoperatorio la pressione è stata stimata, invece,
pari a 35,2 mmHg e al secondo controllo pari a 34,2 mmHg.
I dati rilevati mostrano, quindi, pur senza alcuna correlazione
lineare con l’andamento dell’IM, una generale tendenza al ripristino di
valori pressori fisiologici, dovuta alla rimozione dell’ostacolo
all’efflusso ventricolare sinistro e alle conseguenti ripercussioni sulle
camere sinistre, sul circolo polmonare, sul ventricolo destro e sul
rigurgito a livello della valvola tricuspide.
90
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
91
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Tabelle riassuntive:
parametri relativi alla totalità dei pazienti
Parametri
Preoperatorio 1° Postoperatorio
2° Postoperatorio
IM (% sul totale pz.)
assente
0
1( 2,0%)
2 (5,7%)
1+
0
29 (59,2%)
19 (54,3%)
2+
29 (59,2%)
12 (24,5%)
12 (34,3%)
3+
20 (40,8%)
7 (14,3%)
2 (5,7%)
4+
0
0
0
86,9 ± 26,08
28,5 ± 14,1
25,9 ± 10,7
(mmHg)
55,1 ± 16,6
15,8 ± 7,8
14,5 ± 6,5
AVA (cm²)
0,69 ± 0,19
LVEF (frazione d'eiezione)
54,7 ± 11,9
55,9 ± 11,8
60,11 ± 9,2
Indice di massa
150,5 ± 39,1
135,3 ± 27,48
125,1 ± 22,3
Indice di sfericità
0,65 ± 0,15
0,62 ± 0,14
0,58 ± 0,18
Diametro atrio sinistro (mm)
45,1 ± 5,3
45,7 ± 6,8
44,4 ± 8,1
PAPS
37,9 ± 10,2
35,2 ± 7,08
34,3 ± 7,1
Gradiente aortico max. (mmHg)
Gradiente aortico medio
92
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Gruppo H
Parametri
Preoperatorio 1° Postoperatorio
2° Postoperatorio
IM (% sul totale pz.)
assente
0
0
1 (4,3%)
1+
0
20 (68,9%)
14 (60,9%)
2+
17 (58,6%)
7 (24,1%)
7 (30,4%)
3+
12 (41,4%)
2 (6,8%)
1 (4,3%)
4+
0
0
0
90,7 ± 25,2
30,0 ± 14,3
28,48 ± 11,1
(mmHg)
56,8 ± 17,5
17,0 ± 7,6
15,8 ± 7,1
AVA (cm²)
0,68 ± 0,2
Gradiente aortico max. (mmHg)
Gradiente aortico medio
LVEF (frazione d'eiezione)
57,7 ± 11,56
58,0 ± 11,7
61,8 ± 9,2
Indice di massa
154,8 ± 42,8
134,5 ± 23,8
124,0 ± 19,9
Indice di sfericità
0,65 ± 0,15
0,63 ± 0,15
0,58 ± 0,16
Diametro atrio sinistro (mm)
45,4 ± 4,9
45,2 ± 7,4
45,2 ± 9,1
PAPS
38,9 ± 11,7
35,9 ± 7,2
34,6 ± 7,5
93
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Gruppo N
Parametri
Preoperatorio 1° Postoperatorio
2° Postoperatorio
IM (% sul totale pz.)
assente
0
1 (5,0%)
1 (8,3%)
1+
0
9 (45,0%)
5 (41,7%)
2+
12 (60%)
5 (25,0%)
5 (41,7%)
3+
8 (40%)
5 (25,0%)
1 (8,3%)
4+
0
0
0
81,4 ± 27,0
26,3 ± 13,7
20,9 ± 8, 0
(mmHg)
52,7 ± 15,3
14,2 ± 8,1
11,9 ± 4,4
AVA (cm²)
0,70 ± 0,16
LVEF (frazione d'eiezione)
50,3 ± 11,3
53,0 ± 11,4
56,9 ± 8,7
Indice di massa
144,3 ± 33,1
136,6 ± 33,0
127,3 ± 27,1
Indice di sfericità
0,64 ± 0,16
0,60 ± 0,13
0,58 ± 0,21
Diametro atrio sinistro (mm)
44,8 ± 4,9
46,4 ± 6,0
43,0 ± 5,9
PAPS
36,5 ± 7,5
34,3 ± 7,0
33,7 ± 6,5
Gradiente aortico max. (mmHg)
Gradiente aortico medio
DISCUSSIONE
94
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Tutti i 49 pazienti considerati nello studio presentavano, in
associazione alla stenosi aortica calcifica di grado severo,
un’insufficienza mitralica a carattere prevalentemente funzionale; anche
considerando la totalità della casistica presa in esame, a prescindere dai
criteri di esclusione adottati, si è riscontrata, su 341 pazienti,
un’incidenza globale dell’IM pari al 95,7%, in accordo con quanto
riportato in letteratura (25).
L’incidenza di pazienti con IM andati incontro a miglioramento tra
i 49 casi considerati è stata relativamente alta (75,5% al primo controllo)
a conferma della presupposta patogenesi funzionale del rigurgito
mitralico; infatti, mentre le lesioni valvolari di tipo organico
difficilmente sono soggette a significativo miglioramento dopo AVR, la
dilatazione e la disfunzione del ventricolo sinistro (VS) e dell’atrio
sinistro (AS) possono regredire totalmente o in parte dopo l’intervento
chirurgico, soprattutto se la AVR si associa a CABG.
La riduzione del rigurgito è quindi da correlare al riassetto della
geometria ventricolare, che favorisce la corretta coaptazione dei lembi.
A conferma di quanto osservato in relazione al miglioramento
dell’IM, diversi dati della letteratura suggeriscono che la riduzione
dell’entità del rigurgito mitralico dopo AVR sia correlata non solo alla
riduzione della pressione sistolica intraventricolare sinistra, ma anche, e
forse soprattutto, a variazioni della morfologia e della funzione del VS e
dell’AS.
In particolare, un recente studio (29) di Waisbren E.C. (marzo 2008),
dopo aver evidenziato la notevole frequenza di IM funzionale associata
ad SA tra 227 pazienti sottoposti ad AVR isolata, ha cercato di
identificare i principali fattori responsabili di un significativo
cambiamento postoperatorio del rigurgito, adottando criteri di esclusione
molto simili a quelli del presente studio.
95
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Nel postoperatorio si è rilevato un miglioramento dell’IM nel 66%
dei pazienti e, soprattutto, sono stati individuati fattori predittivi
indipendenti del parziale recupero della continenza valvolare quali la
presenza di una IM preoperatoria di grado lieve, la coesistenza di una
lieve insufficienza aortica, la presenza di un atrio sinistro di dimensioni
inferiori a 45 mm e di concomitante scompenso cardiaco congestizio.
Di notevole interesse è la constatazione di come un paziente
scompensato, secondo l’autore principalmente a causa della stessa SA,
possa presentare una significativa riduzione dell’IM dopo AVR isolata.
Anche la relazione tra fibrillazione atriale, marcata dilatazione dell’atrio
sinistro e minore probabilità di riduzione dell’IM dopo AVR suggerisce
il ruolo di una corretta funzionalità atriale e di una sincrona contrazione
delle camere cardiache nel favorire una corretta coaptazione dei lembi
mitralici.
Lo studio sottolinea, inoltre, come sia ancora in atto il dibattito in
letteratura tra chi considera opportuno un intervento chirurgico
(possibilmente conservativo) anche sulla valvola mitrale e chi ritiene
l’AVR isolata sufficiente a determinare un considerevole miglioramento
dell’IM.
A tale proposito, i risultati dello studio citato sostengono, nei casi
che mostrano un’IM concomitante alla SA, il ricorso ad un approccio
chirurgico mitralico conservativo e strettamente personalizzato,
suggerendo, però, di valutare nel processo decisionale determinate
caratteristiche del paziente, in particolare la presenza o meno dei fattori
predittivi indipendenti di riduzione dell’IM ricordati precedentemente,
che possono rendere superflua la chirurgia mitralica.
Nello studio (30) di Tassan-Mangina S. (2003), sono stati considerati
30 pazienti operati di AVR per SA con concomitante IM di qualsiasi
grado; l’entità del miglioramento dell’IM nel postoperatorio risultava
dipendente dallo spessore telediastolico del setto, dai valori dei gradienti
massimo e medio transvalvolari aortici, dalla velocità di picco
dell’insufficienza tricuspidalica e dall’entità delle calcificazioni
96
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
mitraliche rilevate nel preoperatorio. Nella valutazione non sono stati
tuttavia arruolati pazienti con IM severa o emodinamicamente instabili.
I primi studi relativi alla concomitanza di SA e IM risalgono al
1990, con le valutazioni (31) di Tunick P.A.; si sono studiati 44 pazienti
sottoposti ad AVR isolata, che presentavano IM di grado variabile e, in
circa la metà dei casi, alterazioni mitraliche primitive; la percentuale
delle IM andate incontro a miglioramento è stata del 60%, sebbene il
27% dei casi fosse rimasto invariato e il 13% fosse peggiorato dopo un
periodo di circa 60 giorni dall’intervento.
Di contro, nello stesso anno, Adams P.B. ha riportato (32) un
miglioramento della IM in solo 4 dei 16 pazienti rivalutati circa 176
giorni dopo l’intervento di AVR isolata, forse a causa dell’arruolamento
di soggetti con IM di entità lieve; in considerazione della poco numerosa
casistica analizzata non era stato comunque possibile identificare precisi
fattori prognostici.
Nel 1997 Harris K.M. ha effettuato uno studio (33) su 28 pazienti
sottoposti a AVR con IM almeno moderata all’esame ecocardiografico
preoperatorio, rilevando che la riduzione del grado dell’IM dopo AVR
era direttamente proporzionale alla severità della dilatazione e della
disfunzione sistolica del
VS e alla dilatazione dell’atrio sinistro preoperatorie, mentre non
correlava con i seguenti valori preoperatori: gradiente transvalvolare
aortico, area dell’anulus mitralico, indice di massa del VS e indice di
sfericità.
Il lavoro (34) di Brasch A.V. del 2000, effettuato su 27 pazienti,
proprio in relazione ai risultati ottenuti da Harris K.M., ha ottenuto dati a
sostegno dell’associazione di AVR e chirurgia mitralica ripartiva o
sostitutiva nei pazienti con IM severa concomitante alla SA, vista la
bassa percentuale di miglioramento (52%) nei pazienti considerati dopo
AVR isolata.
Tuttavia, a conferma delle diverse linee di pensiero esistenti, alcuni
lavori hanno dimostrato che è proprio l’IM di entità severa a giovarsi
97
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
maggiormente della AVR isolata (33), indicando l’aggravamento dell’IM
nel postoperatorio come un fenomeno piuttosto raro.
Christenson J.T, a quest’ultimo proposito, ha condotto uno studio
su 60 pazienti con SA e concomitante IM, dimostrando un
miglioramento dell’IM nella maggioranza dei pazienti sottoposti ad
AVR isolata o associata a CABG, indipendentemente dalla sua gravità
alla valutazione preoperatoria; nessun paziente è stato sottoposto a
concomitante chirurgia mitralica (27).
Lo studio escludeva i casi di gravi alterazioni morfologiche della
valvola mitrale e mostrava come, in presenza di una IM preoperatoria di
grado II o III, la gravità restasse invariata nel 34% dei pazienti non
sottoposti a concomitante CABG e nel 20% dei pazienti sottoposti anche
a CABG.
Nella nostra casistica sono stati presi in considerazione pazienti in
cui si associava alla SA la presenza di IM di entità almeno moderata ed a
carattere prevalentemente funzionale, con un grado variabile di
degenerazione fibrocalcifica associata.
La presenza di quest’ultima alterazione, peraltro rivelatasi un
parametro indipendente nella patogenesi dell’insufficienza mitralica
legata al restringimento dell’orifizio aortico(35), è stata considerata
inevitabile, vista l’età media della popolazione arruolata.
I pazienti in cui alla SA si associava una valvulopatia mitralica la
cui patogenesi prevalente era stata attribuita a marcate alterazioni
morfologiche intrinseche all’apparato valvolare non sono stati arruolati
nello studio.
A questo proposito è risultata fondamentale l’effettuazione di un
attento studio morfologico e funzionale preoperatorio dell’apparato
valvolare mitralico, del VS e dell’AS, per stabilire l’eziologia prevalente
dell’IM in ogni paziente, ai fini di un corretto decision-making
chirurgico.
98
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Per giustificare da un punto di vista fisiopatologico l’elevata
percentuale di miglioramento dell’IM nel postoperatorio verificatasi nel
nostro studio è opportuno analizzare separatamente i gruppi ottenuti
considerando il parametro “tipologia di intervento”.
Nel gruppo A, composto da soggetti sottoposti ad AVR isolata, si è
assistito nel 72,4% dei casi (21 pazienti) ad un miglioramento dell’IM e
nel 24,1% (7 pazienti) alla presenza di un rigurgito invariato, solo in un
caso è avvenuto un peggioramento (3,4%).
In questo contesto si può supporre che l’IM fosse determinata dalle
anomalie morfologiche del ventricolo secondarie alla SA.
Tuttavia, nonostante le valutazioni postoperatorie evidenziassero un
corretto funzionamento delle protesi aortiche impiantate e i gradienti
risultassero, nella maggioranza dei casi, normali già al primo controllo
postoperatorio, non si è assistito ad un decremento lineare dell’entità
dell’IM, in accordo con i risultati ottenuti da Harris K.M. e
contrariamente a quanto dimostrato da Tassan-Mangina S..
Quindi la rimozione dell’ostacolo all’eiezione non sempre consente
un conseguente immediato ripristino della geometria e della funzionalità
ventricolare.
Nel gruppo B, composto da soggetti sottoposti a CABG
contestualmente alla AVR, la percentuale di miglioramento dell’IM è
stata maggiore (80%), a fronte di soli 3 casi (15%) di mancata riduzione,
nonostante i pazienti presentassero nel preoperatorio condizioni cliniche
peggiori di quelli del gruppo A.
La spiegazione fisiopatologica dei risultati ottenuti nel gruppo B
può essere ricercata, oltre che nella rimozione dell’ostacolo all’efflusso
del ventricolo sinistro, anche nel miglioramento della perfusione
miocardica dopo la rivascolarizzazione chirurgica, con conseguente
positiva influenza sulla geometria ventricolare globale.
99
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Per una valutazione complessiva dei due gruppi è possibile
confrontare, inoltre, alcuni parametri preoperatori significativi:
•
•
•
La classe NYHA risultava mediamente di entità maggiore (considerando i gradi III e IV) nel gruppo B (90%) rispetto a quella registrata nel gruppo A (61,9%).
La FE del ventricolo sinistro appariva mediamente più bassa nel
gruppo B (49,5%) rispetto a quella del gruppo A (58,4%).
Il grado di IM preoperatorio è risultato di entità maggiore nel
gruppo B (50% con IM 3+) rispetto al valore riscontrato nel
gruppo A (34,3% con IM 3+).
Il peggioramento dell’IM nella nostra casistica si è avuto soltanto in
2 pazienti, entrambi appartenenti uno al gruppo A ed uno al gruppo B; in
uno dei due la causa dell’aumento del rigurgito mitralico è stata da
attribuire alla rottura di una corda mitralica, avvenuta alcuni mesi dopo
l’intervento.
Nei casi di miglioramento dell’IM, con riferimento ai due gruppi, si
può notare come la riduzione del rigurgito sia valutabile già al primo
controllo postoperatorio nella maggioranza dei pazienti (83,3%),
parallelamente al miglioramento degli altri parametri di funzione
ventricolare, in accordo con quanto descritto da Harris K.M. e in
contrapposizione ai risultati di Christenson J.T., secondo cui solo i
pazienti sottoposti ad AVR e CABG mostrano un miglioramento dell’IM
entro la prima settimana postoperatoria.
Inoltre i pazienti sottoposti a CABG contestualmente alla AVR
presentano, nel nostro studio, una particolare precocità nella regressione
dell’IM.
Per quanto riguarda una valutazione complessiva delle
modificazioni subite dal ventricolo sinistro, si può evincere dai dati
100
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
ottenuti che, mentre la riduzione del diametro telediastolico non è
risultata particolarmente significativa, il decremento del diametro
telesistolico è stato di media più evidente.
E’ apprezzabile un miglioramento della FE, anche se non
statisticamente significativo, specialmente nel gruppo dei pazienti
sottoposti a CABG, compatibilmente con il ripristino della perfusione e
quindi della funzione contrattile del ventricolo sinistro, in accordo con
quanto riportato in letteratura(36).
E’ interessante notare come la percentuale di pazienti in cui l’IM è
migliorata sia più alta nel gruppo B, nonostante la FE preoperatoria dei
pazienti di quest’ultimo gruppo fosse significativamente più bassa
rispetto a quella dei soggetti del gruppo A; anche questo dato può essere
giustificato dall’effetto favorevole della rivascolarizzazione miocardica
sulla geometria ventricolare sinistra.
L’ indice di massa ventricolare si è significativamente ridotto in
tutti e due i gruppi senza però mostrare una diretta correlazione con la
101
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
riduzione dell’insufficienza mitralica; ciò è testimoniato dal quadro di
alcuni pazienti, che pur avendo marcatamente ridotto l’indice di massa,
mostrano una IM invariata e, in qualche caso, peggiorata.
La spiegazione della riduzione dell’indice di massa può essere
fornita dal recupero delle dimensioni e degli spessori del ventricolo
sinistro dopo la rimozione dell’ostruzione all’efflusso rappresentata dalla
SA.
Per quanto riguarda l’andamento dell’indice di sfericità, la sua
variazione nel tempo ha mostrato un miglioramento statisticamente
significativo, soprattutto nei pazienti in cui si è verificata una riduzione
dell’IM; il dato è un’ulteriore conferma della stretta relazione tra IM e
geometria ventricolare.
102
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
L’analisi delle dimensioni dell’atrio sinistro si è conclusa senza
rilevare variazioni particolarmente significative tra i valori preoperatori
e quelli postoperatori, indipendentemente dal miglioramento dell’IM.
Nella nostra casistica, inoltre, è stato preso in considerazione il
parametro del ritmo cardiaco ed è emerso che, tra i 12 pazienti in cui
l’IM non migliora o peggiora nel postoperatorio, 5 presentavano, al
controllo preoperatorio, una fibrillazione atriale permanente o un PMK o
entrambi.
Nonostante la ridotta casistica, potrebbe essere interessante stabilire
quanto effettivamente l’asincronia della contrazione inter ed
intravertricolare e le alterazioni della funzione e del diametro atriale
sinistro legate alla FA permanente possano influire negativamente sul
recupero dell’IM dopo AVR, come già sottolineato dallo studio di
Waisbren E.C.(29).
Il secondo obiettivo del presente studio era quello di verificare se la
presenza in anamnesi dell’ipertensione arteriosa avesse influenze
significative sull’outcome dei pazienti e sull’andamento dei parametri
presi in esame.
Per fare ciò è stato necessario procedere ad un ulteriore
elaborazione dei dati. L’intera popolazione è stata divisa in due gruppi
composti dai pazienti che presentavano o meno ipertensione.
Sono poi stati controllati tutti i parametri in esame e la loro
variazione, alla ricerca di differenze significative.
La prima differenza significativa emergeva già nell’analisi dei dati
preoperatori. Una volta divisi i pazienti in ipertesi e non ipertesi si
notava infatti che il primo gruppo (quello degli ipertesi) conteneva
pazienti con una classe NYHA mediamente migliore degli altri. Questo
dato trova una conferma se si tiene conto della migliore performance
ventricolare necessaria per realizzare l’ipertensione arteriosa sistemica in
presenza di ostacolo all’efflusso costituito dalla stenosi aortica.
103
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Non sono emerse invece differenze significative per quanto
riguarda l’incidenza nei due nuovi gruppi di altre comorbilità o di turbe
del ritmo.
Anche la distribuzione della tipologia di intervento ( AVR o AVR
+ CABG) nei due gruppi H e N non ha mostrato differenze significative.
L’analisi dell’evoluzione dei parametri morfologici e funzionali è
stata compiuta con i medesimi criteri della precedente, semplicemente
modificando i gruppi secondo il nuovo parametro.
Non sono emerse significative differenze tra i due gruppi per
quanto riguarda i parametri di funzionalità della valvola aortica e della
valvola mitrale.
E’ emerso invece un valore diverso tra i due gruppi per quanto
riguarda l’indice di massa.
Già in uno studio pubblicato nel 2004 da M. Gaudino (37) era emersa
una correlazione tra l’ipertensione e l’aumento della massa cardiaca.
In questo lavoro, condotto su 260 pazienti sottoposti ad AVR e
seguiti poi con follow up semestrale, l’autore dimostra come il gruppo
dei pazienti ipertesi mostrava un indice di massa cardiaca preoperatoria
più alto e un recupero solo marginale di questo dato nei primi sei mesi
dopo l’intervento con una tendenza successiva ad un nuovo
peggioramento. L’ipertensione, inoltre, aveva un impatto determinante
sulla mortalità durante il follow up.
Anche nel nostro studio, la valutazione preoperatoria, mostrava
come il gruppo degli ipertesi aveva un indice di massa mediamente
superiore (154,7 g/m2 contro 144,3 g/m2); questa differenza è da
ascrivere al maggior postcarico che il ventricolo dei pazienti ipertesi era
chiamato a vincere, compiendo quindi uno sforzo maggiore.
In controtendenza rispetto al lavoro di Gaudino, in questo studio,
dopo l’intervento, entrambi i gruppi hanno mostrato una notevole
riduzione dell’indice di massa (in media da 150,5 a 125,1 g/m 2 al
secondo post).
104
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
Il dato più contrastante è la maggiore riduzione di questo indice
registrata nel gruppo degli ipertesi (da 154,7 a 124,0 g/m 2) che non solo
si riallineano al valore medio ma addirittura risultano il gruppo con il
dato minore.
LIMITI DELLO STUDIO
Il primo limite concettuale di questo studio consiste nella sua natura
di revisione retrospettiva di un numero relativamente ristretto di casi;
pertanto è risultato particolarmente difficile standardizzare i dati di cui si
disponeva e soprattutto è stata inevitabile la perdita del follow-up a
lungo termine di 7 pazienti.
Da un punto di vista ecocardiografico, è stata effettuata una
valutazione dell’insufficienza mitralica di tipo semiquantitativo; tale
metodo è stato ritenuto sufficientemente accurato nella valutazione della
severità del rigurgito mitralico, in accordo con altri studi presenti in
letteratura.
Nella valutazione ultrasonografica non sono stati valutati
estensivamente altri parametri utili per tentare di chiarire la
fisiopatologia della genesi dell’IM e, conseguentemente, della sua
evoluzione dopo AVR, come il diametro dell’anulus mitralico, marker
della dilatazione atrio-ventricolare, e la distanza di tethering delle corde
tendinee, indicatore del rimodellamento ventricolare sinistro.
Sempre ascrivibile all’ipertensione è la differenza nel diametro
dell’atrio sinistro e nella sua evoluzione.
I pazienti con pressione oltre la norma mostravano già al
preoperatorio un diametro maggiore degli altri. Questa differenza si è
accentuata vistosamente nel post operatorio: infatti nei normotesi,
rimossa la stenosi, si è verificato un discreto recupero (da 44,6 a 42,5
mm) mentre nell’altro gruppo, dove permaneva l’ipertensione, il valore è
pressoché rimasto costante.
105
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
106
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
CONCLUSIONI
L’IM a genesi prevalentemente funzionale è un reperto di
frequente riscontro nei pazienti affetti da concomitante SA e la sua
entità non è necessariamente correlata a quella del vizio aortico; infatti,
analizzando i dati elaborati nel nostro studio, si rileva che la grande
maggioranza dei pazienti sottoposti ad AVR per la presenza di SA
severa presenta, nel preoperatorio, una IM di grado lieve e solo nel
14,3% dei casi una IM di grado moderato o superiore.
Nell’ambito dei 49 pazienti selezionati, tutti con IM di grado
almeno moderato, l’entità del vizio valvolare si riduce, dopo AVR, nella
grande maggioranza dei casi (75,5%) e la probabilità che ciò avvenga è
superiore se il soggetto viene sottoposto contestualmente a CABG.
La probabilità invece non cambia, soprattutto nella prognosi a
lungo termine, tra pazienti ipertesi e non ipertesi.
In letteratura non sono ancora emersi fattori sicuramente predittivi
di riduzione dell’insufficienza mitralica dopo chirurgia valvolare
aortica, ma l’ecocardiografia preoperatoria riveste un ruolo
determinante nell’individuare il meccanismo fisiopatologico dell’IM,
suggerendo, di conseguenza, la scelta del successivo atto operatorio.
Il riscontro di evidenti alterazioni morfologiche, suggestive di
patologia primitiva mitralica, indirizza verso l’associazione del
trattamento chirurgico mitralico con quello aortico.
Se, invece, il meccanismo dell’IM si dimostra prevalentemente
funzionale è necessario avviare un delicato processo di decision-making
che consideri da una parte la possibilità che la AVR isolata o
eventualmente associata a CABG possa favorire un rimodellamento
inverso del ventricolo sinistro, legato sia alla riduzione dell’ostacolo
all’efflusso ventricolare che alla riperfusione miocardica, dall’altra
l’eventualità di dover comunque ricorrere alla correzione chirurgica del
vizio mitralico, specie nelle forme di IM particolarmente severe.
107
Il Rimodellamento Ventricolare Sinistro in Pazienti con Insufficienza Mitralica dopo Sostituzione Chirurgica della Valvola Aortica
In ogni caso, nella pianificazione dell’atto operatorio si preferisce,
se possibile, evitare l’impianto di doppia protesi valvolare, favorendo la
chirurgia conservativa della valvola mitrale.
108