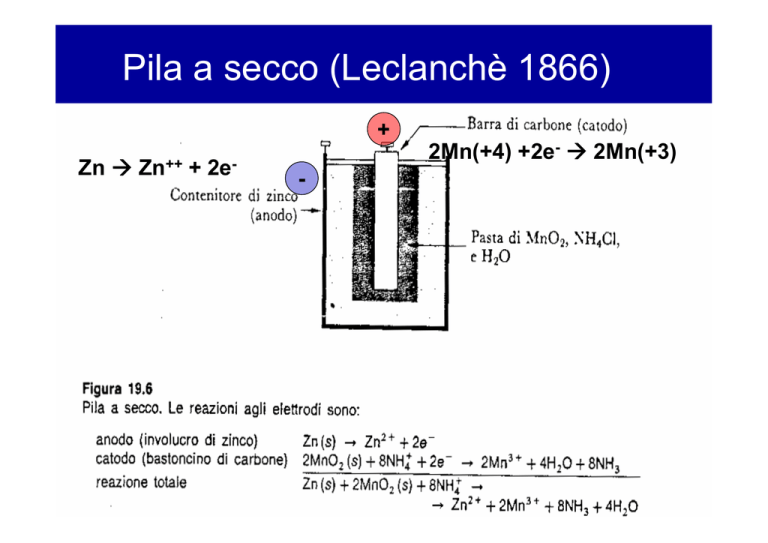
Pila a secco (Leclanchè 1866)
+
Zn Æ Zn++ + 2e-
-
2Mn(+4) +2e- Æ 2Mn(+3)
+
+
-
-
Pile a combustibile
polo (+) O2 + 4H+ + 4e- → 2H2O
polo (-) 2H2 → 4H + + 4e la reazione complessiva è quindi:
2H2 + O2 → 2H2O
-
+
Il problema di pile alimentate ad idrogeno è la scarsa disponibilità
dell’idrogeno, lo si risolve trasformando un combustibile come un
idrocarburo o un alcol in idrogeno con un processo chiamato
“steam reforming”. (reazione con vapore ad alta temperatura su
catalizzatore, endotermica)
CH3OH → CO + 2H2
CO + H2O→ CO2 + H2
non si produce CO e tutto il carbonio si trasforma in CO2.
Nel caso del metano il reforming porta sempre a CO2 e idrogeno
con pochi sottoprodotti inquinanti:
CH4 + H2O → CO + 3H2
CO + H2O→ CO2 + H2
In ogni caso però si produce anidride carbonica che
contribuisce all’aumento dell’effetto serra.
Considerando la resa energetica complessiva di un’auto
elettrica (reformer idrocarburi + pila a idrogeno + motore
elettrico) si ha un valore del 30%, la resa energetica di un’auto
con motore a benzina convenzionale è del 20%.
Elettrolisi
Processo che permette di fare avvenire una reazione
non spontanea fornendo energia elettrica dall’esterno.
Per effettuare l’elettrolisi sarà necessario fornire una tensione
almeno superiore a quella prodotta dalla corrispondente reazione
spontanea (potenziale di decomposizione).
Se la reazione spontanea è Na + 1/2Cl2 Æ NaCl il potenziale
sviluppato dalla reazione è quello di una pila standard sodio-cloro:
Fem = E°(Cl2/Cl-) – E°(Na+/Na) = +1,36 – (-2,71) = 4,07
Per ottenere sodio e cloro per elettrolisi di NaCl sarà necessaria
quindi una tensione di almeno 4,07 V.
Elettrolisi di NaCl fuso
+
-
Leggi di Faraday.
Na + + e- → Na PE = PA
Cu++ + 2e- → Cu PE = PA/2
Al+++ + 3e- → Al PE = PA/3
2Cl - Æ Cl2 + 2e- PE = PM/2
Per ogni grammo equivalente è necessaria una mole di elettroni pari ad una
carica di 96500 coulomb. Quindi se indichiamo con I l’intensità di corrente in
ampère (coulomb/secondo) ed il tempo t in secondi avremo la seguente
equazione:
g
I ( A)t ( s )
eq =
=
PE 96500Ceq −1
Cella elettrolitica industriale per ottenere sodio e cloro
-
+
-
Fem = E°(Cl2/Cl-) – E°(Na+/Na) = +1,36 – (-2,71) = 4,07
In presenza di più specie
• Al polo + (anodo) si ossidano le più riducenti E <
• F- > Cl- > Br - > I• Al polo – (catodo) si riducono le più ossidanti E >
• Au+++ > Ag+ > Cu++ > Zn++
Elettrolisi dell’acqua
Na2SO4 → 2Na+ + SO4- E° (H3O+/H2) = 0,00
E° (H2O/H2) = - 0,83
E(Na+/Na) = -2,71
al catodo (-) 2H2O + 2e- → H2 + 2OHE°(SO4- -/S2O8- - ) = + 2,05
E° (O2/H2O) = +1,23
all’anodo (+) 3H2O → 1/2O2 + 2H3O+ +2e-
-
+
(+) 2H2O --> O2 +4H+ + 4e(-) 4H2O +
4e-
--> 2H2
+4OH-
8.01.2007
Elettrolisi di una soluzione acquosa di NaCl
+
-
+
-
2H2O + 2e- → H2 + 2OH–
-
E° = -0,83 V
2Na+ +2e- → Na E° = - 2,7 V
3H2O → 1/2O2 + 2H3O+ + 2e- E° = +1,23 V
+ 2Cl- → Cl2 + 2e- E° = + 1,36 V
2Cl- → Cl2 + 2e- E° = +1,36 V
3H2O → 1/2O2 + 2H3O+ + 2e- E° = +1,23 V
ECl
2
/ Cl −
=E
°
Cl 2 / Cl
−
0,059
[Cl 2 ]
log
+
2
[Cl − ]2
PCl 2
0,059
log
1, 23 = 1,36 +
2
[Cl − ]2
PCl 2
log
= − 4, 4
− 2
[Cl ]
PCl 2
−5
=
4
⋅
10
[Cl − ]2
Cella a catodo di mercurio
+
-
(-) 2Na+ +2e- → Na E° = - 2,7 V
(+) 2Cl- → Cl2 + 2e- E° = + 1,36 V
Metallurgia del rame
2Cu2S + 3O2 Æ 2Cu2O + 2SO2
2Cu2O + Cu2S Æ 6Cu + SO2
__
-------------------------------------------------------------------
3Cu2S + 3O2 Æ 6Cu + 3SO2
Purificazione elettrolitica del rame
Polo (+) Cu Æ Cu++ + 2e-
Gen. di cc
+
Polo (–) Cu++ + 2e- Æ Cu
-
Cu
Impurezze:
Cu
Pb,
Ni
Ag,
Au
Pb Æ Pb++ + 2eNi Æ Ni++ + 2e-
Cu++
SO4--
Au e AgÆfanghi anodici
Cella per la purificazione elettrolitica del rame
Ingresso soluz.
CuSO4
Ag e Au
Altri metalli: Ag e Au non si ossidano al (+)
Pb e Ni si ossidano al (+) ma non si riducono al (-)
Cu++ + 2e- → Cu
+
-
Estrazione dell’oro dal minerale
4Au + 8NaCN + O2+ 2H2O → 4Na[Au(CN)2] +
4NaOH
2Na[Au(CN)2] + Zn → 2NaCN + Zn(CN)2 + Au (s)
Purificazione dell’oro
L’oro così estratto contiene 88% di Au,10% di Ag, 2% di Cu,Pb,Zn
Una prima purificazione dell’oro consiste nel far passare in Au
fuso Cl2 gassoso.I potenziali standard sono: Au+/Au = +1,7 volt
Cu++/Cu Pb++/Pb Zn++/Zn
Ag+/Ag
Cl2 /2Cl+0,34
-0,12
-0,76
+0,8
+1,36
Avvengono le reazioni:
Cu + Cl2 → Cu++ + 2ClPb + Cl2 → Pb++ + 2ClZn + Cl2 → Zn++ + 2Cl2Ag + Cl2 → 2Ag+ + 2ClI cloruri ottenuti sono volatili e vengono eliminati, si ottiene così
Au puro al 99,6% utile per usi monetari.
Per usi industriali si ottiene oro al 99,99% per elettrolisi di AuCl
+
Gen. di cc
Au+
Au
-
Au
E°/ Volt
Zn → Zn++ + 2e- (-0,76)
Pb → Pb++ + 2e- (-0,13)
Cu → Cu++ + 2e- (+0,34)
Ag → Ag+ + e- (+0,80)
Au → Au+ + e- (+1,7)
Au+ + e- → Au
Accumulatori al Piombo
(+4)
(+2)
(+) PbO2 (s) + 2e- + 4 H+(aq) + SO42- (aq ) = PbSO4 (s)
+ 2 H2O (l )
scarica Æ carica Å
(0)
(+2)
(-) Pb (s) + SO42- (aq ) = PbSO4 (s) + 2escarica Æ carica Å
-
-
+
+