I solidi
I solidi
In un corpo solido le particelle, unite dalle forze di legame, occupano posizioni
fisse, talvolta in una struttura altamente organizzata definita cristallo
I solidi hanno forma e volume propri
e non possono essere compressi.
La temperatura di un corpo è un indice dell energia dei
moti delle sue particelle.
Ogni particella del solido mantiene stabilmente la propria posizione (A),
anche se è continuamente interessata da moti vibrazionali (B).
L aumento della temperatura accentua il movimento di vibrazione.
Movimenti più liberi e ad ampio raggio, come quelli di rotazione attorno a
un asse (C) e di traslazione verso qualunque direzione dello spazio (D),
sono possibili solo nei liquidi e nei gas.
I solidi
• Nei solidi le molecole, gli atomi o gli ioni non sono
liberi di muoversi (anche se possono vibrare e a volte
ruotare).
• Vi può essere una disposizione ordinata a lungo
raggio.
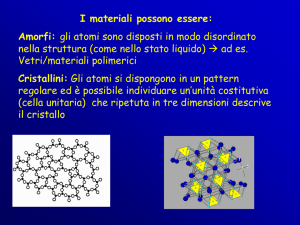
I solidi cristallini
I solidi cristallini, caratterizzati da
particelle disposte con un preciso
ordine geometrico e da un elevata
simmetria, si distinguono dai solidi
amorfi, dove non si riconosce una
regolarità nell organizzazione
particellare.
I solidi cristallini sono
classificati sulla base
del tipo di legame
chimico esistente tra le
particelle, che possono
essere atomi, ioni o
molecole.
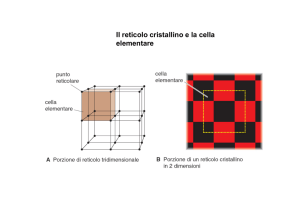
• La forma di un solido
cristallino dipende dalla
disposizione spaziale delle
particelle, che va a definire il
cosiddetto reticolo
cristallino.
I solidi covalenti
Solidi formati da atomi legati in modo covalente con una
disposizione tridimensionale dei legami dei legami in modo
da formare una struttura estesa (quarzo, grafite, diamante).
I solidi covalenti o solidi atomici sono costituiti da atomi uniti tra loro
da legami covalenti omopolari o eteropolari.
I solidi covalenti
Nel diamante ogni atomo di
carbonio, ibridato sp3, è
legato ad altri quattro atomi
disposti ai vertici di un
tetraedro. Nella grafite ogni
atomo di carbonio, ibridato
sp2, è legato con legami
covalenti σ ad altri tre atomi,
disposti sullo stesso piano e a
120° tra loro. Si produce una
struttura a piani paralleli. I
legami tra gli atomi disposti
su piani diversi sono deboli e
la grafite di risulta facilmente
sfaldabile.
I solidi ionici
Un reticolo ionico può essere costruito prima impaccando gli
ioni più grandi (ad esempio Cl- in NaCl) e poi collocando gli
ioni più piccoli (Na+) nelle cavità generate dai primi.
Gli atomi o gli ioni possiedono raggi diversi. Poiché i solidi ionici e
gli ioni metallici sono formati da atomi o ioni che impaccano il più
strettamente possibile, le dimensioni della cella elementare e la
densità del solido dipendono dai raggi degli atomi o degli ioni
interessati.
Solidi molecolari
Nei solidi molecolari ai vertici del
reticolo cristallino vi sono le molecole.
Sostanze caratterizzate da forti
legami covalenti tra gli atomi che
costituiscono le molecole e da
forze relativamente deboli tra le
molecole.
Solidi che contengono unità molecolari discrete in ciascuna
posizione reticolare (ghiaccio, ghiaccio secco, alcune forme di
zolfo e di fosforo, saccarosio).
Solidi metallici
•
Il legame nei metalli è forte e non direzionale
(modello del mare di elettroni, modello a bande).
• Malleabili, duttili, buona conducibilità elettrica e
termica.
Nella struttura di un metallo sono presenti tutti cationi esattamente equivalenti. Uno
slittamento nella struttura non provoca alcuna alterazione e può essere tollerato. I solidi
metallici sono perciò malleabili. (B), nella struttura di un composto ionico uno slittamento
delle posizioni determina una situazione di repulsione tra particelle dello stesso segno; la
struttura ionica non sopporta alcuna alterazione. I solidi ionici non sono malleabili.
Tipo di solido
Esempi
Tipo di legame
Ionico
NaCl, KCl, CsI
Ionico
Metallico
Fe, Zn, Cu, Ag
Metallico
Molecolare
H2O(ghiaccio), I2, zolfo
Dipolo-dipolo etc.
Con struttura estesa
Grafite, diamante,
quarzo
Struttura estesa
con leg. cov.
Difettivi Disordinati
AgI, solidi superionici
Ionico
Non stechiometrici
CdS
Ionico, metallico
Amorfi
Vetro, PET....
Leg. cov., forze
intermol.
Polimorfismo, allotropia ed isomorfismo
• Polimorfismo: capacità di una stessa sostanza
di dare cristalli aventi diversa struttura, come ad
esempio CaCO3 che cristallizza come calcite
(romboedrica) o come aragonite (rombica). Le
fasi sono stabili in un ben determinato intervallo
di T e O (Campo di stabilità, fasi metastabili).
• Il fenomeno del polimorfismo nelle sostanze
elementari viene chiamato Allotropia: diversa
modificazione dello stesso elemento (stessa
T e P)
• Isomorfismo: sostanze diverse che danno
luogo a cristalli molto simili (allumi, vetrioli…).
Solidi amorfi
• Nei solidi amorfi le particelle hanno una
disposizione spaziale non regolare.
Il vetro è un solido formato, come il quarzo, di unità tetraedriche di atomi di silicio legati
ad atomi di ossigeno. Esso però è amorfo e non ha la disposizione regolare delle
particelle, tipica dei cristalli di quarzo. Grazie alla proprietà dei solidi amorfi di rammollire
prima di fondere, il vetro può essere modellato con facilità e, per aggiunta di ossidi
metallici, può assumere colori brillanti e vistosi, come negli oggetti prodotti dai maestri
vetrai di Murano.
Calore specifico
• Si chiama calore specifico di una sostanza la quantità di
calore che bisogna fornire a un grammo della sostanza per
aumentare la sua temperatura di un grado centigrado.
Valori in joule per grammo per
grado centigrado J/(g · °C) del
calore specifico di alcuni
elementi e composti.
Calore latente
• Si chiama calore latente di fusione la
quantità di calore che bisogna fornire a un
grammo di un solido alla temperatura di
fusione per farlo fondere.
• Si chiama calore latente di vaporizzazione la
quantità di calore che bisogna fornire a un
grammo di liquido alla temperatura di
ebollizione per farlo passare allo stato di
vapore.
Entalpia
• Le trasformazioni fisiche e le reazioni chimiche
sono quasi sempre accompagnate da variazioni
energetiche dei corpi. Il contenuto in calore di
una sostanza, a pressione costante e riferito a
una mole, è chiamato entalpia e viene indicato
con H.
• Il passaggio diretto dallo stato solido allo
stato aeriforme si chiama sublimazione.
• Il passaggio inverso è detto brinamento.
La liofilizzazione: medicinali,caffè, latte, agrumi, carne e
tanti altri prodotti vengono prima sciolti in acqua,
raffreddati e congelati; poi il solido è sottoposto a un
vuoto molto spinto. Il ghiaccio sublima e tutta l acqua in
questo modo se ne va. Rimane il liofilizzato, un solido
spugnoso, non alterato e facilmente solubile.
Curve di riscaldamento
Il grafico indica come
varia la temperatura di
un corpo in base al
calore fornito. Il corpo,
in partenza solido, si
scalda, fonde e diventa
liquido, continua a
scaldarsi, bolle e
diventa vapore, si
scalda ancora e infine
diventa gas. La
lunghezza dei segmenti
del grafico dipende dal
valore del calore
specifico e del calore
latente.
Distillazione
• Si chiama distillazione il processo che permette di separare i
componenti di una miscela liquida, sfruttando il loro diverso
punto di ebollizione e condensando separatamente i vapori.
Colonne di rettifica