CORSO DI LAUREA IN SCIENZE GEOLOGICHE
CHIMICA GENERALE INORGANICA CON ELEMENTI DI ORGANICA
ANNO ACCADEMICO 2014/15
Docente: Dott.ssa Antonella Cartoni
e-mail : [email protected]
Studenti target: I anno I semestre
Livello dell’Unità: Formative di base
Pre-requisiti: conoscenze di matematica scuola secondaria secondo grado
Crediti: 12
Descrizione dei contenuti
Introduzione alla chimica. Molecole e atomi. Sostanze pure. Miscele omogenee ed eterogenee di
sostanze. Proprietà fisiche e proprietà chimiche. Il metodo scientifico. Sistema internazionale delle unità
di misura (SI), grandezze fisiche fondamentali e derivate. Simboli, valori numerici e unità di misura.
Concetto di mole. Analisi elementare. Formula minima e formula molecolare (principio di Avogadro e
legge degli atomi di Cannizzaro). Formula di struttura e stereochimica. Numero di ossidazione.
Nomenclatura chimica. Reazioni chimiche e loro bilanciamento (Esercitazioni).
Struttura dell’atomo: modelli atomici. Condizioni di quantizzazione, numeri quantici. Dualismo ondacorpuscolo. Orbitali, significato e rappresentazione geometrica. Principi della minima energia, della
massima molteplicità, di esclusione. Aufbau. Periodicità nella configurazione elettronica periferica.
Proprietà periodiche degli elementi: raggi atomici e ionici, potenziali di ionizzazione, affinità
elettronica. Sistema periodico.
Legame chimico: teoria del legame di valenza (VB). Legame covalente, omeopolare e polare, legame
dativo. Legami semplici, doppi, tripli (sigma e pigreco). Elettronegatività. Legame ionico, energia
reticolare. Ibridazione e forma delle molecole. Risonanza, forme di risonanza, delocalizzazione
elettronica, energia di risonanza. Esempi di strutture molecolari interpretate secondo la teoria VB. Il
metodo VSEPR. Valenza e sistema periodico. Legami intermolecolari:dipoli molecolari permanenti,
indotti, istantanei. Forze di van der Waals. Legame idrogeno: caratteristiche e proprietà legate alla
presenza del legame idrogeno.
Stato Gassoso: Leggi empiriche dello stato gassoso: legge isoterma di Boyle, legge isocora e isobara,
equazione di stato. Principio di Avogadro. Modello ideale ed equazione di stato. Teoria cinetica dei gas.
Miscele gassose, legge di Dalton. Pressioni e volumi parziali, frazioni molari. Legge di Graham. Curva
di distribuzione di Maxwell-Boltzmann delle velocità. Gas reali, deviazioni dal comportamento ideale.
Equazione di van der Waals. (Esercitazioni)
Stato liquido e sue proprietà.
Soluzioni: definizioni, omogeneità, scale di concentrazione. Processo di solubilizzazione, soluzioni
ideali. Proprietà delle soluzioni ideali, legge di Raoult, deviazioni positive e negative. Proprietà
colligative:abbassamento crioscopico, innalzamento ebullioscopico, osmosi, pressione osmotica.
(Esercitazioni).
Stato solido: Solidi ionici, covalenti, molecolari
Elementi di termodinamica: sistemi aperti, chiusi, isolati. Parametri di stato, funzioni di stato.
Trasformazioni reversibili e irreversibili. Trasformazioni isoterme, isobare, isocore, adiabatiche. Calore,
lavoro, energia interna. Primo principio, entalpia, legge di Hess. Secondo principio, entropia.
Trasformazioni adiabatiche ed equilibrio. Significato statistico dell’entropia: ordine – disordine. Energia
libera: variazione di energia libera e spontaneità di una trasformazione.
Equilibri chimici omogenei ed eterogenei. Costante d’equilibrio e dipendenza dalla temperatura:
equazione di van’t Hoff. Diagrammi di stato (acqua, anidride carbonica): l’equazione di ClausiusClapeyron. Principio di Le Chatelier. (Esercitazioni).
Elettroliti (forti e deboli) e non elettroliti. Equilibrio chimico in soluzioni acquose. Prodotto ionico
dell’acqua e pH. Acidi e basi. Idrolisi e soluzioni tampone. Sali poco solubili. Equilibri di solubilità.
Solubilità di gas in acqua. Legge di Henry. (Esercitazioni)
Elettrochimica. Elettrolisi. Equazione di Nernst e forza elettromotrice di una pila. (Esercitazioni)
Cenni di cinetica chimica. Il grado di avanzamento di una reazione. La velocità di una reazione ed i
fattori da cui dipende. Energia di attivazione. Catalizzatore di una reazione chimica.
Cenni di chimica nucleare e radiochimica. (Questo argomento non viene chiesto nella prova d’esame)
Chimica descrittiva: Tavola periodica. Generalità sugli elementi, visti in funzione della loro posizione
nel sistema periodico e con particolare riferimento al primo e al secondo periodo.
Elementi di chimica organica. Principali classi di composti organici e loro proprietà chimiche.
Competenze da sviluppare e risultati di apprendimento attesi
Obiettivi formativi
Gli obiettivi formativi consistono nella conoscenza degli aspetti fondamentali della chimica per
affrontare con solide basi i successivi insegnamenti del corso di laurea.
Risultati dell’apprendimento:
Conoscenze della chimica e delle leggi che regolano le trasformazioni chimiche
Competenze acquisite: Lo studente deve conoscere la struttura dell’ atomo e delle molecole. Deve
saper scrivere le formule dei composti chimici e conoscere il loro comportamento. Deve conoscere le
proprietà dei gas, dei liquidi e delle soluzioni e avere una base di termodinamica e di cinetica chimica.
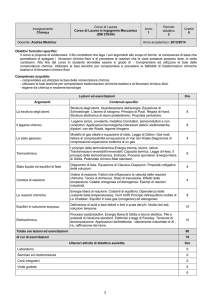
CONTENUTO
(CFU)
9
3
Ore in aula
Lezioni
frontali
Esercitazioni
numeriche
Ore studente a Ore studente Verifiche del
casa
totali
profitto
72
36
Prova scritta e
Prova orale
Valutazione finale
L’esame finale consiste in una prova scritta (da superare con una votazione di almeno 18/30) e di
una prova orale che dovrà essere svolta entro la sessione.
.
Prova scritta: argomenti trattati durante le esercitazioni; Prova orale: tutti gli argomenti del programma
Testi consigliati: Si raccomanda l'uso di un testo universitario di Chimica Generale e Inorganica.
Esempi: J. C. Kotz, P. M. Treichel e J. R. Townsend, Chimica, IV edizione, 2009, EdiSES; P. Zanello, R.
Gobetto, R. Zanoni, Conoscere la Chimica, I edizione, 2009, CEA. Appunti delle lezioni. Ulteriori
indicazioni saranno date a lezione. Per le esercitazioni si consiglia: P. Michelin Lausarot, G. A. Vaglio
Stechiometria (PICCIN) ma anche altri testi sono ugualmente validi.