IL LEGAME COVALENTE SECONDO LA MECCANICA ONDULATORIA
L’elettrone è dissolto in una nube di carica, ovvero il concetto di orbitale sostituisce il • di Lewis
LEGAME DI VALENZA (VB)
Sviluppo quantomeccanico dell’idea di Lewis che il legame covalente fra due atomi sia dovuto alla
messa a comune di una o più coppie di elettroni.
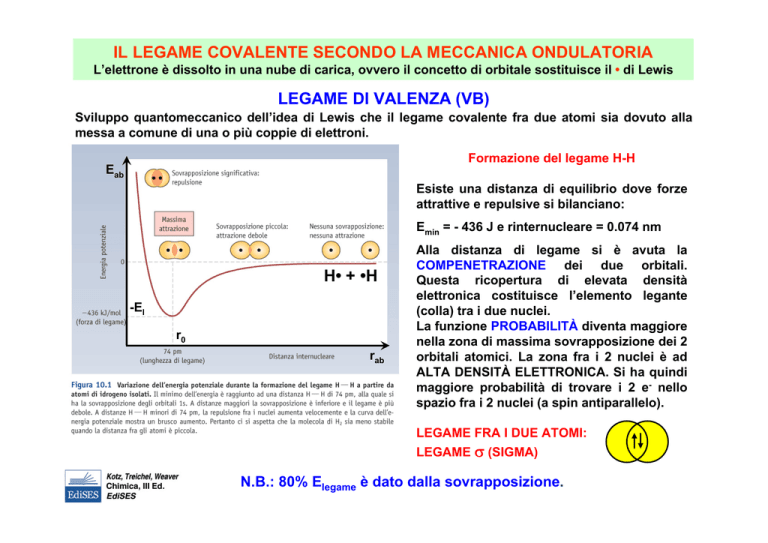
Formazione del legame H-H
Eab
Esiste una distanza di equilibrio dove forze
attrattive e repulsive si bilanciano:
Emin = - 436 J e rinternucleare = 0.074 nm
H• + •H
-El
r0
rab
Alla distanza di legame si è avuta la
COMPENETRAZIONE dei due orbitali.
Questa ricopertura di elevata densità
elettronica costituisce l’elemento legante
(colla) tra i due nuclei.
La funzione PROBABILITÀ diventa maggiore
nella zona di massima sovrapposizione dei 2
orbitali atomici. La zona fra i 2 nuclei è ad
ALTA DENSITÀ ELETTRONICA. Si ha quindi
maggiore probabilità di trovare i 2 e- nello
spazio fra i 2 nuclei (a spin antiparallelo).
LEGAME FRA I DUE ATOMI:
LEGAME σ (SIGMA)
N.B.: 80% Elegame è dato dalla sovrapposizione.
LEGAME σ (SIGMA)
SOVRAPPOSIZIONE DEGLI ORBITALI ATOMICI LUNGO L’ASSE CHE CONGIUNGE I DUE NUCLEI.
LEGAME σ NON POLARE
densità di carica distribuita
uniformemente
LEGAME σ POLARE
densità di carica NON
distribuita uniformemente
δ+
δ-
LEGAME π (P GRECA)
SOVRAPPOSIZIONE DI DUE ORBITALI ATOMICI P PARALLELI FRA LORO E PERPENDICOLARI
ALL’ASSE CONGIUNGENTE I DUE NUCLEI (LEGAME σ)
ZONA DI SOVRAPPOSIZIONE SOPRA E SOTTO IL PIANO CONTENENTE
I DUE NUCLEI.
QUINDI:
I LEGAMI SEMPLICI SONO LEGAMI σ
IL DOPPIO LEGAME È LA SOMMA DI UN LEGAME σ E UN
LEGAME π.
IL TRIPLO LEGAME È LA SOMMA DI UN LEGAME σ E DUE
LEGAMI π.
LEGAME DOPPIO: 1σ + 1π
Es: C=O
CA = 1s2 2s2 2p2
OA: 1s2 2s2 2p4
C
+1
1
σ
O
π
LEGAME TRIPLO: 1σ + 2π
Es: N≡N
NA = 1s2 2s2 2p3
NA: 1s2 2s2 2p3
N
N
IBRIDIZZAZIONE DEGLI ORBITALI ATOMICI: ORBITALI IBRIDI
Le molecole BIATOMICHE (H2, N2, Cl2, F2, HCl, HBr, etc.) si spiegano bene con la sovrapposizione di
orbitali puri (s + s = σ; s + p = σ; p + p = π), ma per molecole POLIATOMICHE (BeCl2, BF3, CH4, NH3,
H2O, etc.) la teoria V.B. è in disaccordo con i dati sperimentali, sia per quanto concerne il n° di legami,
sia per gli atomi di legame.
LA TEORIA V.B. DICE CHE:
a) ogni atomo deve contribuire al legame con un elettrone (tipico legame covalente)
b) uno solo dei due atomi può fornire una coppia di elettroni
atomo (accettore) con un orbitale vuoto
(donatore) ad un altro
Quindi:
n° di legami che un atomo può formare è uguale al n° di elettroni spaiati + eventualmente il numero
delle coppie di non legame, se ci sono atomi accettori.
Atomo
centrale
Orbitali
atomici
Esempio
V.B.
n°legami
Α
V.B.
n° legami
osservato
α
osservato
Be
BeCl2
0
-
2
180°
B
BF3
1
-
3
120°
C
CH4
2
90°
4
109.5°
N
NH3
3
90°
3
107°
O
H2O
2
90°
2
105°
F
HF
1
-
1
-
Ne
Ne
0
-
0
-
A - I composti di Be, B e C
sono in disaccordo con
V.B. sia per n° di legami
che per angolo di legame.
B - I composti di N e O
sono in disaccordo con
V.B. per gli angoli di
legame.
C - Solo i composti del F
(HF = molecola biatomica)
sono in accordo con V.B.
Gli ORBITALI ATOMICI PURI non sono in grado di descrivere i legami covalenti nelle molecole con
più di due atomi. Occorrono NUOVI ORBITALI detti ORBITALI IBRIDI.
ORBITALI IBRIDI: COMBINAZIONE LINEARE DI ORBITALI ATOMICI s, p, d
Sono anch’essi soluzioni dell’equazione d’onda
Combinazione lineare: x orbitali atomici di energia poco diversa [ns, np, (n-1)d] forniscono lo stesso
numero x di ORBITALI IBRIDI ISOENERGETICI.
IMPORTANTE: nella formazione degli orbitali ibridi, all’orbitale s, sempre presente, si somma il
numero degli orbitali p e d per ottenere il numero desiderato di legami σ e di coppie solitarie. La
direzione spaziale degli orbitali ibridi corrisponde a quella prevista dalla teoria VSEPR (direzione
nello spazio di orbitali ibridi uguale alla direzione nello spazio di coppie CL + CS).
Quando un atomo forma x legami con altri atomi
ridistribuisce la sua densità elettronica (quasi
sferica) in definite direzioni (teoria VSEPR). Gli
orbitali atomici puri non danno questa geometria.
Occorre riformulare nuovi orbitali (cioè nuove
funzioni d’onda) in grado di rappresentare la
nuova distribuzione di carica negativa attorno ad
un atomo, quando impegnato nella formazione di
legami.
Ibridi sp3
La combinazione lineare di 1 orbitale s + 3 orbitali
p porta alla formazione di 4 nuovi orbitali
isoenergetici disposti secondo i vertici di un
tetraedro.
ORBITALI IBRIDI: COMBINAZIONE LINEARE DI ORBITALI ATOMICI s, p, d
Ibridi sp2
La combinazione lineare di 1 orbitale s + 2
orbitali p porta alla formazione di 3 nuovi
orbitali isoenergetici disposti a 120°
BF3
Ibridi sp
La combinazione lineare di 1 orbitale s + 1
orbitale p porta alla formazione di 2 nuovi orbitali
isoenergetici disposti a 180°
Cl
Be
Cl
ORBITALI IBRIDI: COMBINAZIONE LINEARE DI ORBITALI ATOMICI s, p, d
Ibridi sp3d e sp3d2
La combinazione lineare di 1 orbitale s + 3 orbitali p e 1 orbitale d porta alla formazione di 5 nuovi
orbitali isoenergetici disposti secondo i vertici di una bipiramide trigonale ⇒ sp3d.
La combinazione lineare di 1 orbitale s + 3 orbitali p e 2 orbitale d porta alla formazione di 6 nuovi
orbitali isoenergetici disposti secondo i vertici di un ottaedro⇒ sp3d2.
LEGAME COVALENTE SECONDO LA TEORIA O.M.
O.M. = ORBITALI MOLECOLARI = combinazione lineare di orbitali atomici (LCAO).
È possibile con questa teoria spiegare la struttura elettronica di molecole che non seguono l’assunto
dell’accoppiamento di elettroni su cui si basa l’approccio della teoria di Lewis e della teoria V.B. In
particolare la teoria O.M. spiega perché la MOLECOLA O2 è PARAMAGNETICA e il LEGAME
METALLICO.
Come visto nella teoria V.B. I legami (CL) e le
coppie solitarie (CS) sono LOCALIZZATI e gli
ORBITALI IBRIDI (che rappresentano CL + CS)
sono MONOCENTRICI.
Nella teoria O.M. si assume che gli orbitali
atomici puri s e p (dello strato di valenza) si
combinino nella molecola per formare NUOVI
ORBITALI MOLECOLARI che abbracciano tutti i
A
C
B
nuclei presenti, ovvero ESETESI SU TUTTA LA
MOLECOLA.
ORBITALI MOLECOLARI sono POLICENTRICI:
perdono la loro individualità e sono delocalizzati
sull’intera molecola.
O.M.: si considerano i vari nuclei degli atomi della molecola fissi nelle loro posizioni di equilibrio e si
cercano le FUNZIONI D’ONDA MOLECOLARI (ΨMO = combinazione lineare orbitali atomici) che
descrivono il comportamento degli elettroni in tale sistema (non più intorno all’atomo ma alla
molecola). Ψ2MO permette di visualizzare le zone di probabilità elettronica.
·
·
V.B.
=
ORBITALI
IBRIDI
MONOCENTRICI: conservano
la propria individualità attorno
ad ogni singolo atomo: CL
localizzata fra i due atomi.
O.M. = ORBITALI MOLECOLARI
POLICENTRICI (perdono la loro
individualità
perché
sono
delocalizzati sull’intera molecola:
CL delocalizzata sulla molecola.
REGOLA LCAO PER OTTENERE ORBITALI MOLECOLARI
LCAO: Linear Combination of Atomic Orbitals
1)
LCAO solo di orbitali atomici con energia simile (ns, np, (n-1)d): solo orbitali atomici di valenza,
perchè gli elettroni più interni non partecipano al legame.
2)
LCAO di N orbitali ATOMICI dà N orbitali MOLECOLARI. LCAO di 2 orbitali atomici porta alla
formazione di 2 orbitali molecolari, la cui energia media è simile all’energia media degli orbitali
atomici di partenza.
MO*
E
EAO
orbitali atomici
MO
3)
Stabiliti i LIVELLI ENERGETICI si procede al loro riempimento, seguendo sempre il criterio
AUFBAU, ovvero la regola di massima molteplicità di HUND e il principio di esclusione di PAULI.
4)
ORDINE DI LEGAME = (n° elettroni LEGANTI – n° elettroni NON LEGANTI) / 2
Quindi:
ordine 0 = quella molecola non può esistere
ordine 1 = legame singolo
ordine 2 = legame doppio
ordine 3 = legame triplo
MOLECOLA DI H2 SECONDO LA TEORIA OM (ORBITALE MOLECOLARE)
Ψ*OM = [ΨA(1s) - ΨB(1s)]
LCAO dei due orbitali 1s dei due
atomi di idrogeno HA e HB
interferenza distruttiva
ΨOM = [ΨA(1s) + ΨB(1s)]
interferenza costruttiva
ΨOM = funzione d’onda molecolare (senza significato fisico)
Ψ2OM = funzione PROBABILITÀ: VISUALIZZA le zone di probabilità elettronica.
Ψ*2OM = [Ψ2A(1s) - 2ΨA(1s) ΨB(1s) + Ψ2B(1s)] = ORBITALE MOLECOLARE DI ANTILEGAME
Ψ2OM
Ψ2OM = [Ψ2A(1s) + 2ΨA(1s) ΨB(1s) + Ψ2B(1s)] = ORBITALE MOLECOLARE DI LEGAME
Ψ*2OM = σ*1S (orbitale di antilegame: non c’è carica elettrica tra i due atomi HA e HB (-2ΨA(1s) ΨB(1s) )
Ψ2OM = σ1S (orbitale di legame: c’è addensamento di carica elettrica tra HA e HB (+2ΨA(1s) ΨB(1s) )
MOLECOLA DI H2 SECONDO LA TEORIA OM (ORBITALE MOLECOLARE)
ORDINE DI LEGAME = 2/2 = 1
Energia potenziale di un
orbitale σ e σ* in funzione
della distanza
Densità elettronica lungo l’asse di
legame per la molecola di H2
MOLECOLA DI H2 SECONDO LA TEORIA OM (ORBITALE MOLECOLARE)
MOLECOLE BIATOMICHE OMONUCLEARI CON n = 2
σ* orbitale antilegante
σ*
in antifase
Orbitali s
in fase
orbitale
antilegante
in antifase
σ
orbitale
legante
σ orbitale legante
Orbitali p
in fase
Orbitali molecolari sigma legante e antilegante che
si formano per sovrapposizione di due orbitali p.
in antifase
N2
N≡N
ORDINE DI LEGAME
(8-2)/2 = 3
in fase
Orbitali p
ORBITALI MOLECOLARI CHE SI FORMANO
IN MOLECOLE BIATOMICHE DEL
SECONDO PERIODO
π*
orbitale
antilegante
π
orbitale
legante
Orbitali molecolari pi greco (π) legante e antilegante
che si formano per sovrapposizione laterale di due
orbitali p.
LA TEORIA DEGLI ORBITALI MOLECOLARI SPIEGA PERCHÈ O2 È
PARAMAGNETICO.
••
•O
••
••
O•
••
orbitali
molecolari
orbitali
atomici
orbitali
atomici
π* 2py π* 2pz
2p
Energia
σ* 2px
2p
π 2py π 2pz
Oa
σ 2px
Oa
σ* 2s
2s
2s
σ 2s












