Corso di Progettazione Ambientale – prof. Fabio Peron
Gli stati di aggregazione della materia
Fabio Peron
Università IUAV - Venezia
Gli stati di aggregazione della materia
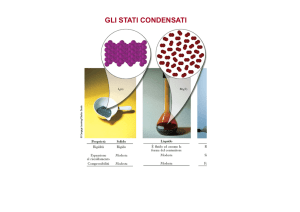
SOLIDO
Forma e volume
propri
LIQUIDO
Forma del
recipiente in cui è
contenuto, ma
volume proprio
GASSOSO
Forma e volume
del recipiente in
cui è contenuto
Gli stati di aggregazione della materia
Il solido
• ha una forma e un volume proprio;
• le molecole sono in posizione fissa e sono “vicine” le une alle altre;
interazioni intermolecolari forti;
• si ha ordine a lungo raggio (reticolo cristallino);
• ha maggiore densità rispetto a liquidi e gas
Il liquido
• ha un proprio volume ma non una propria forma;
• le distanze tra molecola e molecola non sono molto diverse da quelle del
solido;
• interazioni intermolecolari abbastanza forti;
• si ha un certo livello di ordine, ma solo a corto raggio;
• le molecole sono libere di scorrere le une sulle altre
Il gas
• non ha ne forma ne volume proprio;
• occupa tutto il volume che ha a disposizione;
• le molecole sono “lontane “ le une dalle altre;
• non si ha ordine;
• interazioni intermolecolari deboli;
• le molecole si muovono liberamente;
Trasformazioni di stato
• solido
liquido:
fusione o liquefazione
• liquido
solido:
solidificazione
• solido
aeriforme:
sublimazione
• liquido
aeriforme:
evaporazione
• aeriforme
liquido:
condensazione
Trasformazioni di stato
Trasformazioni di stato
Diagramma T-v, pressione atmosferica
Trasformazioni di stato
Diagramma T-v diverse pressioni
Diagrammi di stato
Si individuano tre zone:
a bassi volumi specifici il
liquido sottoraffreddato,
sotto la campana coesistenza
di liquido e vapore
a elevati volumi specifici il
vapore surriscaldato
Diagramma T-v
diagrammi di stato
Si individuano tre zone:
a bassi volumi specifici il
liquido sottoraffreddato,
sotto la campana coesistenza
di liquido e vapore
a elevati volumi specifici il
vapore surriscaldato
Diagramma p-v
diagrammi di stato
Diagramma T-p
diagrammi di stato
I diagrammi presentati sono una finestra su un diagramma più esteso in cui si
trovano anche le zone di equilibrio del solido, la coesistenza solido liquido e quella
solido-vapore e la linea del punto triplo.
diagrammi di stato
Nello spazio delle grandezze p, v, T
fissate due di esse (es. T e v) la
terza p è fissata secondo una
funzione p=p(T, v) ed è
rappresentata da una superficie pv-T i cui punti rappresentano tutti i
punti di equilibrio della sostanza
(combinazione di tre valori delle
tre grandezze).
I diagrammi visti corrispondono a
proiezioni bidimensionali di questo
diagramma di stato “globale”.
La regola delle fasi di Gibbs
Lo stato di un sistema composto da più componenti presenti in diverse fasi è
individuato in maniera completa da un numero V di grandezze di stato intensive che
è in relazione al numero di componeneti C e fasi F secondo la relazione (Regola di
Gibbs):
V=C–F+2
Miscela O2 e H2 gassosa:
Una massa di acqua liquida o
un certo volume di N2 gassoso:
V=1–1+2=2
V=2–1+2=3
Come vaporizzare un liquido?
Pressione costante: aumentando la temperatura
vapore
vapore
liquido
liquido
Q
Q
Q
D
p
T
B
B
D
A
C
C
A
v
v
Come vaporizzare un liquido?
Temperatura costante: diminuendo la pressione
vapore
vapore
liquido
p
liquido
A
T
B
C
B
D
A
D
v
C
v
Il calore latente
Nei passaggi di stato solido ⇒ liquido, liquido ⇒ vapore è necessario fornire
dell’energia che viene impiegata per rompere/allentare i legami tra le
molecole.
Nelle trasformazioni “inverse” liquido ⇒ solido e vapore ⇒ liquido vengono
rilascate le stesse quantità di calore assorbite nella trasformazione inversa.
Perciò il calore latente di vaporizzazione per una particolare sostanza è
esattamente uguale al calore di condensazione.
Questa energia che viene scambiata sotto forma di calore non fa cambiare
la temperatura e viene chiamata latente. Facendo riferimento all’unità di
massa si parla di calore latente di liquefazione e di calore latente di
vaporizzazione, essi sono tipici di ciascuna specie chimica e son espressi
in [J/kg].
Il calore latente
fluido
r
[kJ/kg]
cpL
[kJ/(kgK)]
cpV
[kJ/(kgK)]
ammoniaca 0°C - 4,29 bar
1261,8
4,617
2,660
acqua
0°C - 0,0061 bar
2500,5
4,229
1,868
R134a
0°C - 2,93 bar
198,8
1,335
0,883
R22
0°C - 4,98 bar
204,9
1,171
0,744
In generale il calore latente ha valori molto grandi rispetto ai calori
specifici delle sostanze in fase liquido e gas.
Il calore latente
In generale il
calore latente
ha valori molto
grandi rispetto
ai calori
specifici delle
sostanze in fase
liquido e gas.
Calore latente dell’acqua
Cambiamenti di stato dell’acqua
Energia e acqua
La pressione di vapore
Diagramma T-p
La pressione di vapore
Tsat = f (psat)
psat = f (Tsat)
ln (psat )= A – B / T
A e B costanti
che dipendono dal fluido
Diagramma T-p
La pressione di vapore per l’acqua
Pressione
[Pa]
Tsat
[°C]
Quota
[m]
Pressione
atmosferica
[Pa]
Tsat
[°C]
≈ 100000
≈ 100
0
101325
100
≈ 150000
≈ 110
1000
89550
96.3
≈ 200000
≈ 120
2000
79500
93.2
≈ 300000
≈ 130
5000
54050
83.0
10000
26500
66.2
20000
5530
34.5
Pressione di saturazione e tensione di vapore
La pressione di saturazione per le sostanze pure è legata all’equilibrio-vapore. Un
liquido tende a mettersi in equilibrio con il suo vapore. La pressione a cui si
stabilisce tale equilibrio viene detta tensione di vapore alla temperatura
considerata
Pressione di saturazione e tensione di vapore
Un liquido tende a mettersi in equilibrio con il suo vapore. La pressione a cui si
stabilisce tale equilibrio viene detta tensione di vapore alla temperatura
considerata
La pressione di vapore
Diagramma T-p
Applicazioni
Un liquido che evapora “estrae” calore da ciò con cui è a contatto. Evaporare
significa raffreddare.
Applicazioni
Un fluido che evapora e
condensa all’interno di un tubo
può trasportare calore da un
punto a un altro. Si parla di
Heat Pipes.
Applicazioni: sublimazione
• solido - aeriforme:
sublimazione