ELEMENTI DI
EZIOPATOGENESI
DELLE
MALATTIE UMANE
Corso di Laurea
Magistrale in Farmacia
IL CUORE
Muscolo cavo, situato nella
cavità toracica tra i polmoni,
dietro lo sterno e sopra il
diaframma; con i suoi
movimenti di contrazione e
distensione
permette la
circolazione del sangue.
Ha una forma quasi conica
leggermente asimmetrica
con l’apice rivolto verso
sinistra.
IL CUORE
endocardio
La muscolatura
La muscolatura
IL CUORE- atri e ventricoli
Il cuore contiene quattro cavità
atri: due superiori;
ventricoli: due inferiori.
I due atri sono separati dal setto interatriale, i due ventricoli dal setto interventricolare.
Le arterie sono i vasi sanguigni che portano il sangue lontano dal cuore.
Le vene riportano il sangue al cuore.
IL CUORE – la trasmissione nervosa
Sylvia S. Mader Immagini e concetti della biologia © Zanichelli editore, 2012
IL CUORE la circolazione
tre fattori di regolazione omeostatica
IL CUORE – pressione sanguigna
Il sangue scorre nei circuiti grazie a un’adeguata pressione sanguigna
Sylvia S. Mader Immagini e concetti della biologia © Zanichelli editore, 2012
IL CUORE – pressione sanguigna
SANGUE
VASI
CUORE
IL CUORE – pressione sanguigna
Il volume di sangue emesso ogni minuto dal ventricolo
sinistro nell’aorta è definito gittata cardiaca.
La gittata cardiaca è determinata da:
gittata sistolica: sangue emesso dal ventricolo sinistro
durante ogni battito;
frequenza cardiaca: numero di battiti al minuto
I fattori più importanti nella regolazione della frequenza
cardiaca sono il sistema nervoso autonomo e gli ormoni
adrenalina e noradrenalina, rilasciati dalle ghiandole surrenali.
IL CUORE – pressione sanguigna
La regolazione del cuore da parte del sistema nervoso ha luogo
nel centro cardiovascolare (CV), situato nel midollo allungato.
Da esso partono i neuroni simpatici che raggiungono il cuore
attraverso i nervi cardiaci acceleratori, come anche i neuroni
parasimpatici che raggiungono il cuore attraverso i nervi vaghi.
Alcune sostanze che influenzano sia la fisiologia sia il ritmo
che contrazione
Ormoni: adrenalina e noradrenalina aumentano la frequenza
cardiaca e la forza delle contrazioni;
Ioni: diminuiscono la frequenza cardiaca e la forza della
contrazione.
IL CUORE – pressione sanguigna
Il sangue è un tessuto connettivo fluido composto da:
una parte fluida – PLASMA
una parte corpuscolata: leucociti, eritrociti, piastrine
La percentuale di volume sanguigno complessivo occupato
dai globuli rossi è definito ematocrito.
IL CUORE – pressione sanguigna
La resistenza vascolare è la resistenza che incontra il flusso sanguigno
lungo le pareti dei vasi, dipende da
1. ampiezza del lume;
2. viscosità del sangue;
3. lunghezza complessiva del vaso sanguigno.
REGOLAZIONE
riflesso dei barocettori consente una regolazione rapida della pressione
sanguigna
chemiocettori sono situati nei due glomi carotidei nelle arterie carotidi comuni
e nel glomo aortico nell’arco aortico
il sistema renina-angiotensina-aldosterone (RAA)
adrenalina e noradrenalina
ormone antidiuretico (ADH)
peptide antidiuretico atriale (ANP)
Nelle patologie cardiache due fattori sono fondamentali
diagnosi
terapia
Developing an Interdisciplinary Model
of Care in a Progressive Medical Care Unit
American Association of Critical-Care Nurses , 2012
ISCHEMIA CARDIACA
ISCHEMIA CARDIACA
L’ischemia si manifesta quando la richiesta di O2
del tessuto miocardico supera l’apporto
ANGINA PECTORIS
ridotto flusso sanguigno al muscolo cardiaco, per un breve periodo di
tempo (dell’ordine di pochi minuti).
A differenza dell’infarto, non si instaura un danno miocardico permanente,
poiché il deficit di ossigeno si verifica per un tempo troppo breve.
INFARTO MIOCARDICO
ridotto apporto di sangue, detto ischemia, per un
intervallo di tempo superiore ai venti minuti, che
provoca un danno permanente al cuore
L’ infarto miocardico acuto (IMA) è una sindrome clinica conseguente
all'occlusione improvvisa e prolungata di un ramo arterioso
coronarico che determina la necrosi ischemica delle cellule
miocardiche correlate alla coronaria occlusa.
L' occlusione coronarica nel 90% dei casi è
trombotica e nel 10% dei casi consegue a
condizioni diverse non trombotiche. La necrosi
ischemica ha inizio 20 minuti dopo l' occlusione
coronarica.
Nel giro di poche settimane la zona infartuata (una zona di tessuto miocardico
morta, necrotizzata) si trasforma in una cicatrice fibrosa.
Se l’infarto è piccolo il cuore mantiene le restanti pareti inalterate, e la cinesi viene
conservata. Se l’infarto è esteso, il cuore perde una parte della capacità contrattile,
e può apparire alterato anche nelle zone non infartuate.
Sindrome che riunisce le diverse manifestazioni cliniche della
CARDIOPATIA ISCHEMICA
La SCA riunisce diverse manifestazioni cliniche della cardiopatia ischemica.
Comprende tre principali quadri clinici:
1. IMA, con sopraslivellamento del tratto ST (STEMI=ST elevation
myocardial infarction): prima classificato infarto subepicardico.
Dovuto a occlusione (o sub-occlusione severa) del vaso coronarico
2. IMA, senza sopraslivellamento del tratto ST (NSTEMI=Non-ST
elevation myocardial infarction): prima
classificato infarto
subendocardico. Dovuto a occlusione incompleta o transitoria del
vaso coronarico
3. Angina pectoris o instabile. Il quadro clinico è dovuto a stenosi
coronariche, che ad intermittenza creano una riduzione del flusso di
sangue
ANGINA STABILE
Deriva da sforzi/condizioni (emozionali) costanti
riproducibili, non tende ad aggravamento o
peggioramento per frequenza e gravità nel tempo.
ANGINA INSTABILE
(Sindromi Ischemiche a carattere evolutivo)
• angina progressiva intensità
• angina a riposo di lunga durata
• angina post-infartuale (dopo 24 h da IMA)
• inefficacia terapia medica massimale
e
a
INFARTO MIOCARDICO
Improvvisa e prolungata discrepanza fra richiesta di O2 e capacità
dei vasi coronarici di apporto, caratterizzato da:
• segni clinici (dolore, prolungato, precordiale)
• ECG (onde Q, sopraslivellamento del tratto ST, inversione
dell’onda T)
• Ematochimica (rialzo di CPK, CPK-MB, Troponine)
• Ecocardiogramma e studio emodinamico
La topografia è in funzione della sede dell’ostruzione e
del modello di circolo coronarico
Universal Definition of Myocardical Infarction , K. Thygesen et all., Circulation 2007;116;2634-2653
EZIOPATOGENESI
Coronaropatia aterosclerotica (95%)
Cause non aterosclerotiche:
- Embolia
- Stenosi ostiale da lue
- Aneurisma dissecante (primario o secondario)
- Arteriti (panarteriti, Kawasaki)
- Origine anomala delle coronarie
- Stenosi valvolare aortica serrata
- Aneurismi coronarici
“le prestazioni che fanno parte dell’assistenza erogata non possono essere
considerate essenziali se non sono appropriate”
SN 2003-2005 Normativa LEA
Un esame è appropriato quando ha la capacità di modificare
l’outcome o la decisione medica
Learning Organization
APPROPRIATEZZA
VUOL DIRE
MEZZI
DI CONTROLLO
fare le cose giuste
Applicazione criteri EBLM
al momento giusto
Finestra Diagnostica
nel modo migliore
Metanalisi
per chi ne ha bisogno
Plausibilità e finalità del test
con competenza clinica
(clinico, patologo clinico, paziente)
ISO 15189
APPROCCIO DIAGNOSTICO
APPROCCIO DIAGNOSTICO
PROBABILITA’ DI UNA PERSONA SANA DI AVERE TUTTI I
RISULTATI DEI TEST ENTRO I VALORI DI RIFERIMENTO
NUMERO DI TEST RICHIESTI
PROBABILITA’ %
1
95
6
74
12
54
20
36
100
0,6
J.O. Westgard,T. Dancy. Clinica Chimica Acta 2004
Anamnesi
APPROCCIO AL PAZIENTE CON SCA
I dati anamnestici per sospetta SCA possono essere
importanti per la diagnosi o il trattamento ed in particolare:
pregressa diagnosi di malattia coronarica
pregressa diagnosi di arteriopatia
pregresso riscontro di fattori di rischio per malattia
coronarica (diabete, ipertensione arteriosa, dislipidemia,
tabagismo, familiarità per patologia cardiovascolare)
recente consumo di farmaci e droghe (cocaina)
controindicazioni
anticoagulante.
alla
trombolisi
o
alla
terapia
Anamnesi
APPROCCIO AL PAZIENTE CON SCA
Il riconoscimento precoce della presenza di
danno miocardico nel paziente con sospetta
sindrome coronarica acuta è essenziale nella
scelta di percorsi diagnostici e terapeutici atti
a migliorare sensibilmente la prognosi del
paziente.
D’altro canto l’esclusione della presenza di danno miocardico nel
paziente è altrettanto importante perché indirizza il paziente con
dolore toracico verso percorsi diagnostici e terapeutici diversi che
portano ad evitare ricoveri impropri in reparti ad elevata
specialità e riducono, per quanto possibile, la durata del ricovero.
Il Dolore Toracico
Si definisce DOLORE TORACICO “qualsiasi dolore che, si
collochi, ANTERIORMENTE tra la base del naso e l’ombelico
e, POSTERIORMENTE, tra la nuca e la 12a vertebra e che non
abbia causa traumatica o altra causa chiaramente
identificabile”
Il Dolore Toracico
Il Dolore Toracico
Il Dolore Toracico
Il Dolore Toracico - P. Angeli - Dip. Di Medicina Clinica e Sperimentale - Università di Padova
Il Dolore Toracico
Usuale localizzazione del
dolore miocardico ischemico
Mascella
Lato destro
Epigastrio
Dorso
Sedi meno frequenti del dolore miocardico ischemico
Il Dolore Toracico - P. Angeli - Dip. Di Medicina Clinica e Sperimentale - Università di Padova
Il Dolore Toracico
CARATTERISTICHE DEL DOLORE
Sede del dolore
Eventuale irradiazione: al collo, lungo il braccio sinistro, lungo
entrambe le braccia, lungo il dorso
Modalità di insorgenza: acuta o cronica
Durata: minuti, ore, giorni
Carattere: viscerale o somatico, costrittivo o lacerante o “da
strappo”
Sintomi associati: dispnea, cardiopalmo, nausea
Fattori precipitanti: l’esercizio fisico, la posizione, la relazione con
gli atti del respiro, la distanza dai pasti
Fattori allevianti: la posizione, i pasti,
Il Dolore Toracico
IL DOLORE DELLA SCA
dolore è localizzato in mezzo al torace (dolore retrosternale), nella parete
anteriore dell’emitorace sinistro (dolore precordiale), in tutta la parete
anteriore del torace o in sede infrascapolare.
Si può irradiare alla spalla sinistra, al braccio sinistro, ad ambedue le
braccia, al collo o alla scapola.
Il dolore dura da 2 a 10 minuti (angina pectoris) o più di 20 minuti
(angina instabile e infarto miocardico).
Il dolore risulta intenso, talora insopportabile.
Il dolore è di tipo oppressivo o costrittivo. A volte è urente o sordo o mal
definito ma non ha mai le caratteristiche del dolore trafittivo.
I sintomi d’accompagnamento possono essere: dispnea, cardiopalmo,
nausea, vomito, sudorazione, ansietà, agitazione psicomotoria, sensazione
di morte imminente.
Esame Obiettivo
OBIETTIVITA’ NELLA SCA
Nei pazienti con sospetta SCA possono essere importanti per la
diagnosi o il trattamento:
segni di ipoperfusione tissutale (ipotensione arteriosa,
bradicardia, alterazioni dello stato di coscienza, cute pallida,
fredda e sudata)
riscontro di una tachiaritmia
segni di insufficienza cardiaca (turgore delle vene giugulari
esterne, tachicardia, ritmo di galoppo, rantoli polmonari)
segni neurologici di lato.
Il Rischio
Martin MJ, Hutley SB, Browner WS, et al. Serum cholesterol, blood pressure and mortality: implications from a cohort of 361.662
men. Lancet 1986; 2:933-36.
Il Rischio
Martin MJ, Hutley SB, Browner WS, et al. Serum cholesterol, blood pressure and mortality: implications from a cohort of 361.662
men. Lancet 1986; 2:933-36.
Il Rischio
La presenza contemporanea di tre o più dei seguenti criteri identifica
con sufficiente accuratezza la sindrome metabolica:
VALUTAZIONE RISCHIO CARDIOVASCOLARE
Forza della Raccomandazione A
Fattore di rischio
Valore di rischio
Obesità addominale
presente
Ipertensione
presente
Colesterolo HDL
< 50 mg/dL (F) - < 40 mg/dL (M)
Colesterolo LDL
> 180 mg/dL
Trigliceridi
> 150 mg/dL
Glucosio
> 110 mg/dL
Il Rischio
MONITORAGGIO (Liv I, Forza A).
Nei soggetti che le carte del rischio o l'algoritmo pongono a
basso rischio (<5%), il profilo lipidico andrebbe ripetuto
ogni 5 anni
Per i soggetti con rischio >5%, la misura dovrebbe essere
ripetuta 3 mesi dopo aver modificato lo stile di vita e dopo
un anno dal raggiungimento degli obiettivi
European guidelines on cardiovascular disease prevention in clinical practice. Third joint task force of European and other Societies on
cardiovascular disease prevention in clinical practice. Eur Heart J 2003; 24:1601-10.
IL LABORATORIO
Marcatori cardiaci
I marcatori di danno miocardico sono molecole di natura proteica, ad attività
enzimatica o meno, presenti nella cellula miocardica, liberate in circolo a causa di
una lesione cellulare di qualsiasi natura, in genere ischemica o meccanica, e
dosabili nel siero o nel plasma con differenti metodiche analitiche.
MARKER IDEALE
-precocità o rapidità di rilascio
-sensibilità e la specificità cliniche
- efficacia
ENZIMOLOGIA DIAGNOSTICA
L’utilizzazione nella diagnostica dei dosaggi enzimatici ha avuto inizio nel
primo decennio del 1900, con le osservazioni di Wolgemuth (1908) sul
dosaggio urinario dell’amilasi in diverse patologie.
Il massimo impulso a questa branca della chimica clinica fu negli anni 30,
con gli studi di Kay, Bodansky, Gutberg e Gutman sugli enzimi epatici e
ossei e sulla attività della fosfatasi acida nelle neoplasie prostatiche.
Nel 1954 per la prima volta si mise in evidenza l’aumento delle
transaminasi nel siero di soggetti con infarto del miocardio (La Due e
Wroblesky).
Negli anni successivi la messa a punto di metodi automatizzati di larga
praticabilità e basso costo ha consentito una sempre più ampia diffusione
dei dosaggi enzimatici in chimica clinica.
ENZIMOLOGIA DIAGNOSTICA
L’uso diagnostico degli enzimi ha due contesti
principali:
- indicatori di funzionalità o di lesione di cellule o
tessuti
- marcatori di specifici deficit enzimatici nelle
malattie genetiche e genetico-metaboliche.
ENZIMOLOGIA DIAGNOSTICA
LA MISURA DEGLI ENZIMI
IN CHIMICA CLINICA DIAGNOSTICA
Gli enzimi possono essere dosati su diversi liquidi fisiologici (plasma o siero, urine,
feci, saliva, lacrime, succhi intestinali, essudati o trasudati, etc) o su cellule o
tessuti.
I contesti diagnostici generali in cui si utilizzano i dosaggi delle attività enzimatiche
sono fondamentalmente due:
1. la valutazione della quantità di enzima dismessa dalle cellule nei liquidi
fisiologici in seguito a iperproduzione o a danno cellulare. In questo caso si
osservano di regola valori in aumento.
2. la valutazione dell’attività di produzione dell’enzima, generalmente in
correlazione con una possibile mutazione della sequenza codificante, per la
diagnosi di quelle malattie genetico-metaboliche comunemente indicate come
enzimopatie. In questo caso, di regola, si osservano nei liquidi fisiologici o nelle
cellule e tessuti, attività enzimatiche in diminuzione.
ENZIMOLOGIA DIAGNOSTICA
Gli enzimi sono componenti integrali ed essenziali in tutti i processi
metabolici cellulari.
Nella cellula possono essere liberi, contenuti nel citosol, oppure essere
contenuti in organelli subcellulari come i mitocondri, o il reticolo
endoplasmico, in vescicole o granuli intracitoplasmatici (lisosomi e granuli
di zimogeno) o all’interno del nucleo cellulare. Alcuni enzimi sono localizzati
sulle membrane cellulari e ad esse legati più o meno stabilmente.
Il quadro enzimatico cellulare è correlato alla funzione svolta dalla cellula e
quindi caratteristico e specifico nelle diverse cellule e nei diversi organi.
Inoltre la concentrazione degli enzimi all’interno della cellula è di parecchie
volte (centinaia o migliaia) superiore alla concentrazione che si rileva
all’esterno di essa, nell’ECF o nel plasma.
ENZIMOLOGIA DIAGNOSTICA
La tipicità del quadro enzimatico e l’elevata concentrazione endocellulare
sono alla base dell’enzimologia diagnostica in quanto il riconoscimento
nel sangue di un aumento degli enzimi presenti in determinati tessuti
indirizza il sospetto verso una patologia di questi tessuti.
L’utilità clinica dei dosaggi enzimatici nel sangue deriva quindi :
1. dalle differenze nella concentrazione di enzimi che si osservano nei
vari tessuti
2. dalla localizzazione intracellulare degli stessi
3. dalla presenza di isoenzimi o isoforme specifici per determinati tessuti
o cellule.
ENZIMOLOGIA DIAGNOSTICA
La misura degli enzimi nella gran maggioranza dei casi non avviene in
termini di massa, ma in termini di attività.
Si misura la quantità di substrato che l’enzima contenuto nel campione da
analizzare trasforma nel prodotto per unità di tempo.
Questo criterio di misura, su cui si sono basati i grandi progressi della
enzimologia clinica, ha innegabili vantaggi in termini di praticità e di costo
del dosaggio, ma va anche considerato che, in alcune particolarità
fisiopatologiche, possono falsare l’interpretazione generale del quadro.
ENZIMOLOGIA DIAGNOSTICA
Nella pratica spesso si usa per la determinazione del prodotto una reazione
accoppiata, che usa il prodotto della reazione in esame come substrato di
ulteriori reazioni enzimatiche fino a produrre una sostanza con funzione di
indicatore, che può essere facilmente rilevabile colorimetricamente o
fluorimetricamente.
In molti dosaggi viene usato come indicatore finale l’aumento o la
diminuzione del NAD+ o del NADH, sostanze facilmente dosabili
colorimetricamente con l’assorbanza a 340 nm.
ENZIMOLOGIA DIAGNOSTICA
Con questo metodo, grazie all’accoppiamento di tre reazioni a cascata,
viene prodotta una quantità di NADPH equimolecolare con l’ATP
prodotto dalla CK che agisce sulla creatina fosfato della reazione 1.
Poiché la quantità di NADPH prodotta è facilmente misurabile
colorimetricamente, da questa misura è possibile risalire all’attività del
CK presente nel campione iniziale.
Condizione essenziale perché le misure eseguite in questo modo siano
affidabili è che non ci siano interferenze (ad es. causate da altri enzimi
presenti nel campione) che possano produrre ATP nella reazione 1 o
glucosio 6P nella reazione 2.
Marcatori cardiaci
Tale marker deve essere disponibile sia per una diagnosi precoce che
per un valutazione tardiva del danno miocardico.
Nell’IMA
il
marker
ideale
dovrebbe
inoltre
consentire
un
monitoraggio adeguato della riperfusione ed essere un indicatore
affidabile della dimensione dell’infarto.
Il dosaggio ideale deve essere rapido (sangue intero sarebbe la
condizione ideale), di facile esecuzione, quantitativo e poco costoso.
Marcatori cardiaci
Marcatori cardiaci
Marcatori cardiaci
Marcatori cardiaci
Capacità di un test di dare risultati positivi in un
soggetto malato
Veri positivi al test
Totale dei malati
Marcatori cardiaci
Capacità di un test di dare risultati negativi in un
soggetto non malato
Veri negativi al test
Totale dei non malati
Marcatori cardiaci
Marcatori cardiaci
Storia dei
marker biochimici
1954 AST
1955 LDH
1960 CK
1972 elettroforesi CK CK - MB
1975 CK-MB mediante immunoinibizione CK-B
1975 Mioglobina
1985 CK-MB Massa (saggio immunologico)
1989 Troponina T
1992 Troponina I
Marcatori cardiaci
I dosaggi enzimatici convenzionali, ovvero le determinazioni
dell’attività
totale
di
creatinchinasi
(CK),
aspartato
amminotransferasi (AST) e lattato deidrogenasi (LDH),
devono ritenersi obsoleti
per la loro ben nota scarsa efficacia diagnostica e perché le
potenzialità diagnostiche dei nuovi marcatori sono decisamente
superiori.
Marcatori cardiaci
I vecchi test usati nella diagnostica dell’IMA
-non sono precoci, perché la loro attività catalitica nel plasma si modifica
almeno 6-8 ore dopo l’evento ischemico
- non sono specifici, essendo essi presenti in concentrazione elevata
anche al di fuori del miocardio
- la loro sensibilità diagnostica è totalmente inadeguata alle attuali
esigenze cliniche
- è difficile definire corretti livelli di concentrazione con valore
decisionale.
Marcatori cardiaci
La creatinchinasi, chiamata anche creatinafosfochinasi (CPK), è
un enzima prodotto da varie specie tissutali che appartiene alla
classe delle transferasi.
La sua funzione consiste nel catalizzare la trasformazione
della creatina a fosfocreatina, consumando ATP e
liberando energia chimica.
Catalizza la seguente reazione:
CREATINA + ATP
FOSFOCREATINA + ADP
Marcatori cardiaci
Enzima ubiquitario (presente cioè in tutti i tessuti muscolari): aumenta
in patologie cardiache e non:
CARDIACHE: Infarto, aritmie
NON CARDIACHE: Stimolo Muscoli, Traumi, Miopatie
FINESTRA DIAGNOSTICA
Comparsa: 6-8 h
Picco: 24-36 h
Scomparsa: 3-4 gg
UTILITA’ DIAGNOSTICA: Limitata
Marcatori cardiaci
Ogni molecola di enzima è costituita da due subunità (P.M.
40.000 ciascuna) indicate dalla lettera B (da brain, cervello) e
dalla lettera M (da muscle, muscolo).
Esistono quindi tre isoenzimi:
CK-MM, CK-BB, CK-MB
Marcatori cardiaci
La quantità di isoenzimi varia in relazione ai tessuti in esame.
CK-BB è principalmente presente a livello cerebrale (96%) e raramente la sua
determinazione quantitativa, nel torrente circolatorio sistemico, assume
importanza clinica.
Piccole quantità di CK-BB si riscontrano anche nella muscolatura liscia, come
quella gastrica e intestinale. Nella muscolatura scheletrica abbonda CK-MM (90%)
mentre nel miocardio si ha circa il 70% di CK-MM e il 30% di CK-MB.
Marcatori cardiaci
MM
MB
BB
MUSCOLATURA
SCHELETRICA
96-100%
1-4%
0%
MUSCOLATURA
CARDIACA
70-80%
20-30%
0%
0%
0%
100%
CERVELLO
Marcatori cardiaci
Dopo un infarto acuto del miocardio, la CK-MB va in circolo riflettendo il
danno necrotico.
La sua concentrazione cresce rapidamente, raggiungendo il picco entro
12 ore e tornando normale entro circa 36 – 72 ore.
Tale profilo di valori in crescita e poi in diminuzione seguendo
l’andamento dell’ECG, insieme ai dolori anginosi pregressi, possonio
essere diagnostici per IMA.
Marcatori cardiaci
I dosaggi di CK-MB possono anche coadiuvare la valutazione non
invasiva dell’efficacia della riperfusione miocardica in seguito a terapia
trombolitica.
Concentrazioni elevate di CK-MB sono associate a traumi dei muscoli
scheletrici, ma non presentano il profilo ascendente e discendente
caratteristico dell’IMA.
Marcatori cardiaci
Marcatori cardiaci
In laboratorio a lungo è stata impiegata
la tecnica di
immunoinibizione, che misurava l’attività enzimatica di CK-MB
confrontandola con quella di CK totale; la presenza di CK-BB, di
adenilciclasi o di forme atipiche di CK (macro-CK) portava a valori
di CK-MB sovrastimati.
Marcatori cardiaci
Attualmente viene determinata la CK-MB intesa come proteina,
cioè la CK-MB “massa”, che ben correla con i livelli di attività di
CK-MB; tali test sono di tipo immunochimico, non risentono
alcun tipo di interferenza e prevedono
ridotti tempi di
esecuzione.
Vanno evitati campioni intensamente emolizzati, itterici e
lipemici.
Marcatori cardiaci
Il limite superiore dell’intervallo di normalità per il
CK-MB massa è 5 ng/ml
- vengono quasi sempre rilevati valori superiori a 5 ng/ml
- per distinguere patologie a carico del muscolo scheletrico da
quelle cardiache è utile ricorrere al
calcolo del rapporto
percentuale tra le espressioni numeriche di CK-MB massa e CK
totale
Marcatori cardiaci
Valori di CK MB elevati in assenza di danno
miocardico si riscontrano in condizioni quali traumi,
interventi chirurgici, esercizio strenuo, ustioni
estese, miopatie varie, insufficienza renale cronica,
avvelenamenti, alcolismo cronico.
Marcatori cardiaci
-Basso peso molecolare
(inferiore a 18 kD)
- Marker precoce di danno
cellulare
- Bassa specificità
(indistinguibile da muscolo
scheletrico)
- Emivita 10/20’
- Picco 4-6h
- Durata 8-12h
Marcatori cardiaci
È una proteina a basso peso molecolare (P.M. 18.000) del
citoplasma delle cellule muscolari e delle miocellule
cardiache.
Trasportatore intracellulare di O2 in cellule
muscolari: per espletare la funzione
contrattile in condizioni aerobiche grosse
quantità di ossigeno devono essere
convogliate verso i mitocondri (catena
respiratoria).
Favorendo
una
rapida
diffusione
dell'ossigeno, si trova in grande quantità
nei
muscoli
a
cui
conferisce
il
caratteristico colore rosso dovuto all'eme.
Le sue piccole dimensioni e la
localizzazione
citoplasmatica
permettono alla mioglobina di essere
rilasciata
in
circolo
molto
rapidamente, già dopo una o due ore
dopo un danno muscolare scheletrico
o miocardico.
Marcatori cardiaci
La proteina raggiunge il picco di concentrazione dopo
circa 6-12 ore, e decresce fino ai valori basali entro 2436 ore.
Queste caratteristiche rendono la mioglobina un
marcatore precoce di danno miocardico, le cui
modificazioni nel tempo con prelievi seriati sono molto
utili per la diagnosi precoce di esclusione di un IMA.
Il valore predittivo di un risultato negativo è infatti praticamente del
100% se il dosaggio è effettuato tra le 6 e le 12 ore dall’inizio dei sintomi.
Marcatori cardiaci
Le caratteristiche molecolari della mioglobina
muscolare scheletrica e di quella cardiaca sono
identiche pertanto non risulta possibile attribuire a
questo analita proprietà tessuto-specifiche.
L’efficacia diagnostica della mioglobina è limitata da questa
mancanza di specificità
dal momento che non esistono isoforme cui sia possibile attribuire
specificità tissutale.
Il suo uso deve essere sempre accoppiato a quello di un marcatore
altamente specifico.
Marcatori cardiaci
Il passaggio nel sangue e nell'urina di questa proteina è indice di distruzione
muscolare (muscolo scheletrico e miocardio).
Nelle urine compare in corso di ipermioglobulinemie.
Un aumento dei valori normali di mioglobina può essere dovuto a:
-cause ereditarie: deficit di fosforilasi, di fosfofruttochinasi, sindromi
incompletamente caratterizzate (eccesso di produzione di lattato, diminuita
ossidazione degli acidi grassi), sindromi non caratterizzate (difetti biochimici
familiari non conosciuti).
-cause sporadiche: sforzo fisico, ischemia, alterazioni metaboliche
(intossicazioni da CO, barbiturici, narcotici, tossici e farmaci).
-altre cause: ipokalemia, calore, disidratazione, febbre e infezioni sistemiche,
malattie muscolari acquisite, interventi urologici, cause sconosciute.
Marcatori cardiaci
Livelli di alcuni enzimi serici
nel corso di infarto
Marcatori cardiaci
Livelli di alcuni enzimi serici nel
corso di shock muscolare
Nelle anemie, in particolare in quella
emolitica, la LDH può raggiungere
nel siero livelli superiori a 1000 U/L
Marcatori cardiaci
Struttura muscolo cardiaco
Il sarcomero è l'unità contrattile del
muscolo, ovvero il più piccolo
componente del tessuto che è
capace di contrarsi.
Ciascun sarcomero a riposo è lungo
2,5 mm ed ogni miofibrilla è
composta da migliaia di sarcomeri.
L'azione complessiva di tutti i
sarcomeri di una fibrocellula
determina la sua contrazione.
I
miofilamenti
presenti
nel
sarcomero sono distinguibili in
filamenti spessi e filamenti sottili.
Struttura muscolo cardiaco
Il muscolo cardiaco è un tipo di tessuto particolare,
striato e involontario
La sua anatomia funzionale è molto simile a quella del muscolo scheletrico, ma differisce
per le caratteristiche legate alla propria funzione.
Ogni fibra muscolare cardiaca contiene miofibrille parallele che formano sarcomeri, che le
conferiscono un aspetto striato.
La fibra muscolare cardiaca non è però
affusolata come quella scheletrica, ed è unita a
quella di altre cellule attraverso giunzioni dette
dischi intercalari, che hanno funzioni
meccaniche ed elettriche.
Struttura muscolo cardiaco
I dischi intercalari uniscono le cellule in modo
che queste formino una massa unitaria, detta
sincizio, in cui sono anatomicamente ed
elettricamente congiunte.
In tale modo le fibre muscolari cardiache
costituiscono una lamina contrattile unitaria
attorno a ogni cavità del cuore; tale lamina può
condurre un singolo impulso attraverso un
sarcolemma virtualmente unico, caratteristica
necessaria per una contrazione sincrona e
coordinata.
Il sarcoplasma del muscolo cardiaco trattiene il calcio più a lungo
di quello del muscolo scheletrico, perciò le cellule muscolari si
contraggono in maniera più prolungata.
Struttura muscolo cardiaco
I filamenti sottili sono adiacenti
e perpendicolari alle linee Z, si
prolungano da queste verso il
centro senza toccarsi tra loro.
I filamenti spessi sono disposti
tra quelli sottili ma non arrivano
a toccare le linee Z.
I filamenti spessi sono composti
da miosina, mentre quelli sottili
da
actina,
troponina
e
tropomiosina.
Struttura muscolo cardiaco
I filamenti sottili sono
composti da molecole di
actina,
in
forma
globulare, sulle quali si
trovano
molecole
di
tropomiosina di forma
sottile e allungata e il
complesso
delle
troponine.
Struttura muscolo cardiaco
L'actina è una proteina globulare
(G-actina), i cui monomeri si
associano tra loro per comporre
lunghi e sottili filamenti (Factina),
due
dei
quali
si
avvolgono elicoidalmente l'uno
sull'altro, come due collane di
perle,
dando
origine
allo
scheletro del filamento sottile.
Struttura muscolo cardiaco
Ogni molecola di G-actina contiene un
sito di legame per la testa della
miosina, che, in condizioni di riposo, si
trova
di
fatto
bloccato
da
due
proteine:
•TROPOMIOSINA:
nel
muscolo
a
riposo impedisce il contatto tra 7
molecole di G-actina e le rispettive
teste
di
miosina,
mantenendo
il
muscolo rilassato.
•TROPONINA: quando lega il calcio
cambia la propria conformazione e
sposta la tropomiosina permettendo
l'aggancio con la miosina.
Struttura muscolo cardiaco
La troponina è una famiglia di proteine
presenti nelle fibre muscolari scheletriche
e cardiache che coopera alla contrazione
muscolare.
Esistono tre forme di troponina: C, I, e T.
Struttura muscolo cardiaco
Troponina-I (22.5 kd): inibisce la contrazione
muscolare in assenza di calcio (stato di riposo)
CARDIOSPECIFICO
Troponina-T (39.7 kd): connette il complesso
delle troponine al filamento di tropomiosina
CARDIOSPECIFICO
Troponina-C (18 kd): lega il calcio e permette
l’inizio della contrazione muscolare
NON CARDIOSPECIFICO
Struttura muscolo cardiaco
Tn C è comune a tutta la
muscolatura
TnT
e TnI nell'adulto sono
presenti
nella
muscolatura
scheletrica e nel miocardio come
espressione di 2 geni diversi che le
rende
immunologicamente
differenziabili.
Complesso TROPONINA
I cardiomiociti esprimono specifiche
isoforme della TnI e TnT, indicate
rispettivamente come cTnI e cTnT, che
possono essere facilmente distinte
mediante immunodosaggi.
Le
troponine
cardiache
sono
determinate nel siero mediante
l’utilizzo di anticorpi monoclonali
diretti contro epitopi della cTnI e cTnT.
Questi anticorpi sono
altamente specifici per la
forma cardiaca della troponina e non hanno alcuna cross-reattività con l’isoforma del
muscolo scheletrico.
cTnT e cTnI: non sono presenti in circolo,
sono specifiche per miocardio
Queste forme di troponina sono normalmente contenute in
concentrazione ridotta nel sangue.
Quando avviene un danno alle cellule del muscolo cardiaco, le troponine
vengono rilasciate in circolo.
Maggiore è il danno, maggiore è la concentrazione di troponine
circolanti. Quando il paziente subisce un attacco cardiaco, i livelli di
troponina si eleva in circa 3 o 4 ore dopo l’evento e resta tale per 10 o 14
giorni.
Marcatori cardiaci
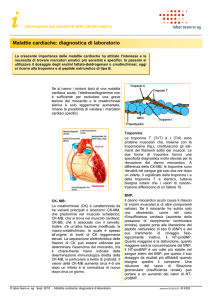
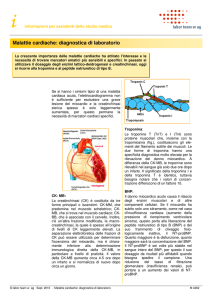
Finestra diagnostica dei marcatori
cardiaci relativamente alla diagnosi di
sindrome coronarica acuta
Marcatore
Mioglobina
CK-MB massa
Troponina T
Troponina I
Finestra
2,5– 20 h
3– 24 h
3h – 5°giorno
3 h– 4°giorno
Marcatori cardiaci
TROPONINE CARDIACHE cTnT e cTnI
Livelli di cTnI:
rimangono elevati per 7-10 gg dopo infarto acuto del miocardio
Livelli di cTnT:
rimangono elevati per 10-14 gg dopo infarto acuto del miocardio
MIOGLOBINA
Rilasciata in circolo nelle prime ore ma rapidamente eliminata dal
rene e non specifica per miocardio
Marcatori cardiaci
50
Myoglobin
CK-MB
Troponin T or I
LD1
15
Multipli
dei limiti
superiori di 10
riferimento
I
5
T
Normal Range
0
1
2
3
4
5
6
Giorni dopo insorgenza di IMA
Wu, A. H., Journal of Clinical Immunoassay 1994;17, 45-48
7
10
Le troponine sono dei marcatori in grado di individuare un
danno miocardico con buona sensibilità e specificità.
Tuttavia la loro determinazione pone problemi di tipo
quantitativo e qualitativo
I falsi positivi
-Reattività crociata verso componenti ematici:
Emolisi
Bilirubina
-Interferenze analitiche per la presenza di anticorpi:
Anticorpi eterofili
Fattore reumatoide
L’incremento della troponina è un rilievo
estremamente frequente nei pazienti con scompenso
cardiaco ed è rilevabile nel 90% dei casi,
indipendentemente dall’eziologia dello scompenso
Ricerca
Ricerca
Troponina-hs
Linee guida diagnosi IMA
la diagnosi deve essere fatta solo in presenza di un “aumento o una
diminuzione di Tn cardiaca con un valore al di sopra il 99° percentile del
valore di riferimento in pazienti con evidenza di ischemia cardiaca”….
Troponina-hs
Troponina-hs
L’aumentata
sensibilità
permette una più precoce
diagnosi di IMA e una
migliore definizione della
cinetica
Dopo 3 ore, dall’ inizio
del dolore, la Tn raggiunge
la massima potenzialità
diagnostica
Marcatore precoce
Alta sensibilità
Specifico per danno miocardico
Minore specificità per danno ischemico
Troponina-hs
Troponina-hs
Troponina-hs
Troponina-hs
le questioni cliniche ….
1. Inquadramento diagnostico
del paziente che presenta dolore toracico (SCA? Patologia
cardiaca non-SCA? Patologia extracardiaca?)
1. Stratificazione del rischio in pazienti con sindrome coronarica
acuta
Troponina-hs
Troponina-hs
ESC Guideliness 2011
Troponina-hs
“Therefore, MI can now be detected more frequently and earlier in
patients presenting with chest pain. The superiority of these new assays,
particularly in the early phase of pain onset, was prospectively
demonstrated”.
“The negative predictive value for MI with a single test on admission is
95% and thereby at least as high as with previous assays achieved only by
serial measurements. Only very early presenters may escape detection. By
including a second sample within 3 h of presentation the sensitivity for MI
approaches 100%”.
Rule out entro 3h
Troponina-hs
Troponina-hs
Lo scompenso cardiaco è una sindrome clinica complessa
1.Segni e sintomi di scompenso cardiaco (dispnea,
astenia, edemi periferici: a riposo o sotto sforzo)
2.Evidenza
oggettiva
(preferibilmente
all’ecocardiografia) di disfunzione cardiaca
(sistolica e/o diastolica)
3.Risposta alla terapia specifica
I criteri 1 e 2 devono essere soddisfatti in ogni caso
Eziologia dello scompenso cardiaco
nello studio di Framingham
Ho KK et al, J Am Coll Cardiol 1993; 22(Supplement A):6A-13A
MEN
19%
WOMEN
7%
11%
No HTN or CHD
30%
40%
CHD = coronary heart disease
HTN = hypertension
Hypertension
alone
CHD+HTN
CHD alone
15%
40%
37%
Il “RIMODELLAMENTO”
è, in gran parte, alla base della
serie di eventi che terminano nello
SCOMPENSO CARDIACO
Background del “Remodelling”
BNP – pro BNP
BNP = Brain Natriuretic Peptide
(Peptide Natriuretico Cerebrale)
B-type natriuretic peptide
(Peptide Natriuretico di Tipo B)
BNP – pro BNP
Peptidi Natriuretici Cardiaci (PNC)
appartengono ad una famiglia di peptidi, con funzione ormonale,
costituita da molecole altamente omologhe. Come gli altri peptidi
natriuretici, hanno azione diuretica, natriuretica e vasodilatatrice,
esercitando un effetto favorevole in caso di scompenso cardiaco
ANP Peptide Natriuretico tipo A o atriale, prodotto dalle cellule atriali
BNP Peptide Natriuretico tipo B o ventricolare, prodotto dalle cellule ventricolari
(isolato per la prima volta nel cervello)
CNP Peptide Natriuretico tipo C, prodotto prevalentemente a livello del SNC
DNP Peptide Natriuretico Dendroaspis, ruolo e origini incerte
Urodilatina Prodotto esclusivamente dal rene, si trova solo nelle urine
BNP – pro BNP
ANP- la sintesi avviene in risposta alla distensione della parete per l’aumento del
volume intravascolare
BNP- assente in condizione basali; la sintesi ventricolare è regolata a livello
trascrizionale da stimoli parietali e stimoli endocrini
BNP – pro BNP
I PNC svolgono un'azione di contro
regolazione
dei
sistemi
neurormonale ed immunologico.
Essi hanno infatti:
•azione diuretica
•azione natriuretica
•azione vasodilatatrice
Attraverso queste azioni i peptidi
natriuretici svolgono il ruolo di
antagonisti
degli
effetti
vasocostrittori e sodio-ritentivi del
sistema
Renina-AngiotensinaAldosterone.
BNP – pro BNP
I peptidi natriuretici possiedono
una regione conformata ad
anello, per la presenza di un
ponte cisteinico.
La porzione residua della
molecola è costituita dalle
estremità terminali libere (-NH2
e -COOH terminali) della catena
peptidica.
I vari peptidi natriuretici hanno in comune la porzione anulare della molecola, di cui
condividono gran parte della sequenza aminoacidica. La lunghezza e la composizione
aminoacidica delle porzioni residue della catena peptidica variano notevolmente tra i vari
ormoni natriuretici.
L'anello è la porzione recettore-specifica della molecola.
BNP – pro BNP
Dal pre-proBNP, attraverso
il distacco proteolitico del
peptide segnale, origina il
pro-ormone (pro-BNP).
Il successivo clivaggio enzimatico del legame tra gli aa in posizione 76 e 77 dà luogo a
due frammenti, secreti in quantità equimolecolare nel circolo sanguigno:
- il frammento carbossi-terminale del pro-BNP 77-108, biologicamente attivo, noto con
il nome di BNP
- il frammento amino-terminale del pro-BNP 1-76, sprovvisto di attività ormonale,
chiamato NT-pro-BNP
BNP – pro BNP
BNP – pro BNP
Nei soggetti normali, la concentrazione
plasmatica del BNP e del NT-proBN
variano con il sesso e con l'età: nelle
donne in età fertile il peptide raggiunge
valori doppi rispetto agli uomini di pari
età; dopo i 50 anni, aumenta in
entrambi i sessi. Per tale motivo è stato
proposto di
usare livelli decisionali diversi
in funzione dell'età e del
sesso
BNP – pro BNP
1) eterogeneità delle molecole circolanti derivate dal proBNP
Le molecole di pro-BNP, così come quelle dei peptidi da esso
derivati, possono interagire tra loro, dando luogo ad oligomeri
circolanti. Trattandosi di forme molecolari multiple, è possibile
che alcuni epitopi siano più esposti di altri nel legame con gli Ab
specifici utilizzati per la loro determinazione.
BNP – pro BNP
2) stabilità del campione biologico
BNP – pro BNP
I metodi più diffusi per la determinazione dei peptidi natriuretici BNP e NTproBNP sono di tipo immunometrico (sandwich).
Per la determinazione del BNP, disponiamo di due metodiche analitiche:
Ab (1)
Ab (1) specifico per la struttura
anulare del BNP (aminoacidi
90-97)
Ab (2) specifico per l'estremità
N-terminale
del
BNP
(aminoacidi 77-86)
Ab (2)
BNP – pro BNP
Ab (1)
Il sandwich è formato da un Ab (1)
specifico per la struttura anulare e
da un Ab (2) specifico per
l’estremità
carbossi-terminale
della molecola (residui 103-107
del pro-BNP).
Ab (2)
Questi metodi dosano anche il proBNP intatto circolante:
possibile sovrastima della concentrazione del BNP
BNP – pro BNP
può elevarsi anche nelle patologie edematose che comportino aumento della
pressione atriale e ventricolare, quali insufficienza renale, cirrosi epatica con ascite,
in presenza di angina instabile ed ipertensione polmonare
ha un alto valore predittivo negativo soprattutto di scompenso cardiaco (se i suoi valori sono
normali è possibile escludere con elevato grado di probabilità la presenza di disfunzioni
ventricolari).
non eccellente è il valore predittivo positivo; valori di poco superiori al limite di normalità
rappresentano un indicatore solo discretamente accurato della presenza di patologia
i valori sono correlati anche alla gravità dello scompenso e della prognosi; tanto maggiore è il
valore tanto maggiore è la gravità della malattia e minori le speranze di sopravvivenza del
paziente
in pazienti con SC, i livelli di BNP rappresentano un mezzo potenzialmente utile per
monitorare la risposta al trattamento
BNP – pro BNP
PATOLOGIA
CONCENTRAZIONE BNP
PATOLOGIE CARDIACHE
SCA
molto aumentato
IMA (primi 2 – 5 giorni)
molto aumentato
Ipertensione Essenziale con IVS
aumentato
PATOLOGIE POLMONARI
Embolia Polmonare
aumentato
BPCO
aumentato
PATOLOGIE Endocrino-Metaboliche
Ipertiroidismo
aumentato
Ipotiroidismo
diminuito
Sindrome di Cushing
aumentato
Iperaldosteronismo primario
aumentato
Diabete mellito
normale o aumentato
Cirrosi epatica con ascite
aumentato
Insufficienza Renale Acuta
molto aumentato
Sindrome Paraneoplastica
normale o aumentato
Emorragoia subarcnoidea
aumentato
GALECTINA 3
Ruolo fisiopatologico
Proteina presente nel nucleo, nel citoplasma e sulla superficie cellulare
Lectina associata ad infiammazione e processo fibrotico
Secreta dai macrofagi, promuove la sintesi del collagene
Scoperta nel 2004 come mediatore nello sviluppo e nella progressione
dello scompenso cardiaco
GALECTINA 3
Un insulto miocardiaco (MI) scatena la
risposta infiammatoria e di riparazione
del danno
I macrofagi rilasciano
la galectina 3
La deposizione del collagene
porta alla formazione di tessuto
cicatrizzante
I macrofagi che portano la
galectina 3 s’infiltrano nel
tessuto necrotico
Rimodellamento
e dilatazione
La galectina 3 si lega e attiva i
miofibroblasti che attivano la sintesi
del collagene
GALECTINA 3
Raddoppia la mortalità a 60 gg, in pazienti con
livelli plasmatici superiori-Predittivo di prognosi
sfavorevole
Non risente di scompenso acuto-Indipendenza
da BNP/NT-proBNP
Marker misurabile e altamente stabile. Nessuna
interferenza da diabete, patologie renali o
epatiche-Performance robuste
Studi su modello animale mostrano che
l’inibizione della Gal 3 migliora la funzione
cardiaca, riduce il contenuto in collagene e
l’ipertrofia-Potenziali applicazioni Teranostiche
GALECTINA 3
GALECTINA 3
Condizione Clinica
Uso previsto - Gal 3
Fase di sviluppo
Pazienti con
diagnosi di
scompenso cardiaco
Come ausilio nella defizione
della prognosi di pazienti con
scompenso cardiaco
Test in sviluppo su
vari sistemi
Decisioni
Terapeutiche
Come ausilio nel predire il
successo terapeutico in
pazienti con scompenso
cardiaco trattati con
rosuvastatina (Crestor) ®
Primi dati positivi
da studi clinici
Rischio di
scompenso cardiaco
dopo infarto del
miocardio
Per identificare pazienti a
rischio elevato di scompenso
cardiaco dopo infarto
Studi clinici in fase
di validazione