Primo principio della termodinamica
8. Un gas perfetto è mantenuto a temperatura costante. Alla pressione di 1,0 · 10 5 Pa esso occupa un volume di 20 · 10-3
m3.
Calcola i volumi occupati dal gas se la pressione aumenta a 2,0 · 10 5 Pa, 2,5 · 105 Pa, 4,0 · 105 Pa.
Disegna prima in un grafico V-p e poi in un grafico T- V questa trasformazione.
[R. 10 dm3; 8,0 dm3; 5,0 dm3]
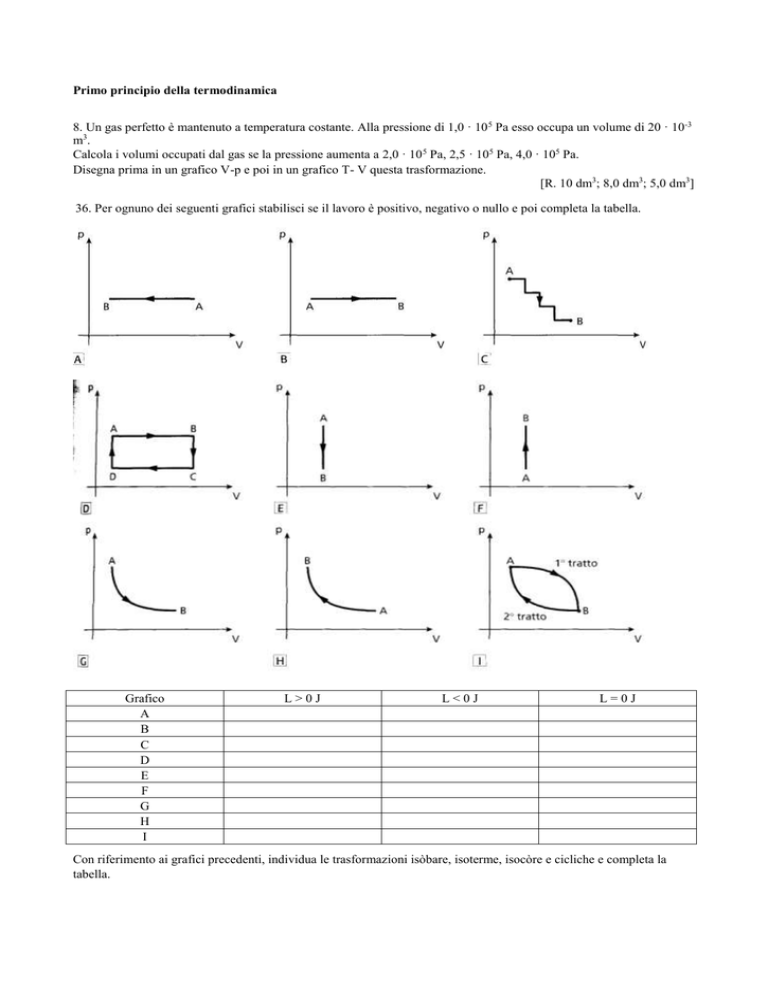
36. Per ognuno dei seguenti grafici stabilisci se il lavoro è positivo, negativo o nullo e poi completa la tabella.
Grafico
A
B
C
D
E
F
G
H
I
L>0J
L<0J
L=0J
Con riferimento ai grafici precedenti, individua le trasformazioni isòbare, isoterme, isocòre e cicliche e completa la
tabella.
Grafico
A
B
C
D
E
F
G
H
I
Isobara
Isocora
Isoterma
Ciclica
39. In un bicchiere sono contenuti 25 di di liquido che viene fatto evaporare alla pressione di 1,0 atm. Il volume del
vapore è 1530 volte quello del liquido. Calcola il lavoro compiuto durante la trasformazione.
[R. 3,9 · 105 J]
40. Una quantità di freon contenuta in un recipiente con una parete mobile viene fatto espandere a una pressione
costante di 2,5 · 105 Pa fino a occupare un volume di 45 dm3. Nell'espansione, il gas compie un lavoro di 4500 J.
Calcola il volume iniziale del gas.
[R. 27 dm3]
42. (*) Una certa quantità di azoto viene fatta espandere passando da un volume V A = 3,5 dm3 a un volume VB = 8,7
dm3, mentre la pressione varia da pA = 2,3 · 105 Pa a pB = 4,9 · 105 Pa. Calcola il lavoro compiuto dal gas durante
l'espansione dallo stato A allo stato B. Se la trasformazione avvenisse in senso inverso il lavoro varierebbe? Motiva la
tua risposta.
[R. 1900 J]
Utilizzando una certa quantità di calore, un sistema termodinamico compie un lavoro pari a 368 J. Sapendo che alla
fine del processo l'energia interna del sistema è variata di 50 J, calcola quante calorie sono state utilizzate.
[R. 100 cal]
A seguito di una trasformazione a volume costante, una massa m di gas perfetto varia la sua temperatura da 15 °C a
115 °C e contemporaneamente la sua energia interna di 2006,4 J. Sapendo che il calore specifico a volume costante del
gas è pari a 2,4 cal/°C · g, calcola la massa del gas.
[R. 2 g]
Calcola la natura di un gas perfetto sapendo che a seguito di una variazione di 100 K provocata da una trasformazione
isocora l'energia interna di una mole di gas, caratterizzato da un calore specifico a volume costante pari a 0,75 kcal/°C
kg, varia di 1254 J.
[R. elio]
1.
Calcola il lavoro compiuto, espresso in joule, la variazione di energia interna espressa in l · atm, e il calore
assorbito espresso di calorie relativi al ciclo rappresentato in figura.
[R. 100 J; 0; 24 cal]
44. Pensa come un fisico. Un sistema termodinamico compie lavoro senza scambiare calore con l'ambiente esterno. Da
dove proviene l'energia spesa?
28. Un sistema termodinamico assorbe una quantità di calore Q = 2.0 kcal mentre compie un lavoro L = 1200 J. Si
calcoli la variazione di energia interna. [R. 7.17 · 103J]
32. Un sistema termodinamico subisce una trasformazione nella quale l'energia interna aumenta di 680 J e viene
eseguito un lavoro L = - 2350 J. Si calcoli la quantità di calore scambiata nella trasformazione.
[R. - 1670 J]
41. Tre moli di gas perfetto espandendosi alla temperatura costante di 50 °C raggiungono un volume finale V2 = 3 V1.
Si calcoli: a) il lavoro eseguito; b) la quantità di calore scambiata. (ln 3 = 1.0986)
[R. a) 8846 J; b) 8846 J]
42. Una mole di gas perfetto alla temperatura iniziale T 1 = 300 K ed alla pressione di 0.3 atm. viene compresso a
temperatura costante fino alla pressione di 1.2 atm. Si calcoli: a) il volume finale del gas; b) il lavoro eseguito; c) la
quantità di calore scambiata.
[R. a) 20.5 1; b) 3.46 · 103 J; c) 3.46 · 103 J]
50. Un veicolo di massa 1,2 · 103 kg si muove con una velocità di 25 m/s su un tragitto orizzontale. Durante il suo
moto compie un lavoro di 3,0 · 10 J. Supponi che tutta l'energia cinetica del veicolo si trasformi in calore.
a) Calcola in kcal la quantità di calore che si sviluppa per attrito quando il veicolo frena fino al suo arresto
completo.
b) Di quanto varia la sua energia interna?
[R. 90 kcal; 350 kJ]
60. Durante una trasformazione isoterma un gas perfetto si espande passando da un volume iniziale di 7,0 dm 3 a un
volume ed una pressione finali di 10 dm3 e 3,0 atm rispettivamente. Calcola il calore assorbito dal gas.
[R. 110 J]
61. Un sistema termodinamico compie la trasformazione ciclica rappresentata nella figura.
a) Individua il tipo di trasformazione relativa a ciascun tratto del grafico.
b) In quali di queste trasformazioni si compie lavoro non nullo?
c) Calcola il lavoro complessivo prodotto nella trasformazione ciclica.
[R. AB = C D: trasformazione isòbara; BC = DA: trasformazione isocora; AB e CD; 8.0 · 10 4 J]
76. Pensa come un fisico. Durante la caduta dei pesi nell'esperienza di Joule per stabilire l'equivalente meccanico della
caloria, avviene una trasformazione termodinamica. Sapresti dire di che tipo si tratta?
80. Un gas perfetto subisce una trasformazione adiabatica in cui compie un lavoro di 20 J. Di quanto è variata la sua
energia interna?
[R. -20 J]
81. (*) Un gas perfetto biatomico alla temperatura iniziale di 250 K occupa un volume di 3,55 · 10 -3 m3. Al termine di
una espansione adiabatica quasistatica il gas occupa un volume V = 6,15 · 10-3 m3. Calcola la temperatura del gas al
termine della trasformazione.
[R. 201 K]
36. Una mole di gas perfetto monoatomico passa da uno stato iniziale caratterizzato da P 1= 2.0 atm e V1= 0.8 m3
ad uno stato finale con P 2 = 2.4 atm e V2 = 1.0 m3. Si calcoli la variazione U dell'energia interna (si ricordi che c v =
3R/2)
[R. 1.2 · 105 J]
37. Due moli di gas perfetto monoatomico subiscono una trasformazione (ideale) a volume costante V = 35 1 nella
quale la pressione passa da 1.2 atm a 1.6 atm. Si calcoli: a) la variazione di energia interna; b) la quantità di calore
scambiata.
[R. a) 4255 J; b) 4255 J]
Un gas perfetto monoatomico compie una trasformazione descritta nel piano (p, V) da una retta AB. Lo stato
iniziale A è caratterizzato dalla pressione pA = 2 · 104 N/m2 e da un volume VA = 1 m3, mentre lo stato finale pB,
VB è caratterizzato da una pressione e da un volume rispettivamente doppi dei valori iniziali. Calcola la quantità
di calore assorbita dal gas, il lavoro compiuto e la variazione di energia interna riguardante la trasformazione
considerata.
[R. Q = 120000 J; L = 3000 J; U = 9 · 10 4 J]
Problemi
2. (*) Un contenitore di forma cilindrica con una base mobile di sezione S = 150 cm 2, racchiude un gas alla pressione di
1,00 atm. Il gas riceve una quantità di calore Q = 480 cal e si espande a pressione costante per un tratto di 25,0 cm.
Calcola la variazione dell'energia interna del gas.
[R. 1630 J]
3. (*) 0,50 moli di un gas perfetto si trovano in uno stato termodinamico caratterizzato da una pressione pA = 2,0 kPa e
da un volume VA = 1,3 m3. Il gas subisce prima una trasformazione isocòra che ne varia la pressione da p A a pB = 0,7
kPa e successivamente una trasformazione isòbara che ne porta la temperatura a un valore T C = 600 K.
a)
Determina per ciascuno degli stati A, B, C valori delle tre variabili termodinamiche.
b)
Disegna in un riferimento p - V i grafici che rappresentano le due trasformazioni.
c)
Calcola il lavoro totale compiuto dal gas durante le due trasformazioni.
[R. TA = 630 K ; TB = 220 K; VC = 3,6 m3; 1600 J]
4. (*) Un gas perfetto è contenuto in un recipiente ermeticamente chiuso. Il gas occupa inizialmente il volume del
recipiente alla pressione di 105 Pa e alla temperatura di 300 K. Il gas subisce una trasformazione a volume costante
passando da stati successivi in cui la pressione vale 2.0 · 10 5 Pa, 3,0 · 105 Pa,4,0 · 105 Pa.
a)
Calcola la temperatura del gas in questi tre stati.
b)
Disegna prima in un grafico V - p e poi in un grafico T - V questa trasformazione.
[R. 600 K; 900 K; 1200 K]
9. (**) Nei cilindri dei motori diesel avvengono continue trasformazioni adiabatiche. Infatti l'aria viene compressa
velocemente in modo da provocare un improvviso aumento della temperatura; così si ottiene l'accensione del
combustibile senza bisogno di candele. Immagina che il pistone comprima l'aria nel cilindro a tal punto da ridurne il
volume fino a 1/10 del suo valore iniziale. Allo stato iniziale i valori della temperatura e della pressione sono: T 0 = 25
°C e p0 = 1,00 atm. Considera l'aria contenuta nei cilindri come un gas perfetto. Calcola i valori finali della pressione p
e della temperatura T. (Suggerimento: l'aria nei cilindri è costituita essenzialmente da N 2 e O2.)
[R. 2,54 · 106 Pa; 749K]
2 Un serbatoio metallico cubico ha pareti sottili, con spigolo di lunghezza 10 cm. Esso contiene un gas monoatomico,
assimilabile a un gas perfetto, alla pressione di 1,5 atm e alla temperatura di 10° C. Posto all'aperto, per prolungata
esposizione al sole, l'intero sistema si porta alla temperatura di 65 °C. Sapendo che il volume del serbatoio non si è
sensibilmente modificato, si calcoli:
a) la pressione finale del gas;
b) la variazione di energia interna del gas;
c) la quantità di calore assorbita dal gas.
(dall'Esame di Fisica, Corso di laurea in CTF, Università La Sapienza di Roma, 2002/2003)