ESPERIENZA DI LABORATORIO N. 3
“TEORIA IONICA E DISSOCIAZIONE ELETTROLITICA”
Con il termine di elettroliti si indicano quelle sostanze (acidi, basi e sali) che disciolte in acqua o in
altri solventi conducono la corrente elettrica. Tale proprietà è dovuta al fatto che in soluzione queste
sostanze si dissociano in ioni cioè in entità con carica positiva e negativa.
In una soluzione di cloruro di sodio (NaCl) sono presenti solo ioni Na+ e ione Cl- ed in una
soluzione di solfato di potassio solo ioni K+ e ioni solfato SO42-.
Non tutti gli acidi, la basi ed i Sali si ionizzano nella stessa misura: alcuni acidi ed alcune basi e la
maggior parte dei Sali sono in soluzione completamente ionizzati; mentre altri sono presenti in
soluzione in gran parte allo stato molecolare, cosicché, pur essendo elevata la concentrazione totale,
la concentrazione ionica è relativamente bassa: i primi vengono indicati come elettroliti forti ed i
secondi come elettroliti deboli.
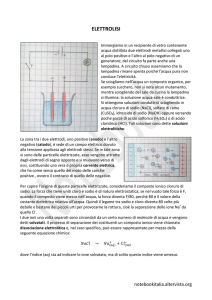
La classificazione di una sostanza in nonelettrolita o in elettrolita debole o forte può
eseguirsi mediante misure di conducibilità
elettrica in quanto il passaggio di una corrente
elettrica attraverso una soluzione è dovuta al
numero di ioni in essa esistente.
Un
semplice
dispositivo
per
misure
di
conducibilità è presentato in figura. Esso è
costituito da un circuito semplice in cui una
coppia di elettrodi è collegata con una
lampadina da 5 watt ed alimentato da una
tensione alternata da 12 V. Con tale circuito è
possibile misurare la conducibilità di una
soluzione osservando se la luminosità delle
lampadine è forte o debole ovvero confrontare
fra loro le conducibilità di due diverse soluzioni.
Materiale occorrente:
-
2 becherini da 100 cc;
-
cloruro di potassio 1,0M, KCl;
-
2 mine di grafite;
-
cloruro di potassio solido;
-
acqua distillata;
-
solfato di solido 1,0M, Na2SO4;
-
glicerina;
-
alcool di etilico;
-
acido cloridrico 0,1M, HCl;
-
zucchero;
-
idrossido di sodio 0,1M, NaOH;
-
aceto;
Procedimento
La misura viene eseguita inserendo gli elettrodi in becher contenenti la soluzione in esame. Dopo
ogni misura lavare gli elettrodi ed asciugarli con un pezzo di carta da filtro.
ATTENZIONE: dopo ogni misura aprire il circuito in modo che non v sia tensione applicata agli
elettrodi.
A. Classificare ognuno dei seguenti composti come conduttori o non conduttori di elettricità.
Riempire volta per volta i becherini con 15-20 ml di ciascuna delle sostanze seguenti ed
immergervi gli elettrodi.
1. Acqua distillata;
2. Glicerina;
3. Cloruro di potassio 0,1M;
4. Solfato do sodio 1,0 M;
5. Alcool;
6. Acqua zuccherata;
7. Aceto;
In quali casi si accende la lampadina?
•
Aggiungere cloruro di potassio solido poco per volta al contenuto del becher n°1;
•
Aggiungere moderatamente acqua distillata al becher n°7;
Sono state osservate variazioni?
Mescolare per ottenere una soluzione omogenea e controllare di nuovo la conducibilità.
Eseguire le misure anche con soluzioni di:
-
Acidi cloridrico 0,1M;
-
Idrossido di sodio 0,1M;
In quali casi la lampadina si accende?
B. Confronto tra elettroliti forti e deboli.
Riempire uno dei due becherini con la soluzione dei composti sotto indicati alla
concentrazione a fianco riportata e l’altro con soluzioni 0,01M dello stesso composto
ottenuto per diluizione:
-
Acido cloridrico 0,1M;
-
Idrossido di sodio 0,1M;
Confrontare la luminosità della lampadina nei vari casi.
Domande:
A. 1) Quali sostanze risultano conduttori e quali no?
2) Mediante l’aggiunta di acqua distillata si ottengono variazioni di conducibilità?
Riportare i risultati sotto forma di tabella.
B. 1) La dissociazione dell’acido cloridrico e dell’idrossido di sodio è influenzata dalla
diluizione?
2) L’aceto è maggiormente dissociato in soluzioni concentrate o diluite?
3) Conduce meglio la corrente una soluzione di acido cloridrico 0,1M oppure una
soluzione di acido acetico della stessa concentrazione?