LICEO SCIENTIFICO STATALE “TALETE”
PROGRAMMAZIONE DIDATTICA DI SCIENZE NATURALI
ANNO SCOLASTICO 2016/2017
CLASSE: 3 SEZ. M (LICEO SCIENTIFICO TRADIZIONALE – NUOVO ORDINAMENTO)
DOCENTE: PROF.SSA ALESSANDRA TOMEI
Libri di testo in adozione:
Biologia – H. Curtis, N.S. Barnes, A. Schnek, G. Flores “Invito alla biologia.blu” Ed. Zanichelli
Chimica – G. Valitutti, M. Falasca, A. Tifi, A. Gentile “Chimica. Concetti e modelli.blu” Ed. Zanichelli
Premessa
Le classi terze affronteranno, come concordato a livello di Dipartimento, e secondo le indicazioni
nazionali, moduli di Biologia a completamento dei contenuti affrontati durante il secondo anno del primo biennio e
moduli di Chimica a completamento dei contenuti di base affrontati sia nel corso del primo che del secondo anno
del primo biennio.
Situazione di partenza
La classe è composta da 23 alunni (14 ragazzi e 9 ragazze), ed è disomogenea nell’interesse, nella
partecipazione, nell’assiduità nell’impegno di studio. In termini di partecipazione, permane la diversità fra il
gruppo maschile e femminile della classe; gli studenti, più esuberanti, partecipano all’attività didattica molto più
delle studentesse, piuttosto passive. Molto diverso è anche l’impegno nello studio individuale. Sono pochi gli
alunni che si applicano con costanza allo studio e all’approfondimento dei contenuti, consolidando in modo
graduale le proprie conoscenze e competenze e partecipando perciò in modo consapevole alle lezioni. La maggior
parte invece non sempre segue con interesse le attività svolte, s’impegna nello studio individuale in modo
discontinuo, e mostra di avere conoscenze meno organiche e più superficiali, frutto di un inadeguato impegno e
talvolta anche di lacune pregresse nelle conoscenze scientifiche.
Da un punto di vista disciplinare, la maggior parte degli studenti ha un comportamento corretto,
consentendo un sereno svolgimento dell’attività didattica.
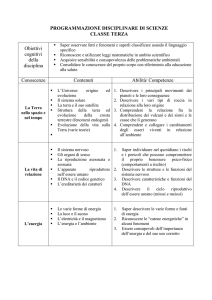
Obiettivi generali della disciplina
Si cercherà di esporre gli argomenti in modo da sviluppare negli studenti la consapevolezza che ogni
ipotesi, teoria o legge che si andrà ad apprendere è conseguenza di dati raccolti in esperimenti e di fenomeni
osservati sistematicamente, e che la validità di tali ipotesi, leggi o teorie può essere smentita da nuove scoperte ed
esperimenti. Si cercherà cioè di dimostrare il modo in cui si realizza il progresso scientifico nelle scienze
sperimentali e i metodi di cui esse fanno uso (osservazione, misura, formulazione di ipotesi e loro verifica,
formulazione di leggi).
A questi obiettivi generali dello studio delle Scienze sperimentali si accompagneranno, nel corso del terzo
anno, finalità più specifiche correlate alle tematiche proposte. In particolare si perseguirà l’obiettivo di far acquisire
agli studenti le conoscenze che sono alla base dei principali fenomeni chimici e biologici relativi soprattutto alla
chimica generale, alla biologia molecolare e alla biologia dell'evoluzione. Si cercherà, anche per connettere
conoscenze e rafforzare l’apprendimento, di proporre agli studenti collegamenti dei contenuti teorici proposti a
fenomeni della realtà quotidiana e di verificare gli stessi, laddove possibile e compatibilmente con l’esiguo monte
ore previsto, con attività di laboratorio.
Obiettivi specifici e contenuti disciplinari
Gli obiettivi formativi ed educativi della disciplina, nel quarto anno di studio delle Scienze naturali, possono così
essere delineati:
- Perfezionamento del metodo di studio basato sulla ricerca e sull’approfondimento.
- Consolidamento di un atteggiamento collaborativo e partecipativo durante l’attività didattica teorica e di
laboratorio.
- Potenziamento delle capacità di analisi e di sintesi di un testo scientifico, se possibile anche in lingua
inglese.
- Potenziamento della capacità di elaborazione di schemi, mappe concettuali, che connettano correttamente i
principali argomenti studiati.
- Ulteriore sviluppo delle capacità logiche ed analitiche, nello studio di fenomeni chimici e biologici.
- Potenziamento delle capacità espositive orali e scritte e dell’uso del linguaggio specifico delle diverse
Scienze sperimentali.
Nel terzo anno si prosegue lo studio dei contenuti di Biologia e di Chimica, seguendo la programmazione condivisa
all’interno del Dipartimento di Scienze. Vengono elencati di seguito i contenuti che s’intende proporre alla classe
con riferimento, in particolare, agli obiettivi di apprendimento in termini di abilità e competenze (quelli sottolineati
corrispondono ai contenuti minimi, concordati a livello di Dipartimento):
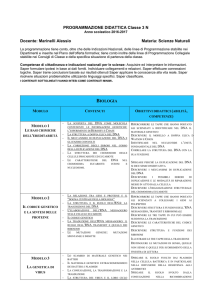
BIOLOGIA
MODULO
CONTENUTI
MODULO 1
- I CROMOSOMI OMOLOGHI, I GENI, GLI ALLELI, IL
GENOTIPO E IL FENOTIPO.
- LA PRIMA LEGGE DI MENDEL: LA DOMINANZA.
- LA SECONDA LEGGE DI MENDEL: LA
SEGREGAZIONE.
- LA TERZA LEGGE DI MENDEL: L’ASSORTIMENTO
INDIPENDENTE.
- LE LEGGI DI MENDEL, CROMOSOMI OMOLOGHI,
ALLELI, TESTCROSS.
- LE MALATTIE GENETICHE UMANE E LA LORO
EREDITARIETÀ.
LA TRASMISSIONE
DEI CARATTERI
EREDITARI
MODULO 2
LE BASI CHIMICHE
DELL'EREDITARIETÀ
-
-
MODULO 3
-
IL CODICE GENETICO
-
E LA SINTESI DELLE
PROTEINE
-
-
LA
OBIETTIVI DIDATTICI (ABILITÀ,
COMPETENZE)
IDENTIFICARE
IL PERIODO STORICO E LE
CONOSCENZE
SCIENTIFICHE
IN
CUI
SI
INQUADRANO GLI STUDI DI MENDEL.
LE
FASI
DEL
LAVORO
ILLUSTRARE
SPERIMENTALE DI MENDEL.
DISTINGUERE UN CARATTERE DOMINANTE DA
UNO RECESSIVO, UN GENE DA UN ALLELE, UN
FENOTIPO DA UN GENOTIPO, UN OMOZIGOTE DA
UN ETEROZIGOTE.
ENUNCIARE
LE LEGGI DELLA DOMINANZA,
DELLA SEGREGAZIONE E DELL'ASSORTIMENTO
INDIPENDENTE.
PREVEDERE LE COMBINAZIONI ALLELICHE
RISULTANTI DA UN INCROCIO, COSTRUENDO IL
QUADRATO DI PUNNET.
APPLICARE IL TEST CROSS PER DETERMINARE IL
GENOTIPO DI UN INDIVIDUO A FENOTIPO
DOMINANTE.
SPIEGARE LA DIFFERENZA TRA UNA MALATTIA
GENETICA DETERMINATA DA UN ALLELE
RECESSIVO E QUELLA DETERMINATA DA UN
ALLELE DOMINANTE.
SCOPERTA DEL DNA COME MOLECOLA
CONTENENTE LE INFORMAZIONI GENETICHE:
L’ESPERIMENTO DI HERSHEY E CHASE
LA STRUTTURA A DOPPIA ELICA DEL DNA
IL MECCANISMO DI DUPLICAZIONE DEL DNA E
GLI ENZIMI COINVOLTI
LA CORREZIONE DEGLI ERRORI NEL CORSO
DELLA DUPLICAZIONE DEL DNA
LA STRUTTURA DEI CROMOSOMI DELLE
CELLULE PROCARIOTE ED EUCARIOTE
LE CARATTERISTICHE DEL DNA NEL
CROMOSOMA
EUCARIOTE:
ISTONI
E
NUCLEOSOMI.
RIPERCORRERE
LA RELAZIONE TRA GENI E PROTEINE E IL
"DOGMA CENTRALE DELLA BIOLOGIA"
LA STRUTTURA E IL RUOLO DELL'RNA: LA
TRASCRIZIONE DEL DNA
L'ELABORAZIONE DELL'RNA MESSAGGERO
RIPERCORRERE
NELLE CELLULE EUCARIOTE
IL CODICE GENETICO
LA TRADUZIONE DELL'RNA MESSAGGERO: IL
RUOLO DELL’RNA TRANSFERT E QUELLO DEI
RIBOSOMI
LE
MUTAZIONI
GENICHE:
MUTAZIONI
SPONTANEE E INDOTTE
LE TAPPE CHE HANNO PORTATO
GLI SCIENZIATI A IDENTIFICARE NEL DNA IL
MATERIALE GENETICO
DESCRIVERE IL MODELLO A DOPPIA ELICA DI
WATSON E CRICK
IDENTIFICARE NEL NUCLEOTIDE L’UNITÀ
FONDAMENTALE DEL DNA
CORRELARE
LA STRUTTURA DEL DNA CON LA
SUA FUNZIONE
SPIEGARE PERCHÉ LA DUPLICAZIONE DEL DNA
SI DICE SEMICONSERVATIVA
DESCRIVERE I MECCANISMI DI DUPLICAZIONE
DEL DNA
I
POSSIBILI
ERRORI
DI
DESCRIVERE
DUPLICAZIONE E LE MODALITÀ DI RIPARAZIONE
MESSE IN ATTO DALLA CELLULA
DESCRIVERE L'ORGANIZZAZIONE STRUTTURALE
DEL CROMOSOMA EUCARIOTE
LE TAPPE CHE HANNO PORTATO
GLI SCIENZIATI A COLLEGARE I GENI AI
POLIPEPTIDI
DESCRIVERE STRUTTURA E FUNZIONI DELL’RNA
MESSAGGERO, TRANFERT E RIBOSOMIALE
DESCRIVERE LE TRE TAPPE IN CUI PUÒ ESSERE
SUDDIVISA LA TRASCRIZIONE
DESCRIVERE LE CARATTERISTICHE DEL CODICE
GENETICO
DESCRIVERE
STRUTTURA
E
FUNZIONI
DEI
RIBOSOMI
ILLUSTRARE LE TRE TAPPE DELLA TRADUZIONE
DISTINGUERE LE MUTAZIONI DI SENSO, QUELLE
NON SENSO E QUELLE PER SCORRIMENTO DELLA
FINESTRA DI LETTURA
MODULO 4
-
LA GENETICA DI
-
VIRUS
E BATTERI
-
LO
SCAMBIO DI MATERIALE GENETICO NEI
BATTERI
IL MATERIALE GENETICO EXTRACROMOSOMICO
DEI BATTERI: I PLASMIDI
LA CONIUGAZIONE, LA TRASFORMAZIONE E LA
TRASDUZIONE
LA STRUTTURA DEI VIRUS E IL LORO CICLO
RIPRODUTTIVO
LA RIPRODUZIONE DEI BATTERIOFAGI: CICLO
LITICO E CICLO LISOGENO
I VIRUS A RNA
SPIEGARE
IL RUOLO SVOLTO DAI PLASMIDI
NELLA CELLULA BATTERICA E IN PARTICOLARE
NELLA DIFFUSIONE DELLA RESISTENZA AGLI
ANTIBIOTICI
SPIEGARE
IL
RUOLO
SVOLTO
DALLA
CONIUGAZIONE
NELLA
RICOMBINAZIONE
BATTERICA
ILLUSTRARE LE MODALITÀ DI RICOMBINAZIONE
GENICA PER TRASDUZIONE E TRASFORMAZIONE
NEI BATTERI
DESCRIVERE LA STRUTTURA DEI VIRUS
DISTINGUERE
IL
CICLO
LITICO
DAL
CICLO
LISOGENO
ILLUSTRARE
RNA
MODULO 5
LA GENETICA
-
CLASSICA
-
-
LE
LEGGI DI MENDEL: LA LEGGE DELLA
DOMINANZA, LA LEGGE DELLA SEGREGAZIONE E
LA LEGGE DELL'ASSORTIMENTO INDIPENDENTE
LE ECCEZIONI ALLE LEGGI DI MENDEL: LA
COMPARSA DELLE MUTAZIONI, LA DOMINANZA
INCOMPLETA E LA CODOMINANZA, GLI ALLELI
MULTIPLI, L'EPISTASI, L'EREDITÀ POLIGENICA,
LA PLEIOTROPIA
GLI STUDI DI MORGAN E LA DETERMINAZIONE
CROMOSOMICA DEL SESSO
LE MALATTIE GENETICHE LEGATE AI
CROMOSOMI SESSUALI
I CICLI RIPRODUTTIVI DEI VIRUS A
ILLUSTRARE
LE
FASI
SPERIMENTALE DI MENDEL
DEL
LAVORO
ENUNCIARE
LE LEGGI DELLA DOMINANZA,
DELLA SEGREGAZIONE E DELL'ASSORTIMENTO
INDIPENDENTE
INDIVIDUARE LE CONSEGUENZE DI UNA
MUTAZIONE
DIFFERENZIARE LA DOMINANZA INCOMPLETA
DALLA CODOMIANZA
SPIEGARE COME UN SINGOLO ALLELE PUÒ
INFLUENZARE
PIÙ
DI
UN
FENOTIPO
O
INFLUENZARE L’ESPRESSIONE FENOTIPICA DI UN
ALTRO GENE
SPIEGARE
COME MAI ALCUNI CARATTERI
COMPAIONO IN UNA POPOLAZIONE CON UNA
ENORME GRADAZIONE DI FENOTIPI DIFFERENTI
DISTINGUERE
GLI AUTOSOMI DAI CROMOSOMI
SESSUALI
DESCRIVERE LE MODALITÀ DI TRASMISSIONE DEI
CARATTERI LEGATI AL SESSO
MODULO 6
LA GENETICA E LO
-
STUDIO DEI PROCESSI
EVOLUTIVI
-
LA
GENETICA
DELLE
POPOLAZIONI:
POPOLAZIONE, POOL GENICO E FITNESS
RIPRODUTTIVA
L'IMPORTANZA DELLA VARIABILITÀ GENETICA E
I FATTORI CHE LA INDUCONO
L'EQUILIBRIO DI HARDY-WEINBERG E I FATTORI
CHE ALTERANO LE FREQUENZE ALLELICHE
LA SELEZIONE NATURALE E LE SUE DIVERSE
FORME:
STABILIZZANTE,
DIVERGENTE,
DIREZIONALE,
BILANCIATA,
FREQUENZADIPENDENTE, SESSUALE
DEFINIRE
IL CONCETTO DI POPOLAZIONE, DI
POOL GENICO E DI FITNESS DARWINIANA
INDIVIDUARE I PRINCIPALI FATTORI CHE
AUMENTANO LA VARIABILITÀ GENETICA IN UNA
POPOLAZIONE
ENUNCIARE LA LEGGE DI HARDY-WEINBERG E
LE CONDIZIONI NECESSARIE PER DETERMINARE
UNA VARIAZIONE DELLE FREQUENZE ALLELICHE
DISTINGUERE LE DIVERSE MODALITÀ CON CUI
AGISCE LA SELEZIONE NATURALE RIPORTANDO
OPPORTUNI ESEMPI
INDIVIDUARE
NELL'ADATTAMENTO
ALL'AMBIENTE IL RISULTATO DELL'AZIONE
DELLA SELEZIONE NATURALE
CHIMICA
MODULO
CONTENUTI
MODULO 1
-
LA CLASSIFICAZIONE
-
DELLA MATERIA
-
LA
COMPOSIZIONE DELLA MATERIA: SOSTANZE
PURE E MISCUGLI.
LE SOSTANZE PURE: GLI ELEMENTI E I COMPOSTI
(MOLECOLARI E IONICI)
SIMBOLI CHIMICI E FORMULE CHIMICHE
I MISCUGLI OMOGENEI: SOLUZIONI, LEGHE E
MISCUGLI AERIFORMI
I MISCUGLI ETEROGENEI: SCHIUME, NEBBIE,
FUMI, EMULSIONI
I PRINCIPALI METODI DI SEPARAZIONE DEI
MISCUGLI
OBIETTIVI DIDATTICI (ABILITÀ,
COMPETENZE)
DEFINIRE
E RICONOSCERE SOSTANZE PURE E
MISCUGLI
DISTINGUERE UN ELEMENTO DA UN COMPOSTO E
UN COMPOSTO IONICO DA UNO MOLECOLARE
INDIVIDUARE I SIMBOLI DEI DIVERSI ELEMENTI
CHIMICI
SPIEGARE IL SIGNIFICATO DELLE FORMULE
CHIMICHE E RICAVARE INFORMAZIONI DA ESSE
DEFINIRE E RICONOSCERE I DIVERSI MISCUGLI
OMOGENEI ED ETEROGENEI
UTILIZZARE LE PRINCIPALI TECNICHE DI
SEPARAZIONE
DEI
COMPONENTI
DI
UN
MISCUGLIO
MODULO 2
LA QUANTITÀ
CHIMICA:
LA MOLE
-
MASSA RELATIVA E MASSA ASSOLUTA
LA MASSA RELATIVA DEGLI ATOMI: L’UNITÀ DI
-
MASSA ATOMICA
LA MASSA MOLECOLARE
CALCOLO
IL CONCETTO DI MOLE E LA MASSA MOLARE
IL NUMERO DI AVOGADRO
CALCOLARE
-
LE REAZIONI CHIMICHE E LE LEGGI PONDERALI:
LA LEGGE DI LAVOISIER, LA LEGGE DI PROUST E
LA LEGGE DI DALTON
LA TEORIA ATOMICA DI DALTON
IL BILANCIAMENTO DELLE EQUAZIONI CHIMICHE
DEFINIRE
MODULO 3
LE REAZIONI
-
CHIMICHE E LE
LEGGI CHE LE
GOVERNANO
-
MODULO 4
-
LA STRUTTURA
DELL'ATOMO E I
-
DIVERSI MODELLI
ATOMICI
-
-
-
PERIODICO
IL
RELATIVO
E I CALCOLI STECHIOMETRICI
-
MODULO 5
IL SISTEMA
E
-
-
MODULO 6
-
I LEGAMI CHIMICI
-
LA
SCOPERTA
DELL’ESISTENZA
DELLE
PARTICELLE SUBATOMICHE
I PRIMI MODELLI ATOMICI DI THOMSON E
RUTHERFORD
ALCUNI DATI SUGLI ATOMI: IL NUMERO
ATOMICO, IL NUMERO DI MASSA E GLI ISOTOPI
LA DOPPIA NATURA DELLA LUCE. IL MODELLO
ATOMICO DI BOHR
IL PRINCIPIO DI INDETERMINAZIONE DI
HEISENBERG
E
LA
DOPPIA
NATURA
DELL’ELETTRONE. L'EQUAZIONE D'ONDA
LA
TEORIA ATOMICA MODERNA: GLI ORBITALI
ATOMICI ED I NUMERI QUANTICI. IL PRINCIPIO
D'ESCLUSIONE DI PAULI
LA CONFIGURAZIONE ELETTTRONICA DEGLI
ELEMENTI CHIMICI
IL PRINCIPIO DI AUFBAU E LA REGOLA DI HUND
IL
SISTEMA PERIODICO DI MENDELEEV E LA
MODERNA TAVOLA PERIODICA DEGLI ELEMENTI
LA
CLASSIFICAZIONE DEGLI ELEMENTI IN
METALLI, NON METALLI E SEMIMETALLI
LA CORRISPONDENZA TRA SISTEMA PERIODICO E
CONFIGURAZIONE
ELETTRONICA
DEGLI
ELEMENTI.
LA NOTAZIONE DI LEWIS
LE PROPRIETÀ PERIODICHE DEGLI ELEMENTI: IL
RAGGIO ATOMICO, L’ENERGIA DI IONIZZAZIONE,
L’AFFINITÀ
ELETTRONICA,
L’ELETTRONEGATIVITÀ
LA CONFIGURAZIONE ELETTRONICA STABILE:
L’OTTETTO
IL LEGAME COVALENTE PURO, POLARE E
DATIVO
IL LEGAME IONICO E I COMPOSTI IONICI, IL
LEGAME METALLICO
LA FORMA DELLE MOLECOLE E LA TEORIA
VSEPR
I LEGAMI TRA MOLECOLE: LE FORZE DIPOLODIPOLO, LE FORZE DI LONDON, IL LEGAME A
IDROGENO
MODULO 7
LA CLASSIFICAZIONE
-
LA VALENZA E IL NUMERO DI OSSIDAZIONE
I COMPOSTI BINARI: OSSIDI, IDRURI, IDRACIDI E
DEFINIRE L'UNITÀ DI MASSA ATOMICA
CALCOLARE LA MASSA MOLECOLARE
DEFINIRE LA MOLE E USARLA COME
UNITÀ DI
MISURA DELLA QUANTITÀ DI SOSTANZA
IL NUMERO DI MOLI DI UNA
SOSTANZA METTENDO IN RELAZIONE IL NUMERO
DI MOLI CON IL VALORI DELLA MASSA E DELLA
MASSA MOLARE
INDICARE IL SIGNIFICATO DELLA COSTANTE DI
AVOGADRO
LE TRE LEGGI DELLA CHIMICA CHE
RIGUARDANO GLI ASPETTI QUANTITATIVI DELLE
REAZIONI CHIMICHE E DISCUTERE LE LORO
IMPLICAZIONI
DESCRIVERE IL MODELLO ATOMICO DI DALTON
RAPPRESENTARE LE REAZIONI CHIMICHE CON
EQUAZIONI CHIMICHE E SCRIVERE QUESTE
ULTIME IN MODO CORRETTO SECONDO LA
SIMBOLOGIA CHIMICA
CENNI AI CALCOLI STECHIOMETRICI
SPIEGARE LE PROPRIETÀ DELLE PARTICELLE CHE
COMPONGONO L'ATOMO
CONFRONTARE I MODELLI ATOMICI DI THOMSON
E DI RUTHERFORD
DEFINIRE IL NUMERO ATOMICO, IL NUMERO DI
MASSA E GLI ISOTOPI
DESCRIVERE
IL
COMPORTAMENTO
ONDULATORIO E CORPUSCOLARE DELLA LUCE
PORRE IN RELAZIONE LE OSSERVAZIONI
DERIVANTI DALLA SPETTROSCOPIA ATOMICA E IL
MODELLO ATOMICO DI BOHR
ILLUSTRARE
LE TAPPE FONDAMENTALI CHE
HANNO CONSENTITO LA FORMULAZIONE DELLA
TEORIA ATOMICA MODERNA
RAPPRESENTARE
LA
CONFIGURAZIONE
ELETTRONICA DEGLI ELEMENTI
SPIEGARE
PERIODICA
LA DIFFERENZA TRA LA TAVOLA
DI MENDELEEV E LA TAVOLA
PERIODICA MODERNA
DESCRIVERE LA TAVOLA PERIODICA E
DISCUTERE LA SUA IMPORTANZA
INDIVIDUARE LE DIFFERENZE TRA METALLI,
SEMIMETALLI E NON METALLI
SPIEGARE LA RELAZIONE TRA STRUTTURA
ELETTRONICA E POSIZIONE DEGLI ELEMENTI
SULLA TAVOLA PERIODICA
SCRIVERE E SPIEGARE I SIMBOLI DI LEWIS
DESCRIVERE LE PRINCIPALI
PROPRIETÀ
PERIODICHE E PORLE IN RELAZIONE CON IL
MODELLO ATOMICO MODERNO
IDENTIFICARE GLI ELEMENTI ATTRAVERSO LE
LORO PROPRIETÀ PERIODICHE
DESCRIVERE I VARI TIPI DI LEGAME CHIMICO TRA
ATOMI
PREVEDERE QUALE TIPO DI LEGAME SI FORMA
TRA DUE ATOMI
STABILIRE LA POLARITÀ DEI LEGAMI COVALENTI
E DELLE MOLECOLE SULLA BASE DELLE
DIFFERENZE DI ELETTRONEGATIVITÀ DEGLI
ELEMENTI E LA GEOMETRIA DELLE MOLECOLE
DESCRIVERE I PRINCIPALI TIPI DI INTERAZIONI
INTERMOLECOLARI
PREVEDERE ALCUNE PROPRIETÀ DELLE
SOSTANZE IN BASE AI TIPI DI LEGAME PRESENTI
NELLE LORO MOLECOLE E AI TIPI DI INTERAZIONI
TRA UNA MOLECOLA E L'ALTRA
DEFINIRE
E ASSEGNARE IL NUMERO DI
OSSIDAZIONE AD OGNI ELEMENTO NEI VARI
E LA NOMENCLATURA
DEI COMPOSTI
INORGANICI
-
-
SALI BINARI, LE LORO CARATTERISTICHE E LE
PRINCIPALI REAZIONI DI FORMAZIONE
I COMPOSTI TERNARI: OSSIACIDI, IDROSSIDI E
SALI TERNARI, LE LORO CARATTERISTICHE E LE
COMPOSTI
RICONOSCERE LE VARIE CATEGORIE DI
COMPOSTI E CLASSIFICARLI IN BASE ALLA LORO
NATURA: IONICA O MOLECOLARE, BINARIA O
PRINCIPALI REAZIONI DI FORMAZIONE
LA NOMENCLATURA TRADIZIONALE E IUPAC
DELLE
DIVERSE
CLASSI
DI
COMPOSTI
INORGANICI
TERNARIA
SCRIVERE LA FORMULA DI UN COMPOSTO
CONOSCENDONE IL NOME E INDIVIDUARE IL
NOME DI UN COMPOSTO DALLA SUA FORMULA
SECONDO LE REGOLE DELLA NOMENCLATURA
IUPAC E TRADIZIONALE
SCRIVERE LE EQUAZIONI APPROPRIATE PER LE
REAZIONI DI FORMAZIONE DEI VARI COMPOSTI
Metodologie di lavoro
La conoscenza degli argomenti sopra elencati e la capacità di applicazione della stessa in contesti diversi da
quello scolastico (competenza), costituiscono gli obiettivi didattici perseguiti.
Si precisa che per gli allievi D.S.A. e per gli allievi B.E.S. (Direttiva 27 dicembre 2012 – C.M. n.8 del 6 marzo
2013 – Nota di chiarimenti 2013), non rientranti nella tutela della legge 170 e della legge 104, si perseguirà la
personalizzazione degli apprendimenti. Resta inteso che il diritto alla personalizzazione è un principio generale
rivolto a tutti gli allievi.
Al fine di facilitare l’apprendimento di tutti gli allievi si ricorrerà anche all’utilizzo di schemi e diapositive
sintetiche, utilizzate a lezione, come guida allo studio individuale. Per questo motivo l’insegnante invierà attraverso
email il materiale didattico utilizzato a lezione ai singoli allievi.
In generale si preferirà la lezione frontale, privilegiando comunque il coinvolgimento della classe durante ogni
forma di attività didattica. Si ricorrerà a lezioni interattive in cui gli allievi interagiscono con il docente anche
attraverso domande stimolo; questa modalità sarà finalizzata anche a poter valutare gli apprendimenti raggiunti,
con strumenti diversi rispetto a quelli tradizionali.
Si darà spazio a lavori di gruppo e a discussioni, cercando comunque di rendere interessante l’attività didattica,
cercando di collegare gli argomenti studiati a fatti ed esperienze della realtà quotidiana.
Sarà possibile utilizzare diversi strumenti didattici, oltre al libro di testo, come la LIM per la proiezione di lezioni
in Powerpoint, audiovisivi, articoli scientifici, ecc.
Sarà utilizzata inoltre l’attività di laboratorio come indispensabile strumento nell’apprendimento delle scienze
sperimentali, soprattutto per gli argomenti trattati di Chimica.
Verifica e valutazione
Si effettueranno frequenti verifiche del grado di apprendimento e del raggiungimento delle abilità richieste,
al fine di programmare eventuali recuperi o approfondimenti. Si utilizzeranno verifiche scritte ed orali (formative e
sommative; strutturate e non strutturate) che costituiranno anche momento di riesame del lavoro svolto in classe e
della programmazione stessa. Nel caso in cui saranno effettuate esercitazioni di laboratorio, verranno valutate
anche le relazioni tecniche redatte sulla base di un protocollo proposto dall’insegnante. Per il numero di verifiche
da svolgere nel corso dell’anno, si rimanda a quanto stabilito nel Piano dell’Offerta Formativa.
Nella valutazione globale si terrà conto, oltre che delle verifiche eseguite, anche della situazione iniziale,
dei progressi compiuti nelle capacità espositive e nella proprietà di linguaggio, dell’impegno e della partecipazione
in classe, della continuità e dell’assiduità nell’impegno di studio. Per i criteri di valutazione adottati si fa
riferimento alle griglie di valutazione incluse nel Piano Dell’Offerta Formativa dell’Istituto, e a quelle elaborate
all’interno del Dipartimento di Scienze, al fine di garantire uniformità di giudizio nelle diverse classi.
Alunni D.S.A.
Ai sensi della legge 170, del Decreto Attuativo n. 5669 e delle Linee Guida per il diritto allo studio degli alunni e
degli studenti con D.S.A., le verifiche saranno costruite tenendo conto degli alunni D.S.A. presenti nella classe.
Sarà consentito a questi alunni di utilizzare gli schemi prodotti durante le verifiche orali e scritte e l’utilizzo di
qualsiasi altro strumento necessario al successo scolastico.
Alunni B.E.S.
Ai sensi della Direttiva 27 dicembre 2012, della C.M. n. 8 del 6 marzo 2013, della Nota di chiarimenti 2013, per gli
alunni B.E.S., individuati formalmente dai C.d.C., non rientranti nella tutela della legge 170 e della legge 104, le
verifiche saranno costruite tenendo conto della situazione di Bisogno Educativo Speciale. In particolare sarà
consentito a questi alunni di utilizzare gli schemi prodotti durante le verifiche orali e scritte e l’utilizzo di qualsiasi
altro strumento compensativo necessario al successo scolastico.
Iniziative di recupero, potenziamento ed arricchimento
Nello svolgimento dell’attività didattica si presterà particolare attenzione a quegli studenti che dovessero
presentare difficoltà nell’apprendimento; in questi casi si potrà programmare una pausa didattica, per consentire il
recupero in orario curricolare. Se, nonostante le strategie messe in atto, alcuni degli studenti dovessero presentare
conoscenze lacunose degli argomenti proposti, sarà compito dell’insegnante valutare, in sede di scrutinio, se
l’alunno sia in grado di recuperare autonomamente le carenze della sua preparazione, o se dovrà frequentare un
corso di recupero o uno sportello metodologico.
In orario curricolare si potranno programmare anche iniziative di potenziamento ed arricchimento per gli
studenti più brillanti ed interessati ad approfondire le tematiche previste nel corso.
Roma, 4 novembre 2016
L’insegnante
Alessandra Tomei