Esercizio1:
a)Una molecola di gas con velocità 300 m/s urta in modo completamente anelastico una molecola di
massa doppia, inizialmente in quiete. Trovare la velocità delle due molecole dopo l’ urto.
Urto completamente anelastico: si conserva solo la quantità di moto del sistema e le due molecole, in
seguito all’urto risulteranno come una massa unica.
v1
m1, v1 , v1 300 m s
Prima dell’urto:
m2
m1
m 2 2m1 , v 2 0
v3
m 3 m1 m 2 3m1 , v 3
Dopol’urto:
Conservazione quantità di moto:
P m1 v1 m 2 v 2 m 3 v 3
v3
m1 v1 m 3 v 3
m1
m1
v1
v1 100 m s
m3
3m1
b) Due molecole identiche che viaggiano alla velocità iniziale, ciascuna in modulo pari a 300 m/s, su
traiettorie convergenti che formano tra loro un angolo di 60°, subiscono un urto completamente
anelastico. Qual è la velocità finale delle due particelle?
y
v1
m1, v1 , v1 v 300 m s
Prima dell’urto:
30°
m 2 m1 m, v 2 , v 2 v 300 m s
x
-30°
v3
m 3 m1 m 2 2m, v 3
Dopol’urto:
Scomponiamo il moto nelle due direzioni lungo x e lungo y
v1x v1 cos 30 v cos 30
v1
v1y v1 sin 30 v sin 30
v 2 x v 2 cos 30 v cos 30
v2
v 2 y v 2 sin 30 v sin 30
Px mv1x mv 2 x 2mv cos 30
Quantità di moto del sistema: P m1 v1 m 2 v 2
Py mv1y mv 2 y mv sin 30 mv sin 30 0
Conservazione quantità di moto:
P m1 v1 m 2 v 2 m 3 v 3
2mv 3
2
3
mv
2
Px 2mv 3x 2mv cos 30
P mv 3
Py 2mv 3y 0
v3
3
3
v
300 m s 260 m s
2
2
Esercizio:
massa m=5 kg. Quando è gonfiato completamente con Elio ha raggio R= 2,879 m. Supponendo che porti
un carico di strumenti la cui massa complessiva è M= 10 kg,
a) Calcolare il peso totale del pallone, dell’ Elio e del carico
4
4
Ftot (M m) ρ (He)
πR 3 g 15 0.16
π 2,883 kg 9.81 m s 2
3
3
15 16 9.81 kg m s 2 304 N
Ftot 304 N
b) Dopo aver calcolato la spinta di Archimede del pallone gonfio con il suo carico, decidere se il
pallone si staccherà dal suolo.
[ raria = 1,16 kg/m3 , rHe = 0,160 kg/m3]
4
4
m
Farch ρ (aria)
πR 3 g 1.16 π 2,883 kg 9.81 2 1.16 99.65 9.81 kg m s 2 1134 N
3
3
s
Farch 1134 N
Farch Ftot
Si il pallone si staccherà dal suolo e salirà
Esercizio:
Un recipiente contenente 0,25 kg di acqua a 20 °C viene posto in un freezer. [fus = 333,7 kJ/kg, cacqua
= 4,2 kJ/(kgK), cghiaccio = 2,1 kJ/(kgK)]
Quanto calore viene sottratto all’acqua per trasformarla interamente in ghiaccio a 0 °C?
• Calcoliamo il calore rilasciato dall’acqua nel passaggio da 20 °C a 0 °C:
Q1 c acqua mΔT c acqua mTf Ti 4.2
kJ
0.25kg 273.16 K (20 273.16) K 21 kJ
kgK
Il segno – sta ad indicare che effettivamente il calore è stato ceduto dall’acqua all’ambiente
• Calcoliamo il calore sottratto all’acqua per trasformarla in ghiaccio => calore latente
Q 2 mλ 0.25 kg 333.7 kJ kg 83.4 kJ
Il calore totale sottratto all’acqua (a 20 °C) per trasformarla interamente in ghiaccio a 0 °C è la
somma dei due contributi:
Q Q1 Q 2 21 kJ 83.4 kJ 104.4 kJ
Quanto calore deve essere sottratto al ghiaccio per portarlo alla temperatura di - 15 °C ?
Q 3 c ghiacciomΔT c ghiacciomTf Ti 2.1
kJ
0.25kg (273.16 15) K (273.16) K 7.88 kJ
kgK
15K
TERMODINAMICA
La termodinamica è lo studio delle trasformazioni reciproche di energia:
Energia meccanica [lavoro,energia cinetica e potenziale]
Energia interna-termica [forma disordinata di energia, moto delle molecole]
Energia interna Eint≡ energia associata ai componenti microscopici (atomi-molecole) del sistema
L’energia interna include:
•Energia cinetica e potenziale associata al moto casuale (traslazionale, rotazionale e vibrazionale) di
atomi e molecole
•Energia di legame fra le molecle
I concetti fondamentali della termodinamica sono:
TEMPERATURA
CALORE
TEMPERATURA
CALORE
Nel S.I si misura in gradi kelvin (K)
•Può essere innalzata a piacere
•Non può scendere al di sotto dello 0 assoulto (T=0 K)
rappresenta il meccanismo di trasferimento di energia sistemaambiente causato dalla differenza di temperatura e è anche la
quantità Q di energia trasferita
Sapendo che:
Contatto termico => Oggetti in contatto termico all’interno di un contenitore isolante:
a temperature diverse si scambiano energia ( calore)
Equilibrio termico => Situazione in cui due oggetti a contatto termico cessano di avere scambio di
energia( calore)
PRINCIPIO ZERO DELLA TERMODINAMICA:
Se i corpi A e C sono separatamente in equilibrio termico con il corpo B,
allora A e C sono in equilibrio termico se posti a contatto termico
PRINCIPIO ZERO DELLA TERMODINAMICA:
Se i corpi A e C sono separatamente in
equilibrio termico con il corpo B, allora A
e C sono in equilibrio termico se posti a
contatto termico
NB:
La temperatura è una proprietà che determina se un corpo si trova in equilibrio
termico con altri corpi.
Due copri in equilibrio termico hanno stessa temperatura e non c’è scambio di calore
SCALE DI TEMPERATURA:
Scala Celsius
TC=TK-273.15°
DTC=DTK
Scala Fahrenheit
TF=9/5 TC+32°
DTF=9/5 DTc
NB: tra il punto di fusione normale e quello di ebollizione normale (EN) dell’acqua si
contano 100 gradi nelle scale Kelvin e Celsius e 180 in quelle Rankine e Fahrenheit, da
cui il rapporto di 5/9 tra l’unità di un grado nelle due scale anglosassoni e quella nelle
due scale SI. Inoltre il punto di fusionenormale si trova a 0°C e a 32°F. Per cui:
TF=9/5 TC+32°
Se (guardando la figura affianco) x è la temperatura
espressa in gradi Celsius ed y la corrispondente
temperatura in gradi Fahrenheit, vale la seguente
proporzione:
y 32
x 0
100 0
212 32
Che si può riscrivere:
x
100
y 32 5 y 32
180
9
Esercizio1:
Determinare la temperatua del punto triplo dell’acqua nella scala Fahrenheit ed in quella assoluta,
sapendo che il punto triplo dell’acqua è lo stato di temperatura (0.01 °C) e pressione (4.55 mm Hg) in cui
coesistono all’equilibrio acqua,vapor d’acqua e ghiaccio
Il valore di temperatura del punto triplo nella scala Fahrenheit è:
9
9
TF TC 32 F 0.01 32 F 32.02 F
5
5
Il valore di temperatura del punto triplo nella scala assoluta è:
TK TC 273.15K
0.01 273.15K
273.16 K
Esercizio2:
796 K equivalgono a circa:
1)796 °C
2)1069 °C
TC TK 273.15C TC 796 273.15C 523C
٧3)523 °C
4)0 °C
Esercizio4:
La temperatura ambientale è di 20°C, convertirla in gradi Fahrenheit.
TF 9 5 TC 32F T 9 5 20 32F 68F
Esercizio5:
A quale temperatura i gradi Fahrenheit risultano
a) Doppi di quelli celsius
b) La metà di quelli Celsius?
TF 9 5 TC 32
TF
T
5
10
320
320
TF
2 TF
TF
F
TF 320F
TC 320 32 C 160C
a ) T
5
9
9
9
9
9
C
TF 32
9
TF
1
5
160
13
160
160
TF
TF
TF
TF
TF
F 12.3F
b ) T
5
2
18
18
18
18
13
C
TF 32
9
5
TC - 12.3 32 C 24.6C
9
Esercizio6:
In una vecchia nota scientifica che descrive una scala Z nella quale il suo punto di ebollizione
dell’acqua si trova a 65 °Z ed il punto di congelamento a -14 °Z.
A quale valore della scala Celsius corrisponde una temperatura di T=-98 °Z, supponendo la scala Z
lineare (TC=A+BTZ)?
0C A B 14Z
100C A B 65Z
ΔTC 100C B 65Z - B 14Z B 79Z B
ΔTc Tc 0C BΔTz B 98Z 14Z 1.27 84C 106C
100
1.27
79
DILATAZIONE TERMICA DEI SOLIDI
I materiali solidi o liquidi variano le loro dimensioni lineari al variare della temperatura
(è il principio di funzionamento dei termometri a liquido)
Giunto su una rotaia
Esempio:
Per i fabbricati, le autostrade le ferrovie ed i ponti
vengono usati dei
GIUNTI PER COMPENSARE LE VARIAZIONI
DI DIMENSIONI CON LA TEMPERATURA
La dimensione lineare di un oggetto cambia di una quantità DL quando la sua temperatura varia
di una quantità DT:
ΔL α L i ΔT L f L i α L i Tf - Ti
Temperatura
To
Dove α è il COEFFICIENTE DI DILATAZIONE LINEARE, dipende
dalla sostanza ed ha come unità di misura (°C)-1
ES:
Alluminio: α =23∙10-6(°C)-1
L + DL
Temperatura
To+DT
Per piccole variazioni di temperatura:
ΔA γ A i ΔT A f A i 2α A i Tf - Ti
ΔV β Vi ΔT Vf Vi 3α Vi Tf - Ti
Dove:
γ = 2α è ilcoefficiente di dilatazione
superficiale
β = 3α è il coefficiente di dilatazione
volumica
COMPORTAMENTO ANOMALO DELL’ACQUA
In generale il volume di un liquido aumenta con T ad eccezione dell’acqua
Da 0 a 4 °C il volume diminuisce (aumenta la densità)
Esercizio1:
Negli stati uniti gli estremi di temperatura vanno dai 60°C in estate ai -40 °C in inverno.
Qual’è l’effetto su 10 m di autostrada?
(α del cemento=12∙10-6 (°C)-1)
ΔL α L i ΔT
12 10 - 6 C1 10 m 40 60C 12 10 - 6 10 3 m 12 10 - 3 m 1.2 cm
Passando dall’estate all’inverno la lunghezza dei 10 m di autostrada diminuisce di 1.2 cm.
Viceversa passando dall’inverno all’estate un pezzo di 10 m di autostrada si allunga di 1.2 cm
Esercizio2:
Un foro circolare in un piatto di alluminio ha diametro di 2.725 cm alla temperatura di 0,000 °C. Qual’è il
diametro del foro quando la temperatura sale a 100°C ?
D f D i α D i Tf Ti
α Al 23 10 6 C
1
D f D i α D i Tf Ti 2.725 cm 23 10 -6 C1 2.725 cm 100. C
2.725 cm 0.006 cm 2.731cm
Esercizio3:
Un cubo di ottone alla temperatura di 20°C ha lato di lunghezza 30 cm. Qual’è l’incremento della sua
superficie totale quando viene riscaldato fino a 75 °C?
La superficie totale del cubo è pari a 6 volte la superficie del quadrato di lato ℓ (il cubo è composto di 6
facce). La dilatazione termica di ogni faccia del cubo è data da:
ΔA γ Ai ΔT 2α A i Tf Ti
α Ottone 19 10 6 C
1
ΔA 2α A i Tf Ti 2 19 10 -6 C1 30 2 cm 2 75 -20 C 1.881 cm 2
L’incremento della superficie totale del cubo èquindi pari a:
ΔATot 6 ΔA 6 1.881 cm 2 11 cm 2
Esercizio4:
Due blocchi di calcestruzzo in un ponte lungo 250 m sono disposti consecutivamente senza spazio fra di
essi.
Se T aumenta di 20°C, qual’è l’altezza y a cui si alzano i blocchi per deformazione?
α cemento 12 10 6 C
1
L’aumento di temperatura, produce una dilatazione
lineare delle due parti del ponte, che di conseguenza si
alzano dalla parte mobile, nel punto di giunzione.
Calcoliamo intanto la dilatazione lineare che subiscono
i due blocchi:
ΔL L f L i α L i ΔT L f L i 1 α ΔT 125 m 1 12 10 6 C1 20 C 125.03 m
L f 125.03m
L’altezza y di cui si alzano i due blocchi si ottiene dal teorema di pitagora:
y
L2f L2i
125.032
125.2 m
15632.501 15625 m
7.5 m 2.74 m
y 2.74 m ! ! ! ! ! ! ! !
Se nella costruzione dei ponti non viene tenuta in considerazione la dilatazione termica dei materiali,
si richiano grossi problemi dovuti alla deformazione delle strutture
CALORE
ENERGIA TRASFERITA tra un corpo (sistema) e l’ambiente circostante a causa di una
differenza di temperatura
Calore: Forma di energia scambiata tra due corpi a diversa temperatura
Temperatura: Osservabile che determina la DIREZIONE DEL FLUSSO di calore (da Tmaggiore a Tminore).
NB: Non misura la quantità di calore
La parità di temperatura blocca il trasferimento di calore
Unità di misura del calore:
Caloria
Poichè il calore, come il lavoro è un
trasferimento di energia si misura anche
in Joule.
quantità di calore necessaria per innalzare
la temperatura di un grammo di acqua da
14.5 °C a15.5 °C
1 cal = 4.186 J
TS>TA
Il sistema cede calore
all’ambiente
Energia esce dal sistema
fin quando non si raggiunge
nuovamente
l’equilibrio termico
Q<0
TS=TA
Il sistema e l’ambiente
sono in equilibrio
termico
Non c’è trasferimento di
energia
Q=0
TS<TA
Il sistema assorbe calore
dall’ambiente fintanto
che non si raggiunge
nuovamente l’equilibrio
termico
Energia entra nel sistema
Q>0
CALORE SPECIFICO
La quantità di calore necessaria
per aumentare la temperatura di
una sostanze dipende dalla sostanza
stessa e dalla sua massa.
Per affrancarsi dalla massa,
viene definito il
CALORE SPECIFICO
Questa dipendenza è
descritta per mezzo della
CAPACITÀ TERMICA C
Q
c
Q c m ΔT
m ΔT
C
Q
ΔT
quantità di calore per
unità di massa ed
unità di T:
Il calore specifico si esprime in joul/(K g) o in J/(K mole) a seconda che la quantità di materia si
misuri in grammi o moli (calore specifico molare).
NB:
La capacità termica è una quantità caratteristica di un dato sistema.
Il calore specifico c è una quantità caratteristica del materiale che costituisce il corpo
In generale il calore specifico dipende dalle condizioni sperimentali, soprattutto per i gas.
esistono due diversi valori del calore specifico a seconda che esso sia associato
a trasformazioni a volume costante (cv) o a pressione costante (cp)
Applicazione
Il calore specifico descrive la capacità di una sostanza di immagazzinare calore. Più alto è il valore
del calore specifico, più una sostanza immagazzina calore.
Il calore specifico dell’acqua, 1 Cal/g °C a 14.5 °C e 1 atm, è superiore a quello della maggior
parte delle altre sostanze.
Ecco perchè il clima vicino al mare o ai grandi laghi è più temperato rispetto al clima continentale,
perché l'acqua assorbe calore quando il sole riscalda e lo cede di notte evitando così forti escursioni
termiche (stesso discorso vale nell’arco dell’anno=> inverni non troppo rigidi poichè durante l’estate
il mare accumula calore che rilascia nell’ambiente durante l’inverno e che viene trasportato a terra dai
venti).
Dipendenza del calore specifico dell’acqua
dalla temperatura (la scala delle ordinate è
molto amplificata!)
c H 2O 1
Cal
g C
una mole di acqua corrisponde a 18,016 g
perché la massa molecolare è uguale
appunto a 18,016.quindi:
1g di H2O contiene 1/18.016 moli
c H 2O 1
Cal
Cal
Cal
1
18.016
g C
1 18.016 moli C
moli C
Esercizio1:
Per misurare il calore specifico di una sostanza a cui è stata somministrata una quantità di calore Q nota,
occorre determinare:
1)la variazione di temperatura
2)la temperatura finale e la massa del corpo
3)la temperatura iniziale e la massa del corpo
٧4)la variazione di temperatura e la massa del corpo
Il calore specifico è definito come:
c
C
Q
m
mΔT
Nota Q, ciò che si deve
conoscere è la variazione di
temperatura e la massa
Esercizio2:
Se tutta l’energia potenziale dell’acqua che precipita dalle cascate del Niagara da un’altezza di 50 m
fosse completamente utilizzata per riscaldare l’acqua, l’aumento di temperatura sarebbe
(cacqua=1cal/(gC)):
L’energia potenziale della cascata è U = mgh
Il calore fornito sarebbe quindi Q = mgh
1)120 C
2)12 C
3)1,2 C
٧4)0,12 C
Conoscendo il calore specifico dell’acqua possiamo
determinare la variazione di temperatura, infatti
Ricordiamo che il calore specifico è:
Q c m ΔT
C
Q
c
Q c m ΔT
m
m ΔT
Q m
gh c acqua m
ΔT ΔT
gh
c acqua
9.8 50 J Kg
490
C 0.12 C
4.186 J gC
4186
1cal=4.186 J
DT = 0.12 °C
Esercizio3:
Due corpi hanno stessa massa e temperatura. Entrambi assorbono uguali quantità di calore da una fonte
esterna. La loro temperatura finale può essere differente perché hanno:
1)differenti coefficienti di espansione termica
2)densità diverse
3)volumi diversi
٧4)capacità termiche diverse
C
Q
ΔT
Se i due materiali hanno capacità termiche C1 e C2 diverse, a parità di calore
fornito, subiranno variazioni di temperatuta diverse.
Esercizio4:
Un ferro di cavallo di 1.5 kg inizialmente a 600°C, è lasciato cadere in un secchio contenente 20.0 kg
d’acqua a 25 àC. Qual’è la temperatura finale?
[trascurare il calore specifico del contenitore e assumere che solo una piccola parte dell’acqua vaporizzi]
c acqua 4190 J Kg 1 C 1
448 J Kg 1 C 1
c Fe
Nel momento in cui il ferro viene immerso nell’acqua comincia il trasferimento di calore dal ferro al
liquido a causa dell’elevata differenza di temperatura tra le due sostanze. Il trasferimento si
interromperà quando la temperatura del ferro e dell’acqua non sarà la stessa.
Il sistema ferro-acqua può essere considerato isolato, cosicchè la somma della quantità di calore
assorbita dall’acqua con quella ceduta dal ferro è nulla=> l’energia ceduta dal ferro è assorbita
dall’acqua.
Q Fe Q acqua 0 m Fe c Fe Tfinale 600C m acqua c acqua Tfinale 25C 0
m Fe c Fe
Tfinale
m acqua c acqua Tfinale m Fe c Fe 600C - m acqua c acqua 25C 0
m Fe c Fe 600C m acqua c acqua 25C
m Fe c Fe m acqua c acqua
1.5 kg 448 J kg - 1 C - 1 600C 20.0 kg 4190 J kg - 1 C - 1 25C
1.5 kg 448 J kg - 1 C - 1 20.0 kg 4190 J kg - 1 C - 1
2498200
C 29.6 C
84472
T 29.6C
Attenzione: notate come la temperatura di equilibrio sia molto vicina a quella iniziale dell’acqua. Questo
perchè il calore specifico dell’acqua è circa 10 volte superiore a quello dele ferro ed inoltre la massa
dell’acqua è circa 13 volte superiore a quella del ferro di cavallo, cosicchè la capacità termica dell’acqua
è circa 125 volte quella del ferro di cavallo =>
a parità di calore trasferito la variazione di temperatura dell’acqua è 125 volte più piccola di quella
del ferro di cavallo!
Calore Latente e Cambio di Fase
Non sempre l’assorbimento o la
cessione di energia da parte di
un sistema corrisponde ad una
sua variazione di temperatura
Esempio: Acqua che bolle in una pentola
Pur fornendo calore tramite la fiamma del fornello, la temperatura
dell’acqua rimane fissa a 100 °C (al livello del mare).
Ci sono dei casi in cui
l’energia trasferita è
utilizzata per modificare la
struttura della sostanza
Cambio di Fase
Solido Liquido
Liquido Gas
Il calore viene utilizzato per il cambio di fase della sostanza e la temperatura rimane
invariata, pur con assorbimento o emissione di calore, fintanto che si è in presenza di una
miscela della sostanza in due (o tre) stati diversi
Ogni sostanza ha due valori di
CALORE LATENTE
caratteristici
Lfus(fusione) ed
Levap(evaporazione).
Levaporazione >> Lliquefazione
Calore necessario per il
cambio di fase (L=calore
latente)
Q m L
Esercizio1:
E’ sempre vero che il calore necessario a produrre un cambiamento di stato completo di un corpo:
1)è inversamente proporzionale alla variazione di temperatura del corpo
2)è indipendente dalla massa del corpo
3)è direttamente proporzionale alla variazione di temperatura del corpo
٧4)è direttamente proporzionale alla massa del corpo
Q m L
Esercizio2:
A ) Quanto calore occorre fornire ad una massa di ghiaccio di 720 g alla temperatura di -10 °C per farlo
passare alla stato liquido ad una temperatura di 15 °C?
B ) Se si fornisce al ghiaccio una quantità di calore totale pari a 210 kJ, quali sono lo stato finale e la
temperatura dell’acqua finale?
c ghiaccio (10C) 2220 J Kg 1 C 1
c acqua 4190 J Kg 1 C 1
L fusione 333 kJ kg 1
A ) si deve dividere il processo in tre stadi:
1) Innalzamento della temperatura del ghiaccio da -10 °C alla temperatura di fusione (=0 °C) (il
ghiaccio non può fondere a T inferiori al punto di congelamento).
2) Fase di liquefazione del ghiaccio (T costante =0 °C).
3) Innalzamento della temperatura del liquido da 0 °C a 15 °C.
Stadio 1) Il calore necessario per portare la massa di ghiaccio ad una temperatura di 0 °C è data da:
Q1 c ghiaccio m ΔT 2220 J kg 1 C 1 0.720 kg 0C 10 C 15.98 kJ
Stadio 2) Il calore necessario per liquefarre l’intera massa di ghiaccio (T= 0 °C) è data da:
Q 2 L liq m 333 kJ kg 1 0.720 kg 238 kJ
Stadio 3) Il calore necessario per portare la massa di acqua ad una temperatura di 15 °C è data da:
Q 3 c acqua m ΔT 4190 J kg 1 C 1 0.720 kg 15C 0 C 45.25 kJ
Calore Q richiesto per l’intero processo:
Q tot Q1 Q 2 Q 3
1 kJ 238 kJ 45.2 kJ 299 kJ
B) dei 210 kJ forniti 16 kJ servono per innalzare la temperatura del ghiaccio a 0°C, rimangono a
disposizione solo 194 kJ che non sono sufficienti a liquefarre tutto il ghiaccio ( <210 kJ).
Rimane quindi una miscela di acqua e ghiacio (alla temperatura di 0°C) dove la massa di
acqua è data:
194 kJ
0.583 kg 583 g
333 kJ kg1
(720 583) kg 140 g
m acqua 198kJ L liq
m ghiaccio m-m acqua
Esercizio3:
Un proiettile di piombo di massa 3.00 g a 30.0 °C, alla velocità di 240 m/s, colpisce un blocco di
ghiaccio a 0°C, rimanendovi conficcato.
Quanto ghiaccio fonde?
v
c acqua 4190 J Kg 1 C 1
c piombo 128 J Kg 1 C 1
L g 333 KJ Kg
In un sistema isolato tutta l’energia cinetica iniziale e tutta l’energia interna del proiettile si trasformano
in energia interna di fusione del ghiaccio. La massa di ghiaccio fuso si determina dal calore latente di
fusione
Q mL m
Q
L
p => proiettile
g => ghiaccio
E cin p Q p Q g
1
m p v 2 m p c Pb ΔT p m g L g m g
2
mg
1
m p v 2 m p c Pb ΔT p
2
Lg
0.5 3 10 3 Kg 240 m s 2 3 10 3 kg 128 kJ kg 1 C 1 0 C 30 C
333 kJ kg - 1
kJ
86.4 Kg m s 2 11.52kJ
97.9
kg 294 g
1
333kJ kg
333
m g 294 g
NB: la maggior parte dell’energia proviene dall’energia cinetica del proiettile, mentre la sua l’energia
interna contribuisce solo per un 12%
Gas Perfetti
Ogni sistema termodinamico è descritto da gandezze macroscopiche:
•
•
•
•.
• Pressione
p
Volume
V
Temperatura T
# di moli
n=Mcampione/M
•Composiszione chimica
•Polarizzazione elettrica..
....
(M=massa molare)
Tutte queste grandezze insieme decrivono il sistema che è composto da un numero elevato di
componenti elementari (almeno NA) e non sono tutte indipendenti tra loro, ma sono legate da
EQUAZIONI DI STATO (quando il sistema è all’equilibrio).
Il sistema più semplice è rappresentato dai gas perfetti all’equilibrio termico
gas perfetto =>
•gas a bassa densità,
•moto casualedi atomi o molecole
•si trascurano le forze a distanza
Molti gas, già a pressione atmosferica, si comportano come gas perfetti.
Sperimentalmente si trova che:
Pressione, Volume, Temperatura e n. di moli di un gas perfetto sono legate, all’equilibrio
termico dalla seguente relazione, che descrive lo stato termodinamico del gas:
Equazione dei gas
perfetti
pV nRT NkT
Dove: R= 8.31 J/(mole·K) è la costante universale dei gas
k=1.38 10-23 J/K è la costante di Boltzman
NB:
nR=Nk con N=n NA numero di molecole. Si ha quindi che R = NAk
Esercizio1:
Quali condizioni fisiche sono necessarie affinché un gas reale abbia un comportamento simile a quello di
un gas perfetto?
٧1)Quando è nelle condizioni di bassa pressione ed alta temperatura
2)Quando la sua temperatura è inferiore a quella di ebollizione
3)Quando occupa il recipiente in assenza di altri gas
4)In nessun caso
Attenzione:La legge dei gas perfetti
•è una legge sperimentale approssimata.
•non tiene conto del volume finito del gas [suppone molecole puntiformi di volume nullo]
•non tiene conto delle forze tra le molecole del gas
•vale solo per gas rarefatti, a temperatura molto lontana da zero assoluto e per volumi macroscopici
•vale per sistema omogeneo all’ equilibrio termico [ove posso definire p, V, T, n …]
esempio: non posso applicarla nel riscaldamento di una pentola d’acqua [vortici, temperature diverse …]
Esercizio2:
Il numero di Avogadro (NA = 6.023 x 1023) rappresenta :
1)il numero di atomi contenuto in 1g di una qualsiasi sostanza
2)il numero di molecole contenuto in 1g di una sostanza qualsiasi
3)il numero di atomi contenuto in 1 mole di una qualsiasi sostanza
٧4)il numero di molecole contenuto in 1 mole di una qualsiasi sostanza
Appunto sulle Moli:
mole= quantità di sostanza che contiene numero di atomi/molecole pari al
numero di Avogadro NA= 6.022 1023, cioè il numero di atomi di 12C tali che il loro peso
complessivo sia di 12 g
Calcolo del numero di moli di una sostanza di massa Mcamp:
n
M camp
M
M mN A
n
M camp
mN A
Mcamp= peso sostanza
M = peso di una mole [peso molare]
m = peso di una molecola
NB. Il peso M di una mole di una sostanza si ricava dalla tabella periodica degli elementi.
pV nRT
Equazione di stato su un grafico P-V:
Ciascuna delle curve
mette in relazione
pressione e volume
del gas a temperatura
costante
Trasformazioni
isoterme
In generale:
note due variabili tra p, V, T, la terza è univocamente determinata (nb solo per i gas perfetti).
A partire da equazione di stato dei gas perfetti si ricavano altre leggi comuni dei gas:
p1V1 p 2 V2
Legge di Boyle:
V1
V2
Legge di Gay-Lussac: T
T2
1
Legge di Dalton
a temperatura costante il prodotto del
volume di una massa m di gas per la
pressione risulta costante
a pressione costante
il rapporto del volume di una massa m di gas
per la temperatura (in Kelvin) risulta costante
p tot p1 p 2 p 3 ....
p tot
n RT
n RT
n 1 RT
3
3
...
V
V
V
RT
n 1 n 2 n 3
V
in una miscela di gas la
pressione totale è
uguale alla somma
delle pressioni parziali
dei suoi gas
componenti
Esercizio:
Un pallone aerostatico gonfiato in modo blando di elio, alla pressio P0 dell’atmosfera, a T020°C, ha
un volume di gas pari a 2.2 m2.
Ad un’altezza di 7000 m la pressione è P=0.5 atm.
a) Non essendo limitato dal contenitore, cosa ha fatto l’elio?
b) Se a 7000 m la temperatura è di -48 °C, quale sarà il volume del gas?
Poichè man mano che il pallone sale la pressione esterna si riduce, il gas tende ad espandersi per ridurre
la pressione interna in modo da annullare la differenza tra esterno ed interno.
Per calcolare il volume a 7000 m applico la legge dei gas perfetti ( l’elio può ben approssimarsi ad un gas
perfetto gia a pressione atmosferica)
pV nRT
p1V1 nRT1
p 2 V2 nRT2
V2
nR
nR
p1 V1
T1
p 2 V2
T2
p 2 V2
p V
1 1
T2
T1
p1 T2
1atm 48 273K
V1
2.2 m 3 2 0.77 2.2 m 3 3.4 m 3
p 2 T1
0.5atm 20 273,16K
Esercizio:
Un cilindro verticale di sezione A è limitato superiormente da un pistone
di massa m, che può scorrere senza attrito.
a) Se nel cilindro ci sono n moli di gas a temperatura T, determinare
l’altezza h a cui il pistone sarà in equilibrio sotto l’azione del proprio
peso.
b) Quanto vale h se:
n = 0.200 moli, T = 400 K, A = 0.00800 m2 ed m = 20.0 Kg
a) All’equilibrio devo avere risultante delle forze agenti sul pistone nulla.
◙
Applicando l’equazione dei gas perfetti per il
gas contenuto nel cilindro:
Sostituendo questo valore nella ◙ ottengo.
b)
NB: pressione ∙ superficie => Forza => Pa∙m2 =N
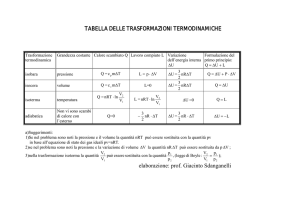
Trasformazioni Termodinamiche
Apparato sperimentale:
•Recipiente isolato termicamente
•n moli di gas perfetto monoatomico
•Pistone (per variare p)
•Termometro (T in k)
•Sistema di riscaldamento (es. fornelletto)
dy
Lavoro fatto da gas:
L>0 Lavoro fatto dal gas verso l’esterno
(es => il gas preme verso l’alto il pistone=>aumento del volume)
L<0 Lavoro fatto sul gas dall’esterno
(es: premo da fuori il pistone=> il volume del gas diminuisce)
dL F d s pAds pdV
L
Vf
pdV
<= Area sottesa dalla curva nel
diagramma p-V
Vi
NB:
per poter risolvere l’integrale devo conoscere come varia p durante la variazione di volume!
Il Lavoro svolto durante una trasformazione, dipende dal percorso effettuato!
Esercizio:
Un gas ideale si espande al doppio del suo volume iniziale Vi = 1 m3, in una trasformazione quasistatica, in cui P = αV2, con α=5.00 atm/m6, come mostrato in figura.
Quanto lavoro compie il gas nell’espansione ?
L
Vf
Vi
L
pdV
Vf
Vi
αV 2 dV
1
αVf3 Vi3
3
1
1
1
N
α 2Vi 3 Vi3 α 7Vf3 5.00 1.015 10 5 Pa m 6 7 m 9 1.18 10 6 2 m 3 1.18 10 6 J 1.18 MJ
3
3
3
m
Esempi:
• Riscaldamento a volume costante
(tengo fisso il pistone)
nRT
p
V
f
L=0
Se V costante e T aumenta => aumenta P
i
Vf=Vi=V
• Espansione a pressione costante
L
Vf
Vf
Vi
Vi
pdV p dV
pf==pi=p
(mantengo la pressione sul pistone costante
magari aumentando la temperatura del gas)
pVf Vi
L>0
i
f
Se p costante e V aumenta => L>0
• Espansione isoterma
L
Vf
Vi
f
V
nRT
dV
dV nRT
nRT ln f
V
V
Vi
Vi
V
L>0
f
pf
nRT
p
pV nRT costante
V
i
pi
(aumento il volume mantenendo costante la temperatura
Tramite un termostato)
0
Vi
Vf
Se T costante V aumenta =>p diminuisce
Primo Principio della Termodinamica
( generalizzazione della conservazione dell’energia meccanica a sistemi microscopici
Si considerino meccanismi di trasferimento di energia solo di scambio di Calore e di lavoro meccanico
Se il sistema assorbe una quantità di calore Q e compie un lavoro L, l’energia interna del
sistema varia di una quantità DEint data da:
ΔEint Q L
E per trasformazioni infinitesime:
dE int dQ dL
La variazione di energia interna, quindi la quantità Q-L non dipende dal percorso
Misurati L e Q posso determinare la variazione di energia interna DEint a partire dal primo
principio della termodinamica...devo però fare attenzione ai segni!
Se L = lavoro fatto sul gas (L<0)
=>
DEint = Q+L
Se L = lavoro fatto dal gas (L>0)
=>
DEint = Q-L
Applicazione primo principio
Trasformazioni Isoterme:
T= costante
Trasformazioni Isobare:
p= costante
Trasformazioni Isocore:
V= costante
Trasformazioni adiabatiche:
Trasformazioni cicliche:
Q= 0
Stato iniziale=Stato finale
DEint0
Trasformazioni isoterme(T=costante)
La variazione di energia interna è nulla poichè non ho variazione di temperatura (Eint dipende solo da T).
Vf
ΔE int 0
Q L
Vi
Vf
pdV
Vi
V
nRT
dV nRT ln f
V
Vi
L>0
L’energia Q assorbita viene trasformata in Lavoro meccanico (espansione)
Es.: treno a vapore=> il calore prodotto nella caldaia viene utilizzato per muovere i
pistoni che fanno girare le ruote sulle rotaie
Esercizio:
Un cilindro metallico con un pistone mobile a tenuta, contiene 0.24 moli di gas N2 (Azoto) ad una pressione iniziale di 140
kPa. Il pistone viene spostato lentamente nel cilindro fino a far raddoppiare il volume occupato dal gas. Il cilindro rimane
durante la trasformazione, in contatto termico con l’ambiente a 310 K. Quanto calore viene ceduto al gas in questa
trasformazione?
T 310 K cost.
Pi 140 kPa
ΔE int 0
Vf 2Vi
Q-L 0
Q L
Q ?
Vf
Q L
pdV
Vi
nRT ln
Vf
2Vi
nRT ln
nRT ln 2 0.24 mol8.31 J mol 1 K 1 310 K ln 2 428 J
Vi
Vi
Trasformazioni Isocore
ΔEint Q L Q
L=0, poichè mantengo il volume costante
Se Q> 0 (gas assorbe energia) => DEint>0 => la temperatura aumenta
Se Q<0 (gas cede energia) => DEint<0=> la temperatura diminuisce
Ricordando che il calore trasferito è
legato alla variazione di temperatura:
E quindi
ΔE int
3
nR ΔT
2
Pistone
bloccato
3 3
Eint nN A kT nRT
2 2
(nel caso di gas monoatomico)
Ricordando che la variazione di temperatura è legata alla quantità di calore fonita/ceduta
mediante la capacità termica e quindi dal calore specifico del gas (nel caso di volume
costante =>cV) :
3
3
Q nc V ΔT nc V ΔT nRΔT
c V R Gas monoatomico
2
2
In generale:
ΔEint nc V ΔT
Trasformazioni Isobare
Pistone libero di muoversi
ΔEint Q L nc p ΔT p ΔV
pΔV nRΔT
ΔE int
3
nR ΔT
2
ΔE int
3
nR ΔT nc p ΔT nR ΔT
2
cp
5
R
2
Gas
monoatomico
cp cV R
NB:
Legge di Mayer
cp>cV sempre
In una trasformazione a pressione costante una parte dell’energia interna
deve essere spesa per compiere lavoro meccanico
R cp - cV
La costante universale dei gas acquista significato fisico come
differenza di calori specifici
Trasformazioni Adiabatiche
Q 0
Sistem Isolato => Non c’è scambio di calore
ΔEint Q L L
Se L >0 (gas compie lavoro:espansione)
=>
DEint <0
=> T diminuisce
Se L <0 (gas subisce lavoro:compressione)
=>
DEint >0
=> T aumenta
pV nRT
dpV Vdp pdV
Vdp pdV nRdT
dnRT nRdT
Equazione di Stato=>
dE int nc V dT dL pdV
Vdp pdV
cp cV
pR
dV
pdV
cV
cV
dT dL
Dividendo entrambe i
membri per pV
c p c V dV
c p dV
c p dV
dp
dp
dV
dV
p
V
cV
V
V
cV V
p
cV V
Integrando =>
p
dV
nc V
lnp γlnV cost lnpVγ cost
Ponendo gcp/cV>1
pVγ cost
p i Vi
Quindi:
γ
p f Vf
Trasformazione isoterma =>
PV=costante => P=costante/V=> iperbole
Trasformazione adiabatica =>
PVg =costante dove g1 P=costante/Vg
La curva adiabatica è più ripida di quella isoterma
γ
Calori specifici molari per vari gas
L’energia necessaria per aumentare di
un certo ΔT la temperatura di n moli di
gas dipende dal tipo di trasformazione
effettuata
Non ho un valore
unico di Q
Trasformazione a VOLUME COSTANTE
Trasformazione a PRESSIONE COSTANTE
Per un gas monoatomico, per il quale la teroria cinetica prevede:
Per un gas biatomico, per il quale la teoria cinetica prevede:
3 3
Eint nN A kT nRT
2 2
E int
5
nRT
2
Esercizio
Una persona mangia a cena una quantità di cibo pari a 2000 kCal di energia. Per fare un lavoro equivalente
in palestra, sollevando un peso di 50.0 kg, quante volte deve sollevare il peso per spendere tutta l’energia
accumulata?(si supponga che l’oggetto venga alzato di 2 m ogni volta)
Si vogliono trasferire 2000 kCal di energia dal corpo compiendo lavoro sul sistema
Oggetto-terra
Il lavoro equivalente in joule (1 cal=4.186 J) è L= 2 ·103·103· 4.186 J = 8.37 ·106J
Il lavoro che si svolge ogni volta che si solleva un peso di 50 Kg di massa di un’altezza pari a 2m è:
L=mgh=50·9.8·2 J= 980 J
Se quindi vogliamo fare un lavoro totale di 8.37 ·106J dovremo sollevare il peso per un numero N di
volte pari a:
N
L tot
8.37 10 6
8541
L
980
Esercizio
Determinare il lavoro compiuto da un fluido nell’espansione da i ad f che avviene come mostrato in figura.
Quanto lavoro è compiuto sul fluido se esso è compresso da f ad i?
a b
Sappiamo che il lavoro compiuto dal sistema è pari
all’area sottesa dalla curva P-V valutata dal punto
c d
iniziale i al punto finale f. Possiamo quindi
scomporre il percorso in tre zone:
1) Espansione a pressione costante (da a-> b)
L p a Vb Va 6 10 6 Pa 2 1 m 3 6 10 6 Pa m 3 6 10 6 J
2)
3)
Espansione con riduzione di pressione (da b-> c)
6 10 6 2 10 6 Pa 3 - 2m 3 2 10 6 Pa 3 - 2m 3 4 10 6 J
L bc
2
Espansione a pressione costante
L p c Vd Vc 2 10 6 Pa 4 3 m 3 2 10 6 J
L if L ab L bc L cd 12 10 6 J 12 MJ
Il lavoro compiuto sul fluido nel percorso f -> i è uguale ed opposto in segno,a quello
che fa il fluido nell’espansione
L fi 12 MJ
1 kg di acqua liquida, alla temperatura di 100°C, si trasforma in vapore alla stessa temperatura, bollendo a
pressione atmosferica. Il volume passa da un valore iniziale di 1.00 ·10-5 m3 dal liquido a 1.671 m3
di vapore.
a) Quanto lavoro viene compiuto dal sistema durante il processo?
b) Quanto calore viene fornito al sistema durante il processo
c) Qual’è la variazione di energia interna del sistema durante il processo di ebollizione?
Pressione costante
L
Vf
Vf
pdV p dV pVf Vi 1.01 10 5 Pa 1.671 m 3 1.69 10 5 J 169 kJ
Vi
Vi
Il calore è quello necessario per far evaporare tutta l’acqua:
Q m L vapore 1kg 2256 kJ 2256 kJ
La variazione di energia interna si ottiene dal primo principio della termodinamica:
ΔEint Q L 2256 169 kJ 2087 kJ
La variazione di Energia interna è dovuta al lavoro interno al sistema, necessario per
vincere i legami che tengono unite le molecole di H2O nel liquido
D18) Nel caso di cambiamenti di volume in un sistema termodinamico:
1) Ad un espansione (variazione positiva di volume) corrisponde un lavoro positivo eseguito dal sistema
2) Ad una compressione (variazione negativa di volume) corrisponde un lavoro positivo eseguito dal sistema
3) Sia ad espansioni che compressioni corrisponde un lavoro nullo
4) Ad un espansione (variazione positiva di volume) corrisponde un lavoro negativo eseguito
dal sistema
L>0
pf==pi=p
Esempio:
• Espansione a pressione costante (Vf>Vi)
Vf
Vi
Vi
pdV p dV
pVf Vi 0
L
Vi
f
V
nRT
dV
dV nRT
nRT ln f
V
V
Vi
Vi
V
f
i
pi
• Espansione isoterma (Vf>Vi)
Vf
i
Se p costante e V aumenta => L>0
0
L>0
f
pf
L
Vf
Se T costante V aumenta =>Vf>Vi=> L>0
Vi
Vf
D9) Due gas identici, inizialmente alla stessa temperatura, pressione e volume, si espandono, il primo
isotermicamente ed il secondo adiabaticamente, in modo che i volumi finali diventino uguali.
Si verifica che:
Il primo ha una pressione maggiore del secondo
Il primo ha una pressione minore del secondo
Hanno la stessa temperatura
Hanno la stessa pressione
Quindi:
Trasformazione isoterma
=>
Trasformazione adiabatica =>
PV=costante => P=costante/V=> iperbole
PVg =costante dove g1 P=costante/V2
La curva adiabatica è più ripida di quella isoterma, a parità di volume finale la pressione p che
si ottiene è proporzionale all’inverso di V, mentre in quela adiabatica, la pressione p è
inversamente proporzionale ad una potenza di V con fattore di potenza g1 .
D10) Mediante un pistone mobile viene compresso un gas contenuto in un cilindro. Il lavoro compiuto
dal gas è :
Il prodotto della forza per la variazione di volume
Il prodotto della pressione per la variazione di volume
Il prodotto della forza per la variazione di pressione
Il rapporto della forza per la variazione di pressione
dL F dr Fˆj dyˆj F dy pAdy pdV
D12) Durante una qualunque trasformazione, in un sistema termodinamico si verifica che:
Il calore scambiato dipende solo dallo stato iniziale e dallo stato finale
Il lavoro scambiato dipende solo dallo stato iniziale e dallo stato finale
La variazione di energia interna dipende solo dallo stato iniziale e dallo stato finale
L’energia interna aumenta sempre
Per il primo principio della termodinamica La variazione di energia interna in un sistema
termodinamico è pari alla differenza tra il calore scambiato ed il lavoro compiuto (positivo se
fatto dal sistema, negativo se subito dal sistema)
ΔEint Q L
D8) Indicando con Cp il calore specifico a pressione costante di un gas monoatomico, con Cv quello a
volume costante e con R la costante universale dei gas, fra essi sussiste la seguente relazione:
1) Cp – Cv = R.
2) Cv – Cp = R.
3) Cp + Cv = R.
4) Cp /Cv = R.
Q nc V ΔT nc V ΔT
Trasformazione isocore:
In generale:
cV
3
R
2
Gas monoatomico
ΔEint nc V ΔT
Trasformazioni Isobare:
ΔE int
pΔV nRΔT
ΔE int
3
nRΔT
2
3
nR ΔT nc p ΔT nR
ΔT
2
L
cp
Q
5
R
2
Gas monoatomico
3
nR ΔT
2
cp cV R
R cp - cV
Legge di Mayer
3) Le dimensioni fisiche dell’equazione di stato dei gas perfetti PV = nRT sono pari a quelle
della potenza
dell’energia
della temperatura
della forza
4) Un gas contenuto in un cilindro è compresso a pressione costante tramite un pistone mobile. Il lavoro
compiuto sul gas è pari :
al prodotto della variazione di volume per la pressione applicata
al rapporto della variazione di volume per la pressione applicata
al prodotto della forza applicata per la variazione di volume
al rapporto tra la forza applicata e la variazione di volume
Trasformazioni Isobare:
L p Vf Vi
Teoria cinetica dei gas
le grandezze macroscopiche p, V, n, T possono essere comprese su base microscopica.
La TEORIA CINETICA DEI GAS ci permette di stabilire le relazioni fra le variabili
macroscopiche e quelle microscopiche come, ad esempio, la velocità delle molecole del gas
MODELLO MOLECOLARE PER LA PRESSIONE
La pressione di un gas sulle pareti dell’involucro
che lo contiene è dovuta agli urti delle molecole
del gas con le pareti stesse.
Ipotesi:
•Gas rarefatto ( grande distanza tra le molecole del gas)=> posso trascurare
gli urti tra le molecole
•Le molecolo seguono le leggi di Newton
•Le forze tra le molecole sono trascurabili (eccetto negli urti)
•Gli urti delle molecole con le pareti sono elastici
nM 2
p
v
3V
1
p ρv 2
3
Pressione sulle pareti
del recipiente
v = velocità quadratica media delle
molecole
r= densità del gas
Ricordando che:
1)
EC
1
mv 2
2
R= 8.31 J/(mole·K)
costante universale
dei gas
2)
p
nRT
1 nM 2
v v
V
3 V
Energia cinetica traslazionale
media di una singola molecola del
gas
3RT
M
Dall’eq. Dei gas perfetti
EC
3RT
3
kT
2N A
2
EC
3 V
p
2 N
2 N
p
EC
3 V
La pressione del gas è proporzionale:
• all’energia cinetica media delle singole molecole
•al numero di molecole per unità di volume
MODELLO MOLECOLARE PER LA TEMPERATURA
La temperatura è una misura diretta dell’energia energia cinetica
traslazionale media delle molecole
EC
3RT
3
kT
2N A
2
A TEMPERATURA FISSATA tutte le
molecole hanno stessa energia cinetica
traslazionale media
Fissata T, la distribuzione delle velocità delle molecole nel gas segue la distribuzione
di Maxwell:
3/2
M
2
Pv 4π
v 2 e Mv /(2RT)
2 ππR
NB: P(v)dv rappresenta la frazione di
molecole con velocità
compresa tra v e v+dv
v
3RT
M
La velocità quadratica media delle molecole
dipende dalla temperatura
La velocità quadratica
media delle molecole
dipende dal peso molare
È maggiore per molecole
più leggere.
VELOCITÀ ELEVATISSIME!!!
Moto casuale
1
1
1
1
mv x2 mv 2y mv z2 mv 2
2
2
2
3
EC
1
3
mv 2 kT
2
2
1
1
1
1
1
mv 2x mv 2y mv 2z mv 2 kT
2
2
2
3
2
Ogni grado di
libertà traslazionale
acquista uguale
energia ½ kT
Teorema di equipartizione dell’energia:
Quando il numero di particelle e’ elevato e vale la meccanica Newtoniana, a ciascuno dei gradi di liberta’
compete la stessa energia media, pari a ½ kT.
L’energia di un sistema in equilibrio termico è ripartita ugualmente fra tutti i gradi di libertà
Gas monoatomico => 3 gradi di libertà (solo traslazionali)
l’ energia interna è la somma delle energia cinetiche
traslazionali delle sue molecole. Per ogni molecola,
l’ energia cinetica media dipende solo dalla
temperatura ed è pari a 3/2 kT. Per n moli:
3 3
Eint nN A kT nRT
2 2
Moti rotazionali
Per gas formati da molecole con più atomi
Moti vibrazionali
Per gas formati da molecole biatomiche si considera solo il moto rotazionale
intorno ai due assi perpendicolari la congiungente i due atomi (si trascura il
moto vibrazionale considerandoli a distanza fra loro fissata)
Gas biatomici => 5 gradi di libertà
(2 rotazionali 3 traslazionali)
5
5
E int nN A kT nRT
2
2
Esercizio:
L’energia cinetica media di una molecola di gas perfetto dipende:
1)solo dalla pressione
2)solo dalla temperatura assoluta
3)solo dal numero di moli
C
4)dal volume occupato
E
3RT
3
kT
2N A
2
Esercizio:
a)Quanti atomi di elio riempiono un pallone di un diametro D = 30.0 cm a T = 20°C e P=1 atm ?
b)Qual’è l’energia cinetica media per ciascun atomo di elio?
c) Qual’è la velocità quadratica media di ciascun atomo?
a)Il numero di atomi del pallone è pari al numero di moli presenti nel
pallone moltiplicato per il numero di avogadro, cioè il numero di
molecole presenti in una mole: N=nNA
Dall’equazione dei gas perfetti ricavo il numero di moli:
Dove: V
n
pV nRT
n
pV
RT
4
4 D3
1
πR 3
π
π D 3 1.41 10 2 m 3
3
3
8
6
pV
RT
1.013 10 5 Pa 1.41 10 2 m 3
0.587mol
J
8.315
20.0 273.0K
mol K
N nN A 0.588mol 6.02 10 23 molecole mol 3.54 10 23 atomi
b)Energia cinetica media:
Ec
c)
1
3
3
1.38 10 23 J K 293K 6.07 10 21 J
mv 2
kT
2
2
2