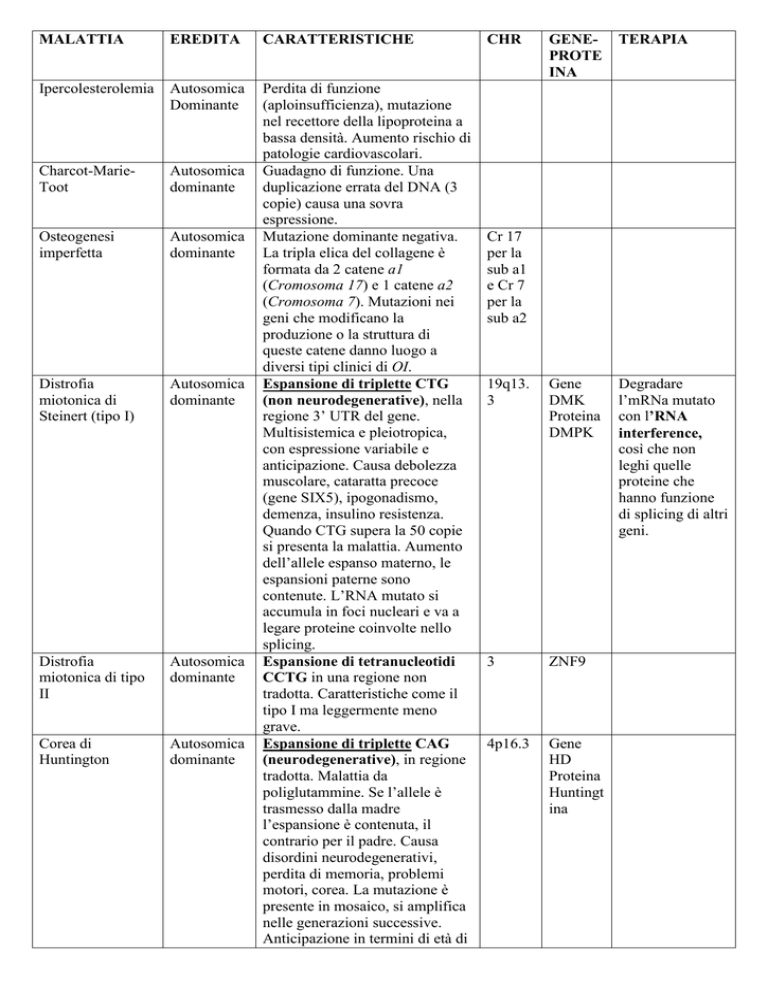
MALATTIA
EREDITA
CARATTERISTICHE
Ipercolesterolemia
Autosomica
Dominante
Charcot-MarieToot
Autosomica
dominante
Osteogenesi
imperfetta
Autosomica
dominante
Distrofia
miotonica di
Steinert (tipo I)
Autosomica
dominante
Distrofia
miotonica di tipo
II
Autosomica
dominante
Corea di
Huntington
Autosomica
dominante
Perdita di funzione
(aploinsufficienza), mutazione
nel recettore della lipoproteina a
bassa densità. Aumento rischio di
patologie cardiovascolari.
Guadagno di funzione. Una
duplicazione errata del DNA (3
copie) causa una sovra
espressione.
Mutazione dominante negativa.
La tripla elica del collagene è
formata da 2 catene a1
(Cromosoma 17) e 1 catene a2
(Cromosoma 7). Mutazioni nei
geni che modificano la
produzione o la struttura di
queste catene danno luogo a
diversi tipi clinici di OI.
Espansione di triplette CTG
(non neurodegenerative), nella
regione 3’ UTR del gene.
Multisistemica e pleiotropica,
con espressione variabile e
anticipazione. Causa debolezza
muscolare, cataratta precoce
(gene SIX5), ipogonadismo,
demenza, insulino resistenza.
Quando CTG supera la 50 copie
si presenta la malattia. Aumento
dell’allele espanso materno, le
espansioni paterne sono
contenute. L’RNA mutato si
accumula in foci nucleari e va a
legare proteine coinvolte nello
splicing.
Espansione di tetranucleotidi
CCTG in una regione non
tradotta. Caratteristiche come il
tipo I ma leggermente meno
grave.
Espansione di triplette CAG
(neurodegenerative), in regione
tradotta. Malattia da
poliglutammine. Se l’allele è
trasmesso dalla madre
l’espansione è contenuta, il
contrario per il padre. Causa
disordini neurodegenerativi,
perdita di memoria, problemi
motori, corea. La mutazione è
presente in mosaico, si amplifica
nelle generazioni successive.
Anticipazione in termini di età di
CHR
GENEPROTE
INA
TERAPIA
19q13.
3
Gene
DMK
Proteina
DMPK
Degradare
l’mRNa mutato
con l’RNA
interference,
così che non
leghi quelle
proteine che
hanno funzione
di splicing di altri
geni.
3
ZNF9
4p16.3
Gene
HD
Proteina
Huntingt
ina
Cr 17
per la
sub a1
e Cr 7
per la
sub a2
Fibrosi Cistica
Autosomica
recessiva
Atassia di
Friedreich
Autosomica
recessiva
comparsa e gravità. La tripletta
nei malati è presente dalle 36
copie fino alle 100.
Frequenza: 1/2500; Portatori:
7q31.2
1/25. Pleiotropica, espressività
variabile ed eterogeneità clinica.
Mutazione sul codone 508 della
fenilalanina (70% dei casi). Il
difetto primario è legato
all'assenza della Proteina CFTR o
ad una sua anomalia (blocco della
regolazione). Queste alterazioni
sono causa di uno squilibrio
ionico a livello della membrana
apicale delle cellule epiteliali
delle vie aeree, del pancreas,
dell'intestino, apparato
riproduttivo. Lo squilibrio ionico
è causato da un'alterazione nella
secrezione da parte delle cellule
epiteliali di ioni cloro e un
conseguente maggior
riassorbimento di sodio e acqua.
Esistono più di 1000 mutazioni
mappate nel gene, in base alla
mutazione possiamo avere:
assenza di sintesi, blocco della
maturazione, blocco della
regolazione, funzionalità ridotta e
sintesi ridotta.
Frequenza: 1/50.000 disturbi
della coordinazione della
posizione eretta, dei movimenti,
dell'articolazione, associati ad
altri segni neurologici e talvolta
ad una cardiomiopatia e ad una
forma di diabete. La malattia si
evolve progressivamente e dopo
10-20 anni di evoluzione il
9q1213
CFTR
Gene
X25
Proteina
Frataxina
Correzione delle
cellule
dell’epitelio
respiratorio.
Applicazioni in
aerosol o
installazione
liquida.
Ripristinando il
5-7% di
espressione della
proteina wt si
ottiene un
fenotipo
selvatico. Dal
momento che le
cellule epiteliali
sono
differenziate non
si possono
utilizzare vettori
retrovirali. Nei
tentativi di
terapia genica
sono quindi stati
utilizzati vettori
adenovirali o
liposomi per
trasferire un
minigene CFTR
di dimensioni
adeguate. Il
targeting SFHR
ha i vantaggi del
gene targeting ed
ha un’effcienza
di conversione
dell’1%.
L’SFHR misura
400-800 bp ed è
omologo al locus
bersaglio tranne
per la mutazione
desiderata
Daltonismo
X linked
recessiva
Ipofosfatemia
X linked
dominante
X linked
dominante
Anche se
potrebbe
pure essere
una X
linked
recessiva
Sindrome dell’X
fragile (FRAXA)
o sindrome di
Martin Bell
Sindrome di
Prader-Willi
Da
imprinting
paziente non e più in grado di
camminare senza aiuto.
Espansione anomala e instabile
di una tripletta GAA negli
introni. La malattia e dovuta ad
una diminuzione della frataxina
che si ripercuote sul mitocondrio
alterando il metabolismo
energetico della cellula, in
seguito ad un disturbo del
metabolismo del ferro.
Dovuta all’inattivazione dell’X:
una femmina genotipicamente
sana può essere affetta pur
essendo eterozigote perché nei
tessuti che causano la malattia è
prevalentemente disattivato il chr
X sano
Rachitismo resistente alla
vitamina D
Xq27.3
Espansione della tripletta
CGG. Frequenza: 1/1500 maschi
(penetranza 80%); 1/2500
femmine (penetranza 35%).
Responsabile del 10% dei casi di
ritardo mentale (3% della
popolazione) Non è una patologia
dominante canonica. Il gene
FMRP è espresso in diversi
organi (cervello, rene, polmoni,
testicolo, cuore) e il suo prodotto
è una proteina adibita
all’esportazione degli mRNA dal
nucleo al citoplasma. Colpisce il
sistema nervoso, l’apparato
genitale, viso stretto e allungato,
articolazioni, prolasso della
valvola mitralica. Espansione
CGG in una regione non tradotta
(promotore) del gene FMR1: 660 ripetizioni il gene è trascritto e
tradotto. 60-200 ripetizioni il
gene è trascritto e tradotto ma
mutazione vicina.
Più di 200 ripetizioni abbiamo
una sequenza anomale e
mutilazione del gene che causa
quindi silenziamento.
Delezione prossimale del braccio 15q11lungo del chr 15 paterno.
13
Nessuna delle due copie
dell’allele è espresso: paterno
deleto e materno sottoposto ad
imprinting. Obesità, bassa
statura, ipogonadismo, piedi
piccoli, ritardo mentale. Può
Gene
FMR1
Proteina
FMRP
essere dovuta da Disomia
uniparentale.
Sindrome di
Angelman
Da
imprinting
Delezione prossimale del braccio
lungo del chr 15 materno.
Nessuna delle due copie
dell’allele è espresso: materno
deleto e paterno sottoposto ad
imprinting. Ritardo mentale e
motorio, assenza di linguaggio
atassia e crisi improvvise di riso.
Può essere dovuta da Disomia
uniparentale.
15q1113
Patologie Cromosomiche
Sindrome di down
Trisomia 21 1/1000 nati vivi, ¼ di tutte la malattie di ritardo mentale. 92% dovute
a trisomia libera, i cui il 95% origina da non disgiunzione materna. Rischio alla
nascita correla con l’età materna.
Sindrome di Edwards
Trisomia 18 1/7700 nati vivi, rapporto femmine maschi 5:1. Il 95% origina da
trisomia libera di origine materna. Correlazione con l’età materna
Sindrome di Patau
Trisomia 13 1/10000 nati vivi. Il 95% è abortito spontaneamente. Il 90% presenta
trisomia libera, gli altri pazienti hanno trisomia in mosaico o da traslocazione.
Correlata con l’età materna
Sindrome di Turner
1/5000 – 1/10000 nati vivi. Il corredo cromosomico più caratteristico è la
monosomia X che nei 2/3 dei pazienti origina dal lag anafasico nella
spermatogenesi. Non correla con l’età dei genitori.
Sindrome di Klinefelter
Maschio XXY 1/1000 maschi 1% tra i ritardi mentali, bassi livelli di testosterone e
azospermia. Errore nella meiosi materna (non disgiunzione). Correlata con l’età
materna Circa ¾ degli errori materni e paterni si verificano alla prima divisione
meiotica. Meno del 10% presenta un mosaicoXY/XXY
Sindrome di “Di
Microdelezione 22q11.2
Gorge”
La privazione di un solo gene causa tutta la sintomatologia della malattia. La
malattia genetica è causata dalla perdita (o delezione) di alcune porzioni di Dna
all’interno del cromosoma 22. Il gene responsabile è il gene Tbx1, un fattore di
trascrizione, un gene cioè che controlla l’attivazione di una serie di altri geni
durante lo sviluppo, responsabili dei principali sintomi cardiaci della malattia.
Tumori ereditari
Retinoblastoma
Poliposi adenomatosa
familiare (FAP)
Dovuto ad una mutazione autosomica dominante.
13q14
Nella forma ereditaria localizzazione bilaterale, in
quella sporadica monolaterale. Delezione del braccio
lungo del cromosoma 13. Gene malattia RB1: una
sola copia del gene normale è sufficiente a proteggere
dal tumore (oncosoppressore: impedisce la
proliferazione del retinoblastoma in eterozigosi).
1000 polipi di natura benigna. 1/8000-10000 nati.
5q21.3
Trasmessa con modalità autosomica dominante anche
se il gene APC è un oncosoppressore. I polipi sono
trasmessi con modalità dominante ma non hanno
natura maligna. Quando la seconda copia del gene
APC è inattivata nasce il carcinoma. Il 95% dei
pazienti FAP presenta mutazioni troncanti del gene:
le mutazioni nella parte centrale sono associate ad
una forma più grave.
Inattivazione del gene APC ipometilazione del
DNA attivazione proto-oncogene perdita del chr
18q e inattivazione del gene oncosoppressore DCC
perdita di p53 che consente la perdita e
dell’induzione di apoptosi in cellule tumorali
Cancro collaterale non
poliposico
ereditario (HNPCC)
Eredità autosomica dominante. I geni che causano
malattia sono del tipo Mismatch Repair (MLH1,
MSH2 MSH6), coinvolti nella riparazione post
replicativa degli errori di appaiamento
3p22.3
(MLH1)
50%
2p21
(MSH2)
40%
2p16.3
(MSH6)
10%
Oncogeni possono formarsi a causa di traslocazioni cromosomiche: chr Philadelphia.
Traslocazione cromosoma 9-22 si forma il gene BCR/ABL che produce una proteina
di fusione anomala ad attività tirosin-chinasica.












