Intervento di Bypass coronarico
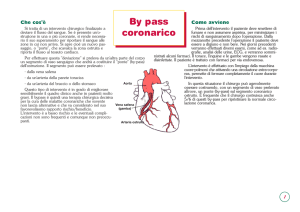
Il bypass coronarico (CABG) è una tecnica chirurgica che consente l’apporto di sangue
ossigenato a valle delle ostruzioni coronariche (stenosi ≥70%) mediante l’utilizzo di grafts
arteriosi, prevalentemente in arteria mammaria interna, o di graft di vena safena autologa (fig. 1).
Il CABG è la metodica di rivascolarizzazione più efficace nel garantire migliore sopravvivenza e
libertà da eventi a distanza, prevenire l’infarto miocardico e la morte per eventi coronarici acuti.
Grazie ai miglioramenti delle tecniche chirurgiche, dei metodi di protezione miocardica,
dell’assistenza anestesiologica e rianimatoria, nonostante l’aumentata incidenza negli ultimi dieci
anni di molteplici fattori di rischio operatorio (i.e. l’arteriopatia polidistrettuale, la
broncopneumopatia cronica, l’insufficienza renale, la concomitante presenza di patologie
cardiache associate, la disfunzione ventricolare sinistra), la mortalità operatoria del CABG resta
attualmente molto contenuta, essendo mediamente stimata al 2-3%. Il CABG risulta infatti essere
la metodica più efficace nel garantire migliore sopravvivenza e libertà da eventi a lungo termine
in presenza di malattia del tronco comune della coronaria sinistra (stenosi ≥50%), malattia
trivasale, malattia bivasale con stenosi prossimale del ramo discendente anteriore. Il beneficio
della chirurgia risultava ancor più evidente in presenza di gravi sintomi per angina, prova da
sforzo positiva, ridotta funzione sistolica del ventricolo sinistro espressa da un valore di frazione
di eiezione <50%. Mentre, il CABG non offre vantaggi superiori alla terapia medica in presenza
di malattia monovasale e bivasale con buona funzione del ventricolo sinistro senza
coinvolgimento dell’arteria discendente anteriore.
L’intervento di CABG prevede l’accesso al cuore ed all’aorta del paziente mediante sternotomia
mediana, il prelievo dell’arteria mammaria interna dalla fascia endotoracica e/o della vena safena
dall’arto inferiore del paziente stesso, l’avvio della circolazione extracorporea e l’arresto del
cuore con la cardioplegia ematica. Il chirurgo esegue quindi il/i bypass dopo aver praticato una
piccola incisione della/e coronaria/e a valle dell'ostruzione, suturando alla coronaria l’arteria
mammaria nella sua estremità distale o il segmento di vena safena. L’estremità prossimale della
vena safena viene poi suturata all’aorta ascendente, da cui il sangue, attraverso la vena stessa
raggiunge l’arteria coronaria, mentre l’estremità prossimale dell’arteria mammaria è già
naturalmente collegata al sistema arterioso (all’arteria succlavia).
Innesti per il bypass coronarico. Gli innesti più frequentemente utilizzati per la
rivascolarizzazione sono l’arteria mammaria interna (AMI) e la vena safena autologa. L’AMI
rispetto alla vena safena si è dimostrata avere una superiore pervietà a distanza, stimata a 10 anni
del 95% rispetto al 50-60% della vena safena(39). Quindi il suo utilizzo consente di prevedere
rispetto all’impiego della sola vena safena, una maggiore libertà da infarto miocardico e da
reintervento e per tale motivo, particolarmente sul ramo discendente anteriore della coronaria
sinistra (che è il vaso più importante ai fini prognostici perché responsabile di oltre il 50%
dell’irrorazione del ventricolo sinistro) l’AMI è da preferire. Per la dimostrata migliore
sopravvivenza derivante dall’uso di un’arteria mammaria interna rispetto alla vena safena, si è
diffuso l’impiego della doppia arteria mammaria (generalmente la destra per il ramo discendente
anteriore, la sinistra per il ramo marginale ottuso dell’arteria circonflessa, (fig. 2) che, rispetto
all’uso dell’arteria mammaria singola, si è confermato associarsi ad un ulteriore miglioramento
della sopravvivenza a 20 anni e ad una maggiore libertà da reintervento.
a. succlavia sin
a. mammaria interna sin
v. safena
tronco comune coron. sin
a. circonflessa
coronaria ds
a. discendente anteriore
Fig. 1. Schema di triplo bypass coronarico con l’impiego dell’a. mammaria interna sinistra per il ramo
discendente anteriore e della vena safena per il ramo marginale ottuso e il ramo interventricolare posteriore
della coronaria destra.
AMI destra
sul ramo
discendente anteriore
AMI sinistra
sul ramo
del margine ottuso
Fig. 2. Impiego delle doppia arteria mammaria (AMI) per il bypass coronarico.
2
Chirurgia della valvola mitrale
Le tecniche riparative hanno attualmente il ruolo preponderante nella chirurgia
dell’insufficienza mitralica. I vantaggi della riparazione rispetto alla sostituzione sono legati
alla possibilità di conservare la funzione dell’apparato sospensore sottovalvolare (utile al
mantenimento di una corretta geometria ellittica del ventricolo sinistro), di evitare la terapia
anticoagulante e i rischi tipicamente legati alle protesi valvolari (endocardite e
tromboembolia). La possibilità di preservare meglio la geometria e quindi la funzione
cardiaca è particolarmente utile nei pazienti con funzione cardiaca depressa. Per tali motivi,
grazie ad una migliore comprensione della fisiologia dell’apparato valvolare mitralico ed
all’uso dell’ecocardiografia transesofagea intraoperatoria, l’insufficienza mitralica viene
trattata quasi esclusivamente con le tecniche di riparazione.
Nell’insufficienza mitralica da prolasso, quasi sempre del lembo posteriore, il tessuto
esuberante viene resecato (di norma un frammento quadrangolare), la continuità dell’anello e
del lembo ricostruita con suture e quindi la forma e le dimensioni dell’orificio valvolare
stabilizzate in genere con l’impianto di un anello protesico. Nel nostro centro il trattamento
dell’insufficienza mitralica da prolasso mediante le tecniche di riparazione viene effettuato
pressoché nel 100% dei pazienti.
Nell’insufficienza mitralica secondaria a cardiomiopatia ischemica l’impianto di un anello
protesico è sufficiente nella maggior parte dei pazienti a ridurre le dimensioni dell’anulus
nativo e quindi l’insufficienza.
Le tecniche più utilizzate nella nostra esperienza sono la resezione quadrangolare del lembo
posteriore, la plastica a doppio orificio, l’impianto di anello protesico (figure).
La stenosi mitralica (definita come grave per un’area valvolare inferiore a 1.5 cm2) di origine
reumatica viene nella maggior parte dei casi trattata non chirurgicamente mediante metodica
cardiologica invasiva di valvuloplastica percutanea, grazie alla dilatazione delle commissure
con il pallone gonfiabile proposto da Inoue. La chirurgia sostitutiva viene riservata ai casi di
calcificazione della valvola (anello e lembi) e/o dell’apparato sottovalvolare (corde tendinee,
muscoli papillari) o di insufficienza associata a stenosi.
Per il rischio operatorio molto basso (mortalità 0.5% rispetto al 3-5% della sostituzione
mitralica), per l’elevata libertà da rientervento e da morte cardiaca a 10 anni (superiori al
95%) e per gli indiscutibili vantaggi che le tecniche di riparazione presentano rispetto alla
sostituzione, l’indicazione chirurgica alla riparazione risulta essere più liberale, anche in
presenza di pochi sintomi, in quanto l’intervento precoce previene il deterioramento della
funzione cardiaca da sovraccarico volumetrico e permette di ottenere più facilmente una
riparazione perfetta della valvola.
L’ablazione chirurgica della fibrillazione atriale. La fibrillazione atriale è un’aritmia che
molto frequentemente si associa alla valvulopatia mitralica. Infatti, sia nella stenosi che
nell’insufficienza mitralica il sovraccarico dovuto sia all’elevata pressione che al volume di
sangue nell’atrio sinistro, comporta un’alterazione strutturale ed elettrica dell’atrio stesso.
L’insorgenza della fibrillazione, oltre a causare un peggioramento dei sintomi (dispnea,
cardiopalmo, astenia), comporta il rischio di embolia sistemica dovuta alla formazione di
trombi che dall’atrio possono mobilizzarsi in circolo e raggiungere il distretto cerebrale
ovvero le arterie viscerali o degli arti inferiori, con possibile grave danno clinico (ictus,
insufficienza renale, insufficienza vascolare periferica). Con la tecnica chirurgica di
ablazione (la più utilizzata è quella di Cox-Maze) è possibile con una sonda a radiofrequenza
o a freddo (crioablazione) interrompere i circuiti elettrici responsabili di tale aritmia,
3
favorendo contestualmente alla riparazione o alla sostituzione della valvola mitralica e/o
aortica il ripristino del ritmo cardiaco sinusale. In effetti un nostro studio dimostra che i
pazienti sottoposti a chirurgia della valvola mitralica mostra che l’eliminazione della
fibrillazione (70% circa dei casi) migliora la qualità di vita rispetto ai pazienti con
persistente aritmia. Il ripristino del ritmo sinusale comporta inoltre a distanza una più elevata
probabilità di sopravvivenza, libertà da eventi cardiaci ed embolici cerebrali.
Figura 1. Resezione quadrangolare del lembo posteriore.
Figura 2. Completamento della riparazione con impianto di anello.
Figura 3. Plastica a doppio orificio.
4