ISTITUTO TECNICO INDUSTRIALE STATALE «E.FERMI»
Via S. Croce n°14 – Tel 0424.525.318 – 0424.220.271 –
Fax: 0424.220271-C.F.: 82002530242 –www.fermibassano.it
email: [email protected] - [email protected]
36061 BASSANO DEL GRAPPA
DIPARTIMENTO DI SCIENZE INTEGRATE
PROGRAMMAZIONE DISCIPLINARE DI CHIMICA
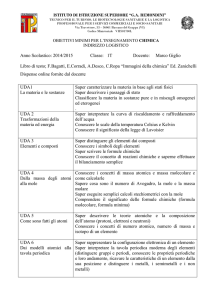
SELEZIONE DELLE COMPETENZE classe SECONDA
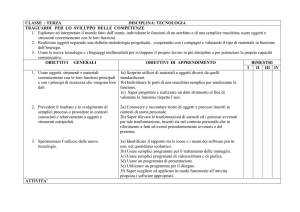
CD
S1
COMPETENZE IN
ESITO
(1° BIENNIO)
Osservare, descrivere ed
analizzare fenomeni
appartenenti alla realtà
naturale e artificiale e
riconoscere nelle sue varie
forme i concetti di sistema
e di complessità.
ABILITÀ’
CONOSCENZE
Spiegare la forma delle molecole
e le proprietà delle sostanze.
Il legame chimico: regola dell’ottetto, principali
legami chimici e forze intermolecolari, valenza,
numero ossidazione, scala di elettronegatività,
forma delle molecole.
Utilizzare le regole della
nomenclatura IUPAC e
tradizionale.
Sistemi chimici molecolari e sistemi ionici:
nomenclatura.
Spiegare l’azione dei
catalizzatori e degli altri fattori
sulla velocità di reazione.
Riconoscere sostanze acide e
basiche tramite indicatori, anche
di origine vegetale.
I catalizzatori e i fattori che influenzano la velocità
di reazione.
Le teorie acido-base: pH, indicatori, acidi e basi
forti e deboli.
Pile, corrosione ed elettrolisi.
Disegnare e descrivere il
funzionamento di pile e celle
elettrolitiche.
Descrivere le proprietà fisiche e
chimiche di idrocarburi, dei
1
Idrocarburi alifatici ed aromatici, gruppi
funzionali, nomenclatura e biomolecole.
DISCIPLINE di
RIFERIMENTO
DISCIPLINE
CONCORRENTI
CHIMICA
FISICA
BIOLOGIA
ITALIANO
diversi gruppi funzionali e delle
biomolecole.
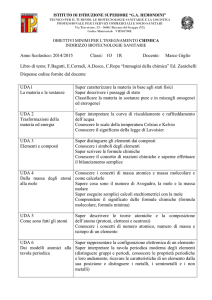
S2
Analizzare
qualitativamente e
quantitativamente
fenomeni legati alle
trasformazioni di energia a
partire dall’esperienza.
Spiegare le trasformazioni
chimiche che comportano scambi
di energia con l’ambiente
Energia e trasformazioni chimiche.
Le reazioni chimiche, bilanciamento e calcoli
stechiometrici.
Preparare soluzioni e
interpretazione delle loro
proprietà.
Le soluzioni e le proprietà colligative.
Determinare la costante di
equilibrio di una reazione dalle
concentrazioni di reagenti e
prodotti.
Calcolo e misura di pH.
S3
L1
2
FISICA
BIOLOGIA
MATEMATICA
CHIMICA
FISICA
BIOLOGIA
CHIMICA
ITALIANO
SCIENZE
INTEGRATE
L’equilibrio chimico, la costante di equilibrio,
l’equilibrio di solubilità, il principio di Le
Chatelier.
pH, reazioni acido-base, calore di neutralizzazione,
acidi e basi forti e deboli, idrolisi, soluzioni
tampone.
Bilanciare le reazioni di
ossidoriduzione (redox) col
metodo ionico elettronico
Reazioni di ossidoriduzione e loro bilanciamento.
Essere consapevole delle
potenzialità delle
tecnologie rispetto al
contesto culturale e sociale
in cui vengono applicate.
Saper leggere le etichette per
individuare la pericolosità delle
sostanze.
Etichette e simboli di pericolosità di elementi e
composti.
Sapersi comportare
adeguatamente nel laboratorio di
Chimica nel rispetto della
normativa vigente.
Norme di sicurezza in laboratorio chimico e
dispositivi di protezione individuale.
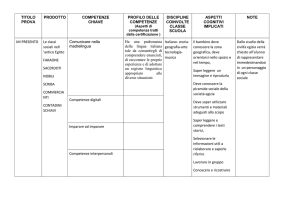
Padroneggiare gli
strumenti espressivi e
argomentativi
indispensabili per gestire
l’interazione comunicativa
verbale in vari contesti.
Comprendere il messaggio
contenuto in un testo orale.
Linguaggio specifico.
Cogliere le relazioni logiche tra
le varie componenti di un testo
orale.
CHIMICA
L2
L3
M3
M4
3
Leggere, comprendere e
interpretare testi scritti di
vario tipo.
Analizzare un testo specifico e
saper individuare le informazioni
necessarie collegandole in modo
logico.
Linguaggio specifico
ITALIANO
SCIENZE
INTEGRATE
CHIMICA
Produrre testi di vario tipo
in relazione ai differenti
scopi comunicativi.
Produce testi rigorosi, chiari e
logici per descrivere esperienze e
fenomeni.
Linguaggio specifico
ITALIANO
SCIENZE
INTEGRATE
CHIMICA
Individuare le strategie
appropriate per la
soluzione di problemi.
Analizzare comprendere e
risolvere problemi in ambito
disciplinare.
Formule e procedure specifiche
MATEMATICA
SCIENZE
INTEGRATE
CHIMICA
Analizzare dati e
interpretarli sviluppando
deduzioni e ragionamenti
sugli stessi anche con
l’ausilio di
rappresentazioni grafiche,
usando consapevolmente
gli strumenti di calcolo e le
potenzialità offerte da
applicazioni specifiche di
tipo informatico.
Leggere, interpretare e costruire
grafici anche da dati
sperimentali.
Individuare relazioni notevoli.
Rappresentazione di grandezze dipendenti in un
sistema cartesiano.
Proporzionalità diretta, inversa e quadratica.
MATEMATICA
SCIENZE
INTEGRATE
CHIMICA
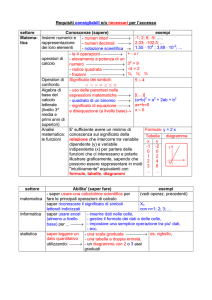
PIANO DI STUDIO DELLA DISCIPLINA
PIANO DELLE UDA del 2° ANNO
UDA
COMP
UDA
(sigla)
ABILITÀ UDA
CONOSCENZE UDA
UDA n.0
Saper calcolare la molarità.
Molarità (ripasso) e reagenti in soluzione;
Titolo:
Ripasso
(stechiometria)
ore 6
Settembre
Saper prevedere dalla stechiometria di reazione, i
rapporti tra reagenti e prodotti, e calcolarne le
quantità.
Individuare le condizioni stechiometriche e non in
una reazione chimica.
Condizioni stechiometriche e non in una reazione chimica.
S1
S2
S3
DISCIPLINE
CONCORRENTI
Reagente limitante.
Saper riconoscere il reagente limitante e prevedere
le quantità dei prodotti di reazione.
Attivita’ di laboratorio
Resa di reazione; Stati di ossidazione del manganese
(Mn).
UDA n.1
Prerequisiti:
struttura della
materia e sistema
periodico
S1
S3
Titolo: Il legame
chimico tra
atomi e molecole
Saper illustrare il meccanismo di formazione di una
molecola biatomica a partire dagli atomi isolati.
Origine e natura del legame chimico. Elettronegatività.
Descrivere le interazioni tra atomi in termini di
legami forti (covalente, ionico, metallico) e tra
molecole in termini di legami deboli (legame ad
idrogeno, forze di Van Der Waals).
Il legame covalente, il legame ionico, il legame metallico.
I legami intermolecolari.
Saper spiegare come il tipo di legame influenzi le
proprietà fisiche delle sostanze.
Saper prevedere il tipo di legame in una sostanza
dati gli elementi che la costituiscono.
Proprietà dei composti ionici e covalenti.
Descrivere la geometria di semplici molecole
ricorrendo al modello VSEPR.
La geometria molecolare e la polarità
ore 12 Ottobre
4
FISICA
BIOLOGIA
SCIENZE
APPLICATE
TECNO. RAP.
GRAF.
ITALIANO
Attivita’ di laboratorio
Ossidi acidi e basici.
Costruzione di alcuni semplici modelli molecolari.
Polarità, solubilità e miscibilità di sostanze liquide e
solide.
Studio della volatilità di quattro liquidi.
Misure di conducibilità.
UDA n.2
Prerequisiti:
Bilanciamento di
reazione
UdA1
Titolo:
Nomenclatura
dei composti
inorganici e loro
preparazione
S1
S3
Saper utilizzare la nomenclatura chimica per
distinguere alcune categorie di composti inorganici.
Nomenclatura di composti inorganici binari e ternari:
ossidi, idrossidi, acidi e sali.
Saper descrivere le reazioni di sintesi dei composti
studiati.
Reazioni di sintesi e semplici preparazioni.
Saper classificare i principali tipi di reazioni
chimiche
Reazioni di sintesi, di decomposizione, di scambio
semplice e doppio, reazioni di precipitazione
Conoscere i principali meccanismi di dissoluzione
di sostanze in acqua.
Attivita’ di laboratorio
Reazioni di precipitazione.
Determinazione quantitativa dei residui catramosi di una
sigaretta.
Dissociazione ionica, ionizzazione, solubilizzazione
semplice.
Conoscere le proprietà colligative delle soluzioni.
Proprietà colligative. Elettroliti e non elettroliti.
ore 20
Novembre
Dicembre
UDA n.3
Prerequisiti:
Sistemi omogenei
Significato di
concentrazione
relative unità di
misura
UdA 1
Titolo: Le
soluzioni
acquose
ore 10 Gennaio
5
S1
S2
S3
Saper svolgere semplici problemi di applicazione.
Saper scrivere l’equazione ionica netta per una
reazione di precipitazione
Equazioni in forma ionica.
Attivita’ di laboratorio
Preparazione di soluzioni a molalità nota.
Studio crioscopico delle soluzioni preparate.
BIOLOGIA
FISICA
BIOLOGIA
ITALIANO
UDA n.4
Definire il calore di reazione.
Calore di reazione.
Prerequisiti:
Calore,tempe
ratura e relative
unità di misura
Conoscenza e
lettura dei grafici
cartesiani
Definire e riconoscere reazioni eso-ed
endotermiche.
Reazioni eso- ed endotermiche e loro rappresentazione.
Interpretare un diagramma energetico.
Definire la velocità di reazione.
Velocità di reazione.
Descrivere i fattori che influenzano la velocità di
reazione.
Fattori che influenzano la velocità di reazione.
Interpretare l’influenza dei vari fattori sulla base
della teoria dell’urto efficace.
La teoria dell’urto efficace. I catalizzatori.
S2
S3
Titolo: Aspetti
energetici e
cinetici nelle
reazioni
chimiche
Attivita’ di laboratorio
Calore di reazione e calore di solubilizzazione.
Velocità di reazione e concentrazione dei reagenti.
Influenza della temperatura e di un catalizzatore sulla
velocità di reazione
ore 10
Febbraio
(UFA_energia)
UDA n.5
Prerequisiti:
Equazione di
reazione
Molarità
Titolo:
Equilibrio
chimico
ore 12
Marzo
6
FISICA
BIOLOGIA
MATEMATICA
ITALIANO
SCIENZE
APPLICATE
S1
S2
S3
Saper descrivere le condizioni di equilibrio chimico
e calcolare la costante di equilibrio (Keq).
Reazioni reversibili. La costante di equilibrio. Reazioni
possibili e reazioni impossibili.
Sapere quali fattori possono modificare l’equilibrio
chimico.
Conoscere e saper applicare il principio di Le
Chatelier.
Il principio di Le Chatelier e le sue applicazioni .
Attivita’ di laboratorio
L’influenza della temperatura e della concentrazione
sull’equilibrio.
FISICA
BIOLOGIA
MATEMATICA
ITALIANO
UDA n. 6
Saper scrivere il prodotto ionico dell’acqua
Prodotto ionico dell’acqua
Prerequisiti:
UdA 2
UdA 3
UdA 5
Conoscere la definizione di acido e di base secondo
Brønsted e Lowry. Saper definire una soluzione
acida, basica, neutra.
Reazioni con scambio di protoni. Definizione di acido e di
base secondo Brønsted e Lowry. La forza degli acidi e
delle basi.
Saper illustrare una reazione di neutralizzazione.
Reazioni di neutralizzazione.
Titolo: acidi e
basi
Saper definire il pH di una certa soluzione.
Saper calcolare il pH di acidi forti e deboli.
La scala del pH. Determinazione del pH di acidi e basi
forti e deboli
ore 12
Aprile
Saper definire e spiegare l’idrolisi salina.
Idrolisi.
S2
S3
MATEMATICA
FISICA
BIOLOGIA
ITALIANO
Attivita’ di laboratorio
Indicatori acido-base.
Scala colorimetrica del pH.
Titolazioni acido-base.
Idrolisi salina.
Saper riconoscere le reazioni di ossidoriduzione
attraverso la variazione del numero di ossidazione.
UDA n.7
Prerequisiti:
Bilanciamento
Sistema periodico
Differenze di
potenziale
UdA 2
Titolo:
reazioni di
ossidoriduzione
ore 15
maggio giugno
7
S2
S3
Ossidazione e riduzione; ossidante e riducente.
Bilanciamento di redox.
Saper scrivere l’equazione globale di una redox a
partire dalle due semiequazioni dopo aver stabilito
in quale senso avvengono preferenzialmente.
Saper confrontare tra di loro le coppie redox
utilizzando la definizione di potenziale
elettrochimico.
Scala dei potenziali di riduzione standard.
Conoscere il principio teorico su cui si basa
l’utilizzo della pila e saper descrivere lo schema
della pila Daniell.
Le pile. Pile ed accumulatori di uso pratico.
Conoscere il principio teorico su cui si basa
l’elettrolisi e le sue principali applicazioni .
L’elettrolisi. I processi elettrolitici e la galvanoplastica.
Le leggi di Faraday.
MATEMATICA
FISICA
BIOLOGIA
SCIENZE
APPLICATE
ITALIANO
Attivita’ di laboratorio
Reazioni di ossidoriduzione.
Le pile.
Elettrolisi di una soluzione acquosa.
METODOLOGIA
L’avvicinamento ai temi della Chimica e l’apprendimento dei suoi fondamenti si realizzano attraverso l’integrazione di più momenti fondamentali:
1) Lezione frontale con eventuale impiego di mezzi audiovisivi e di computer.
2) L’effettuazione di esperimenti (prove, riscoperte, misure) in cui gli allievi dovranno avere parte attiva;
3) L’elaborazione teorica attraverso l’utilizzo di mappe mentali;
4) L’applicazione dei contenuti acquisiti attraverso esercizi e problemi.
L’esperienza concreta ha il duplice scopo di esercitare le abilità cognitive e pratiche; tali abilità permettono di arrivare al complesso attraverso l’elemento e portano a
discernere, in un oggetto o in un fenomeno, gli elementi che lo costituiscono.
L’esecuzione degli esperimenti in laboratorio viene realizzata singolarmente o a piccoli gruppi dagli alunni, se possibile, altrimenti viene proposta in modo dimostrativo
dall’insegnante. Verrà richiesto il completamento del quaderno di laboratorio nelle sue varie parti con l’esecuzione di grafici indicati.
Strategie da attivare
Al fine di raggiungere le competenze e le abilità indicate, l’insegnante:
userà sempre il linguaggio specifico disciplinare;
spiegherà significati e derivazioni dei termini utilizzati e chiederà ai ragazzi di essere altrettanto precisi nella selezione del lessico, sia nelle comunicazioni
scritte che orali;
offrirà agli alunni i “modelli” di analisi, i criteri e gli strumenti di sintesi, indicando come vanno applicati e utilizzati all’interno dell’area disciplinare propria e
non;
insisterà sull’acquisizione di una certa autonomia, da parte degli studenti, nell’uso degli strumenti formativi;
osserverà in maniera sistematica le abilità dell’allievo e l’esecuzione del lavoro assegnato.
L’insegnante, inoltre, si impegna a sostituire il più possibile la lezione-informazione con un’analisi problematizzante dei contenuti, in modo che l’apprendimento
dell’alunno sia il risultato della soluzione di problemi posti o individuati e di una didattica operativa, scandita nei momenti del metodo scientifico. Infine , l’insegnante
cercherà di far acquisire comportamenti atti a rafforzare e migliorare lo spirito di collaborazione interpersonale e di gruppo.
Mezzi e strumenti
Libro di testo: “Immagini della Chimica, multimediale” edizione arancione, di Bagatti, Desco, Corradi, Ropa ed. ZANICHELLI .
Quaderno di laboratorio realizzato dai docenti.
Uso dei DPI durante le prove sperimentali.
Altri strumenti quali fotocopie, sussidi audiovisivi ed informatici, verranno utilizzati ad integrazione del testo e delle attività di laboratorio. L’uso del laboratorio
costituisce un momento fondamentale della metodologia adottata. La frequentazione dello stesso dipenderà dal tipo di unità di apprendimento in fase di svolgimento e,
soprattutto, dalla reale possibilità di effettuare le esperienze.
8
ATTIVITÀ DI RECUPERO
Alla fine di ogni unità didattica, e in relazione alle esigenze del gruppo classe, saranno proposte lezioni di recupero in itinere. Sulla base delle indicazioni del Collegio
Docenti, gli insegnanti sono disponibili al recupero extra curricolare in forma di sportello pomeridiano per classi parallele.
Ciascun docente, valutato il profilo delle classi e considerate le programmazioni dei rispettivi Consigli di Classe (CdC), avrà cura di:
intervenire con particolare attenzione negli ambiti di debolezza della classe;
agire in modo flessibile sul percorso didattico generale, salvaguardando il raggiungimento delle abilità minime disciplinari per il conseguimento delle
competenze del biennio.
VERIFICA E VALUTAZIONE
Gli elementi di verifica “in itinere” saranno costituiti da: test, questionari aperti e colloqui orali. Sono previste da due a tre verifiche sommative al quadrimestre costituite
da prove scritte e/o colloqui orali. Le verifiche di laboratorio saranno effettuate tramite relazioni o questionari con domande riguardanti gli aspetti salienti dell’attività
sperimentale.
La valutazione, in via prioritaria, avrà come riferimento di base il raggiungimento delle minime abilità per le competenze d’asse. A tale scopo i docenti predisporranno
prove comuni per valutare il livello di padronanza delle competenze.
Si considereranno, inoltre, la partecipazione alle attività proposte sia individuali che di gruppo, l’impegno profuso nel lavoro personale scolastico e domestico, e
l’interesse dimostrato.
Le prove scritte saranno valutate con apposite griglie predisposte in funzione della tipologia e della complessità dei quesiti; nella valutazione intermedia e finale, gli
insegnanti fanno propria la griglia condivisa dai rispettivi CdC e indicata nel P.O.F..
Per quanto riguarda gli studenti DSA e BES, ci si atterrà ai Piani Didattici Personalizzati (P.d.P.) specifici e si utilizzeranno metodologie compensative fruibili
dall’intera classe.
ABILITÀ MINIME del PERCORSO DIDATTICO
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
Saper descrivere il sistema periodico;
Eseguire semplici calcoli stechiometrici;
Identificare il tipo di legame tra atomi e tra molecole;
Saper denominare e riconoscere le fondamentali classi di composti inorganici binari e ternari;
Saper fare semplici previsioni di reazioni;
Saper definire il carattere energetico di una reazione dalla sua equazione termochimica;
Definire la velocità di reazione;
Saper scrivere la costante di equilibrio;
Descrivere un acido ed una base secondo la teoria di Brønsted e Lowry;
Definire il pH e saperlo calcolare in semplici casi;
Calcolare il pH di acidi e basi forti e deboli;
Riconoscere e bilanciare semplici reazioni redox.
Versione aggiornata in data: 05/09/2016 _ a.s. 16/17
9